中国乳腺癌患者发病年龄较轻,60%的女性患者在诊断时为绝经前。与绝经后相比,未绝经女性卵巢功能旺盛,可持续大量分泌雌激素、促进乳腺癌细胞增殖。卵巢功能抑制已用于乳腺癌临床治疗数十年,大量循证证据表明,单用卵巢功能抑制和加用卵巢功能抑制均可降低未绝经女性乳腺癌的复发风险并改善生存。部分卵巢功能抑制研究的长期随访数据(SOFT和TEXT研究12和13年随访、STO-5研究20年随访、亚裔人群的ASTRRA研究8年随访)近期陆续公布,进一步证实对于早期乳腺癌患者加用卵巢功能抑制可显著降低10年以上的复发风险,提高治愈可能。monarchE和NATALEE研究显示,部分CDK4/6抑制剂叠加在绝经前早期乳腺癌患者含有药物去势(促性腺激素释放激素类似物)的辅助内分泌治疗方案时仍可进一步增加生存获益。中国抗癌协会乳腺癌专业委员会召集了国内乳腺癌治疗领域的临床专家,在2021年版的基础上共同商讨编制了《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》。本共识建议,促性腺激素释放激素类似物仍作为绝经前激素受体阳性早期乳腺癌卵巢功能抑制方式的首选。促性腺激素释放激素类似物联合内分泌治疗基础上添加特定CDK4/6抑制剂的激素受体阳性绝经前乳腺癌获益人群包括:淋巴结阳性,淋巴结阴性且满足任一条件(G3,G2伴Ki-67增殖指数≥20%,G2伴21基因、50基因、70基因、12基因评分为高风险)。本共识也认可将2023年圣加仑共识中有化疗指征的风险因素作为卵巢功能抑制适用判定标准之一。促性腺激素释放激素类似物用药推荐根据激素受体阳性乳腺癌患者化疗前的卵巢功能状态进行决策。如果考虑卵巢保护,推荐促性腺激素释放激素类似物同步化疗,不影响患者生存获益;如果不考虑卵巢保护,促性腺激素释放激素类似物同步化疗和促性腺激素释放激素类似物在化疗结束后序贯使用均被认可,后者更为推荐。围绝经期患者的内分泌治疗建议参照绝经前方案。促性腺激素释放激素类似物辅助内分泌治疗的时长建议为5年。中高风险患者完成5年联合促性腺激素释放激素类似物的内分泌治疗后,如果未绝经且耐受性良好,可考虑继续2~5年联合促性腺激素释放激素类似物的内分泌治疗或单用2~5年选择性雌激素受体调节剂治疗。辅助治疗方案中添加促性腺激素释放激素类似物安全可耐受,推荐应用前和患者充分沟通药物的使用方法和可能的不良事件,安全性管理有助于提高患者的依从性。对于接受药物去势的患者,在去势过程中不推荐常规监测雌激素水平,如怀疑不完全的卵巢功能抑制(包括改变用法如注射人员缺乏该药物熟练注射经验、更换剂型或出现某些可能提示卵巢功能恢复的生理变化如月经恢复或更年期症状的周期性波动时),可进行雌激素水平测定以辅助决策。绝经前乳腺癌患者如有需求,无论激素受体阳性或阴性,均可使用促性腺激素释放激素类似物保护卵巢功能,降低卵巢功能早衰的发生风险,减少生育能力损害,推荐化疗前至少1周开始使用促性腺激素释放激素类似物,每28天1次,直至化疗结束后2周给予最后1剂。针对激素受体阳性乳腺癌患者开展的临床试验,不推荐仅纳入绝经后人群,也应当探索促性腺激素释放激素类似物应用条件下的绝经前人群,以明确试验药物对这类患者的实际效应。另外本共识还新增了早期或局部晚期乳腺癌患者卵巢功能抑制药物应用的全程管理路径,以期进一步助力临床决策。
 张剑.中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)[J/OL].中国癌症杂志,1-19[2024-0403].
张剑.中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)[J/OL].中国癌症杂志,1-19[2024-0403].
世界卫生组织(World Health Organization, WHO)下属国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的最新数据[1]显示,估计2022年全球乳腺癌新发病例数230万例,死亡67万例,成为全球第四大癌症杀手。中国乳腺癌发病率年增幅是世界平均水平的2倍,相较于美国乳腺癌患者中位诊断年龄的64岁,中国乳腺癌患者的中位诊断年龄为 48 ~ 50岁,更为年轻,约60%的患者在诊断时为绝经前状态[2]。据统计,中国绝经前女性早期乳腺癌患者中50%~60%为激素受体阳性,辅助内分泌治疗是降低这类患者复发风险的重要手段,选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)治疗5 ~ 10年已经成为绝经前激素受体阳性早期乳腺癌患者的有效内分泌治疗手段[3-7]。卵巢功能抑制(ovarian function suppression,OFS)已经应用于乳腺癌治疗数十年,早期辅助治疗研究(如SOFT研究 8年随访和TEXT研究9年随访结果的联合分析数据[8]、ASTRRA研究[9]和HOBOE-2研究[10]结果)都证实OFS联合治疗方案能够为绝经前激素受体阳性乳腺癌患者带来获益。近两年来, OFS研究的长期随访数据陆续公布,药物OFS 经典研究SOFT和TEXT研究公布了12和13年的随访结果[11-12],STO-5研究公布了20年随访数据[13],亚裔人群的ASTRRA研究公布了8年随访数据[9],进一步证实早期乳腺癌患者OFS的应用能够显著降低患者10年以上的复发风险,使早期乳腺癌患者长期生存获益,提高治愈可能。新的治疗药物CDK4/6抑制剂联合内分泌治疗以及 OFS在绝经前早期乳腺癌患者中的应用能够进一步提高绝经前女性患者的生存获益,如monarchE研究[14-15]和NATALEE研究[16-18],NATALEE研究的中期分析结果表明,可将CDK4/6抑制剂获益人群进一步拓展到广泛的需要进行辅助治疗的乳腺癌患者[ⅡA期:N0伴G2且高危(Ki-67 增殖指数≥20%/21基因评分≥26分或其他高危基因特征),N0伴G3,N1;ⅡB期:N0或N1; Ⅲ期]中。基于YBCC-Catts研究[19]数据,中国<35岁的年轻乳腺癌患者比例显著高于西方国家,与单独接受他莫昔芬(tamoxifen,TAM)治疗相比,芳香化酶抑制剂(aromatase inhibitor, AI)联合OFS治疗能够降低患者的死亡风险和复发风险;另外,与内分泌治疗<2年的患者相比,接受内分泌治疗2 ~ 5年和>5年的患者死亡风险和复发风险均显著降低。因此,中国抗癌协会乳腺癌专业委员会召集了国内乳腺癌治疗领域的临床专家,在《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2021年版)》的基础上共同商讨制订了《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》。本共识基于最新的循证医学证据及中国的临床实践,参考《中国抗癌协会乳腺癌诊治指南与规范(2024 年版)》[20]的推荐等级标准,并结合专家认可度进行调整,从而为进一步规范和优化OFS在绝经前早期乳腺癌患者中的临床应用提供指导意见。专家意见由专家组内成员有针对性地讨论得出,讨论过程中,所有参与者均不存在利益冲突。
本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册编号为
PREPARE-2024CN280。
OFS的作用机制
绝经前女性下丘脑分泌促性腺激素释放激素(gonadotropin releasing hormone,GnRH),也称作黄体生成素释放激素(luteinisinghormone releasing hormone,LHRH),与垂体细胞膜上相应受体结合,使垂体释放黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicle-stimulating hormone,FSH),从而作用于卵巢并释放雌激素,而雌激素能促进乳腺癌的生长[21-22]。OFS是指通过手术、放疗或药物抑制卵巢产生雌激素。常用药物为GnRH类似物(GnRH analog,GnRHa)。GnRHa代表药物有戈舍瑞林、曲普瑞林和亮丙瑞林。GnRHa通过对垂体持续刺激,抑制垂体分泌LH和FSH,雌激素的分泌量随之减少,从而达到下调雌激素水平的目的[23-24]。
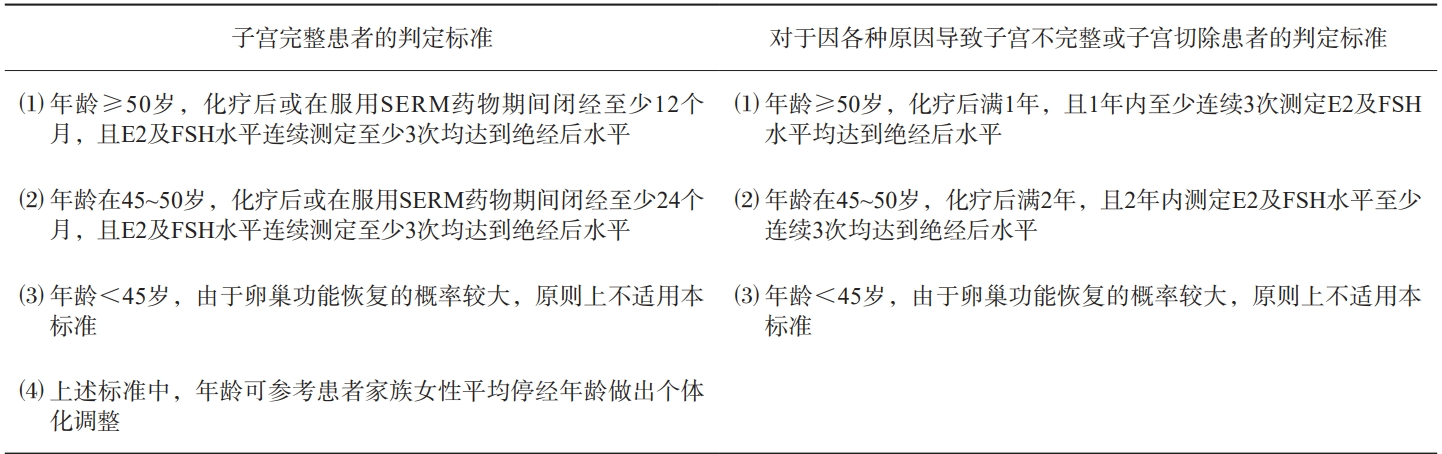
绝经状态判定
绝经可分为自然绝经和人工绝经,一般是指月经永久性终止,卵巢基本上停止合成和分泌雌激素。乳腺癌治疗可能影响卵巢功能和月经。在化疗开始时处于绝经前并发生化疗诱导闭经的患者中,尽管发生闭经,卵巢功能仍可能完整,或可能随着时间的推移而恢复[25]。绝经状态的判定对于内分泌治疗的选择至关重要。年龄、治疗导致的闭经时间、雌二醇(estradiol,E2)水平和FSH水平是判断绝经状态的指标。但乳腺癌患者绝经诊断缺乏循证医学标准,不同的乳腺癌临床试验采用的绝经定义不尽相同
根据国外指南[20,25-26]制定的绝经状态判定标准见表1,结合中国女性实际绝经的中位年龄和临床实践的可操作性制定的绝经状态判定标准见表2。需要注意的是,正在接受GnRHa治疗的患者无法确定绝经状态;化疗前未绝经者,即便化疗后闭经,也不能判断其为绝经后状态。围绝经期是从月经正常到绝经的过渡状态。围绝经期的初期会出现月经周期不规律(与既往周期时间相差≥7 d)、存在无排卵周期与排卵周期交替、伴FSH升高,持续到闭经12个月后结束[27]。化疗 或内分泌治疗后闭经的患者需反复测定FSH和E2 水平,确认其为绝经后状态时方能应用AI。绝经前患者使用AI存在两个方面的问题:AI相关的绝经前雌激素水平可以使AI疗效降低、失效甚至可能增加乳腺癌的复发风险;AI的促排卵作用可以导致非预期怀孕。有研究[28]显示,化疗闭经患者的绝经判定可能需要至少8个月的等待时间,年龄<45岁的亚洲女性的等待时间可长达2 年。
表1 绝经状态的判定标准
 表2所示的绝经状态判定标准适用于中国部分乳腺癌患者在手术治疗时或药物治疗前并未达到停经的状态,但在接受化疗和(或)内分泌治疗中或过程后月经不再来潮者[29]。推荐的激素水平检测时间间隔以>1个月为宜,激素水平受到不同测量仪器和方法的影响,建议依据测定单位具体设备所附注的绝经后参考值范围,原则上参考值暂时推荐为:FSH>40 U/L且E2<110 pmol/L(或<30 pg/mL)[30]。
表2所示的绝经状态判定标准适用于中国部分乳腺癌患者在手术治疗时或药物治疗前并未达到停经的状态,但在接受化疗和(或)内分泌治疗中或过程后月经不再来潮者[29]。推荐的激素水平检测时间间隔以>1个月为宜,激素水平受到不同测量仪器和方法的影响,建议依据测定单位具体设备所附注的绝经后参考值范围,原则上参考值暂时推荐为:FSH>40 U/L且E2<110 pmol/L(或<30 pg/mL)[30]。
表2 经治的乳腺癌患者绝经状态的判定标准
绝经前激素受体阳性早期乳腺癌患者OFS临床应用的专家观点
OFS方式和选择
OFS方式主要包括双侧卵巢手术去势、卵巢放疗去势和药物去势。手术去势包括传统外科切除术和腹腔镜下切除术,为有创性并且不可逆。卵巢切除术虽然可使血清E2浓度迅速降低,但患者也永久性失去卵巢。20% ~ 30%的患者经放疗后不能成功达到卵巢去势的效果,且整体诱导雌激素下降的水平显著逊于卵巢切除术,因而临床使用受到限制。
去势药物GnRHa能够抑制血清中雌激素水平,其抑制程度与手术去势相似。在激素受体阳性的转移性乳腺癌患者中开展的Intergroup研究[31]显示,戈舍瑞林对乳腺癌治疗的客观有效率与手术去势相当,且使用戈舍瑞林患者的安全性和耐受性良好。在辅助治疗的ZEBRA 研究[32]中,接受为期2年的戈舍瑞林辅助治疗后,77%的患者在3年内恢复卵巢功能,而接受 CMF方案(环磷酰胺+甲氨蝶呤+5-氟尿嘧啶)化疗的患者3年内仅有23%恢复卵巢功能。2020年基于Cochrane数据库的1篇激素受体阳性早期乳腺癌辅助治疗中OFS的综述[33]纳入15项研究,总共对11 538例患者进行了分析,结果显示,使用药物进行OFS相较于不进行OFS,可显著改善无病生存(disease-free survival,DFS)率和总生存(overall survival,OS)率,而手术去势或放疗去势相较于不进行OFS,DFS率和OS率则未见显著改善。因此GnRHa是绝经前乳腺癌患者一种理想的OFS方法。2016年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)关于OFS的指南更新[34]也推荐药物去势(GnRHa)作为OFS疗法的首选
专家观点:GnRHa能够迅速降低绝经前女性血清雌激素水平,达到人工绝经状态,停药后卵巢功能多可恢复。因GnRHa现在均已进入医保,考虑到手术的有创性和不可逆性,以及放疗效果有限,因此建议将药物去势(GnRHa)作为绝经前激素受体阳性的早期乳腺癌OFS的首选。
OFS的获益人群
激素受体阳性乳腺癌患者的内分泌治疗依据风险因素分为高危、中危和低危,随着临床试验所获循证医学证据的不断更新,尤其CDK4/6 抑制剂在高危和中危激素受体阳性患者中均观察到临床获益,危险分级也随之更新,此次OFS共识将新的循证医学证据如monarchE研究[14-15]和NATALEE研究[16-18]纳入到中高危风险评价体系中,将进一步规范绝经前中高危患者的用药治疗方案选择。
2023年ASCO大会公布了NATALEE研究[16]预设的中期疗效判定终点无侵袭性疾病生存(invasive DFS,iDFS)的第2次分析结果,该研究旨在探索瑞波西利联合内分泌治疗±戈舍瑞林对于存在复发风险的激素受体阳性/人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性早期乳腺癌患者(纳入人群为ⅡA期:N0伴G2且高危[Ki-67增殖指数≥20%/21基因评分≥26分或其他高危基因特征),N0伴G3,N1;ⅡB期:N0或N1;Ⅲ期]的疗效,对于纳入的绝经前患者,加用戈舍瑞林进行药物去势,中位随访27.7个月,瑞波西利联合方案绝对iDFS获益为3.3%,与对照组相比,瑞波西利联合方案使疾病进展风险降低25.2%。2023年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)大会更新结果[17]显示,绝经前亚组分析与主要结果一致,与对照组相比,瑞波西利联合方案使疾病进展风险降低 27.8%。最新的NATALEE研究结果[18]支持瑞波西利+非甾体类AI±戈舍瑞林作为Ⅱ期或Ⅲ期激素受体阳性/HER2阴性早期乳腺癌复发风险患者(包括淋巴结阴性疾病患者)的新治疗选择。
STO-5研究[13]第2次分析评估了绝经前乳腺癌患者的20年长期治疗获益情况,患者随机分组接受戈舍瑞林(3.6 mg皮下注射,每28 d 1次)、 TAM(40 mg口服,每天1次)、戈舍瑞林联合 TAM治疗或不进行辅助内分泌治疗(对照组),为期2年。雌激素受体(estrogen receptor,ER)阳性患者中,相比对照组,戈舍瑞林、TAM和联合用药组患者长期无远处复发间期得到显著改善[风险比(hazard ratio,HR)=0.49,95% CI: 0.32 ~ 0.75;HR=0.57,95% CI:0.38 ~ 0.87;HR=0.63,95% CI:0.42 ~ 0.94]。多基因检测高危患者显著受益于戈舍瑞林(HR=0.24,95% CI:0.10 ~ 0.54)。结果显示,即便接受2年OFS 治疗,仍可降低患者的长期远处复发转移风险。
2021年第44届美国圣·安东尼奥乳腺癌研讨会(San Antonio Breast Cancer Symposium, SABCS)公布了SOFT和TEXT研究13年的随访数据[11],与单独使用TAM相比,使用OFS(无论联合哪种口服内分泌治疗药物)可使远处复发率和死亡率呈现持续且有意义的相对降低,因此需要恰当的筛选患者来接受OFS治疗。2023年 Francis等[12]报告了SOFT研究中位随访12年数据,结果显示,与TAM相比,TAM联合OFS可显著改善DFS率(HR=0.82,95% CI:0.69 ~ 0.98)和OS率(HR=0.78,95% CI:0.60 ~ 1.01),远处复发率也更低。在既往接受过化疗的HER2阴性患者中,TAM组的OS率为78.8%,TAM联合 OFS组为81.1%,AI联合OFS组为84.4%。总之,治疗12年后,OFS联合辅助内分泌治疗仍可获益,随着基线复发风险的增加,OS绝对获益更加明显。
2019年韩国乳腺癌研究小组公布的ASTRRA 研究[9]结果显示,ER阳性、年龄<45岁、既往接受过(新)辅助化疗且未绝经或后续恢复卵巢功能的早期乳腺癌患者,在TAM治疗5年的基础上联合OFS 2年,相较于TAM单药治疗,可显著改善DFS率(5年DFS率:91.1% vs 87.5%)和OS 率(5年OS率:99.4% vs 97.8%)。2022年ASCO 大会更新了ASTRRA研究8年随访结果[35]。中位随访106.4个月,TAM联合OFS组的8年DFS率仍优于TAM组(85.4% vs 80.2%,HR = 0.67,95% CI:0.51 ~ 0.87),TAM联合OFS组的DFS事件发生率低于TAM组(14.6% vs 25.1%),除局部区域复发及远处转移外,TAM联合OFS组的对侧乳腺癌发生率较高(1.4% vs 0.8%),第二原发肿瘤的发生率较低(1.3% vs 2.6%)。
2020年Cochrane数据库的1篇激素受体阳性早期乳腺癌辅助治疗中OFS的系统综述[33]纳入15 项研究,共11 538例患者进行分析,结果显示,联合OFS相较于不进行OFS,能够显著改善DFS率和OS率,并减少对侧乳腺癌发生风险。
多项指南认为有化疗指征的患者是OFS适用人群,如2023年第5版美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)乳腺癌指南[25]记载,浸润癌>0.5 cm 且pN0的拟接受化疗者,强烈推荐21基因检测评估,若复发风险评分≤15分,推荐辅助内分泌治疗±OFS,若16<复发风险评分<25分,推荐辅助内分泌治疗±OFS或辅助化疗序贯内分泌治疗;pT1-3、pN+患者,评估是否适合化疗后选择是否联合或序贯OFS药物。2021年St. Gallen共识[36]中,考虑推荐OFS的因素包括:Ⅰ/Ⅱ期乳腺癌存在较高复发风险(特别是有化疗指征患者)、年龄<40岁、复发风险评分为16 ~ 25分; Ⅲ期乳腺癌。2022年BCY5指南[37]推荐对于有较高复发风险的患者应该在SERM或AI的基础上联合GnRHa;临床分期为Ⅰ/Ⅱ期的年轻女性乳腺癌患者如果不能服用SERM(由于禁忌证或严重不良事件),可以单独接受GnRHa、卵巢切除术或AI联合GnRHa。复发风险较高,化疗结束后 2年内使用TAM卵巢功能恢复的女性患者,应考虑联合GnRHa。
中国和亚洲其他国家的回顾性研究[38]显示,亚裔人群中存在部分对SERM代谢障碍的患者(如CYP2D6*10 TT型),即使临床中低危患者,也往往表现出对SERM耐药,需要使用AI等替代内分泌治疗策略,绝经前患者如使用AI,也需要同时联合OFS。
2020年ASCO和美国病理学家协会(College of American Pathologists,CAP)指南[39]指出, ER在1% ~ 10%为ER低表达,ER>10%为ER高表达。有研究[8]证实,OFS联合TAM可显著提高绝经前女性乳腺癌患者[ER或孕激素受体(progesterone receptor,PR)>10%]的8年DFS 率和OS率。
专家观点:判定未绝经的有化疗指征的中高危激素受体阳性乳腺癌患者推荐接受含GnRHa 的内分泌治疗;未绝经患者如决定使用AI,需同时接受GnRHa。推荐采用如下临床路径(表3)协助选择辅助内分泌治疗方案。接受化疗序贯 SERM单药辅助治疗的早期乳腺癌患者,如2年内判定为“未绝经”,建议在SERM的基础上联合GnRHa。对低危患者推荐SERM单药治疗。对存在SERM使用禁忌证的患者,推荐OFS单药或OFS+AI治疗。
表3 绝经前激素受体阳性/HER2阴性早期乳腺癌的辅助内分泌治疗推荐临床路径

尽管存在治疗引起的闭经,但在开始治疗前绝经前或围绝经期的患者应按照绝经前患者治疗。应根据化疗前的月经状态判断是否使用 OFS,不建议根据化疗后是否闭经干扰OFS的选择。
OFS联合方案的选择
在绝经后辅助内分泌治疗中,初始5年的 AI治疗相比SERM能够显著降低患者的复发风险[40]。辅助治疗5年的OFS联合AI在绝经前激素受体阳性乳腺癌患者中是否有潜在的治疗获益,需要在SOFT和TEXT研究中进行进一步评估。2014年发布的两项研究联合分析结果[41]显示,OFS联合AI治疗组相对于OFS联合TAM治疗组,5年DFS率分别为91.1%和87.3%,绝对获益率为3.8%;5年无乳腺癌生存率分别为92.8% 和88.8%,绝对获益率为4.0%,在接受化疗的患者中,远处复发率降低了2.6%(TEXT)和3.4% (SOFT)。2018年最新的SOFT研究8年随访和 TEXT研究9年随访联合分析结果[8]再次证实, OFS联合AI能够显著改善总体人群的预后。与 OFS联合TAM相比,OFS联合AI使DFS持续获得改善,8年DFS率分别为82.8%和86.8%,绝对获益率为4%。并减少了远处复发,8年无远处复发率分别为89.7%和91.8%,绝对获益率为2.1%; HER2阴性患者(占总病例数的86%)中,OFS联合AI能够改善所有亚组患者的预后;对于HER2 阴性且风险高需接受化疗的患者,OFS联合AI能够使患者取得显著的临床获益,在SOFT和TEXT 研究中,DFS的绝对获益率分别为9.2%和6.9%,无远处复发间期的绝对获益率分别为7.0%和 5.0%。基于SOFT和TEXT研究的亚群处理效果模式图(subpopulation treatment effect pattern plot, STEPP)分析,纳入绝经前激素受体阳性/HER2 阴性的患者,通过综合复发风险评分评估5年无乳腺癌间期(breast cancer-free interval,BCFI)的绝对获益率,结果显示,OFS联合AI相较于 TAM单药在高危复发风险患者中5年BCFI的绝对获益率为10% ~ 15%,中危复发风险患者5年BCFI 的绝对获益率至少有5%,而非常低危的患者5年 BCFI的绝对获益有限[42]。2018年ASCO大会公布了基于SOFT和TEXT研究8年随访的STEPP分析[43],评估8年无远处复发率的绝对获益率,结果显示,OFS联合AI相较于OFS联合TAM或单药TAM,在高危复发风险患者中,8年无远处复发率的绝对获益率为10% ~ 15%;在中危复发风险患者中,8年无远处复发率的绝对获益率为4% ~ 5%;在低危复发风险患者中,TAM单药治疗基础上强化内分泌治疗的获益较少,因为超过97%的患者在治疗第8年时仍未出现远处复发。2018年ESMO大会公布了HOBOE-2研究的结果[44],这是一项Ⅲ期平行对照研究,纳入1 065 例患者,随机分为3个治疗组,分别为TAM联合曲普瑞林、来曲唑联合曲普瑞林及唑来膦酸联合来曲唑和曲普瑞林,患者的中位年龄为45岁,中位随访65个月。结果显示,绝经前激素受体阳性早期乳腺癌患者接受5年唑来膦酸联合来曲唑和曲普瑞林、5年来曲唑联合曲普瑞林及5年TAM联合曲普瑞林的5年DFS率分别为93.3%、93.2%及 85.4%,5年来曲唑联合曲普瑞林相较于5年TAM 联合曲普瑞林的DFS绝对获益率为7.8%;在此基础上联合唑来膦酸相较于5年TAM联合曲普瑞林可显著改善DFS,减少48%的疾病发生风险,绝对获益率为7.9%。
在OFS联合传统内分泌治疗的基础上, CDK4/6抑制剂联合内分泌治疗可进一步降低激素受体阳性早期乳腺癌患者的复发风险。 monarchE研究[14]是一项全球Ⅲ期临床研究,共纳入5 637例激素受体阳性/HER2阴性高危早期乳腺癌患者,按1∶1比例随机分组,分别接受2 年疗程的CDK4/6抑制剂阿贝西利联合5 ~ 10年标准内分泌治疗或单独5 ~ 10年标准内分泌治疗, 2023年ESMO大会公布了该研究的5年数据[15],结果显示,辅助治疗中阿贝西利治疗获益持续,与2年、3年和4年结果相比,5年iDFS率和无远处复发生存的绝对获益率分别提高7.6%和6.7%,且阿贝西利组的死亡人数更少。NATALEE研究[16]纳入患者范围更广泛[包括ⅡA期:N0(G3, G2伴Ki-67增殖指数≥20%或多基因检测高危)或N1;ⅡB期:N0或N1;Ⅲ期:N0、N1、N2或 N3],包含约44%的绝经前患者。2023年ASCO 大会公布了该研究的结果[17],与对照组相比,瑞波西利联合非甾体类AI和戈舍瑞林组意向治疗(intention-to-treat,ITT)人群的iDFS获益差异有统计学意义(P<0.05),3年iDFS率的绝对获益率为3.3%;各关键亚组的iDFS获益与ITT人群一致,与疾病分期、淋巴结累及、绝经状态、年龄和Ki-67增殖指数无关。基于上述两项研究,对于绝经前激素受体阳性早期乳腺癌患者,应用 OFS+AI/TAM+特定CDK4/6抑制剂方案可使患者获益更为 显著。
OFS联合AI的不良事件发生率与AI在绝经后激素受体阳性乳腺癌中相似。AI联合OFS组多见骨质疏松、骨折和阴道干燥等;SERM联合 OFS组多见血栓形成、潮热和盗汗;两组患者的依从性良好,3、4级不良事件发生率相似(32% 和31%);AI联合OFS组早期停止既定的口服内分泌治疗药物的患者更多(1年:14% vs 6%;4 年:25% vs 19%);曲普瑞林停药率无差异(4 年:18% vs 19%)。阿贝西利联合内分泌治疗组常见不良事件为腹泻、中性粒细胞减少和疲劳等,其中3、4级常见不良事件为中性粒细胞减少(19.6%)和腹泻(7.8%),严重不良事件为感染(5.3%)和胃肠道疾病(2.1%)。瑞波西利联合内分泌治疗组的常见不良事件为中性粒细胞减少、关节痛及肝脏相关不良事件等,其中≥3级常见不良事件为中性粒细胞减少(43.8%)、肝脏相关不良事件(8.3%)及心电图QT间期延长(1.0%)。
《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[20]在绝经前激素受体阳性乳腺癌患者辅助内分泌治疗方面推荐高危患者采用 OFS+内分泌治疗+CDK4/6抑制剂联合方案,中危患者采用5年OFS+AI/TAM方案。
专家观点: S T E P P 评分对鉴定出添加 GnRHa的高获益人群有一定帮助。对于激素受体阳性绝经前中高危乳腺癌患者,推荐GnRHa 联合内分泌治疗基础上添加特定CDK4/6抑制剂,但需要尽量符合相应临床研究的入组人群。
GnRHa用药时机
对于接受化疗的绝经前激素受体阳性早期乳腺癌患者,使用GnRHa的起始时间(同步化疗还是等化疗结束且确认绝经前状态后序贯使用)一直存在较多的争议。2018年ASCO大会公布的一项韩国的ASTRRA研究[9],纳入ER阳性、年龄<45岁、既往接受过(新)辅助化疗且未绝经或后续恢复卵巢功能的早期乳腺癌患者,评估TAM(5年)+OFS(2年)对比TAM(5年)的疗效。该研究在最后1次化疗后3个月内进行卵巢功能基线评估,并且每6个月进行1次卵巢功能评估,持续2年,当评估为绝经前患者时进行随机分组,对化疗诱导闭经的患者先给予口服TAM。结果显示,OFS联合TAM组和TAM单药组5年DFS率分别为91.1%和87.5%。在TEXT研究[43]中,计划接受化疗的患者,接受OFS同步化疗的治疗方案,结果显示,OFS联合AI和OFS 联合TAM的5年DFS率分别为89.8%和84.6%,8年 DFS率分别为86.8%和82.8%。SOFT研究[42]入组的患者如接受化疗,则在末次化疗后8个月内确认绝经前状态后再接受OFS,结果显示,OFS联合AI和OFS联合TAM的5年DFS率分别为84.3%和 80.6%,8年DFS率分别为85.9%和83.2%。SOFT 和TEXT研究的两组患者接受内分泌治疗的依从性相当。另外,PROMISE-GIM6研究[45]入组的绝经前患者接受化疗同步GnRHa治疗对比化疗,其中80%患者为激素受体阳性,生存分析结果显示,两组的5年DFS率分别为80.5%和 83.7%。一项在绝经前早期乳腺癌患者化疗期间短期采用GnRHa进行卵巢抑制的meta分析[46]显示,GnRHa组与对照组的5年DFS率差异无统计学意义(85.1% vs 87.6%,P >0.05),5年的OS 率差异也无统计学意义(96.6% vs 95.6%,P>0.05)。
SOFT和ASTRRA研究中,化疗后确认绝经前状态后再使用GnRHa,可避免部分因化疗导致卵巢永久性损伤患者不必要地使用GnRHa。在ASTRRA研究中观察时间甚至长达2年,95.1% 的患者在化疗结束2年后卵巢功能恢复。过长的等待将会造成部分患者丧失接受OFS和AI治疗的机会。
专家观点:GnRHa用药推荐根据激素受体阳性乳腺癌患者化疗前的卵巢功能状态进行决策,不推荐化疗前未绝经的中高危患者在化疗后长期等待确认卵巢功能后再使用GnRHa。如果考虑卵巢保护,推荐GnRHa同步化疗,不影响患者生存获益;如果不考虑卵巢保护,GnRHa 同步化疗和GnRHa在化疗结束后序贯使用均被认可,后者更为推荐。
GnRHa最佳疗程
关于GnRHa在绝经前乳腺癌治疗中的最佳疗程,目前尚无定论。既往关于GnRHa用于绝经前乳腺癌辅助治疗的重要临床研究采用了2、3或5 年的OFS疗程,如ZIPP研究[47]中GnRHa的疗程为2年,ABCSG-12研究[48]中GnRHa的疗程为3 年,SOFT和TEXT研究[43]中GnRHa的疗程为5 年。上述疗程均证实了GnRHa具有良好的安全性和患者耐受性。SOFT研究[43]显示,GnRHa联合 TAM组的5年DFS率、无乳腺癌生存率和OS率分别达86.6%、88.4%和96.7%,8年DFS率、无乳腺癌生存率和OS率分别达83.2%、89.4%和93.3%。HOBOE-2研究结果[44]显示,5年唑来膦酸联合AI 和OFS、5年AI联合OFS及5年TAM联合OFS的5年 DFS率分别为93.3%、93.2%和85.4%。ASTRRA研究[35]中虽然接受OFS治疗的疗程仅为2年,但纳入的人群是接受过(新)辅助化疗且未绝经或使用TAM后卵巢功能恢复的早期乳腺癌患者,结果显示,接受5年TAM联合2年OFS对比5年TAM,可显著改善5年DFS率(91.1% vs 87.5%)和OS率(99.4% vs 97.8%)。CDK4/6抑制剂在早期激素受体阳性高危乳腺癌患者(包括绝经前和绝经后)中开展的monarchE研究[14-15]、NATALEE 研究[16- 17]、PALLAS研究[49]和PENELOPE-B研究[50]选择的标准内分泌治疗对照组的治疗时长也是至少为5年。由于没有GnRHa不同疗程的对比研究,基于内分泌治疗延长治疗的理念及SOFT和 TEXT研究[43]的长期随访结果,建议辅助GnRHa 的标准疗程为5年。
2017年的一项meta分析[51]纳入了88项试验,共62 923例ER阳性乳腺癌女性,评估接受5 年既定的内分泌治疗,后续远处复发的绝对风险以确定是否延长治疗。其中年龄<55岁的患者约占46%,年龄≥55岁的患者约占54%。T1N0期患者20年的远处复发风险为13%,T2N2期患者20 年的远处复发风险则高达41%。远处复发风险持续存在,延长内分泌治疗势在必行。2023年中国临床肿瘤学会乳腺癌指南[26]对于完成初始5年 OFS+AI治疗的未绝经且耐受性良好的患者,推荐使用TAM或OFS+AI。
《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[20]推荐的GnRHa疗程为5年,对于接受了5年药物性OFS+TAM/AI治疗的特别高危的绝经前患者,尽管没有较强的循证医学证据,后续也可以考虑延长TAM单药治疗时间,或继续维持原方案的延长治疗。2023年St. Gallen共识[40]、2016年ASCO关于OFS的指南更新[34]及2022年BCY5指南[37]推荐的疗程为5年。
专家观点:GnRHa辅助内分泌治疗的时长建议为5年。中高危患者完成5年联合GnRHa的内分泌治疗后,如果未绝经且耐受性良好,可考虑继续2~5年联合GnRHa的内分泌治疗或单用2~5年的SERM治疗。
GnRHa辅助治疗的安全管理
GnRHa联合AI或GnRHa联合SERM的主要不良事件与AI及SERM在绝经后乳腺癌患者中的不良事件相似。两种含GnRHa的辅助内分泌治疗方案的3、4级不良事件发生率相当,但相比SERM 单药明显增加。AI联合OFS组多见骨质疏松、骨折和阴道干燥等;SERM联合OFS组多见血栓、潮热和盗汗。阿贝西利联合内分泌治疗组常见不良事件为腹泻、中性粒细胞减少和疲劳等,其中 3、4级常见不良事件为中性粒细胞减少和腹泻,严重的不良事件为感染和胃肠道疾病;所有级别需要特别关注的不良事件为静脉血栓性栓塞和间质性肺炎。瑞波西利联合内分泌治疗组常见的不良事件为中性粒细胞减少、关节痛及肝脏相关不良事件等,其中常见的≥3级不良事件为中性粒细胞减少、肝脏相关不良事件及心电图QT间期延长;所有级别需要特别关注的不良事件为中性粒细胞减少、肝脏相关不良事件、心电图QT间期延长及间质性肺炎。
在SOFT和TEXT研究[43]中,中位随访68 个月时,仅13.7%的患者在早期停止了治疗,其中OFS联合AI组的停药率为16.1%,而OFS联合 TAM组的停药率为11.2%。中位随访9年时,15% 的患者早期停止所有研究方案规定的治疗,OFS 联合AI组早期停止规定的口服内分泌治疗的患者更多(1年:14% vs 6%;4年:25% vs 19%);曲普瑞林停药率无差异(4年:18% vs 19%)。在monarchE研究[15]中,中位随访42个月时,阿贝西利联合内分泌治疗组因不良事件导致的停药率为6.4%,常见的不良事件为腹泻(2.4%)和疲劳(1.0%)。在NATALEE研究[17]中,中位随访34个月时,导致停药的较常见的全级别不良事件(瑞波西利+内分泌治疗 vs 单独内分泌治疗)为肝脏相关不良事件(8.9% vs 0.1%)和关节痛(1.3% vs 1.9%)。大多数与瑞波西利相关的不良事件导致停药的事件发生在治疗早期,中位停药时间为4个月。
总之,含GnRHa类药物的辅助治疗方案安全可耐受,两种CDK4/6抑制剂联合内分泌治疗方案中与CDK4/6抑制剂相关的不良事件(如腹泻、疲劳、中性粒细胞减少、心电图QT间期延长及间质性肺炎等)可参考《乳腺癌CDK4/6抑制剂相关性不良反应管理共识》[52]对症处理。GnRHa联合AI或GnRHa联合SERM不会严重影响大部分患者的生活质量,但是部分患者确实因不良事件影响了治疗的依从性,从而影响患者的生存获益。针对性的治疗能够有效地缓解不良事件导致的症状,改善患者的生活质量,提高患者对治疗的依从性,从而降低乳腺癌的复发风险[53-54]。
专家观点:辅助治疗方案中添加GnRHa安全可耐受,推荐应用前和患者充分沟通药物的使用方法和可能的不良事件,安全性管理(表4)有助于提高患者的依从性。
表4 含GnRHa辅助内分泌治疗安全管理治疗推荐

雌激素水平检测
计划进行辅助内分泌治疗的绝经前患者,化疗都有可能诱导闭经,造成后续内分泌治疗方案的选择困难。但对于年轻患者而言,化疗导致的闭经大多是可逆的。一项纳入595例患者的观察性研究[56]显示,<35岁的患者因化疗导致的闭经在化疗后6个月内恢复月经的比例为85%, 35 ~ 40岁的患者因化疗导致的闭经在化疗后6个月内恢复月经的比例为61%。一项针对45岁以下的中国女性乳腺癌患者的研究[57]显示,91.1% 的患者因化疗导致闭经,66.7%的患者化疗后能够恢复月经。ASTRRA研究[35]纳入年龄<45岁的患者,发现81.4%的患者在化疗结束1年后恢复了卵巢功能,95.1%的患者在化疗结束2年后恢复了卵巢功能。因此,在化疗后对激素水平进行反复检测,以判定是否处于绝经前状态,进而决定是否进行OFS治疗,这种方式的检测既不可靠又会延误后续治疗。此外,较低的雌激素水平的检测需要精确度和灵敏度均较高的设备,尽管精准的雌激素水平检测值得进一步研究,但是广泛地检测雌激素水平仍然无法大范围实施[58]。
CBCSG008研究[59]开展了性激素三项的全国多中心临床调查研究,发现国内医疗机构由于使用了多种不同的检测仪器和多种试剂盒,各自的参考范围亦不相同,目前尚无公认且权威的中国女性不同绝经状态的激素水平正常值,因此,本共识不推荐在使用药物去势期间仅根据所检测的激素水平来作出治疗的决定。此外,雌激素水平随生理周期波动,在OFS治疗的基础上联用其他内分泌治疗药物也会影响雌激素水平,激素水平的检测结果未必能真实地反映患者的卵巢功能状态[60]。此外,患者和医师应当在接受药物去势期间警惕某些可能提示卵巢功能恢复的生理变化,如月经恢复、更年期症状的周期性波动。因此,在化疗开始前判断患者的卵巢功能状态更为合理[48]。
专家观点:对于接受药物去势的患者,在去势过程中不推荐常规监测雌激素水平,如怀疑不完全的OFS(包括改变用法如注射人员缺乏该药物熟练注射经验、更换剂型或出现某些可能提示卵巢功能恢复的生理变化如月经恢复或更年期症状的周期性波动时),可进行雌激素水平测定以辅助决策。
GnRHa长效制剂
GnRHa有3个月或1个月两种给药剂型,两者在2 ~ 4周内均可快速降低E2水平,4周时可降至 30 ng/L以下,且整个治疗期间可使患者体内的雌激素维持在绝经后水平[61-62]。一项在日本开展的多中心、开放、随机、平行、干预性Ⅱ期临床研究[62],纳入绝经前ER阳性、行根治性手术的早期乳腺癌患者170例,戈舍瑞林10.8 mg组与 3.6 mg组E2的曲线下面积比为0.974(95% CI:0.799 ~ 1.188),95%上限低于预设的非劣效界值1.25,证实戈舍瑞林10.8 mg非劣效于戈舍瑞林 3.6 mg。研究安全性方面,头对头研究[60-61]证实两种剂型的GnRHa安全性良好。从成本差异看,与1个月剂型相比,3个月剂型GnRHa减少了患者往返医院的次数和花费等直接非医疗成本,也减少了劳动力损失造成的间接成本,可能提高治疗的依从性,进而满足患者的个性化需求[63]。《新型冠状病毒肺炎疫情下乳腺癌诊疗十个热点问题的思考》[64]指出,激素受体阳性患者的辅助内分泌治疗可用在化疗后或直接用于低危、无需化疗者;绝经后患者首选口服AI;绝经前低危患者,口服TAM即可,需要行OFS的高危患者,可采用每3个月1次的长效制剂。
绝经前早期乳腺癌患者卵巢功能保护临床应用的专家观点
随着乳腺癌患者对于生存质量的重视以及 2021年中国一对夫妻可以生育3个子女政策的实施,化疗期间的卵巢功能保护开始受到越来越多的关注。化疗所致的卵巢损伤是不可逆的,女性卵巢中的卵泡数目自出生时就已经确定,不会再增加,化疗导致的卵泡凋亡将直接耗竭卵巢的储备,诱导卵巢纤维化。化疗所致卵巢功能损伤与化疗方案、化疗药物的累积剂量以及化疗时患者的年龄密切相关。比较成熟的卵巢保护方法包括卵泡冷冻技术、胚胎冷冻技术及GnRHa类药物保护,这些方法各有利弊。其中GnRHa类药物保护卵巢作为当前最简便易行的方法,越来越多的临床研究也证实了其保护卵巢的有效性和安全性。
POEM研究纳入257例可手术的激素受体阴性绝经前乳腺癌患者,评估化疗期间使用戈舍瑞林对卵巢功能的保护作用,主要研究终点为2年时卵巢衰竭的发生率,次要终点包括妊娠结局、 DFS率和OS率。2015年Moore等[54]报道的中位随访4.1年的结果显示,戈舍瑞林组和单独化疗组2年时卵巢衰竭的发生率分别为8%和22%,与单纯化疗组相比,戈舍瑞林组有更多的女性怀孕(21% vs 11%,P = 0.03)。2018年Moore等[65]报道的中位随访5.1年的最终分析结果显示,戈舍瑞林组和单独化疗组的DFS和OS差异无统计学意义。上述研究结果证实,化疗中使用戈舍瑞林可以防止卵巢衰竭,降低早期绝经风险,改善生育前景,对疾病转归没有明显的不良影响。
PROMISE-GIM6研究纳入281例Ⅰ ~ Ⅲ期绝经前乳腺癌患者,其中激素受体阳性患者约占 80%,激素受体阴性患者约占18%,评估化疗期间给予GnRHa类药物对年轻乳腺癌患者早期绝经发生率的影响。2011年Del Mastro等[66]的研究结果显示,最后1个化疗周期后12个月,单独化疗组和GnRHa组的早期绝经率分别为25.9%和 8.9%,绝对差异为-17%,与治疗相关的早期绝经的优势比为0.28。2015年Lambertini等[45]的中位随访7.3年的研究结果显示,GnRHa组和单独化疗组5年累计月经恢复率分别为72.6%和64.0%, GnRHa组和单独化疗组5年累积妊娠发生率分别为2.1%和1.6%,GnRHa组和单独化疗组5年DFS 率分别为80.5%和83.7%。2021年ASCO公布的中位随访12.4年的最终分析结果[67]显示,10 年DFS率(GnRHa组和单独化疗组分别为72.4% 和71.2%)和10年OS率(GnRHa组和单独化疗组分别为82.0%和85.9%)差异无统计学意义。 PROMISE-GIM6研究证实在化疗期间使用GnRHa 作为激素受体阳性的绝经前乳腺癌患者保存卵巢功能的策略是安全的。
2018年一项系统综述和基于患者个体数据的 meta分析[46]纳入5项研究,共873例患者,其中 ER阳性患者约占40%,ER阴性患者约占60%。结果显示,GnRHa组和对照组的卵巢功能早衰率分别为14.1%和30.9%。治疗后妊娠率分别为 10.3%和5.5%。整体人群的DFS和OS差异无统计学意义,根据ER状态进行亚组分析,无显著交互作用。该研究证实,暂时性OFS有效且安全, GnRHa作为一种可行的选择,可以减少化疗诱导的卵巢功能早衰的发生风险,保护绝经前早期乳腺癌患者的未来生育能力。
ESMO BCY5指南[37]推荐,在(新)辅助化疗期间应同时使用GnRHa类药物以降低卵巢功能早衰的发生风险,保护卵巢功能,减少对生育能力的损害。GnRHa类药物不能替代已确定的生育能力保存方法,且应提供给所有的年轻患者。2019年ESMO早期乳腺癌指南[68]指出,在化疗期间进行OFS对卵巢功能有一定的保护作用,且对肿瘤患者的预后无不良影响,因此应该向患者推荐。然而在想要怀孕的情况下,OFS不应该是唯一保留生育能力的方法。《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[20]推荐绝经前患者(包括激素受体阳性或阴性),在辅助化疗期间可考虑使用OFS药物保护患者的卵巢功能。《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[20]和2019年《年轻乳腺癌诊疗与生育管理专家共识》[69]都推荐在化疗前1 ~ 2 周给药,化疗结束后2周给予最后1剂药物。有妊娠需求的患者,推荐至辅助生殖科咨询。
专家观点:绝经前乳腺癌患者如有需求,无论激素受体阳性或阴性,均可使用GnRHa保护卵巢功能,降低卵巢功能早衰的发生风险,减少生育能力损害,推荐化疗前至少1周开始使用 GnRHa,每28 d 1次,直至化疗结束后2周给予最后1剂。
绝经前乳腺癌患者参加临床试验的专家观点
2021年6月美国食品药品管理局(Food and Drug Administration,FDA)正式发布《绝经前乳腺癌女性治疗药物研发的行业指南》[70],提议绝经状态不应作为任何乳腺癌临床试验的排除标准,雌激素充分抑制的绝经前女性应享有和绝经后女性同等的资格参加药物或联合治疗的临床试验。2021年Cao等[13]在《为绝经前乳腺癌患者提供安全有效的治疗:努力扩大合格标准》[71]中回顾了将绝经前女性纳入研究的激素受体阳性乳腺癌关键性临床试验的结果,与绝经后女性相比,绝经前女性的肿瘤生物学行为或对生活质量的长期影响可能存在内在差异,支持将绝经前女性纳入临床试验,以便收集和研究这些信息,而不仅仅是推断。在评估用于治疗激素受体阳性乳腺癌患者的抗肿瘤药物临床试验中,患者不应该基于其绝经状态而被排除在临床试验之外,对于绝经前但雌激素充分抑制的女性来说,符合条件并纳入临床试验是很重要的。
专家观点:针对激素受体阳性乳腺癌患者开展的临床试验,不推荐仅纳入绝经后人群,也应当探索GnRHa应用条件下的绝经前人群,以明确试验药物对这类患者的实际效应。
绝经前激素受体阳性/HER2阴性乳腺癌患者的治疗路径推荐
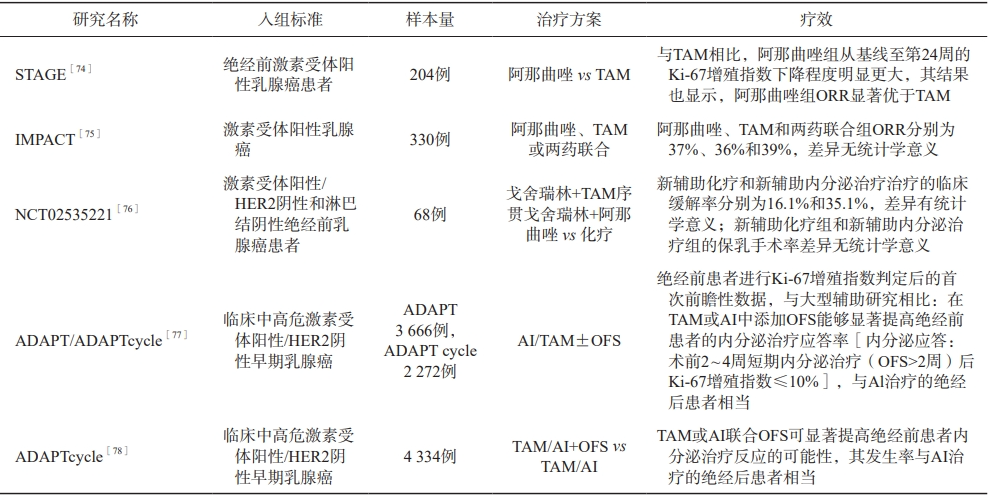
新增早期/局部晚期乳腺癌患者OFS药物应用的全程管理路径见图1。绝经前激素受体阳性乳腺癌新辅助化疗联合OFS研究汇总见表5。绝经前激素受体阳性乳腺癌新辅助内分泌治疗部分研究汇总见表6。
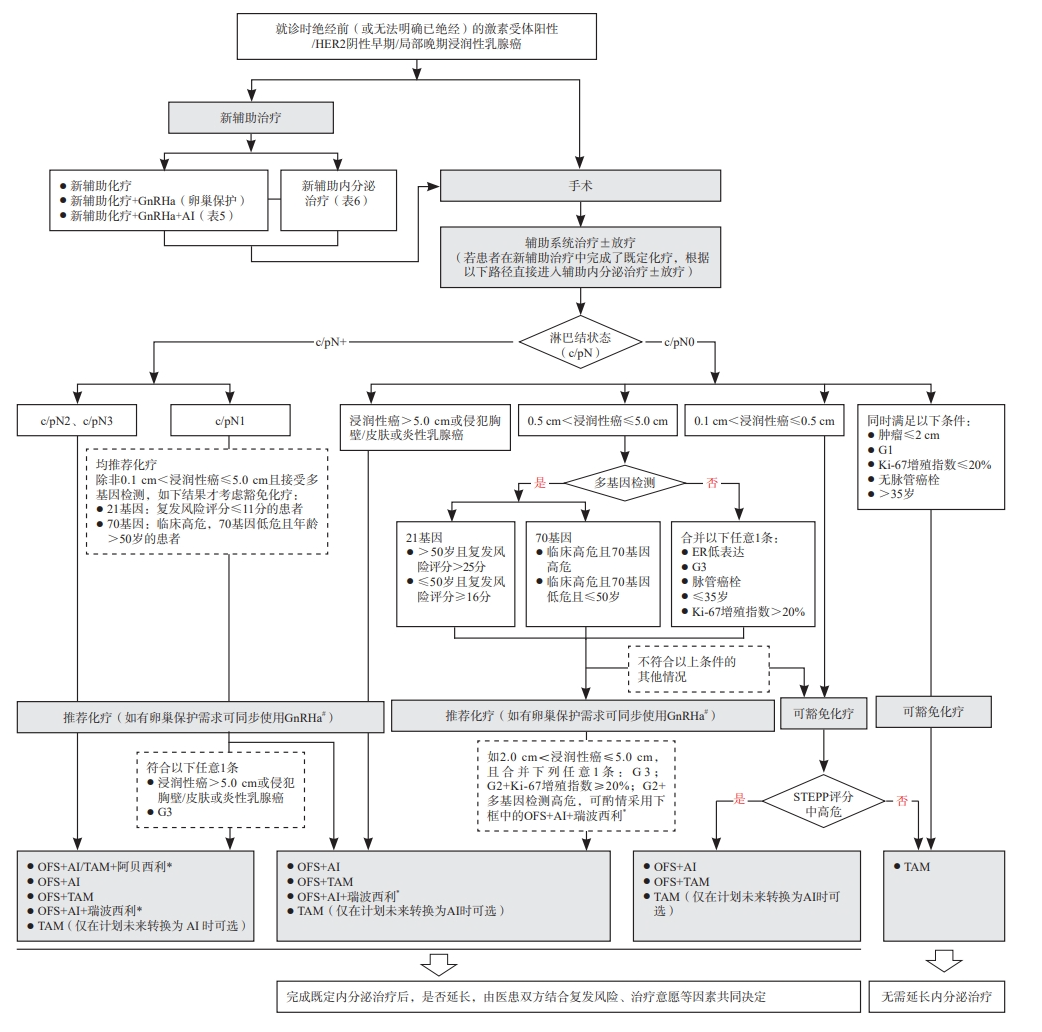
图1 早期/局部晚期乳腺癌患者OFS药物应用的全程管理路径
*:基于monarchE研究和NATALEE研究证据更新,其中瑞波西利未获批早期乳腺癌适应证,阿贝西利早期乳腺癌适应症为联合内分泌治疗(他莫昔芬或芳香化酶抑制剂)用于激素受体阳性、HER2阴性、淋巴结阳性,高复发风险且Ki-67增殖指数≥20%的成年早期乳腺癌患者的辅助治疗,monarchE研究的B队列人群添加阿贝西利是否获益尚不明确;#:基于POEMS研究、PROMISE-GIM6研究、2018年J Clin Oncol的meta分析和2015年JAMA的随机对照临床试验证据更新。根据《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》进行术后辅助化疗的推荐或豁免;当ER 1% ~ 10%低表达,或ER阴性/PR阳性时,考虑内分泌敏感性低,内分泌强化或延长的证据不充分;围绝经期患者应按照化疗前的激素水平、参照绝经前患者的治疗,需要联合OFS的患者,在2 ~ 5年OFS+内分泌治疗期间,如果明确判断达到了绝经状态,则方案转化为AI;患者存在BRCA1/2胚系突变情况治疗请参考OlympiA研究 [72],此处不再详细展开;STEPP复发风险评分工具:评分大于1.42分的患者为复发中高危风险人群,中高危风险人群选择5年OFS联合AI的获益优于OFS联合TAM或TAM单药。
表5 绝经前激素受体阳性乳腺癌新辅助化疗联合OFS研究汇总
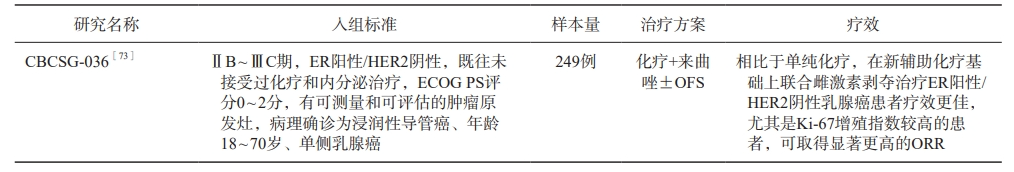
表6 绝经前激素受体阳性乳腺癌新辅助内分泌治疗部分研究汇总
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


