本期精选4篇在2024年2月份发表的结直肠癌领域文献,部分研究邀请到中山大学附属第六医院张剑威教授进行深入解读。
专家介绍
中山大学附属第六医院肿瘤内科副主任,医学博士,硕士生导师
中国临床肿瘤协会(CSCO)青年委员会委员
中国抗癌协会整合肿瘤分会青年委员会委员
中国临床肿瘤协会(CSCO)翻译小组成员
广东省抗癌协会化疗专业委员会青委会常委
广东省医学教育协会肿瘤学专业委员会常委
广东省医学会肿瘤学分会生物标志学组秘书
Gastroenterology Report 杂志学术委员会委员
基线ctDNA基因改变作为帕尼单抗联合化疗治疗转移性结直肠癌生存的生物标志物1
某些特定的基因改变以及右半原发肿瘤可能与抗EGFR单抗治疗mCRC出现耐药相关。PARADIGM研究预设的探索性生物标志物分析(n=733例)评价了ctDNA检测的基因改变与疗效结局之间的相关性,重点关注了可能与EGFR单抗耐药相关的泛基因改变,包括KRAS、NRAS、PTEN和EGFR胞外域的突变,HER2/MET扩增以及ALK/RET/NTRK1基因融合。结果发现,在ctDNA检测未发现上述基因改变(即超选阴性)的患者中,帕尼单抗联合mFOLFOX6治疗组相比贝伐珠单抗联合mFOLFOX6治疗组具有更长的OS(两组人群的mOS:40.7m vs 34.4m;HR 0.76;95%置信区间,0.62-0.92),左半超选阴性患者,帕尼单抗组mOS显著优于贝伐珠单抗组;右半超选阴性患者,帕尼单抗组mOS相比贝伐珠单抗组有获益趋势(38.9m vs 30.9m)。但在ctDNA检测到具有任何基因改变的患者中(不区分左右半),帕尼单抗组患者与贝伐珠单抗组患者相比OS相似或更短(19.2m vs 22.2m,HR 1.13;95%置信区间,0.83-1.53)(图1)。
利用ctDNA进行阴性负向超选可能成为指导mCRC患者最佳治疗的选择。
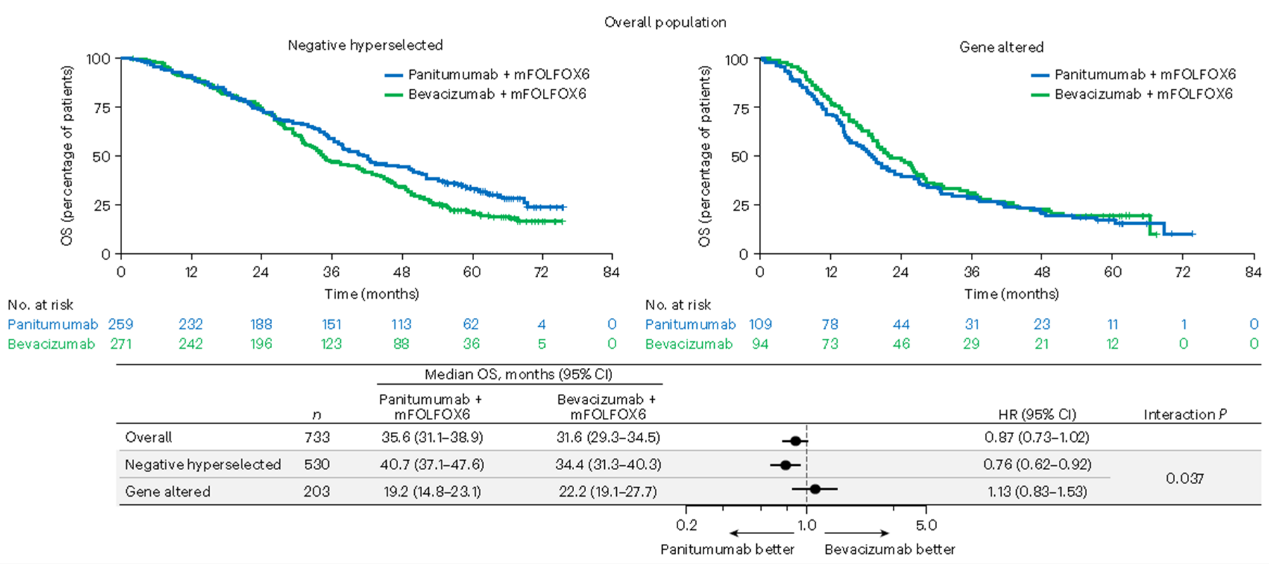
图1:不同负性超选状态下,生物标志物可评价的总人群OS的Kaplan–Meier曲线图
张剑威教授:基于CALGB/SWOG 80405 和FIRE-3这两项研究的事后分析发现,对于RAS/BRAF野生型结直肠癌的一线治疗,需要区分左右半进行不同靶向药物的选择,野生型的左半结直肠癌,一线化疗联合抗EGFR单抗优于抗VEGF单抗,但右半结直肠癌,一线化疗联合抗VEGF单抗优于抗EGFR单抗。
PARADIGM研究是首个针对左半野生型结直肠癌,头对头比较一线化疗联合帕尼单抗与化疗联合贝伐珠单抗疗效的III期研究,主要终点是左半野生型结直肠癌的OS。该研究经过多次的方案修订后改为现在的研究终点,但在前期已入组部分右半结肠癌的患者,占总人群的20%~25%。 研究结果也表明,左半野生型结直肠癌,一线化疗联合EGFR单抗的OS优于化疗联合贝伐珠单抗(37.9m vs. 34.3m, HR 0.82, P=0.03),达到了主要研究终点,此外,一线化疗联合EGFR单抗的ORR及根治性手术切除率方面也更有优势,该研究进一步夯实了现有的临床证据。
对于RAS野生型的左右半结直肠癌,不同靶向药物的治疗为何会存在这样的差异?既往从左右半胚胎起源不同,左右半肠道菌群的不同等角度进行解释。PARADIGM研究基线ctDNA结果的后续分析,从基因角度更直接地解释了左右半存在差异的原因。
PARADIGM研究纳入疗效分析共802例,其中733例(91.4%)有基线ctDNA信息。重点关注的是EGFR抑制剂耐药相关基因,包括KRAS、NRAS、PTEN、EGFR-ECD突变、HER2和MET扩增,ALK/RET/NTRK1基因融合。值得注意的是,PARADIGM研究仅排除组织基因检测KRAS/NRAS突变人群,因此并未排除BRAF突变人群。在ctDNA检测结果中,可以看到全组有10.6%的BRAF突变存在,以右半结肠癌为主;存在6.0%的KRAS突变,1.4%的NRAS突变,这说明RAS的异质性约占7.4%;HER2扩增占4.4%(图2)。ctDNA分析的人群中,左半结直肠癌有114例(20.6%)的EGFR相关耐药基因突变,而在右半结肠癌中,有84例(49.7%)存在EGFR耐药基因突变,一定程度上解释了为何右半结肠癌对EGFR单抗疗效欠佳。
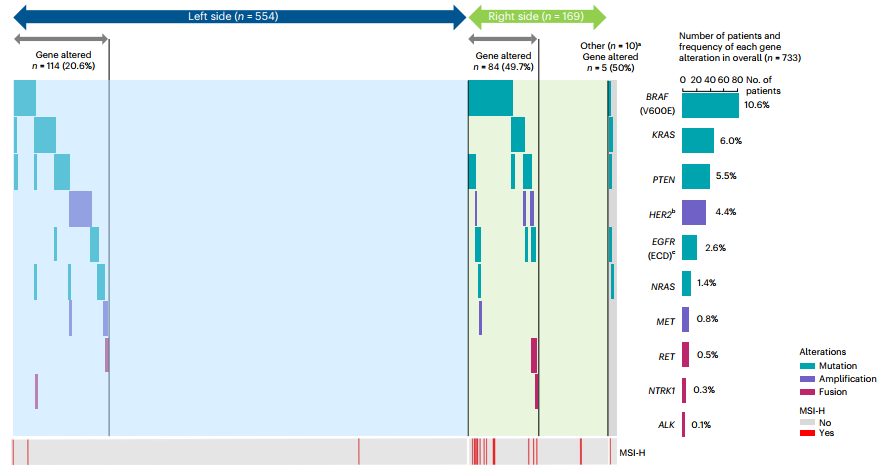
图2:ctDNA检测的不同基因改变频率
经过ctDNA筛选,在左半人群中,基因超选阴性的患者一线化疗联合帕尼单抗和贝伐珠单抗治疗的OS分别为42.1月 vs 35.5月(HR 0.76, 95%CI 0.61-0.95),生存差异更为显著,有效率分别为83.3% vs 66.5%;而ctDNA存在耐药基因变异的左半人群,两组OS分别为24.2月 vs 26.4月(HR 1.08),有效率分别为67.5% vs 73.5%,EGFR单抗的优势则不明显了。相反地,在右半人群中,ctDNA超选阴性的患者,一线化疗联合帕尼单抗和贝伐珠单抗的OS分别为38.9月vs 30.9月(HR 0.82, 95%CI, 0.5-1.35),一线治疗有效率分别为71.4% vs 66.0%,数值上仍然是帕尼单抗组优于贝伐珠单抗组;但在ctDNA存在基因变异的右半人群中,两组OS分别为14.1月 vs 18.5月(HR 1.33, 95%CI 0.84-2.11),有效率分别为41.9% vs 65.9%,反而是化疗联合贝伐珠单抗更优,潜在提示,某些右半结肠癌患者,经过基因的超选择,潜在能从一线抗EGFR单抗治疗中获益。原发肿瘤位置可能不是唯一的决定因素,阴性超选择状态可能比肿瘤位置更有助于治疗选择,但需要进一步的研究来确认抗EGFR抗体治疗是否真的对阴性超选择的右半mCRC患者有益。
不可切除转移性结肠癌患者全身治疗前的原发灶切除:SYNCHRONOUS和CCRe-IV试验的联合结果2
化疗是IV期和不可切除的转移性结直肠癌患者的主要治疗手段。关于化疗前原发灶切除(PTR)是否可以延长生存期,从既往非随机临床试验的数据来看仍一直未有定论。该研究旨在探索初诊不适合根治性治疗的IV期结肠癌患者中PTR对预后的价值。
本研究通过对SYNCHRONOUS和CCRe-IV这两个多中心、随机研究进行联合分析,研究纳入的患者来自奥地利、德国和西班牙的100个研究中心,不可切除的同时性转移结肠癌患者被随机分配接受PTR或前期化疗(无PTR组)。化疗方案由当地团队自行决定。有肿瘤相关症状、不能耐受手术和(或)全身化疗、有其他癌症史的患者不纳入该研究。研究的主要终点是OS,对ITT人群进行结果分析。
在2011年11月至2017年3月期间,共有393例患者被随机分配至PTR组(n=187)和无PTR组(n=206)。无PTR组和PTR组分别有6.4%和24.1%的患者未接受化疗。中位随访时间为36.7个月(95% CI,36.6-37.3)。PTR组的中位OS为16.7个月(95% CI,13.2~19.2),无PTR组为18.6个月(95% CI,16.2~22.3)(P = 0.191)。多变量分析进一步证实了两组及所有亚组之间的OS相似(HR 0.944 [95% CI,0.738-1.209],P=0.65)。不可切除的同时性转移性结肠癌患者中,系统性化疗前进行PTR与OS延长无关。SAE在无PTR组中更常见(PTR组 vs 无PTR组,10.2% vs 18.0%;P=0.027)。
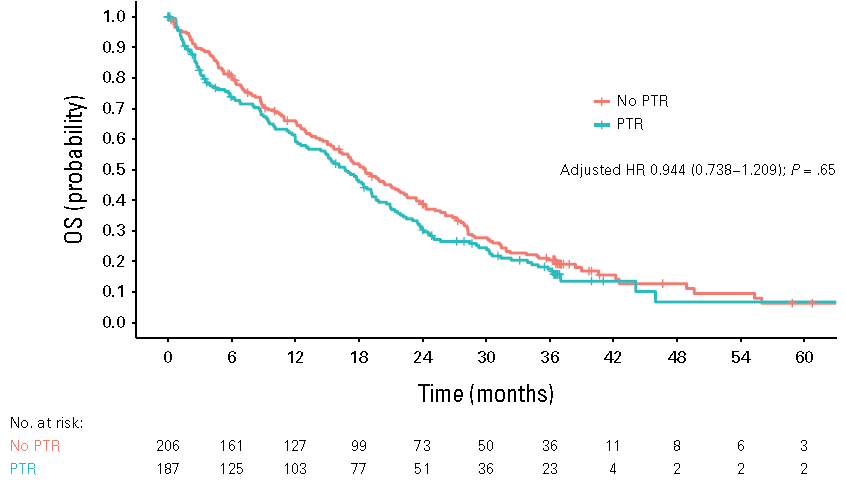
图3:ITT人群OS的Kaplan-Meier估计值。PTR组的中位OS为16.7个月(95% CI,13.2-19.2),无PTR组为18.6个月(95% CI,16.2-22.3)
张剑威教授:对于转移灶不可切除的IV期结肠癌,若原发灶存在肿瘤相关并发症,如梗阻、出血、穿孔等,目前已有共识,是先进行原发灶切除再考虑全身系统性治疗。但对于无症状的原发灶,在系统性化疗前进行原发灶切除是否能延长生期,是否能降低原发灶相关的并发症,一直存在争议,各项回顾性研究结果不一。也有多项前瞻性随机对照临床研究针对这个问题进行探索,其中包括日本的iPACS研究、荷兰的CAIRO IV研究、德国的SYNCHRONOUS研究和西班牙CCRe-VI研究。
日本的iPACS研究入组165例患者,在第一次中期分析时就提前终止,原发灶手术切除未显示生存获益,且围术期死亡率4%。SYNCHRONOUS研究和CCRe-VI研究均未完成原计划的入组样本量,但两项研究研究设计基本一致,两项研究合并分析总体样本量达393例,在直接原发灶切除组(PTR)206例,系统性化疗组(No PTR)187例,更好地进行分析解释了两种治疗选择的差异。总体的结论上,对于原发灶无症状的,转移灶不可切除的晚期结肠癌,先进行原发灶手术切除,并不能延长总生存,甚至数值上还不如进行系统性化疗(16.7m vs. 18.6m)。但值得注意的是,系统性化疗组中,后续未接受化疗的比例仅为6.4%,但在姑息性手术切除组,有24%的患者后续未接受任何化疗,这一数据在SYNCHRONOUS研究和CCRe-VI两项研究中均相当,这在一定程度上也影响了这组患者的总生存,潜在原因包括术后并发症、患者依从性等。
在实际的临床实践中,多学科综合治疗(MDT)更为重要,对于转移性结直肠癌,原发灶无症状的,仍然是系统性治疗先行,根据肿瘤位置、基因状态综合考虑,选择最佳治疗方案,前期的系统性药物治疗,既是控制缩小肿瘤,同时也是检验肿瘤的生物学行为,在这个过程中,部分初始不可手术的患者可能转化成功,获得手术切除或NED的机会,此时再考虑进行局部治疗,才能使患者获得更好的生存预后。
PD-1抑制剂用于新辅助治疗高危错配修复完整(pMMR)直肠癌3
全程新辅助治疗(TNT)是局部晚期直肠癌的标准治疗,尤其是对于有高危因素的患者。然而,TNT联合免疫治疗对错配修复完整(pMMR)的直肠癌患者的疗效尚不清楚。
该研究旨在评价化疗联合免疫治疗诱导后进行长程放化疗的TNT模式对pMMR状态的高危直肠癌患者的安全性和有效性,并确定与疗效相关的潜在分子生物标志物。该队列研究是一项单臂II期试验,于2020年6月至2021年10月在北京大学肿瘤医院胃肠肿瘤中心进行。治疗前收集患者活检组织和血浆样本,分别进行全外显子测序和无细胞DNA测序。于2022年5月至2022年9月进行数据分析。受试者接受了3个周期的奥沙利铂+卡培他滨+PD-1单抗的诱导治疗,然后进行了放疗(50.6Gy,分22次)联合卡培他滨的并行治疗。无疾病进展的患者继续接受2个周期的奥沙利铂/卡培他滨巩固治疗(图4)。研究主要终点为病理完全缓解率。
入组的25例患者(19例男性[76%];6例女性[24%];中位年龄58岁[IQR,48-64])中有22例患者(88%)完成了TNT计划。病理完全缓解率为33.3%(7/21)。12例患者(48%)获得临床完全缓解,4例患者(16%)选择观察等待。完成TNT计划并接受手术治疗的患者共21例,均为R0切除,主要病理缓解率为38.1%(8/21)。最常见的不良事件为恶心(80%,20/25);25例患者中有9例患者(36%)发生3级毒性反应。较高的LRP1B基因突变百分比见于奥沙利铂/卡培他滨联合PD-1单抗诱导治疗后肿瘤缩小达到50%或以上的患者,或临床完全缓解的患者。LRP1B突变与TMB和肿瘤新抗原负荷相关。肿瘤突变负荷高的患者均从治疗中获益。
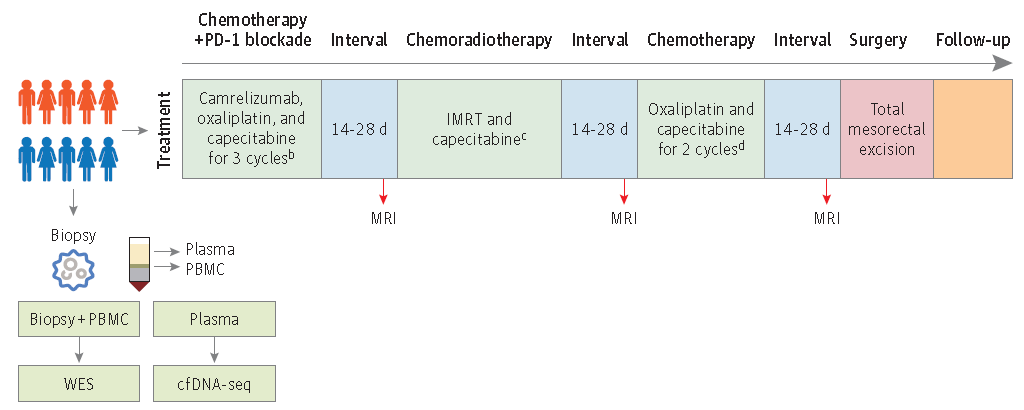
图4:研究时间表概览
该研究发现,对于pMMR状态的高危直肠癌患者,化疗联合PD-1单抗诱导治疗后进行长程放化疗的TNT模式是安全有效的。仍然需要更长时间的随访和更大规模的临床研究来验证这种创新方案,此外还迫切需要进一步验证LRP1B的预测价值并探索其它对直肠癌具有潜在预测价值的新型生物标志物。
张剑威教授:对于dMMR局部进展期直肠癌,6个月的术前免疫治疗,cCR率达100%,对于这部分患者,可豁免手术,实现保肛保功能的目的。但dMMR的直肠癌也仅占5%左右,更多的是pMMR患者。近年来,免疫治疗在pMMR直肠癌新辅助治疗领域的作用一直是研究的热点,有多项探索研究,更多的是联合长程或短程放化疗的研究。例如,在长程放化疗后,采用免疫治疗进行巩固治疗的Voltage研究,pCR率约30%。另一项来自美国2期随机对照研究(NRG-GI002)是TNT模式,针对高危的II-III期患者,先接受4个月的FOLFOX方案诱导化疗,随后一组接受卡培他滨联合放疗,另一组在放化疗基础上同步加上最多6次的帕博利珠单抗治疗,pCR率分别为31.9%和29.4%,未进一步提高短期疗效。在2023年ESMO上公布的III期随机对照研究(UNION研究),则是在短程放疗后,CAPOX联合PD-1单抗巩固治疗2程,对比长程放疗后,CAPOX巩固治疗2程,pCR率从15.3%提高到39.8%,该研究表明PD-1单抗联合放化疗,提高了新辅助治疗的近期疗效,远期生存预后如何,还有待更长时间的随访。
而这项长程放疗联合免疫的TNT模式,采用的是CAPOX联合PD-1诱导治疗3个疗程后,再行放化疗,之后再行CAPOX巩固治疗,样本量较小,纳入25例患者,接受手术患者21例,另有4例患者选择待观察策略,总体pCR率为33.3%(7/21),与既往TNT研究的结果相当。但该研究同时进行了探索性分析,发现LRP1B突变有潜在的免疫治疗疗效预测价值,肿瘤退缩明显或达到cCR的患者有更高比例的LRP1B突变,而这个基因突变本身与更高的TMB和新辅助相关。因此,对于pMMR人群的新辅助免疫治疗,后续需要寻找精准的疗效预测biomarker,筛选出合适的人群去联合免疫治疗,不应该是“一刀切”的模式。
RAS/RAF共突变和ERBB2拷贝数调节结直肠癌HER2异质性和对HER2靶向治疗的反应性4
随着对治疗研究的逐渐深入,ERBB2扩增作为结直肠癌(CRC)的一种独特分子亚型,当其合并RAS/RAF突变时所产生的影响尚不清楚。Dana-Farber和Foundation Medicine公司使用基因组分析技术识别出CRC队列中的ERBB2扩增病例(Dana-Farber,n=47/2,729[1.7%];Foundation Medicine公司,n=1857/49,839[3.7%])。报告了接受HER2靶向治疗的患者结局(Dana-Farber,n=9;Flatiron Health-Foundation Medicine临床基因组学数据库,FH-FMI CGDB,n=38)。通过多位点HER2免疫组化分析和基因组学分析,了解HER2瘤内和病灶间的异质性。在同源CRC细胞系和异种移植模型中研究了ERBB2扩增合并RAS共突变时对HER2靶向治疗有效性的影响。
结果显示,ERBB2扩增在左半CRC中富集,20%的ERBB2扩增CRC同时存在RAS/RAF突变。RAS/RAF野生型CRC通常呈现克隆性ERBB2扩增,RAS/RAF突变型CRC中ERRB2扩增水平更低且ERRB2扩增水平在肿瘤内和病灶间具有更高的异质性。这些不同的基因组模式导致了患者对HER2靶向治疗的反应和耐药模式不同。ERBB2扩增合并RAS/RAF突变的CRC对基于曲妥珠单抗的联合治疗(如曲妥珠单抗/图卡替尼)耐药,但在体外和鼠模型中对DS-8201仍保持敏感性。DS-8201还在高水平ERBB2扩增合并RAS/RAF共突变的CRC病例中显示出临床疗效。
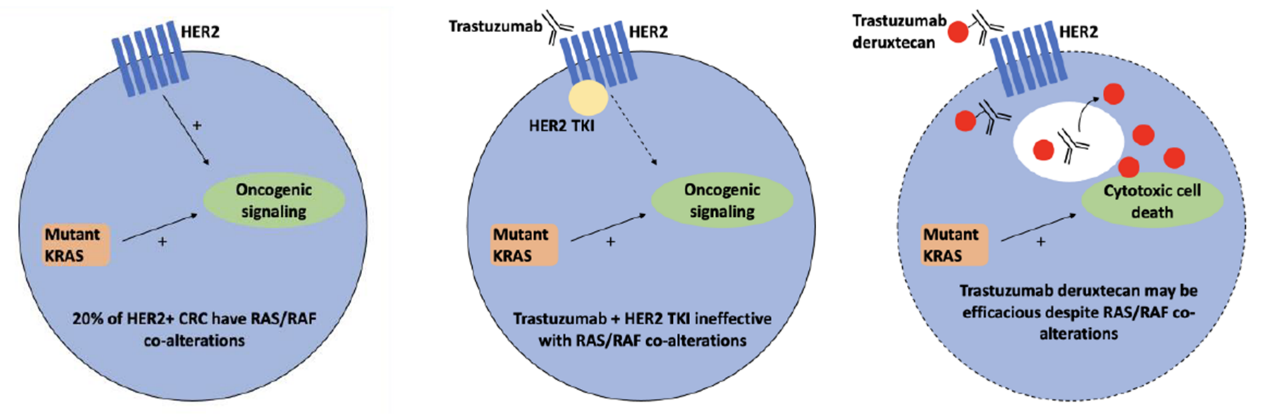
图5:HER2靶向治疗mCRC的模拟示意图:RAS/RAF共突变的肿瘤对基于曲妥珠单抗的HER2联合治疗耐药,但可能对HER2 ADC(如DS-8201)有反应
合并RAS/RAF突变作为ERBB2扩增型CRC的一个独特亚型,增加了肿瘤内异质性、病灶间不一致性和对基于曲妥珠单抗联合治疗的耐药性。未来有必要围绕DS-8201对这些ERBB2扩增CRC队列展开进一步探索。
本期看点:
1、PARADIGM研究的探索性生物标志物分析评价了ctDNA检测的基因改变与疗效结局之间的相关性,重点关注了与EGFR抑制剂耐药相关的泛基因改变,结果提示利用ctDNA进行阴性负向超选可能成为指导mCRC患者最佳治疗的选择。
2、SYNCHRONOUS和CCRe-IV试验的联合分析发现对于同时性转移的结肠癌患者,原发灶无症状的情况下,系统性化疗前进行原发灶切除与OS延长无关,还可能引发更多的AE。
3、一项国内单臂II期研究探索了化疗联合PD-1单抗诱导治疗后进行长程放化疗的TNT模式对pMMR状态的高危直肠癌患者的安全性和有效性,并确定与疗效相关的潜在分子生物标志物。
4、在ERBB2扩增的CRC队列中探索了合并RAS/RAF突变时对HER2靶向治疗的反应和耐药性影响,发现了肿瘤内和病灶间的异质性以及对基于曲妥珠单抗联合治疗的耐药性,但DS-8201可能治疗这类共突变患者有效,仍值得进一步探索。
1、Shitara K, Muro K, Watanabe J, et al. Baseline ctDNA gene alterations as a biomarker of survival after panitumumab and chemotherapy in metastatic colorectal cancer. Nat Med. Published online February 12, 2024.
2、Rahbari NN, Biondo S, Frago R, et al. Primary Tumor Resection Before Systemic Therapy in Patients With Colon Cancer and Unresectable Metastases: Combined Results of the SYNCHRONOUS and CCRe-IV Trials. J Clin Oncol. Published online February 27, 2024.
3、Li Y, Pan C, Gao Y, et al. Total Neoadjuvant Therapy With PD-1 Blockade for High-Risk Proficient Mismatch Repair Rectal Cancer. JAMA Surg. Published online February 21, 2024.
4、Singh H, Sahgal P, Kapner K, et al. RAS/RAF co-mutation and ERBB2 copy number modulates HER2 heterogeneity and responsiveness to HER2-directed therapy in colorectal cancer. Clin Cancer Res. Published online February 12, 2024.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


