头颈部肿瘤是全球第六大常见肿瘤类型,每年有超过80余万新发病例和40余万死亡病例。我国头颈部肿瘤约占全身肿瘤的5%,其中头颈部鳞状细胞癌(HNSCC)是最常见的类型。但是由于头颈部解剖结构比较复杂,异质性较高,导致不同部位、不同亚区的治疗手段和预后模式均有所不同。在此,【肿瘤资讯】特别邀请河南省肿瘤医院头颈甲状腺外科李鹏主任为大家分享局部晚期HNSCC新辅助治疗的最新研究进展及临床诊疗发展。
河南省肿瘤医院
头颈甲状腺外科
中国抗癌协会甲状腺癌整合康复专委会常务委员
中国抗癌协会中西整合甲状腺癌专委会委员
中国医促会外科学分会委员
中国研医会甲状腺专委会青年委员
中国研医会甲状腺专委会围手术期学组秘书
河南省医学会甲状腺专委会青委副主任委员
河南省医学会耳鼻咽喉头颈外科专委会委员
河南省抗癌协会理事会青年理事
河南省医师协会甲状腺专委会秘书及委员
河南省抗癌协会头颈肿瘤专委会委员及秘书
河南省甲状腺疾病诊疗中心秘书
河南省肿瘤医院科技拔尖人才
先后到美国纪念斯隆-凯特琳癌症中心和美国罗斯威尔-帕克癌症研究所交流访问;发表文章30余篇,其中SCI收录25篇;主持或参与国自然课题2项、省厅级课题6项;荣获省厅级成果4项
探索前沿,新辅助免疫治疗再拓局部晚期HNSCC治愈新希望
李鹏主任:研究表明,与传统的单一学科诊疗模式相比,多学科(MDT)诊疗有助于缩短治疗等待时间,改善患者的整体治疗预后。目前,国内外治疗HNSCC均建议遵循MDT诊疗模式,重视包括外科、内科、放疗科、免疫治疗科等在内的多学科团队合作,并制定综合治疗方案。对于早期头颈部肿瘤患者,临床可采取外科手术切除肿瘤,也可与放疗等进行联合治疗。同时,放疗作为头颈部肿瘤的主要治疗手段之一,无论是早期、局部晚期、复发和转移的患者都可适用。此外,多年来,化疗方案有所改进,但仍面临着诸多挑战;靶向治疗、免疫治疗的加入,则为局部晚期HNSCC患者带来了更多治疗选择。
一项发表于《肿瘤学年鉴》的研究指出,局部晚期HNSCC的治疗模式可大致分为两大块:一、可手术切除患者应直接进行外科手术,而有强烈的器官保留意愿的患者可采取新辅助治疗后再进行手术;二、不可手术患者多采取放疗、化疗及MDT治疗。目前临床对于是否需要进行新辅助治疗存在较大争议。新辅助治疗的目的主要有:1、缩小肿瘤体积,降低肿瘤分期,使因为瘤块体积较大而无法进行根治性切除的患者能够行根治性手术或者放疗;2、在肉眼或影像学未发现可能出现的远处转移灶的情况下,新辅助治疗可提前杀死进入循环的肿瘤细胞;3、肿瘤对新辅助治疗的反应有助于预测患者抗肿瘤治疗的效果,判断预后。
2023年发布于医学顶刊《新英格兰医学》杂志上的SWOG 1801研究提出了首个免疫新辅助治疗+手术+辅助治疗的“三明治”治疗模式,在恶性黑色素瘤领域及头颈癌领域引起强烈反响,展现出了新辅助免疫治疗的巨大潜力:原发灶存在时,新辅助免疫治疗可以诱导原发灶组织驻留记忆T细胞产生局部快速免疫应答,使活化的T细胞克隆明显扩增,多样化增加,从而诱发全身持久免疫反应;术前新辅助治疗可保留淋巴结的完整性,从而引导特化抗原呈递细胞在肿瘤内交又呈递,并移动到引流淋巴结以呈递肿瘤抗原,极大地提高免疫治疗效果。
以替雷利珠单抗为例,其具有Fc段改造的独特结构优势,不结合巨噬细胞,避免了ADCP效应,不仅可以避免效应T细胞的消耗,有效杀伤肿瘤细胞,而且可以避免正常组织的损伤,大大降低不良反应,成为HNSCC新辅助治疗的新选择。2023年ASCO大会中公布的低剂量放疗联合替雷利珠单抗联合化疗新辅助治疗可切除的局部晚期HNSCC的Ⅱ期临床研究(NeoRTPC02)中共纳入10例未经治疗的、经病理学确诊的可手术的局部晚期HNSCC(包括口腔、口咽、下咽、喉)患者,并取得了较好的疗效。研究结果显示,在7例完成新辅助治疗和手术的患者中,57%(4/7)的患者达到病理完全缓解(pCR),达到第一阶段统计学目标;100%(7/7)的患者达到主要病理缓解(MPR)。另一项替雷利珠单抗联合化疗新辅助治疗局部晚期口腔/口咽鳞癌的Ⅱ期研究结果亦令人鼓舞。研究结果显示,29例患者接受了手术,R0切除率为100%,41.4%(12/29)的患者达到pCR,65.5%(19/29)的患者达到MPR。
实例分享,新辅助治疗HNSCC患者获益显著
李鹏主任:在此,我想与大家分享几例我们中心治疗的HNSCC病例。
病例一(图1):本例患者的活检病理示:高分化鳞癌;免疫组化示:KI-76 40%、P16-、P53(+)10%;PD-L1 CPS评分示:(22C3): 80、(SP263): 90,为越过中线的舌癌(T4期)。该例患者可进行舌癌大部切除+皮瓣修复术,但患者拒绝手术。在与患者充分沟通后,临床给予3周期的TP(紫杉醇+铂类)联合细胞程序性死亡蛋白受体1(PD-1)抑制剂方案进行治疗。治疗3周期后,肿瘤缩小明显。后因疫情、赠药活动,患者继续使用免疫单药维持治疗近3年。目前,患者的肿瘤病灶完全消失,舌体运动及感觉与常人无异。
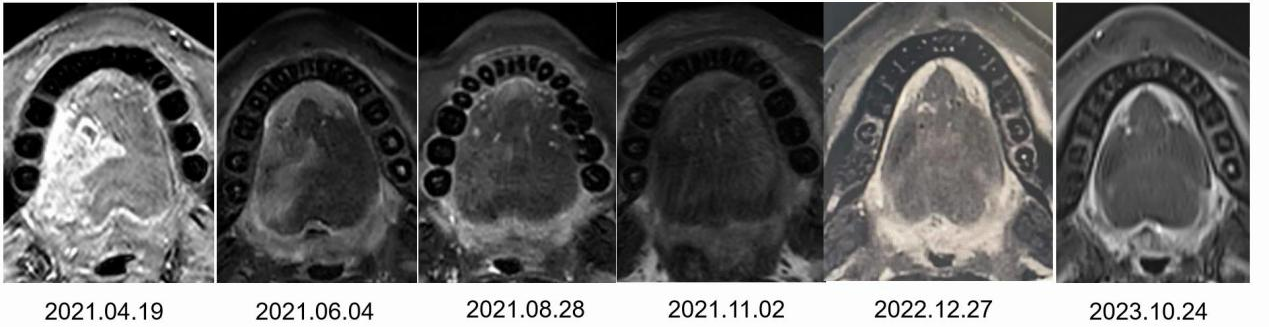
图1
病例二(图2):该患者于前年来我院就诊,PD-L1 CPS评分示:(22C3) : 10、(SP263):15,为越过中线的口咽癌。经2~3个周期的TP+ PD-1新辅助方案治疗后,疗效评估为完全缓解(CR)。因存在肉眼可见微小瘢痕挛缩,后续进行了手术治疗。术后发现原肿瘤病灶已达到pCR,且未有淋巴结转移。
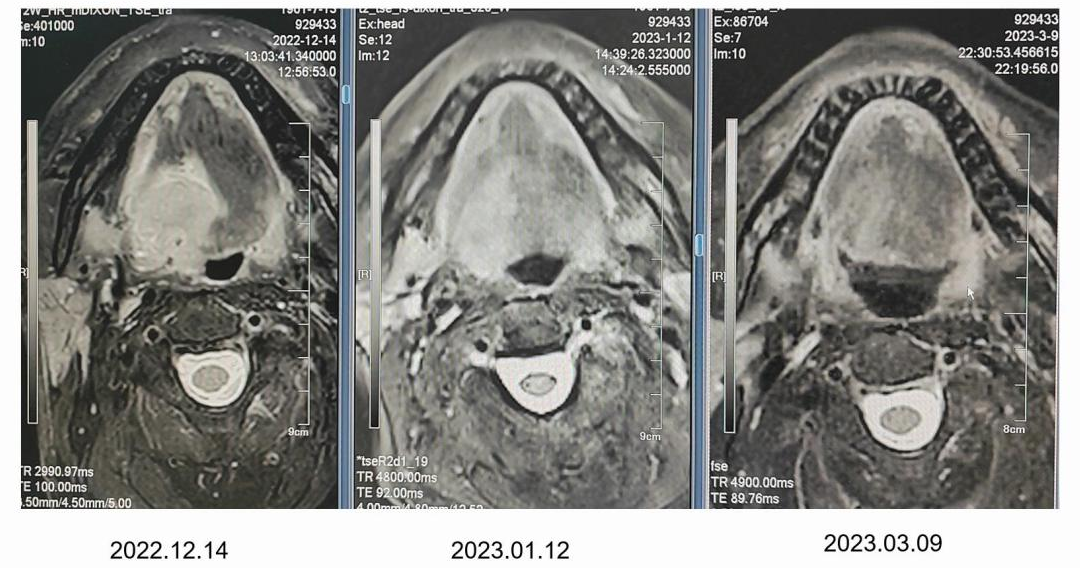
图2
病例三(图3):该临近中线的舌癌患者经2周期的新辅助化疗治疗后,疗效达到CR。
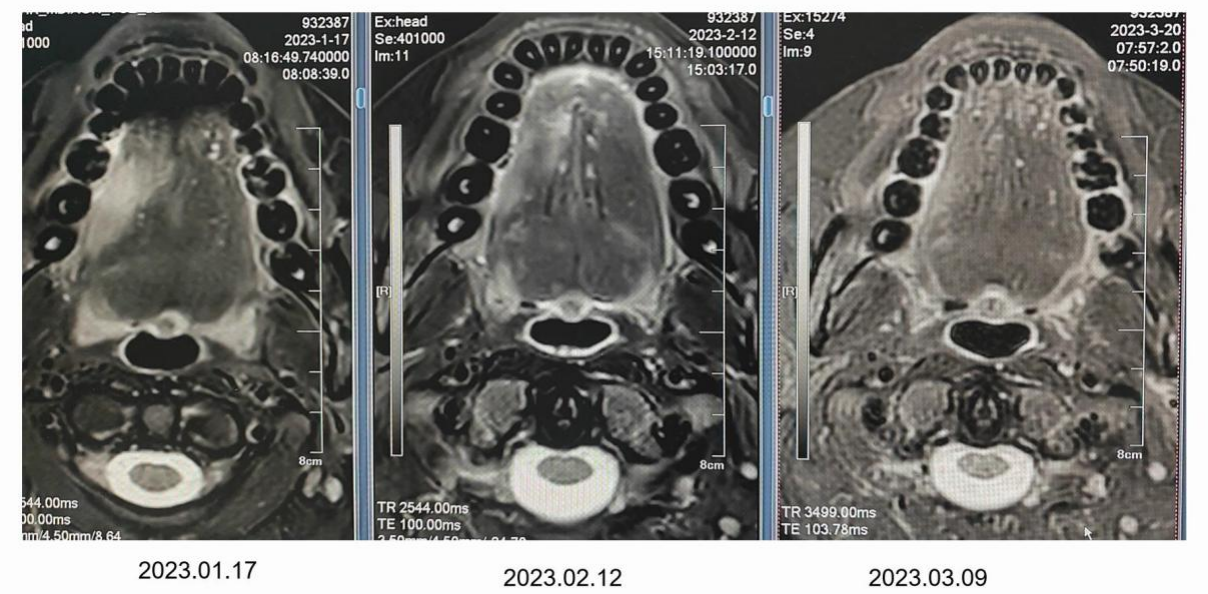
图3
病例四(图4):该患者为舌根中后1/3舌癌及部分口咽癌。经治后达到部分缓解(PR),随后进行了手术,疗效很好。
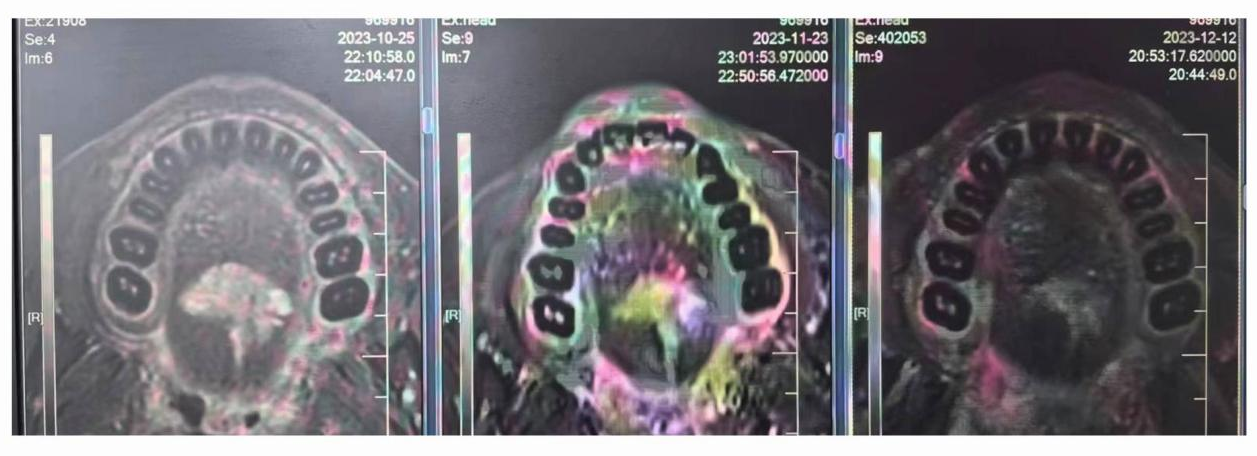
图4
病例五(图5):该喉癌患者有较强的保留喉部功能的意愿。经新辅助治疗后,喉腔占位明显缩小至完全消失。随后,继续放疗。患者已完成治疗至今已有三年余,疗效评估CR。
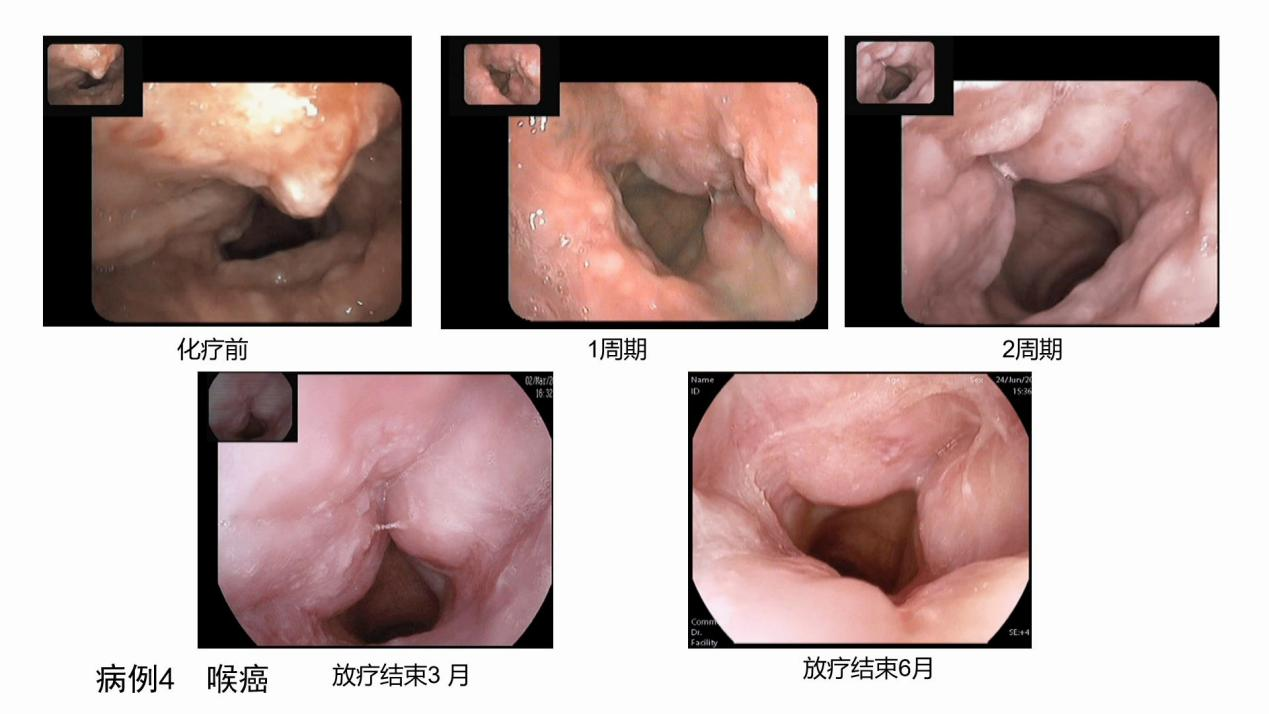
图5
病例六(图6):该患者为声门上型喉癌,经治后疗效评估为CR。
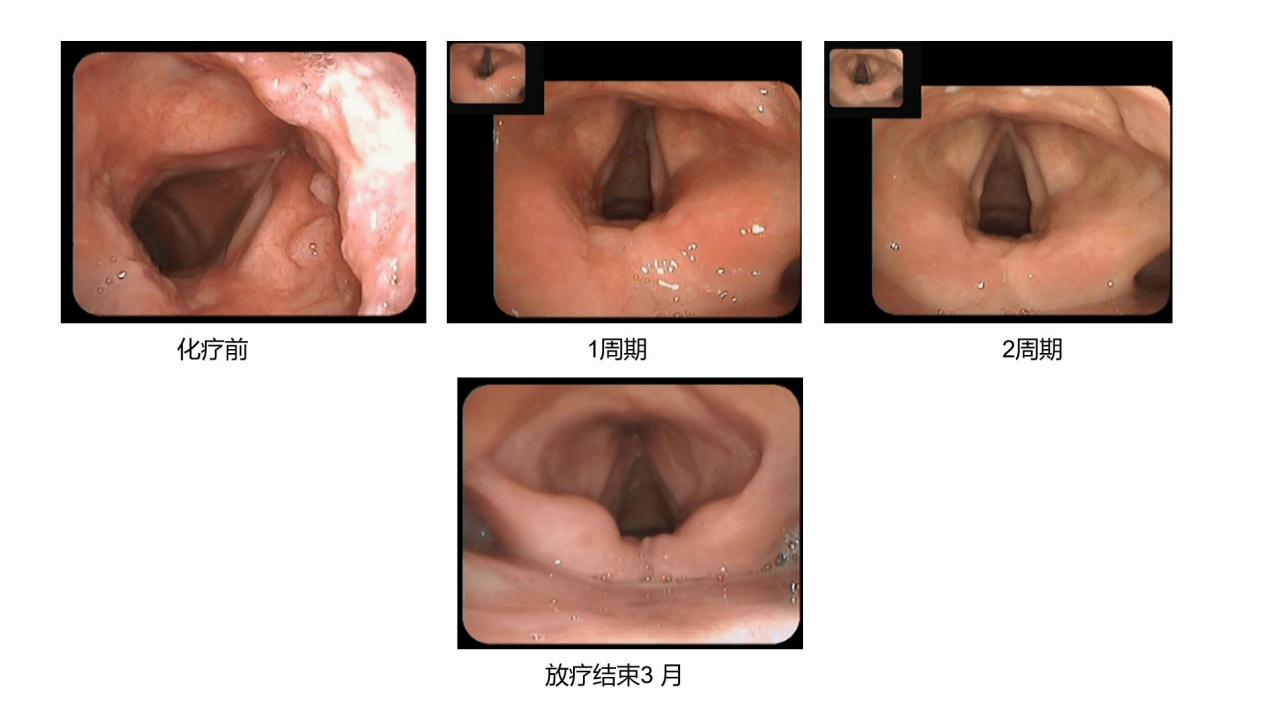
图6
病例七(图7):该患者入院时呼吸困难,喉镜示:肿物几乎占满喉腔。患者十分拒绝手术,临床给予TP+PD-1抑制剂新辅助治疗,并联合放疗。疗效评估为CR。至今已过去了两年多,患者近期复查见:声门、声带活动及两侧梨状窝、会咽部均未见异常。
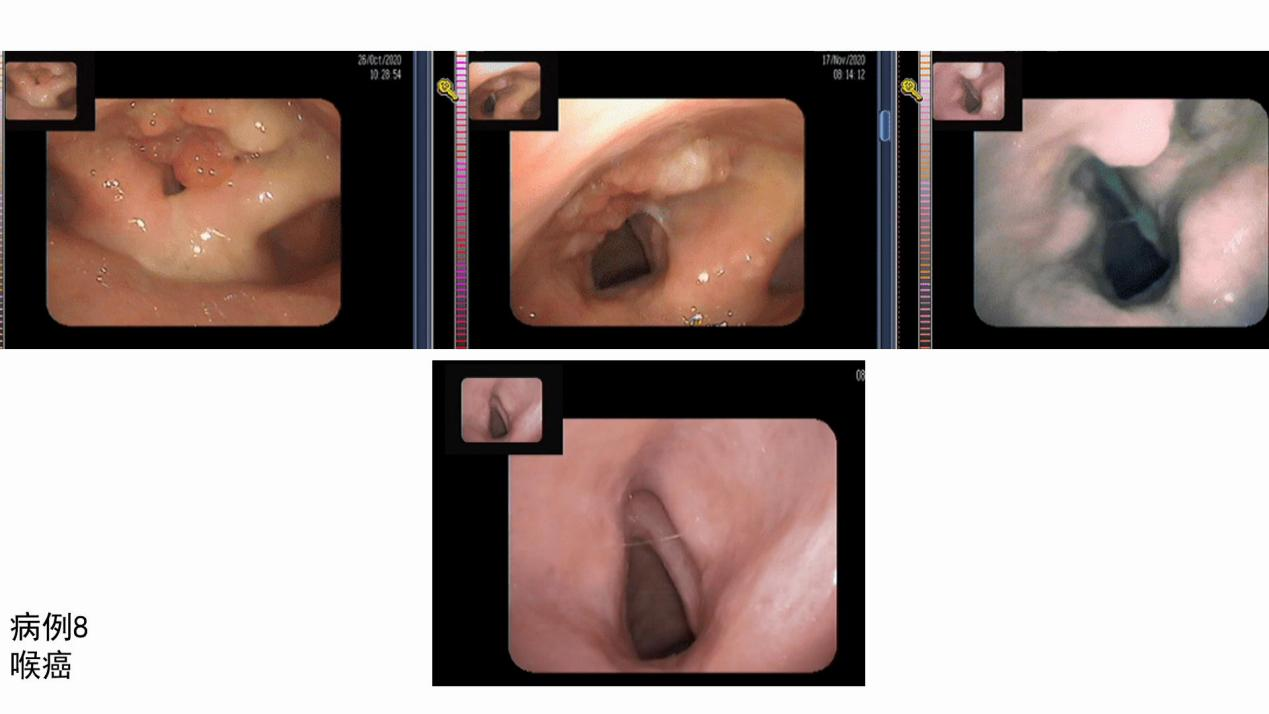
图7
病例八(图8):该患者为舌尖舌癌,新辅助治疗后影像学评估为CR。因患者比较担忧,遂进行了进一步的局部切除手术,病理性评估亦为PCR。
图8
病例九(图9):该下咽癌患者经1~2周期的新辅助治疗后疗效显著,且声带白斑随之消失,为临床治疗声带白斑提供了更多思路。
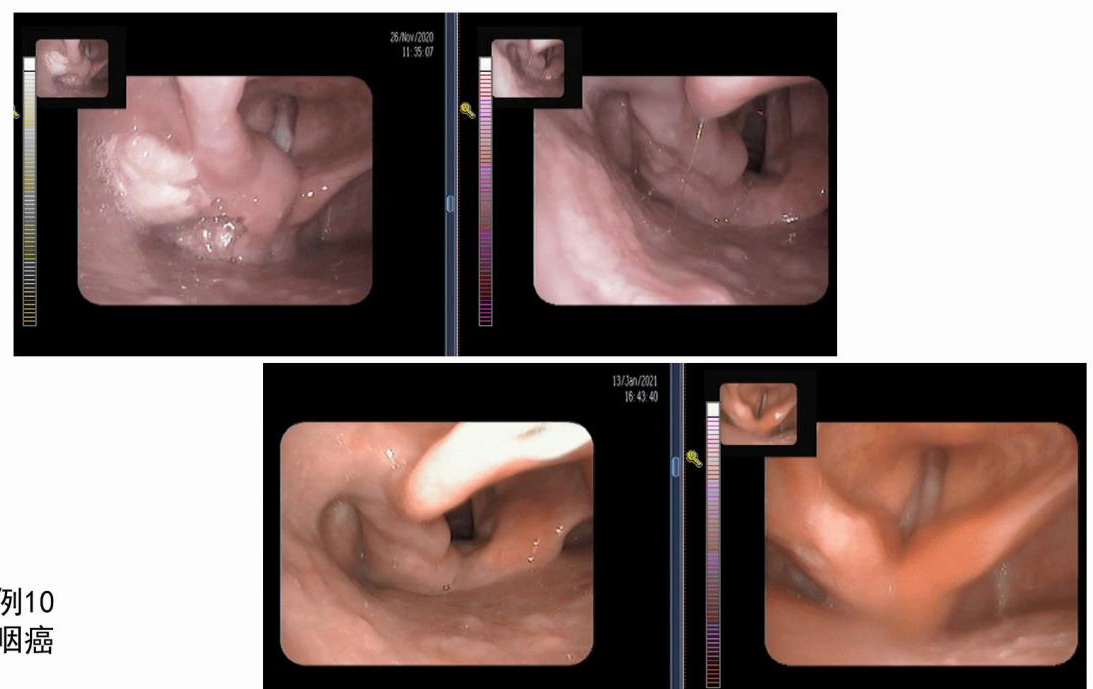
图9
病例十(图10):对于该早期舌癌患者,临床建议直接手术治疗,但患者选择尝试新辅助方案治疗。经治后,疗效评估CR,手术切除后原发灶为PCR, 淋巴结内可见角化、坏死及多核巨细胞,符合化疗后改变,也是PCR。
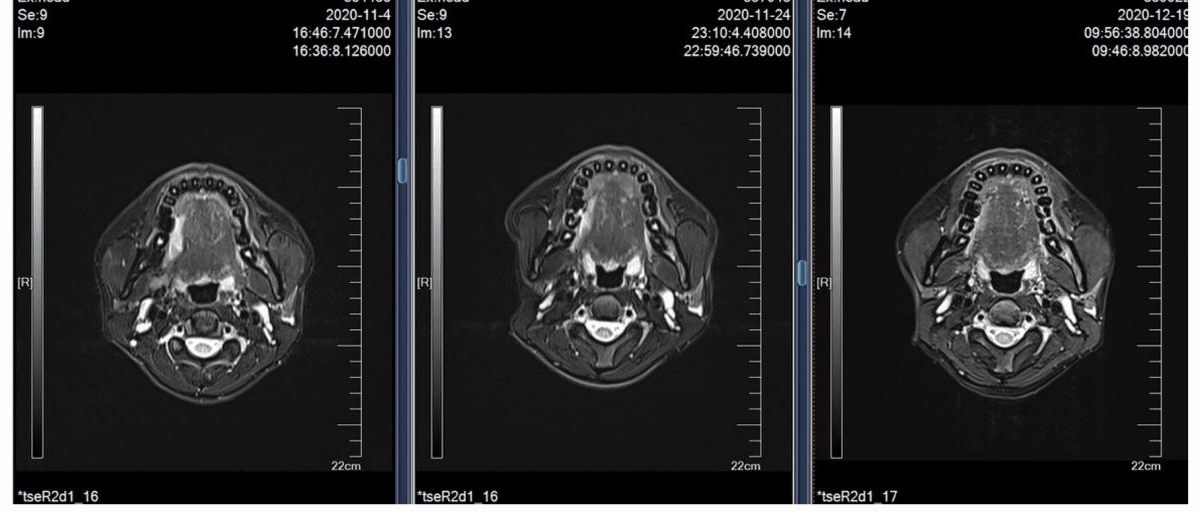
图10
慎思明辨,洞悉头颈部肿瘤的未来研究方向
李鹏主任:当然,除了疗效显著的患者外,也有部分患者的临床疗效不佳。如下图11,患者为累及下部内侧的口咽癌,经2周期的新辅助治疗后,疗效评估为疾病进展(PD)。临床立即进行了手术治疗,术后半年后疾病复发,伴脑部转移、胸膜转移。这也提示临床治疗过程中,若患者新辅助治疗效果不佳,其近期疗效和远期疗效可能均不佳。图12所示的患者同样是累及甲状腺的声门型喉癌,疗效不佳,全候切除术后发现该肿瘤侵及环状软骨。可见,肿瘤侵袭下颌骨、环状软骨、甲状软骨等部位的患者疗效不如只侵袭软组织的患者。图13所示的患者为黏膜癌侵及下颌骨,新辅助治疗的效果不佳,手术切除后发现脉管癌栓。图14为一例舌根癌患者,疗效评估为病情稳定(SD)或小PR,手术切除发现残留病灶。
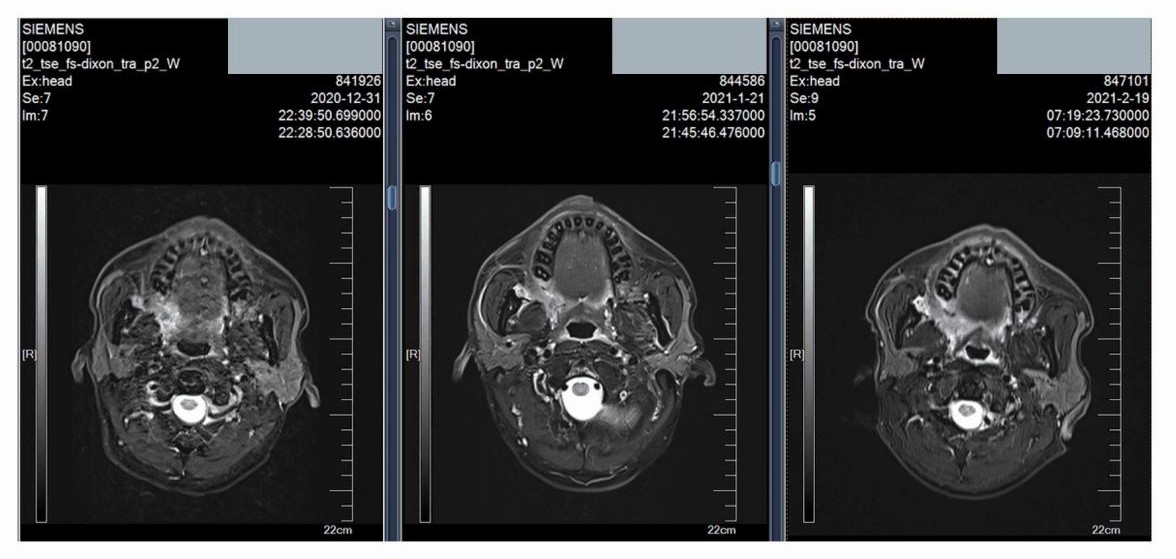
图11
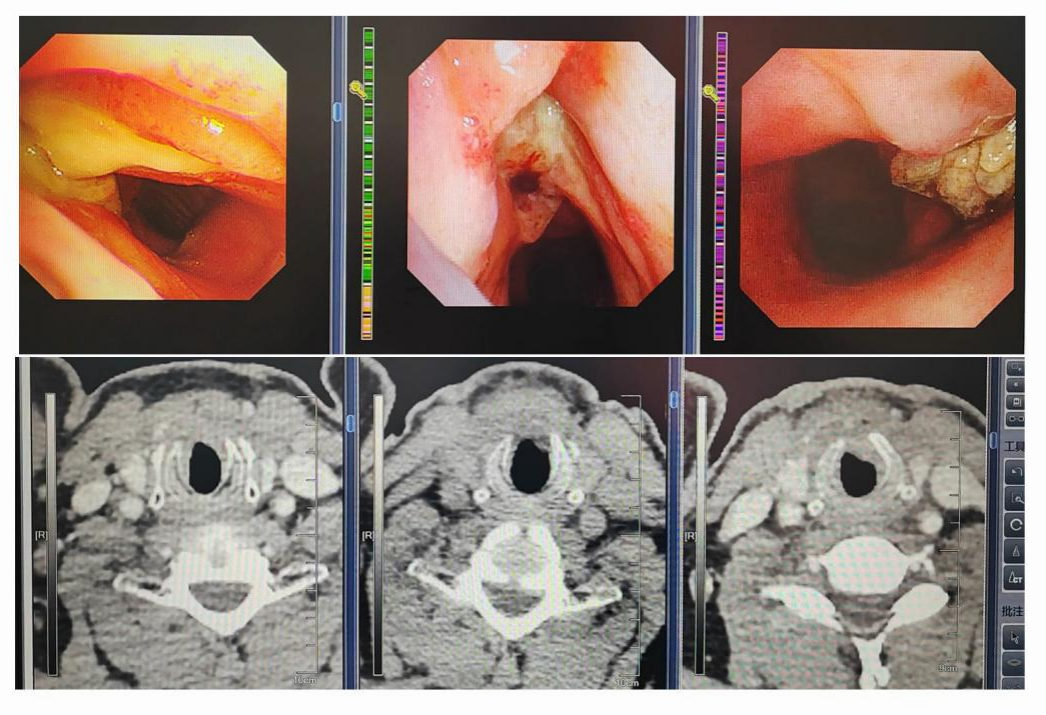
图12
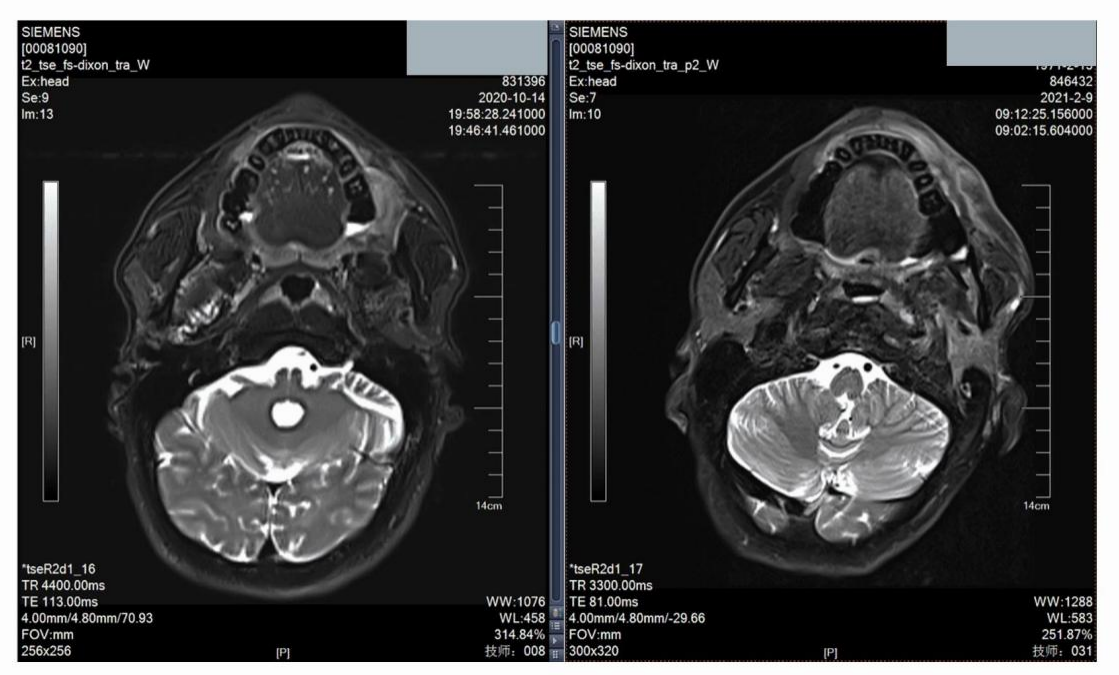
图13
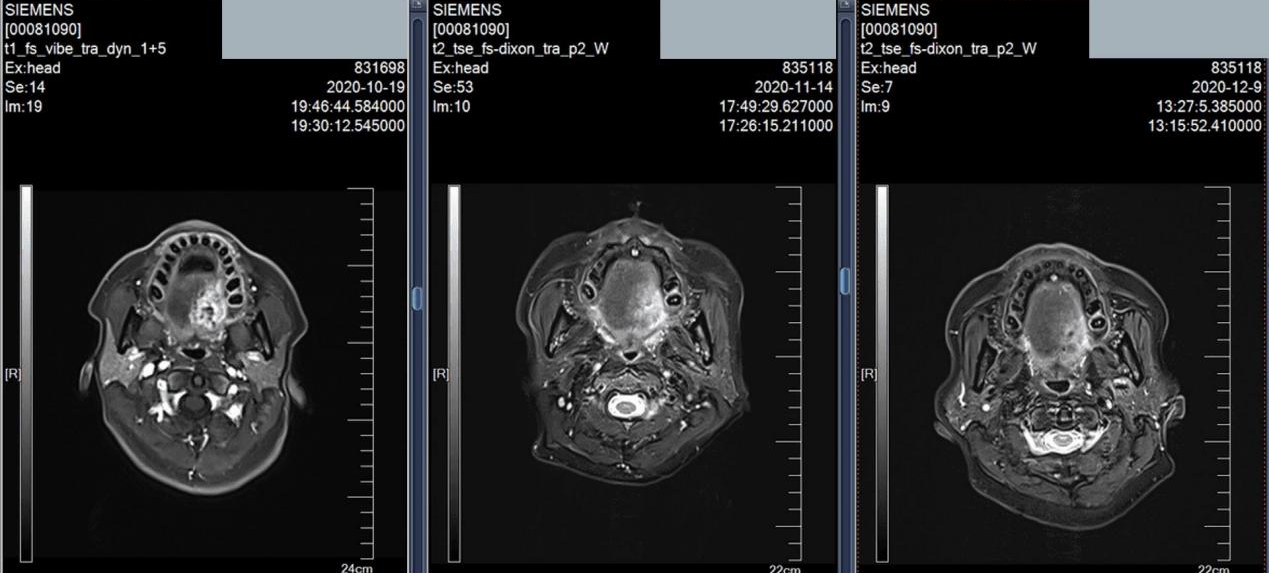
图14
这不禁令人思考免疫联合化疗是否可以开启HNSCC治疗的新时代?既往循证医学数据及临床治疗经验显示,免疫治疗的加入的确为临床提供了更多的治疗选择,为患者带来了更多希望。但在使用相同治疗方案的情况下,仅存在原发灶的患者疗效好于存在淋巴结转移的患者,而一旦肿瘤累及骨组织等,临床疗效普遍不佳。此外,有临床发现,口腔癌的疗效不如口咽癌,口咽癌的疗效不如喉癌,喉癌的疗效不如下咽癌,下咽癌的疗效不如颈段食管癌。目前国内外相关研究缺乏长期随访疗效数据,临床中亦存在很多争议话题。如患者是否会出现复发?如果复发,会不会出现冰冻颈、咽痿、冰冻口底?是否会导致手术困难?淋巴结转移患者疗效不佳时,临床应如何处理?若原发灶CR,淋巴结PR/SD,能否只做淋巴结清扫?手术切除的范围如何选择?正因为这些问题的存在,更促使我们继续探索,帮助临床确定未来研究的方向与目标。总之,新药的研发为临床治疗带来了新的治疗选择,让医生多了一个武器,使患者多了一份希望,但未来的路还很长,期待更多新方法、新证据的出现,让更多患者可以从中获益。
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


