免疫检查点抑制剂(ICI)已成为治疗非小细胞肺癌(NSCLC)的标准药物;然而,其使用中的关键限速步骤是发生主要归因于药物诱导的T细胞失调的一组独特炎性副作用的风险,称为免疫相关不良事件(irAE)。irAEs的识别、诊断和管理已成为临床实践的关键,其潜在的高度毒性影响着治疗决策。本文总结了标准ICI方案的常见和严重毒性,重点关注新兴NSCLC治疗环境中的特殊考虑,如围手术期治疗、胸部放疗(RT)、ICI/靶向治疗组合的使用以及副肿瘤综合征患者。此外,还讨论了未来的发展方向,包括irAE的诊断、管理和预防的新进展,以及这可能对胸部肿瘤学产生的影响。
PD-(L)1抑制剂单药治疗的第一致命毒性——肺炎
背景和发病率
肺炎是NSCLC中PD-1抑制剂单药治疗最常见的irAE,帕博利珠单抗或纳武利尤单抗治疗的发生率为3%-7%,接受纳武利尤单抗和伊匹木单抗双重免疫检查点阻断的患者的发病率较高,总体为8.3%,3-4级事件为3.3%。大多数晚期NSCLC患者接受三药化疗-IO方案一线治疗,其中ICI-P的总体发生率与ICI单药治疗相似或更低(3+级:KEYNOTE-189为4.4%-6.5%; KEYNOTE-407为2.8%-3.1%)。在接受四种药物联合治疗的患者中(IMpower 150:卡铂/培美曲塞/贝伐珠单抗/阿替利珠单抗或CheckMate-9 LA:双联化疗×2剂+伊匹木单抗/纳武利尤单抗),ICI-P发生率出奇地低,分别为2.8%-5.9%(所有级别)和1.5%-2.8%(高级别)。IMpower150中ICI-P发生率略低可能与抗PD-L1药物的使用有关。但在荟萃分析中已经证实,当在抗PD-(L)1 ICI的基础上加用化疗治疗NSCLC时,所有级别和高级别ICI-P的发生率均翻倍。
在真实世界研究中,ICI-P的发生率通常高于临床试验。在对接受化疗和放疗后免疫治疗的III期NSCLC患者的研究中,肺炎的发病率通常合并考虑免疫相关或放疗相关事件,总发病率高达33%。令人欣慰的是,这些研究中高级别肺炎的总体发病率较低,为1%-4%。最近的多变量分析显示,没有患者或治疗的重要因素与严重程度相关。
风险因素、诊断和管理
ICI-P临床表现多种多样,从临床无症状但表现出放射学ICI-P,到出现轻微咳嗽,再到临床严重呼吸困难或出现新的吸氧需求。ICI-P较差预后的风险因素包括间质性肺病(ILD)、当前吸烟和既往胸部放疗;然而,这些因素尚未在前瞻性数据集中得到确认。ICI-P的发病时间变异性是一个关键的临床特征,这使其与其他毒性区分开来。尽管大多数irAE发生在治疗的前3个月,但ICI-P的中位发病时间从11-34周不等,范围从1.5-127周,甚至在最后一次ICI给药后的数月内。ICI-P的诊断是排除性的,必须排除其他临床状况,包括感染、ILD或既往放射治疗。在ICI治疗前对有既往ILD的患者进行多学科评估,包括临床、放射学和肺功能评估,可以提供一个全面的基线评估,以便解释ICI-P的变化。支气管肺泡灌洗 (BAL) 样本的影像学检查结果和病理学评估可用于支持初始诊断,因为可用于排除其他病因。Fleischner Society 已通过CT成像识别和完善了ICP-P的影像学亚型,包括五类:隐源性机化性肺炎、磨玻璃影、超敏反应、间质性肺炎和非特定性肺炎,其中机化性肺炎亚型与更严重的临床病程相关(图1)。在治疗方面,指南推荐的治疗方案建议对有症状的ICI-P(2级)使用0.5-1 mg/kg的皮质类固醇治疗,口服或静脉注射,对高级别(3级+)使用甲泼尼龙1mg/kg,在4-6周内逐渐减量。尽管大多数患者对高剂量糖皮质激素有反应,但在48-72小时后无反应的患者被认为是糖皮质激素难治性,会考虑二线免疫抑制治疗(如环磷酰胺、英夫利昔单抗、静脉注射免疫球蛋白[IVIG]、吗替麦考酚酯[MMF])。糖皮质激素难治性病例通常发生在治疗过程的早期,并且已发现多达18%的患者被转诊至多学科治疗,患者死亡率>50%。这种情况下的最佳免疫抑制治疗方案尚不清楚,但一项前瞻性临床试验(EAQ172: NCT04438382)正在头对头比较IVIG和英夫利昔单抗这两种常用方案。
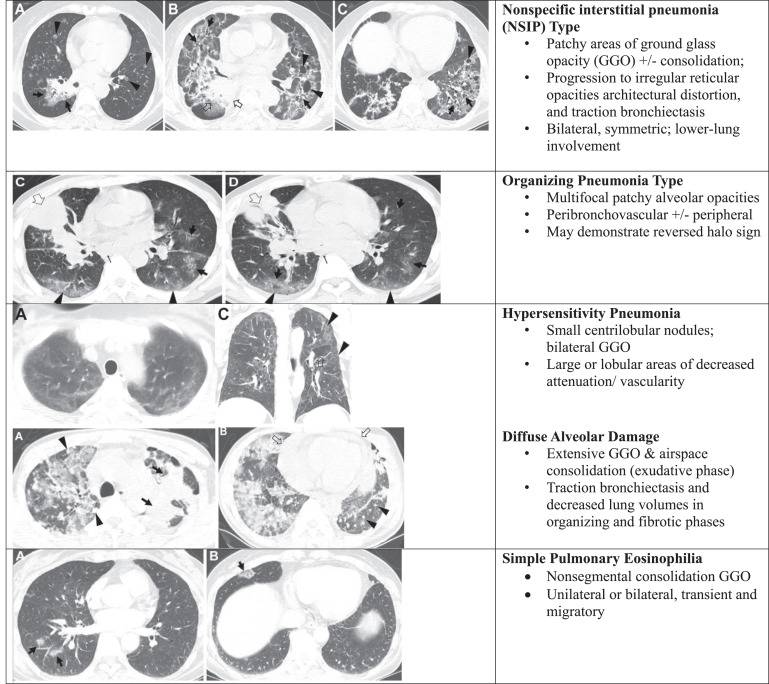
图1.Fleischner ICI-P的放射学亚型
PD-(L)1/CTLA-4联合治疗的第一致死毒性——心肌炎
背景和发病率
心肌炎是最常见的心脏irAE,但心包炎、心肌病、心力衰竭、心律失常和心包积液均有报道。虽然总体发病率较低(<1%),但心肌炎是 PD(L)-1/CTLA-4 联合治疗中致死率最高的irAE,死亡率高达50%。与单独使用 PD-(L)1 相比,接受 PD-(L)1/CTLA-4 联合治疗的患者的发病率显着增加。骨骼肌肌炎和横纹肌肌溶解导致的呼吸衰竭并发被认为是导致高死亡率的原因。许多最初的ICI 3期试验没有记录到心脏毒性病例;然而,这可能是由于样本量小或难以诊断ICI诱发的心肌炎。
危险因素、诊断和治疗
除了联合治疗外,没有证实的心肌炎危险因素,但正在对潜在的危险因素进行调查,例如预先存在的心血管疾病、自身免疫性疾病和遗传因素。中位发病时间为30天(范围:2-54 周)。尽管迄今为止的证据尚未发现常规心电图和心脏生物标志物对评估后续心肌炎风险有益,但进行这些评估的门槛较低。症状从疲劳、胸痛、晕厥或呼吸急促到心源性休克、急性心力衰竭和致命性心律失常不等。在症状发作后72小时内,肌钙蛋白(T和I)、肌酸激酶、肌酸激酶-MB和脑利钠肽升高,发现肌钙蛋白-T比肌钙蛋白-I更敏感。心电图可检测新的心律失常,如心房颤动、室性心动过速或心脏传导阻滞。从影像学角度来看,心脏磁共振成像(T1+T2)在明确诊断方面优于超声心动图。然而,心内膜心肌活检仍然是诊断心肌炎的公认标准。ICI心肌炎的治疗很复杂,因为使用大剂量皮质类固醇或二线免疫抑制(阿巴西普、血浆置换、MMF)进行标准化irAE治疗仍会导致死亡率超过60%。然而,在一项前瞻性研究中,皮质类固醇、阿巴西普和JAK2抑制剂芦可替尼联合使用,与超过30%的死亡率相比,可使死亡率降低3.4%。一项前瞻性研究(ATRIUM)正在评估阿巴西普在类固醇难治性心肌炎(NCT05335928)中的应用。
PD-(L)1 单药治疗的最常见毒性——内分泌毒性
背景和发病率
ICI诱发的内分泌疾病可影响内分泌和外分泌系统。甲状腺功能障碍是PD-(L)1单药治疗最常见的ICI诱发的内分泌病,而垂体炎是CTLA-4抑制剂最常见的ICI内分泌病。甲状腺功能亢进症或甲状腺功能减退症可以独立发生,也可以在ICI介导的甲状腺炎范围内发生。在发生甲状腺炎的患者中,患者会出现快速进展的甲状腺毒性状态,随后游离甲状腺素 (T4) 急剧下降,导致甲状腺功能减退。所有ICI的甲状腺功能障碍发生率都相对较高。垂体炎很少见,在已发表的含ICI治疗NSCLC的3期试验中,只有不到1%的患者发生垂体炎。双重CTLA-4/PD-(L)1阻断的内分泌irAE发生率很高。与单药治疗相比,化疗-IO联合治疗的内分泌irAE发生率相似,甲状腺功能减退症的发生率为7%-13%。
危险因素、诊断和治疗
ICI内分泌病发作的中位时间为14.5周(范围:1.5-130周)。虽然大多数ICI诱发的甲状腺炎和甲状腺功能减退症患者无症状,但垂体炎患者常表现为疲劳、肌无力、关节痛、恶心、厌食、视力改变和生化体征。由于癌症相关疲劳可能与这些表现相似,因此接受ICI治疗的患者应定期进行常规T4和促甲状腺激素水平评估,并在相关情况下进行甲状腺抗体评估(甲状腺过氧化物酶抗体[TPO]、甲状腺球蛋白抗体和促甲状腺激素受体)。在危险因素方面,在开始ICI之前具有可检测到TPO抗体的患者更有可能发生ICI-甲状腺功能障碍。与大多数其他irAE不同,ICI诱导的内分泌病不需要停用ICI。ICI介导的甲状腺炎可通过监测或β受体阻滞剂进行治疗,以控制症状,然后进行甲状腺素替代治疗。有趣的是,患有ICI甲状腺炎和抗TPO抗体阳性的患者可能需要更高剂量的甲状腺素,这可能是由于甲状腺的破坏更快。此外,患有严重甲状腺毒症的患者,包括有眼部体征或甲状腺肿的患者,可以考虑在抗甲状腺药物的同时使用糖皮质激素,这是该规则的典型例外。我们知道,大多数发生甲状腺功能障碍的患者可能会有永久性后遗症,而另一些患者则会恢复内分泌功能。在评估 KEYNOTE-010的5年结局数据时,25.3%的患者患有持续性甲状腺功能减退症,而在接受 2年(或35个周期)帕博利珠单抗治疗的患者中,8.9%的患者患有甲状腺功能亢进症。
PD-(L)1 单一疗法和联合疗法的最早毒性——皮肤毒性
背景和发病率
在接受ICI联合治疗方案的患者中,高达50%-70%的患者会出现皮肤毒性,并且是临床上最早出现的。皮肤irAE的范围从低级别严重程度,包括皮疹/麻疹样皮疹(影响23%接受ICI的患者,5%的患者≥3级)、瘙痒、白癜风样色素脱失和苔藓样皮炎,到不太常见但更严重的反应,例如Stevens-Johnson综合征、中毒性表皮坏死松解症和大疱性类天疱疮。ICI类别往往会引起特定的皮肤毒性,CTLA-4抑制剂更常见皮疹和瘙痒,抗PD-(L)1更常见瘙痒或白癜风。化疗-IO联合治疗的皮肤毒性发生率似乎取决于所使用的特定ICI治疗,而不是化疗联合治疗。
危险因素、诊断和治疗
皮肤irAE最早发生在ICI开始后4周。严重的皮肤反应,包括 Stevens-Johnson综合征、中毒性表皮坏死松解症、药疹伴嗜酸性粒细胞增多和全身症状综合征,通常在早期出现,伴有发热、皮疹、皮肤脱落和终末器官功能障碍。皮肤活检有助于排除其他病因,确定特定的皮肤毒性,以及详细的用药史和过敏史。治疗取决于CTCAE分级,使用对体表面积的评估进行分级,并评估大疱发育或黏膜受累,从而将严重程度的毒性提升至3级。治疗通常包括局部润肤剂和抗组胺药,同时加用全身性皮质类固醇治疗2+级表现。全身性类固醇对接受ICIs治疗的患者生存的影响仍在研究中。皮肤毒性≥3级的患者需转诊至皮肤科专科医生,以考虑进行皮肤活检和类固醇保留免疫抑制剂。
化疗-IO的常见毒性——肾炎
背景和发病率
在接受ICI的患者中急性肾损伤(AKI)并不常见,但新数据表明,ICI诱导的AKI和肾炎在化疗-IO后可能更高。总发病率估计为2%-7%,但据报道高达29%,接受PD-(L)1/CTLA-4 的患者发病率更高。尽管ICI诱导的AKI可由多种因素引起,但多达20%的ICI 治疗患者可发生,但只有2%-5%会继续发展为ICI诱导的肾炎。ICI诱发肾炎的常见病因包括急性间质性肾炎、微小病变、免疫球蛋白A肾病和足细胞病。与其他irAE相比,这种毒性的潜伏期更长,中位发病时间为14至24周。肾毒性也可能由其他irAE引起。
危险因素、诊断和治疗
没有特定的临床特征可以区分ICI诱导的AKI和其他病因。患者最常表现为无菌性脓尿或肾病范围蛋白尿,但也可能出现尿频、面部、腹部或外周水肿和高血压。一项多中心研究发现,ICI诱导的AKI的危险因素包括同时使用PPI、CTLA-4/PD-(L)1 和较低的基线估计肾小球滤过率。CTCAE等级由肌酐水平升高至基线以上决定。因此,患者在每次ICI给药前应有基线肌酐水平,在疑似病例中,可考虑进行随机尿/肌酐比值和肾活检。影像学上,有一些证据表明,发生ICI诱导的AKI的患者肾皮层中F-氟脱氧葡萄糖摄取增加、CRP水平升高和尿肌酐水平升高可能表明这种毒性,但这些尚未得到验证。肾活检的适应症仍存在争议,在实践中,许多患者对1级肾炎进行保守治疗,或对2-4级肾炎进行经验性糖皮质激素治疗。ICI诱导的AKI治疗后肾功能未能恢复到基线水平与死亡率增加有关。肾毒性后重新引入ICI仍然是一个不确定的领域,需进一步研究。
免疫治疗和靶向治疗组合的常见毒性——肝炎
ICI诱发的肝炎通常无症状,在接受ICI的患者中发生率为18%,6%的患者发生≥3级事件。危险因素包括年龄较小、联合ICI(双联ICI或其他药物)和基线血清天冬氨酸转移酶水平。ICI单药治疗的ICI诱导肝炎的发生率较低,但使用两种ICI药物或化免联合可显著增加。
危险因素、诊断和治疗
免疫相关性肝炎患者的最佳诊断评估仍存在疑问。肝活检可能适用于一部分患者以确认诊断。ICI诱发的肝炎的组织病理学表现分为以下三种不同模式:肝炎(52%)、胆管炎(19%)和混合型(29%)。与其他irAE一样,大剂量皮质类固醇是治疗的基石。如果皮质类固醇治疗失败,通常使用MMF。其他治疗方式,如血浆置换和抗胸腺细胞球蛋白,已被发现在特定病例中有益。
ICI肝炎现在被认为是新兴的ICI靶向联合治疗试验的一个特定问题。KRAS G12C抑制剂sotorasib与同时抗PD-(L)1给药时的试验可能导致肝转氨酶升高(阿替利珠单抗组60%> 3级,帕博利珠单抗组79%)。通过调整给药以包括ICI前2周的sotorasib导入策略,这些组合的级别≥3级肝炎的发生率有所缓解,将阿替利珠单抗组的肝炎总发病率降低至30%,而帕博利珠单抗组为53%。但在其他KRAS G12C抑制剂中没有发现这种模式。
责任编辑:TY
排版编辑:TY
O'Leary CL,Pierce N,Patel SP,Naidoo J. Immune-Related Toxicity in NSCLC: Current State-of-the-Art and Emerging Clinical Challenges.J Thorac Oncol.2023 Nov 25:S1556-0864(23)02374-2. doi: 10.1016/j.jtho.2023.11.018.
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


