肿瘤相关贫血为肿瘤患者常见的不良反应,其发生率与肿瘤类型、治疗方案和周期疗程等均有关,其发病机制尚未明确。肿瘤相关贫血有可能导致化疗药物剂量降低、化疗时间延迟、需要输注红细胞等,从而增加患者的治疗费用、降低化疗效果和患者的生存质量、缩短生存时间。肿瘤相关贫血的主要治疗包括输注红细胞、促红细胞生成治疗和补充铁剂等。基于文献及临床研究的发展,中国抗癌协会肿瘤临床化疗专业委员会和肿瘤支持治疗专业委员会组织专家制定了《中国肿瘤相关贫血诊治专家共识(2023版)》,相较于《中国肿瘤化疗相关贫血诊治专家共识(2019年版)》,2023版共识采用了新的循证医学证据、纳入了中医相关内容,旨在为肿瘤相关贫血患者提供更为合理的诊疗方案,从而帮助患者改善肿瘤相关贫血,提高生存质量。
肿瘤相关贫血 (cancer related anemia, CRA) 主要是指肿瘤患者在疾病进展和 (或) 治疗过程中发生的贫血,表现为外周血中单位容积内红细胞数减少、血红蛋白浓度减低或红细胞比容 (red blood cell specific volume, HCT) 降低至正常水平以下。30%~90%的肿瘤患者合并贫血,其发生率及严重程度与年龄、肿瘤类型、分期、病程、治疗方案、药物剂量及化疗期间是否发生感染等因素有关。CRA会导致患者出现多脏器缺血缺氧性改变和免疫力降低,加剧疾病进展,影响预后,严重影响患者的生存质量。出血、溶血、机体营养吸收障碍、遗传性疾病、肾功能不全、内分泌紊乱及患者接受长期多种治疗等均为CRA发生的主要原因。
恶性肿瘤本身也能通过多种途径导致或加重贫血 ,如肿瘤直接侵犯骨髓产生细胞因子导致铁吸收障碍,肿瘤侵犯血管或器官导致慢性失血等。多数情况下,CRA属于低增生、正细胞性贫血,血清铁和转铁蛋白饱和度降低,而血清铁蛋白正常或升高。
化疗药物可通过阻断红系前体细胞的合成直接影响骨髓造血。细胞毒性药物的骨髓抑制效应可能会在重复治疗周期的过程中蓄积,导致贫血的发生率和严重程度随着化疗周期增多而增高和加重。铂类药物广泛应用导致的肾不良反应为CRA发生的一个重要因素 [ 8 ]。细胞毒性药物和铂类药物能促进红细胞凋亡,同时会造成肾小管细胞损伤导致内源性促红细胞生成素(erythropoietin, EPO)减少而导致贫血。化疗新药的开发及联合应用使贫血问题在临床上日渐凸显。
此外,靶向治疗药物也会引起血液不良反应,如PARP抑制剂可靶向作用于PARP1、PARP2、PARP3和PARP13,PARP除参与DNA修复外,在其他生理过程中也起到重要作用,PARP1调节骨髓或血液系统的细胞分化 ,PARP2在调节红细胞生成过程中发挥作用。研究表明,PARP2缺失会损伤小鼠红系细胞分化,增加溶血反应,导致贫血。贫血如果得不到有效治疗,会导致多脏器缺血缺氧性改变和免疫力降低,加剧疾病进展影响预后,严重影响患者生存质量。根据药物说明书,PARP抑制剂的贫血总体发生率为21%~70.8%,≥3级贫血发生率为5.9%~35.6%;奥拉帕利贫血发生率为21%~46%,3~4级贫血发生率约为5.1%~22%;尼拉帕利固定起始剂量用药人群 (300 mg,1次/d) 贫血总体发生率50.1%~70.8%,3~4级贫血发生率为25.3%~35.6%;个体化起始剂量用药人群 (200或300 mg,1次/d) 贫血总体发生率为49.7%~53.1%,3~4级发生率为14.7%~22.5%;氟唑帕利贫血总体发生率为58.7%~64.6%,3~4级发生率为25.1%~32.7%;帕米帕利贫血总体发生率为69.1%,3~4级发生率34.7%。多数贫血患者可表现为头昏耳鸣、体倦乏力、心悸气短、食欲不振及面色萎黄或苍白等症状和体征。
免疫抑制剂也会引起血液系统不良反应。CheckMate078研究显示,在纳武利尤单抗相关血液系统不良反应中贫血发生率约为4%,3~4级贫血发生率<1%。卡瑞丽珠单抗的Ⅰ期临床研究显示,贫血发生率为11%,其中3~4级贫血发生率为2%。由于肿瘤及其并发症、其他抗肿瘤治疗均可导致血细胞减少,因此在诊断免疫相关的血液系统不良反应时应排除这些因素。
因此,随着新治疗方法在肿瘤治疗中的广泛应用,临床医师应熟悉靶向、免疫治疗药物的不良反应,包括溶血性贫血,及时发现并给予相应的处理。中国抗癌协会肿瘤临床化疗专业委员会和肿瘤支持治疗专业委员会组织专家制定了《中国肿瘤相关贫血诊治专家共识(2023版)》,旨在为肿瘤相关贫血患者提供更为合理的诊疗方案,为临床医师提供相关指导。基于证据级别和专家意见形成以下共识,根据循证医学级别和专家意见对推荐级别进行了分类推荐 ( 表1 、表2 ) 。
表1共识推荐方案的证据级别分类
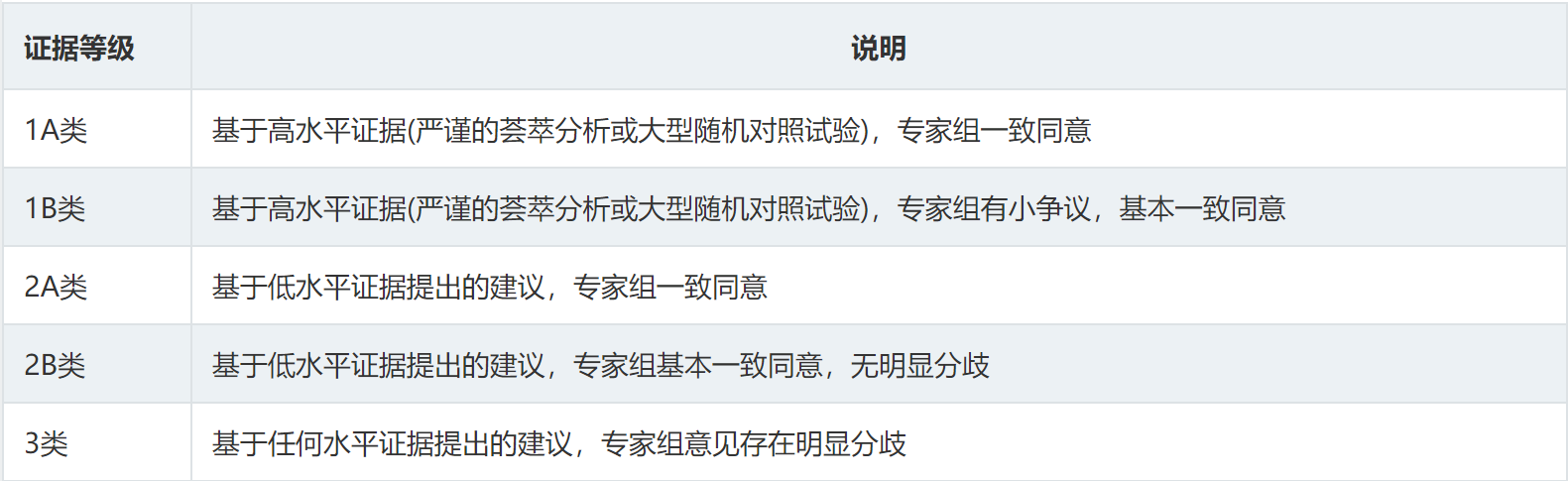
表2共识推荐方案的推荐等级分类

一、CRA 的诊断及分级
1.外周血血红蛋白的正常值范围:正常成人外 周血血红蛋白的范围标准为成年男性:120~160 g/ L,成年女性:110~150g/L 。
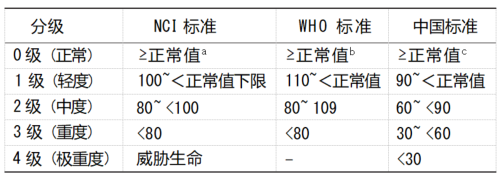
2.CRA分级:参照美国国家癌症研究所(National cancer institute,NCI) 和 WHO贫血分级标准,同时结合中国国情,对 CRA进行分级和贫血 严重程度评估。 CRA 的分级见表3。2012年中国 CRA调查显示,CRA发生率为 49.24%, 其中 轻 度 贫 血 发 生 率 为 28.84%, 中 度 贫 血 为 15.91% ,重度贫血为3.66%,极重度贫血为0.84%。不同瘤种的贫血情况为泌尿系统肿瘤伴贫血发生率 最高 (62.89%) , 其次为妇科肿瘤 (60.32%) 、胃肠道肿瘤(51. 13%)与肺( 50.69%); 但中国 CRA 治疗率仅 7. 16%。
表 3 肿瘤贫血严重程度分级( g/L)
3. CRA 的筛查:鉴于血红蛋白水平在健康个体间差异较大,故难以确定通用的正常值 。美国国家综合癌症网络专家组建议肿瘤患者中血红蛋白水平≤ 110 g/L 时提示应进行贫血评估;对基线水平高者,血红蛋白水平降幅≥20 g/L 者也应予以关注并评估。
CRA 可能由许多原因导致,其中部分原因可能与肿瘤无直接关系 。因此,评估的总目标为找出贫血的特点,并在初始治疗前确定任何潜在的可纠正的基础性合并症。
4. CRA 的初始评估:贫血的特征性检查包括全血细胞计数和确定是否存在其他细胞缺乏症的指标 。外周血涂片形态学检查的图像分析对判断红细胞的大小、形状和血红蛋白含量较为重要 。CRA 的初始评估包括病史问诊、体格检查和实验室检查等。
详细的病史问诊和体格检查是必须的,病史包括症 状及其持续时间、合并症、家族史和是否使用过任何抗肿瘤药物或放疗暴露史 。常见主诉有晕厥、活动 后呼吸困难、头痛、眩晕、胸痛、工作和日常活动乏力,明显的皮肤、黏膜苍白,以及女性患者月经异常, 可能有黄疸 。区分肿瘤相关性乏力和健康个体乏力 的关键特征为前者难以通过休息缓解 。但是,上述临床表现无法判断贫血类型 。临床医师还需要注意潜在病因的征象,如黄疸、脾大、神经症状、便血、皮肤瘀点及心脏收缩期杂音。
5. CRA 的评价方法:有两种常见方法来评价贫血:形态学法和动力学法,完整的评价应综合应用此两种方法。
形态学方法通过平均红细胞体积或平均红细胞大小描述贫血特征,将贫血分类如下:( 1) 小细胞性贫血(平均红细胞体积<80 fL):最常见原因为缺铁, 其他病因包括珠蛋白生成障碍性贫血、慢性病性贫血和铁粒幼细胞性贫血;( 2) 大细胞性贫血( > 100 fL):常见原因为药物和酒精,两者均为非巨幼细胞贫血类型 。骨髓增生异常综合征也可导致轻微的巨红细胞症 。巨幼细胞贫血中见到的巨红细胞症最常见的原因为叶酸摄入不足或内因子缺乏导致的吸收不充分,造成维生素 B12 缺乏 。巨红细胞症伴有大出血或溶血后网织红细胞计数的增高;( 3) 正常细胞性贫血( 80 ~ 100 fL):可能原因包括出血、溶血、 骨髓功能衰竭、慢性炎症性贫血或肾功能不全,关键的随访检查有网织红细胞(未成熟红细胞)计数。
动力学法的关注点为贫血的潜在机制,对红细胞的生成、破坏和丢失进行区分 。最基础的红细胞指标为网织红细胞指数( reticulocyte index , RI) , 该指数通过校正网织红细胞计数,修正由所测定的 HCT确定的贫血程度 。网织红细胞计数为红细胞 总数目中网织红细胞的数目 。RI 则基于网织红细胞计数计算得到,为骨髓红细胞生成能力指标 。RI 正常范围为 1 .0 ~ 2.0 , 其升高可提示溶血性或失血性贫血,降低提示骨髓增生低下或红细胞系成熟障 碍 。RI = 网织红细胞计数( %) ×(观察到的HCT/预期的HCT) , 预期的 HCT = 45%。
6. CRA 的随访风险评估:CRA 的可能原因包括肿瘤相关性和(或)骨髓抑制性化疗(针对实体瘤或淋巴系恶性肿瘤),贫血风险评估对于确定初始干预计划是必须的 。CRA 的治疗方案取决于诸多因素 。对于因疾病需立即提升血红蛋白的重度贫血患者,需输注浓缩红细胞,而对于 CRA 的长期管理,应根据个 体 贫 血 风 险 评 估 考 虑 促 红 细 胞 生 成 药 和 (或)补充铁剂治疗。
二、CRA 的治疗
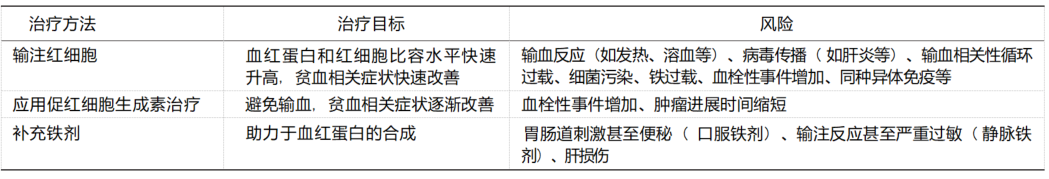
CRA 的治疗方法主要包括输血治疗、促红细胞 生成治疗和补充铁剂等 。当考虑贫血治疗方案时应 告知患者治疗风险和目标,见表 4。
1 . 输血治疗:输注红细胞或全血是临床治疗 CRA 的主要方法,优点为可以迅速升高血红蛋白浓度,可用于严重贫血或急性出血引发贫血的肿瘤患者,合并有心脏病、慢性肺疾病、脑血管病的无症状性贫血患者 。在不伴随同时失血的情况下,每输注 1 单位红细胞约可提升 10 g/L 血红蛋白水平或提升 2% ~3%的红细胞压积。但不应依据患者的血红蛋白。
表 4 输注红细胞与应用促红细胞生成治疗的目标与风险
水平是否达到规定的阈值(60 g/L) 而输血 。其应用情形可分为下述 3 类:(1) 无症状且无明显合并症:此时适合观察和定期再评价 。对于血流动力学稳定的慢性贫血,输血目标是使血红蛋白>70 g/L; (2)高危:如血红蛋白水平进行性下降且近期进行过强化化疗或放疗,或无症状但有合并症( 如心脏病、慢性肺病和脑血管疾病等),可考虑输血,输血目标是根据预防症状及需要维持血红蛋白水平;(3) 有症状:如持续性心动过速、呼吸急促、胸痛、劳力性呼吸困难、头晕、晕厥、重度乏力妨碍工作和日常活动等,此时患者应接受输血 。对血流动力学不稳定或输氧能力不足的急性失血,应及时输血以纠正血流动力学异常并维持充足供氧。
除影响组织需氧的其他因素,贫血的临床表现还与贫血的发作、严重程度和持续时间有关 。当贫血急性发作时,症状更加明显;机体为了代偿血液携氧能力的降低,可伴随贫血的逐渐加重和时间延长而出现生理适应性调节 。适应性调节包括心输出量增高、冠状动脉血流增加、血液黏滞度改变,以及氧消耗和排出的变化 。合并心血管、肺或脑血管基础性疾病可能损害患者对贫血的耐受能力。因此 ,对于是否需要立即治疗贫血,应以个体患者特征、贫血严重程度、合并症的严重程度以及医师的临床评估 为依据。
输血的整体目标为治疗或预防血液携氧能力的不足,以改善机体组织的供氧情况 。然而输血会导致输血相关性反应、输血相关性循环过载、病毒传播、细菌污染、铁过载和红细胞同种异体免疫等一系 列风险。针对 CRA 的治疗,在规范输注全血或红细胞的前提下,可使用促红细胞生成药物来降低 输血引发的相关问题 。肿瘤患者红细胞输注的适应 证见图 1。
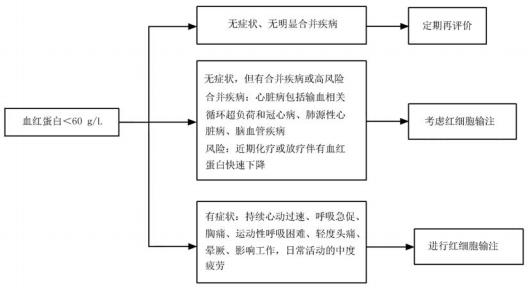
图 1 恶性肿瘤贫血患者红细胞输注的适应证
2. 促红细胞生成治疗( 1A 类证据,Ⅰ级推荐):红细胞的生成受 EPO 的调控 。EPO 为一种在肾脏内生成的细胞因子,其在临床上的广泛应用已被证实能改善贫血症状和降低肿瘤化疗患者对输注浓缩红细胞的需要 。促红细胞生成素类药治疗为目前治疗 CRA 的重要方法。
促红细胞生成素类药治疗的主要优点为符合正常生理、耐受性好、使用方便,可用于门诊患者,明显提高患者的生存质量 。EPO 使用方法和剂量参考见图 2。
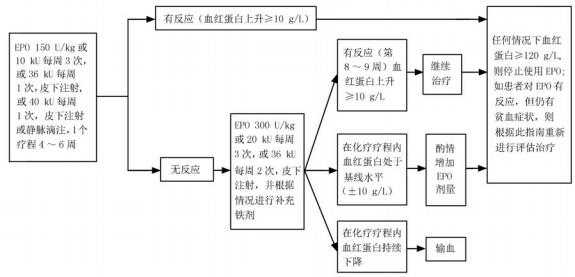
图 2 恶性肿瘤贫血患者促红细胞生成素( EPO) 使用方法和剂量
EPO 启 动 治 疗 时 机 为 血 红 蛋 白 ≤ 100 g/L。EPO 治疗的血红蛋白目标值是 120 g/L;如超过 120g/L , 则需要根据患者的个体情况减少 EPO 剂量或停止使用 EPO(2A 类证据,Ⅰ级推荐)。用药方案:每 2 周 1 次 80 000 U , 或每 3 周 1 次120 000 U 静脉滴注(2B 类证据,Ⅲ级推荐)。
3. 补充铁剂(2A 类证据,Ⅰ级推荐):在肿瘤或化疗引起的肾衰竭患者中,持续使用 EPO 会引起功能性缺铁(铁蛋白≤500 μg/L 且转铁蛋白饱和度<50%) ,储备于网状内皮系统中的铁在受到 EPO 刺激后快速产生,在红细胞生成过程中被大量转运到骨髓而导致血清铁降低,无法支持进一步的造血功能,影响后续促红细胞生成素类药的治疗效果 。对于绝对性缺铁患者( 铁蛋白≤30 μg/L 且转铁蛋白饱和度<20%) , 须行补铁治疗 。 目前,补充铁剂的方法主要为口服和肠道外补充铁剂 。铁剂补充适应证见表 5。
表 5 恶性肿瘤贫血患者铁剂补充适应证

常见的口服铁剂包括硫酸亚铁、富马酸铁、葡萄糖酸亚铁、琥珀酸亚铁等,临床应用相对较多的是硫酸亚铁 。不同铁剂元素铁含量不同,口服剂量:按元素铁每天每千克体重 4 ~ 6 mg 计算,每次用量不建议超出每千克体重1 . 5 ~ 2 mg。折合成硫酸亚铁每天每千克体重约 30 mg。
肠道外途径铁剂补充优于口服铁剂,能够完全被人体吸收、起效快,无胃肠道刺激症状 。 口服铁剂的不良反应主要为胃肠道刺激症状和过敏 。胃肠道症状与剂量相关,餐后服用可减少胃肠道不良反应。 维生素 C 可增强口服铁剂吸收,磷酸盐可影响铁剂吸收 。对于口服铁剂不耐受或补铁治疗反应较弱的患者,推荐使用肠道外途径补充铁剂 。肠道外铁剂给药剂量及途径见表 6。
表 6 恶性肿瘤贫血患者肠道外铁剂给药推荐
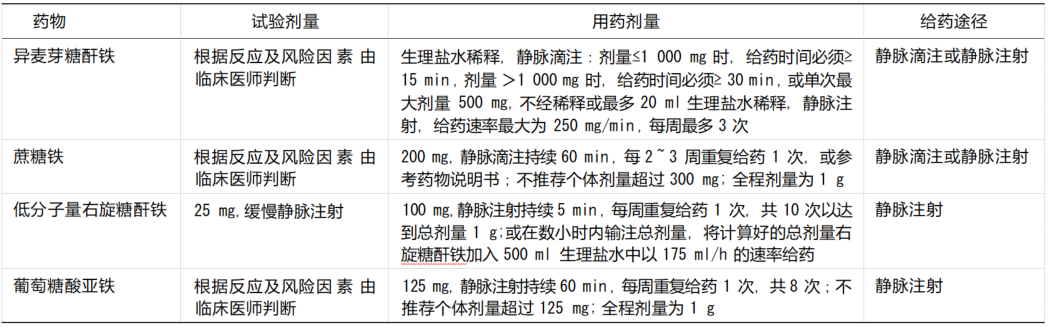
如铁剂治疗在 4 ~ 6 周后失败,且已给予预期的总剂量,可考虑重复铁代谢检查 。监测患者铁过载的证据,包括心肌病、内分泌疾病和肝不良反应的体征和症状 。如存在铁过载证据,不给予静脉铁剂。如血清铁蛋白超过 1 000 ng/ml 或转铁蛋白饱和度超过 50% , 则应暂停给予后续铁剂量 。低分子量右旋糖酐铁需试验给药剂量,而葡萄糖酸亚铁、蔗糖铁无此要求 。异麦芽糖酐铁为新上市的静脉铁剂,每次给药期间和给药后,均应仔细观察患者是否出现超敏反应体征或症状 。应确保在有完备可用的急救设备下,并且有处理超敏反应经验的医务人员在场时,才能进行异麦芽糖酐铁给药 。每次给药后,患者需留观至少30 min , 以观察是否有不良反应发生。
对低分子量右旋糖酐铁或其他静脉铁剂过敏或有多种药物过敏史的患者,在应用葡萄糖酸亚铁或蔗糖铁时建议试验剂量 。活动性感染的患者不应接受静脉补铁治疗。
4. 中医中药治疗:CRA 的中医病因病机类似于中医学血枯、萎黄、虚劳、血虚证等范畴,但这些病证名并没有充分体现。
CRA 是在恶性肿瘤疾病基础上并发贫血的病机、病因与病性等特点 。为规范其名称,中华中医药学会血液病分会组织行业专家反复讨论认为,CRA 是“癌”和( 或)“毒”导致血液虚少或枯竭,涉及脾 胃、心、肝、肾等多脏器病变以及气血、阴阳失衡的复杂变化过程 。因此,在《常见血液病的中医分类与命名》和全国中医药行业高等教育“十三五”创新教材《 中医血液病学》中,专家一致建议用“ 癌毒血枯病”病名。
辨证使用汤剂或中成药,建议依据《肿瘤相关性贫血中医药防治专家共识》。
5. 对拒绝输血CRA 患者的管理:对拒绝输血的 CRA 患者最佳管理的有效数据有限 。在重度且危及生命的贫血的极端情形下,纯氧吸入可增加血氧浓度 。为减少失血,尽量不行静脉穿刺、不分多次检查和使用儿科采血管 。在骨髓抑制性化疗开始前应考虑:(1) 因治疗导致贫血的风险;(2) 每日补充叶酸和维生素B12; (3) 评估并纠正基线凝血异常;(4) 对临床高度疑似叶酸和维生素 B12 缺乏的患者,应排除营养不良,使用静脉铁剂纠正铁缺乏。 可对部分患者使用促红细胞生成药 。促红细胞生成药不推荐用于:(1) 未接受化疗的肿瘤患者;( 2) 接受非骨髓抑制性治疗的患者;(3) 接受治愈性骨髓抑制性化疗的患者。
6. CRA 的防治:目前血源紧张,全球都在实施更加严格的患者血液管理(patient blood management , PBM) , PBM 的目标和意义在于改善患者预后、减少医疗资源花费和浪费、提升医疗效率和治疗并且改善患者体验 。贫血管理作为 PBM 的基本原则之一, 包括贫血的早期识别和全程监测、提高对贫血的耐受性、及时使用循证医学所支持的药物干预,以支持造血、确定贫血的病因和促进因素、合理输血 。药物干预的选择主要是促红细胞生成素类药和铁剂,现还在探索阶段的药物如 CDK4/6 抑制剂,在小细胞肺癌人群可以减少红细胞输注次数;缺氧诱导因子脯氨酰羟化酶抑制剂( hypoxia⁃inducible factor prolylhydroxylase inhibitor, HIF⁃PHI) 在一项针对中国透析患者的单独Ⅲ期试验中显示,相较于促红细胞生成素类药物,HIF⁃PHI 纠正贫血不受 C 反应蛋白水平(炎症标志物)影响,在炎症环境下,HIF⁃PHI 罗沙司他治疗贫血可能比促红细胞生成素类药更有效, 同时该药物在中国开展化疗相关性贫血Ⅲ期研究 ( NCT05301517) 。贫血管理涉及多个临床学科,需要多学科团队的努力。
三、常用治疗方法的不良反应
(一)输血的风险与铁过载
1 . 输血的风险:输注浓缩红细胞的相关风险包括输血相关性反应、输血相关性循环过载、病毒传播、细菌污染、铁过载、血栓事件以及红细胞及血小板的同种异体免疫 。有研究表明,输注浓缩红细胞会导致静脉、动脉血栓栓塞和住院死亡率的风险增高, 但该研究属于回顾性,患者的死亡风险还可 能与严重贫血状态及肿瘤进展相关,故不能确立因果关系 。因此,需要更多研究深入分析输血和静脉血栓栓塞事件和死亡事件发生率之间的关系 。红细胞同种异体免疫反应为长期输血患者面临的重要问题 。据报道,15% 的输血依赖且患有骨髓增生异常综合征或慢性髓系白血病的患者存在同种异体免疫反应。血小板同种异体免疫反应可能会发生,抗人类白细胞抗原抗体可导致血小板输注无效,继而可造成患者出血增加、住院时间延长及生存率下降 。
2. 铁过载:每输注1个单位浓缩红细胞将有 147 ~ 278 mg 过量铁无法排泄 。当铁储存饱和 时,铁依然为非转铁蛋白结合铁。输注10 ~ 20 次浓缩红细胞后,多余的铁就会沉积在肝脏、心脏、 皮肤和内分泌器官内 。经历铁过载的患者可能发生乏力、黑皮、关节痛、肝大、心肌病或内分泌障碍 。输血相关性铁过载的现象可见于数年中需要频繁输血 以治疗贫血( 如骨髓增生异常综合征)的患者 。 发生铁过载时应给予去铁治疗 。铁螯合剂包括去铁胺、去铁酮和地拉罗司 。浓缩红细胞输注的获益需要与心脏和肝脏铁过载毒性累积风险相权衡,应基于个体情况评估其风险和获益 。建议临床上基于患者症状、肿瘤病程及治疗情况、并发症和患者意愿综合做出决定。
(二)促红细胞生成治疗的不良反应
1 . 影响长期生存:有研究报告显示,接受促红细胞生成类药物治疗以纠正贫血且目标血红蛋白水平>120 g/L 的患者生存率下降,但由于影响因素较多,难以认定促红细胞生成类药物对生存造成负面作用 。曾有学者认为重组人促红细胞生成素与其在癌细胞上表达促红细胞生成素受体(erythropoietin receptor, EPOR) 结合刺激肿瘤增殖和生长、减少肿瘤细胞的凋亡和增强了对恶性肿瘤治疗的抵抗力,但是理论结果存在质疑 。有研究使用特异性 EPOR 抗体检测,结果均显示未存在明显的肿瘤 EPOR 表达。
除非有新的证据表明获益,不建议在肿瘤治疗期以外给予患者促红细胞生成药治疗 。治疗期是指启动贫血治疗并持续至治疗(化疗)结束后约 6 周 。有报道认为促红细胞生成药治疗血红蛋白< 120 g/L 患者时仍有生存期缩短和肿瘤进展的风险,建议推迟促红细胞生成药治疗至血红蛋白<100 g/L 时再使用,以降低血栓及生存下降的风险。但有研究结果表明,促红细胞生成药物对肿瘤患者的生存并无不良反应。
权威指南亦明确了规范化使用促红细胞生成素类药并不增加肿瘤进展或复发等风险 。基于上述问题,建议临床上告知患者促红细胞生成素类药治疗与红细胞输注相比的风险与获益情况。
2. 血栓形成:静脉血栓栓塞的病因非常复杂,其基线风险增高与肿瘤本身和化疗均有关 。EPO 具有导致血栓形成的潜力,与血红蛋白水平无关。 肿瘤患者中静脉血栓栓塞的其他风险因素包括既往静脉血栓栓塞病史、遗传性或获得性突变、高凝状态、化疗前血小板计数增高、近期手术、激素类药物、 制动、类固醇,以及诸如高血压等合并症。既往有血栓形成风险因素的患者在使用促红细胞生成药物时可能面临更高的血栓形成风险 。已有资料表明在肿瘤患者中血栓栓塞事件(包括静脉血栓栓塞)的增多与促红细胞生成药治疗相关 。荟萃分析结果证实,促红细胞生成药使用与血栓事件风险增加之间具有显著相关性 。
对于伴有慢性肾病的肿瘤患者,促红细胞生成药的使用与卒中风险的显著增高有关。针对肿瘤合并慢性肾性贫血的患者,可以考虑罗沙司他等 。在促红细胞生成素类药治疗前,应评估患者的风险因素,包括血栓栓塞史、遗传性突变、高凝性、化疗前血小板计数升高、高血压、类固醇激素、长期制动、近期手术、多发性骨髓瘤的某些治疗等 。建议依据《中国肿瘤相关静脉血栓栓塞症的预防与治疗专家指南(2019 版)》进行血栓管理 。同时,掌握好促红细胞生成素类药的使用规范和靶目标值可降低 CRA 患者血栓发生风险。
3. 高血压/癫痫:在开始促红细胞生成类药物治疗前,必须对患者定期监测并控制血压。在接受促红细胞生成类药物治疗的慢性肾功能衰竭的患者中,有发生癫痫的报告。尽管目前尚未明确接受促红细胞生成药治疗 CRA 患者是否存在癫痫风险,但在使用促红细胞生成药治疗时,建议监测血红蛋白水平及时停药,从而降低不良反应。
4. 纯红细胞再生障碍性贫血 ( pure red cell aplasia , PRCA) : PRCA 是以低网织红细胞计数和骨髓原始红细胞丢失(抗 EPO 中和抗体的出现导致) 为特征的一种罕见的贫血综合征 。研究显示,1998—2004 年PRCA 发病率显著增高,除美国之外,90%的患者使用阿法依泊汀制品 , 原因为非人血清白蛋白配方、皮下给药和无覆盖胶塞。
2005 年,美国食品药品监督管理局 ( Food and Drug Administration , FDA) 对中和抗体相关性贫血的定义修改为 PRCA 和重度贫血,从而调整了全部 EPO 药物的适用范围 。从 2005 年起,FDA 安全性数据库纳入 30 个抗体相关性 PRCA 新病例,主要为皮下注射红细胞生成刺激药的慢性肾功能衰竭患者。 任何突发红细胞生成刺激药疗效丧失、伴有重度贫血和网织红细胞计数低的患者,均应接受 PRCA 的病因学评估,包括 EPO 中和抗体的评估 。如果疑似中和抗体相关性贫血,应暂停全部促红细胞生成刺激药物的使用。
综上所述,在治疗 CRA 时应深刻认识并熟练掌握其用药规范,以确保治疗安全性及有效性 。伴随新研究成果的出现,专家委员会将定期更新本共识。
中国肿瘤相关贫血诊治专家共识(2023版)DOI: 10.3760/cma.j.cn112152-20230711-00289











 苏公网安备32059002004080号
苏公网安备32059002004080号


