本期精选4篇在2023年12月份发表的结直肠癌领域文献,部分研究邀请到中国医学科学院肿瘤医院孙永琨教授进行深入解读。
专家介绍
主任医师、博士生导师
从事消化系统、泌尿系统肿瘤内科治疗
负责和参与多项抗肿瘤新药的I~IV期临床研究
中国医疗保健国际交流促进会消化肿瘤多学科诊疗学分会常务委员
中国医疗保健国际交流促进会肿瘤内科分会委员
中国医药教育协会肿瘤化学治疗专业委员会常务委员
中国临床肿瘤学会CSCO青年专家委员会委员
中国临床肿瘤学会CSCO抗肿瘤药物安全委员会委员
北京癌症防治学会胃癌防治专业委员会副主任委员
北京癌症防治学会食管癌专业委员会常务委员
《肝癌电子杂志》编委
Divarasib联合西妥昔单抗治疗KRASG12C阳性结直肠癌:一项1b期试验1
结直肠癌(CRC)中KRASG12C突变的发生率约为4%,常与不良预后相关。Divarasib是一种KRASG12C抑制剂,它在400 mg剂量下单药治疗KRASG12C突变CRC时可表现出中度的疗效。表皮生长因子受体(EGFR)是RAS-MAPK信号通路的主要上游激动剂,是KRASG12C抑制剂在CRC中发生耐药的关键机制。研究人员开展了一项1b期临床研究,其中C队列是Divarasib联合西妥昔单抗(EGFR抑制剂)治疗KRASG12C突变的CRC患者(n = 29)。该研究的主要终点是安全性,次要终点包括初步的抗肿瘤活性。
该联合方案的安全性特征与Divarasib单药和西妥昔单抗单药使用时一致。因治疗相关不良事件导致4例患者(13.8%)Divarasib减量,无患者退出治疗。初次使用KRASG12C抑制剂治疗的患者(n = 24)的客观缓解率(ORR)为62.5%(95% CI:40.6%~81.2%)。中位缓解持续时间为6.9个月。中位无进展生存期为8.1个月(95% CI:5.5个月~12.3个月)(图1)。作为探索性目的,研究人员还观察到疾病缓解与KRASG12C突变等位基因频率下降相关,并确定了疾病进展时与耐药相关的获得性基因组改变。
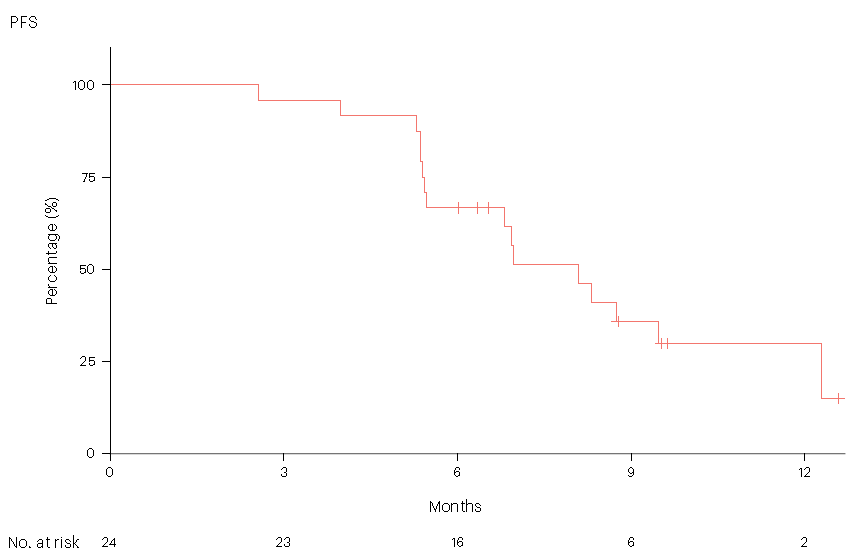
图1:24例KRASG12C抑制剂初治患者中位PFS的Kaplan-Meier曲线
Divarasib联合西妥昔单抗治疗导致ctDNA水平KRASG12C 突变丰度降低。值得注意的是,与单药Divarasib相比,Divarasib加西妥昔单抗联合治疗ctDNA水平KRASG12C 突变丰度的下降程度更大。(ClinicalTrials.gov identifier: NCT04449874)
孙永琨教授:结直肠癌病例中,KRAS或NRAS突变发生率为35%~40%,其中较常见的亚型是KRASG12D突变,发生率为10%~12%(Feng J, et al. 2023;42(20):1620-1633.),KRASG12C突变亚型相对较罕见,发生率约为4%。KRAS突变虽然是结直肠癌的重要驱动基因之一,但受限于该靶点的蛋白特性,一直以来缺乏行之有效的靶向治疗药物。直到近年,随着KRASG12C突变亚型中新引入的半胱氨酸易形成共价键的特性被发现,KRASG12C抑制剂被越来越多的研究和开发。已经上市的KRASG12C抑制剂包括Adagrasib和Sotorasib,2023年ESMO大会上还报道了由中山大学肿瘤防治中心徐瑞华院长牵头开展的Garsorasib的早期研究,在新靶点的精准治疗方面国内外都有了突破。
KRASG12C突变位于MAPK信号通路上,Adagrasib和Sotorasib的单药研究数据均表明肠癌中单纯抑制KRASG12C的疗效无法令人满意,而联合阻断该通路上游的EGFR位点可以获得更好的疗效,既往KRYSTAL-1研究和CodeBreak 101研究已对此进行了验证。在去年ESMO大会上报道的CodeBreak 300研究进一步证实了相比于三线标准治疗,KRASG12C抑制剂联合抗EGFR单抗在PFS、ORR等方面均显著获益,且3级以上AE的发生率更低,或可成为后线治疗的标准选择之一。可以预见的是,同一通路下多靶点组合的治疗策略也将会是未来KRASG12C、KRASG12D等靶向抑制剂研发的主要方向。
该研究的一大亮点在于采集了患者治疗过程中多个时间点的血浆样本,回顾性地分析了ctDNA谱,描述了疾病缓解/进展与KRASG12C突变等位基因频率的相关性变化,还对Divarasib联合西妥昔单抗治疗的潜在耐药位点和耐药机制进行了探索,也为未来的研究提供了新的指导方向。
dMMR/MSI转移性胃肠道肿瘤患者对免疫治疗的原发性耐药:谁有风险?一项AGEO真实世界研究2
免疫治疗在dMMR/MSI转移性胃肠道(GI)肿瘤中疗效显著,接受免疫治疗的患者数量迅速增加。然而,其中20%~30%的患者会出现免疫检查点抑制剂原发性耐药(ICIPR),对这类患者需要进行进一步的分析。
真实世界AGEO研究回顾了该研究中心2015年至2022年间接受免疫治疗的dMMR/MSI转移性GI肿瘤患者资料,分析了免疫检查点抑制剂(ICI)的疗效和安全性,并确定了与ICIPR相关的临床因素。
该研究共纳入399例患者,其中284例为结直肠癌(CRC)患者,115例为非CRC患者,大部分患者(88.0%)均接受了抗PD(L)1治疗。结果显示24个月的PFS率为55.8%(95%CI 50.8%~61.2%),48个月的OS率为59.1%(95CI 53.0%~65.9%),ORR为51.0%,ICIPR发生率为25.1%。CRC组和非CRC组的ORR、DCR、PFS或OS无统计学差异。在多因素分析中,ICIPR与ECOG-PS≥2(OR = 3.36)、肝转移(OR = 2.19)、腹膜转移(OR = 2.00)、≥1线既往治疗(OR = 1.83)和年龄≤50岁(OR = 1.76)相关(表1)。
表1:ICI原发性耐药患者的多变量模型
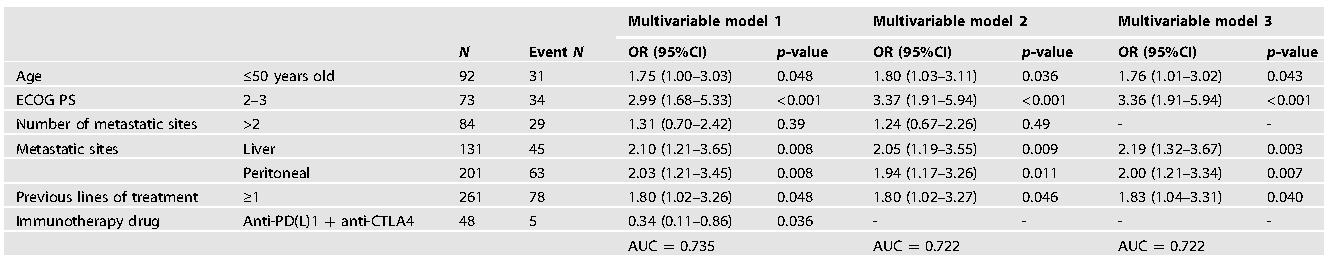
临床医生应考虑这5个与ICI原发性耐药相关的临床因素,以确定转移性dMMR/MSI GI肿瘤患者的治疗选择。
孙永琨教授:近年来,随着各线MSI-H结直肠癌治疗研究结果的报道,免疫检查点抑制剂成为MSI-H结直肠癌患者治疗的临床首选。在如今免疫检查点抑制剂一线广泛使用的大背景下,我们同时也需要关注和警惕不少患者使用免疫治疗疗效不佳甚至会出现超进展。KEYNOTE-177研究显示一线免疫单药治疗组较标准治疗组的ORR虽有所提升,但数值也仅有45.1%,两组患者的PFS曲线在治疗早期也存在交叉,同时安全性分析表明免疫单药治疗组中约9%的患者出现3级以上免疫相关不良反应或输液反应,7%的患者因此终止治疗。这篇文章从耐受性和安全性的角度,提示了我们在临床上选择免疫检查点抑制剂时仍应严格评估、谨慎使用,同时也对如何通过临床特征去辅助判断免疫检查点抑制剂的适宜人群进行了探究。
该研究提到“ECOG-PS≥2”是免疫检查点抑制剂原发性耐药的潜在危险因素,这一点在KEYNOTE-177研究的总生存期亚组分析也得到印证——ECOG-PS=0的患者更能从免疫治疗中获益;而该研究提到另一个耐药潜在危险因素“年龄≤50岁”则与KEYNOTE-177研究结果有所不同,KEYNOTE-177研究的OS亚组分析显示年龄较小的患者(≤70岁)接受免疫治疗有更长的生存获益。
此外,该研究还提出“肝转移”、“腹膜转移”、“≥1线既往治疗”也是免疫检查点抑制剂原发性耐药的潜在危险因素,其中“肝转移”这一因素尤其值得关注。“肝转移”是患者在一、二线及后线接受免疫检查点抑制剂及其联合治疗后疗效不佳的预测因素,这可能与免疫调节因子的参与有关,如调节性T细胞和巨噬细胞介导的肝转移瘤内T细胞的拮抗或消除机制,以及CCL4+肝转移瘤微环境中的肿瘤相关中性粒细胞通过募集巨噬细胞和抑制T细胞,导致免疫检查点抑制剂耐药和患者预后不良。目前肝转移患者的免疫治疗尚未形成共识,也是临床面临的一大挑战,对于肝转移患者的优化治疗方案值得深入探索。
KRAS和BRAF突变对结直肠癌免疫细胞浸润的相反作用-对免疫治疗的潜在预测价值3
免疫微环境对结直肠癌(CRC)的预后和免疫治疗的疗效均具有重要的临床意义。该研究旨在探索肿瘤免疫细胞浸润与临床上公认的CRC分子标志物之间的关系。
在257例CRC患者的队列中,通过多重免疫组化染色和多光谱成像评价细胞毒性T细胞(CD8 +)、Th1细胞(T-bet +)、Treg细胞(FoxP3 +)、B细胞(CD20 +)和巨噬细胞(CD68 +)的肿瘤浸润。
与预期一致,该研究发现较高的免疫细胞浸润和微卫星不稳定性相关。此外,与BRAF野生型肿瘤相比,BRAF突变型肿瘤显示出免疫细胞浸润增加,而在KRAS突变型肿瘤中却呈现出免疫细胞浸润减少。细胞毒性T细胞和Th1细胞在不同类型肿瘤中的差异最为显著。在另一个包含608例CRC患者的独立队列中,再次验证了细胞毒性T细胞浸润数量在BRAF和KRAS突变型肿瘤中呈现出相反的趋势。在这两个CRC队列的野生型、KRAS突变型和BRAF突变型患者中,均发现了细胞毒性T细胞浸润对预后潜在的重要正向作用(图2)。
综合评估MSI状态、KRAS和BRAF突变状态以及免疫细胞(细胞毒性T细胞)浸润状态,可能为CRC患者的预后和免疫治疗疗效预测提供重要参考。
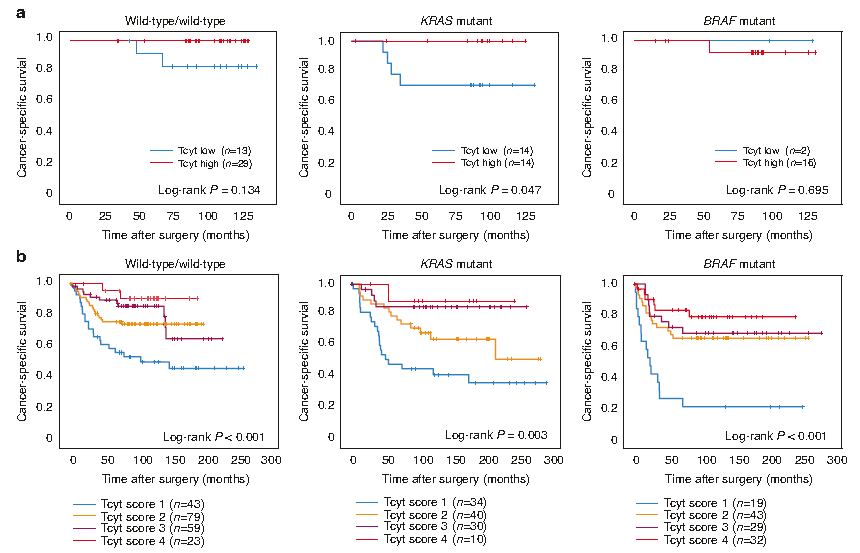
图2:细胞毒性T细胞浸润对不同KRAS/BRAF突变状态CRC患者预后的重要性。(a)研究队列;(b) 北瑞典健康和疾病研究(NSHDS)验证队列。所示为KRAS /BRAF野生型肿瘤、KRAS突变型肿瘤和BRAF突变型肿瘤中不同水平的细胞毒性T细胞(Tcyt)浸润时,对应患者的特异性生存期Kaplan–Meier曲线,排除术前放疗的直肠癌,采用Log-rank检验计算组间5年生存率的差异,P < 0.05为差异有统计学意义。
孙永琨教授:本期的第二篇文献从临床因素的角度对免疫治疗的疗效进行了预测分析,这篇文章则从基因层面探索了KRAS和BRAF突变对于免疫检查点抑制剂疗效的影响。一般而言,KRAS突变和BRAF突变的结直肠癌患者的预后都相对较差,其中BRAF突变患者相比KRAS突变患者的预后更差且常规化疗和靶向治疗的疗效有限。
KEYNOTE-177研究的总生存期亚组分析发现BRAF突变患者相比于KRAS突变患者从免疫治疗中获益更多。此外需要注意的是,约40%的BRAF突变患者合并高水平的TMB,约 20%~30%的BRAF突变患者合并dMMR/MSI,因此从机制上来看BRAF突变或许本身就是一种对免疫检查点抑制剂比较敏感的亚型。
CheckMate 142研究中比较了单药免疫与双药免疫治疗的疗效差异,后线单药组、后线双药组与一线双药组中BRAF突变患者的ORR分别为42%、70%和82%;KRAS突变患者的ORR分别为33%、68%和80%。可以发现双免联合治疗相比纳武利尤单抗单药治疗具有更显著的获益优势,而且这一优势从后线推至一线时进一步扩大。提示对于这部分患者来说,双免联合治疗可以弥补单免治疗的疗效不足。
目前BRAF抑制剂联合抗EGFR单抗的双靶方案已经成为BRAFV600E突变患者的二线标准治疗,在双靶治疗的基础上联合其他靶向治疗、化疗或免疫治疗的研究以及上述方案向一线的探索正在如火如荼地进行中。除了关注到BRAF突变合并MSI-H的患者外,BRAF突变合并MSS也是近年来研究的热点,这类患者的预后可能更差,治疗手段更加局限。2022年ASCO会议报道的SWOG 2107研究探索了后线使用康奈非尼联合西妥昔单抗及纳武利尤单抗治疗BRAF V600E突变/ MSS转移性结直肠癌患者的疗效,初步研究结果显示该方案的ORR为50%,DCR为96%,中位PFS 为7.4 个月,中位OS 为15.1 个月,纳入患者中未发现剂量限制性毒性,总体显示出良好的耐受性和抗肿瘤活性。这项研究显示出靶免联合方案在结直肠癌治疗中的疗效,这种联合模式未来也可能会成为一线治疗的选择之一。
总体而言,这些研究从不同视角为我们打开了思路,在为患者选择免疫检查点抑制剂治疗时,结合临床因素及分子标志物情况综合分析能为患者做出更加全面的判断和更加合理的选择。
液体活检循环细胞外囊泡来源的
RNA标记可预测转移性结直肠癌患者
对一线化疗的疗效4
结直肠癌(CRC)是世界上威胁最大的肿瘤之一,化疗在转移性CRC(mCRC)患者的治疗中仍然占主导地位。本研究的目的是开发一种生物标志物组合以预测mCRC患者一线化疗的疗效。
该研究共纳入190例在3家不同机构接受FOLFOX或XELOX化疗的mCRC患者。研究人员提取了患者血浆细胞外囊泡(EV)RNA进行RNA测序,然后构建模型。通过在训练队列(n = 80)中运用随机森林算法和LASSO算法缩减变量个数,最终生成模型特征。通过内部验证队列(n = 62)和外部前瞻性验证队列(n = 48) ,研究者对其结论进行了验证。
该研究建立了一个由22个EV RNA组成的能识别治疗应答者的生物标志物组合,在训练、内部验证和外部验证队列受试者中运行相关模型算法得到曲线下面积(AUC)值分别为0.986、0.821和0.816(图3)。该模型算法还可以确定无进展生存期(PFS)和总生存期(OS)。不仅如此,研究者还构建了一个包含7个基因的组合,它可以预测肿瘤对一线含奥沙利铂化疗以及二线含伊立替康化疗的疗效。
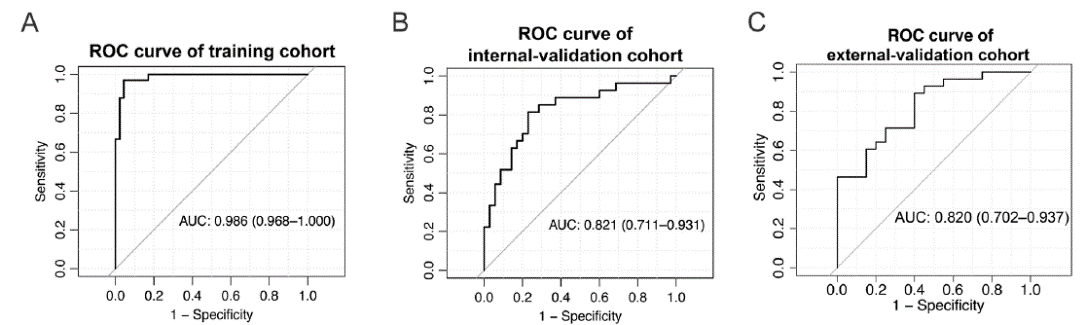
图3:不同队列中22个基因标记物组合的预测能力。ROC分析展现了该基因模型对训练队列(A)、内部验证队列(B)和外部验证队列(C)中的受试者的识别和预测能力
该研究首创性地开发了EV来源的RNA作为生物标记,使用无创方法高精度地预测了mCRC对一线化疗的疗效,或可帮助mCRC患者选择最佳的方案。
本期看点:
1、Divarasib联合西妥昔单抗治疗KRASG12C CRC的1b期研究展现出该联合方案具有可管理的安全性和令人鼓舞的抗肿瘤活性,为后期研究奠定了基础。
2、一项真实世界研究,探索了dMMR/MSI GI肿瘤患者中与免疫检查点抑制剂原发性耐药相关的临床因素,发现原发性耐药可能与ECOG-PS≥2、肝转移、腹膜转移、≥1线既往治疗和年龄≤50岁等5个因素相关。
3、一项肿瘤免疫标志物研究,探索免疫细胞浸润与不同突变类型的CRC之间的关系,研究发现MSI状态、KRAS和BRAF突变状态与免疫细胞浸润状态的联合评估可能为CRC患者预后和免疫治疗反应提供重要参考。
4、一项血浆胞外囊泡RNA的生物标志物研究,开发的生物标志物算法模型通过无创方法高精度地预测了mCRC患者对一线化疗的反应,或可帮助mCRC患者选择最佳的治疗方案。
1、Desai J, Alonso G, Kim SH, et al. Divarasib plus cetuximab in KRAS G12C-positive colorectal cancer: a phase 1b trial. Nat Med. Published online December 5, 2023.
2、Flecchia C, Auclin E, Alouani E, et al. Primary resistance to immunotherapy in patients with a dMMR/MSI metastatic gastrointestinal cancer: who is at risk? An AGEO real-world study. Br J Cancer. Published online December 15, 2023.
3、Edin S, Gylling B, Li X, et al. Opposing roles by KRAS and BRAF mutation on immune cell infiltration in colorectal cancer - possible implications for immunotherapy. Br J Cancer. Published online December 1, 2023.
4、Yang Y, Zhang J, Zhang W, et al. A liquid biopsy signature of circulating extracellular vesicles-derived RNAs predicts response to first line chemotherapy in patients with metastatic colorectal cancer. Mol Cancer. 2023;22(1):199.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


