食管鳞状细胞癌(ESCC)是国内食管癌的主要病理学亚型。近些年来,化疗、免疫治疗等全身治疗大大改善了晚期/转移性ESCC的生存获益,但寡转移性ESCC的首选治疗方案是否仍为全身治疗尚不清楚。2023年11月6日,复旦大学附属肿瘤医院赵快乐教授担任通讯作者于国际知名学术期刊The Lancet Gastroenterology & Hepatology发表了一项Ⅱ期随机对照试验ESO-shanghai 13,旨在探索寡转移性ESCC患者接受全身治疗联合转移灶局部治疗对比单纯全身治疗的疗效与安全性,结果显示,全身治疗联合局部治疗可显著延长患者的无进展生存期(PFS),并且不增加3级及以上治疗相关不良事件1。
日新月异:ESCC伴寡转移患者标准治疗方案尚未统一
根据2016年数据统计,食管癌是中国发病排名第六、死亡排名第五的恶性肿瘤之一,其中,食管鳞状细胞癌是国内的主要病理学亚型。过去五年来,全身化疗是复发或转移性食管癌患者的标准治疗选择,但未能改善患者的生存获益。
一系列3期试验支持抗程序性死亡受体-1(PD-1)治疗在晚期食管癌中的生存获益,其中,一线抗PD-1治疗的患者中位总生存期(OS)范围为12.6-17.2个月,二线抗PD-1治疗的患者中位OS范围为8.2-10.9个月。在过去的十年中,由于免疫治疗及靶向治疗的加入,晚期转移性食管鳞状细胞癌(ESCC)患者面临更有效、更具有安全性的全身治疗选择。
然而,复发性ESCC的治疗手段多为“治标不治本”。自Hellman和Weichselbaum于1995年引入寡转移概念后,数项回顾性和单臂前瞻性研究表明,积极的根治性治疗可能改善寡转移ESCC患者的预后。寡转移是肿瘤发展过程中介于局部转移和广泛转移之间的一种中间状态,针对寡转移灶的局部治疗能够改善肿瘤寡转移患者的预后2。
研究者既往报道过一项试验,纳入34例ESCC患者,其所有转移灶均接受了立体定向放射治疗,结果显示,患者的中位无进展生存期(PFS)为13.3个月,2年OS率为58%。另有两项回顾性研究发现,与单纯化疗相比,对异时性寡转移灶进行根治性放疗可适度延长PFS和OS。Schizas及其同事分析了涉及420名患者的6项研究,发现接受手术切除的食管癌伴寡转移患者(特征为少于5个转移灶)的生存期超过24个月。然而, ESCC伴寡转移患者的最佳治疗方案及根治性治疗的获益仍存在争议。
这一现状源于以下两个主要困境:首先,该领域尚缺乏足够的随机试验,同时,现有研究多为回顾性,这意味着对上述方案对于患者结局的影响可能被高估。其次,既往非小细胞肺癌和其他肿瘤的研究表明,放射治疗联合免疫治疗相较单纯免疫治疗可延长生存期。尽管自PD-1单抗问世以来,免疫治疗极大改善了患者的生存结局,成为潜在的治疗选择,但晚期食管癌领域尚无相关研究进展。
因此,研究者开展了一项随机2期临床试验,旨在探究局部消融治疗联合全身治疗是否可以显著改善原发灶可控且合并至多4个转移灶的寡转移ESCC患者的PFS。
中国视角:ESO-shanghai 13随机Ⅱ期试验启动
本试验是一项探索性、多中心、开放标签的随机2期试验,在中国的6个医学中心开展。
入组标准为:①经组织病理学证实的ESCC;②原发肿瘤接受切除或放射治疗3个月以上未进展;③3-4个任何部位的转移灶,每个转移灶直径≤5cm;④至少1个转移灶接受过病理组织活检,且4个转移灶均应符合局部治疗适应症。⑤患者≥18岁,东部肿瘤协作组体能状态评分(ECOG PS)为0-1;⑥所有转移灶既往未接受过局部治疗;⑦所有病灶均采用RESIST1.1v进行评估。
排除标准为:①原发灶未控制或仅局部复发;②具有广泛转移史;③严重器官功能障碍、急性感染或严重内科合并症;④脑转移或椎体转移并伴脊髓压迫症状;⑤未控制的胸腔积液、心包积液或盆腔积液,需反复引流;⑥入组前3个月内接受过抗肿瘤药物治疗;⑦妊娠或哺乳期。
入组患者按照1:1接受随机分配至接受全身治疗(全身治疗组)或全身治疗联合根治性局部治疗(如放疗、手术或热消融;全身及局部治疗组)。
患者在随机化两周内开始接受治疗。两个治疗组的患者初始时接受四个周期的标准化疗,可选择的化疗方案包括紫杉醇联合顺铂一线治疗、紫杉醇+多西他赛+伊立替康二线治疗。在全身及局部治疗组,若患者接受常规放疗作为局部治疗,则首选同步放化疗,而后进行巩固化疗,确保总共四个周期的化疗。
因试验期间,ESCC标准治疗方案有所更新,故研究者于2020年7月12日对治疗方案进行了修订,允许全身治疗中使用PD-1单抗:对于既往一线标准治疗后疾病进展的患者,PD-1单抗单药治疗作为二线治疗方案,即PD-1单抗联合紫杉醇/氟尿嘧啶+顺铂联合治疗四个周期,再行PD-1单抗维持治疗直至进展或不可耐受的毒性。
局部治疗方式选择取决于病变的位置和大小、邻近器官及转移灶的既往治疗方案,旨在实现疾病控制的同时最大限度地减少潜在的毒性作用。首选的局部治疗是立体定向消融性体部放疗(SABR;最多5次,每次≥7Gy)或确定性大分割放疗。若SABR不适宜,则选择常规放疗、手术或热消融。常规放疗剂量规定分别为:腹部45-50Gy,25-28次;颈胸部50-66Gy,25-34次。手术在预期可实现完全切除时进行,若未能完全切除,则需二次手术或术后放疗。
热消融多用于肝或肺转移灶,单发病灶≤5cm,多发病灶≤3cm。全身治疗组的患者不允许在疾病进展前接受局部治疗,以缓解症状为目的标准姑息性放疗或介入治疗为主。
患者在治疗后的前2年每3个月进行一次评估,治疗后每6个月进行一次评估,直到治疗后5年,此后每年进行一次评估。疾病进展后,由治疗医生酌情进行持续扫描。两组中出现新转移灶的患者可进行局部挽救性治疗。
本研究的主要终点为无进展生存期(PFS)。预设的次要终点为总生存期(OS)、靶病灶局部控制的患者比例、毒性、生活质量等。
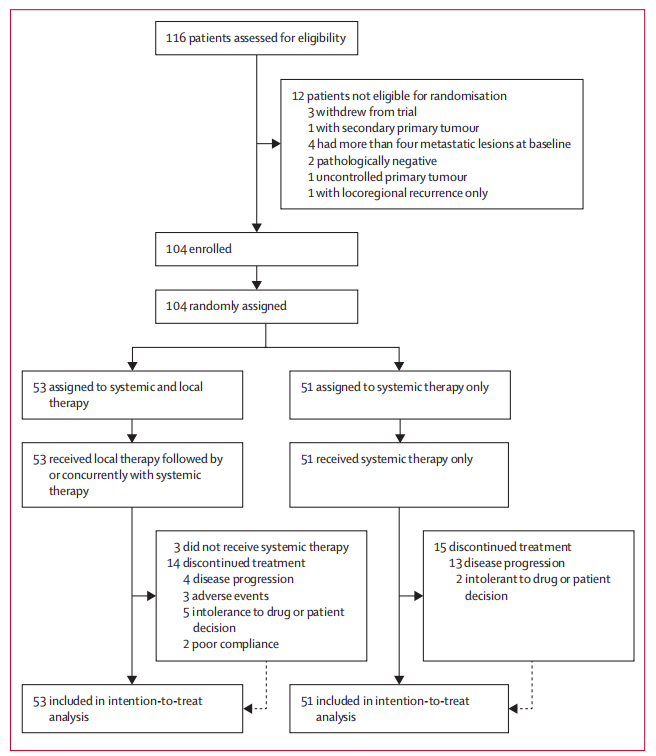 图1.试验入组流程
图1.试验入组流程
鞭辟入里:全身联合局部治疗组的PFS显著延长
结果显示,自2019年3月5日至2021年9月16日,116例患者接受筛选,最终有104例患者入组并被随机分配至全身及局部治疗组(n=53)和全身治疗组(n=51)。
表1.患者基线特征
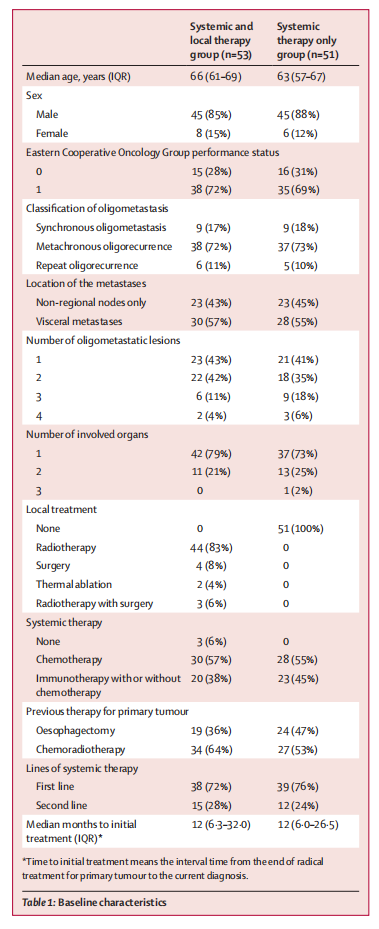
总体而言,93例(89%)患者在接受根治性治疗后首次被诊断为复发性或转移性ESCC,至首次转移的中位时间为10.0个月;全身及局部治疗组患者至首次转移的中位时间为9.8个月,全身治疗组患者至首次转移的中位时间为11.0个月。根据2020年寡转移病灶分类,104例患者中有22例(17%)在治疗后3-6个月期间发生寡转移(同时性寡转移),75例(72%)患者治疗后超过6个月发生寡转移(异时性寡转移),11例(11%)患者出现二次复发。首次复发至二次复发的中位时间为12.5个月,全身及局部治疗组为12.5个月,全身治疗组为6.0个月。
两组中治疗相关不良事件导致治疗剂量减少的比例相似,全身及局部治疗组18例(34%),全身治疗组15例(29%),两组中最为常见的上述不良事件为粒细胞缺乏症(全身及局部治疗组18例/34%,全身治疗组15例/29%)。
在全身及局部治疗中,20例(38%)患者接受SABR,25例(47%)患者接受常规分格调强放疗,2例(4%)患者接受大分割放疗,4例(8%)患者接受转移灶切除手术,3例(6%)患者接受手术联合放疗,2例(4%)患者接受热消融治疗。自局部治疗至全身治疗开始的中位时间为4天,3例患者接受手术并在术后14-30天开始全身治疗。1例患者因放疗不耐受而提前终止,3例患者因血液学毒性推迟放疗3天。
104例患者均纳入PFS分析。截止2023年5月1日,中位随访时间为30.5个月。全身及局部治疗组患者的中位PFS为15.3个月,全身治疗组患者的中位PFS为6.4个月(分层HR 0.26;分层对数秩P<0.0001)。全身及局部治疗组的1年和2年PFS率分别为60.4%和35.8%,全身治疗组则分别为27.5%和9.8%。79例患者出现疾病进展,其中全身及局部治疗组有33例(62%),全身治疗组为46例(90%);两组患者之间的进展模式(即发生疾病进展的患者比例)具有显著差异(p<0.0001)。
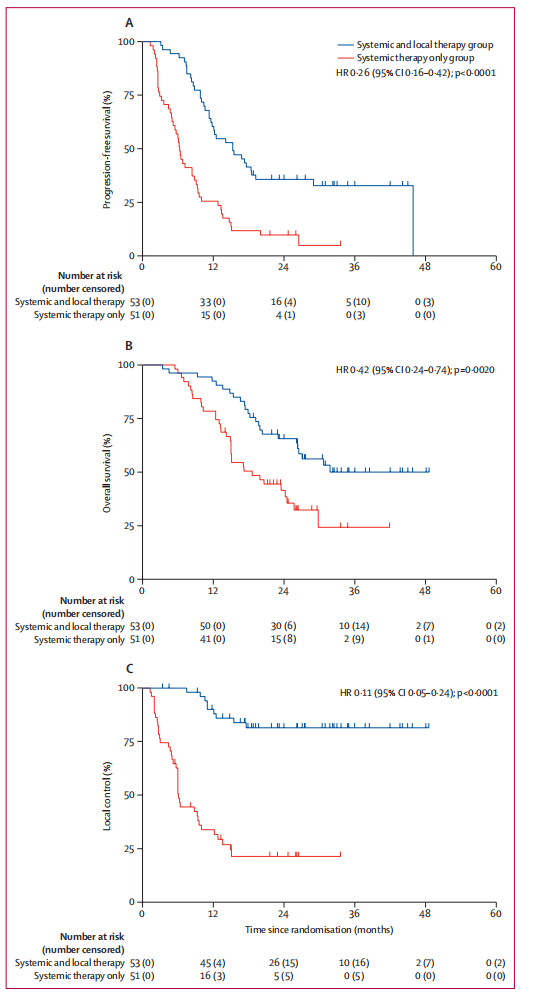
图2.生存分析的KM曲线
在全身及局部治疗组,33例疾病进展的患者中有25例(75%)仅出现新的转移灶,6例(18%)患者仅出现原有病灶进展,2例(6%)患者两者兼有。在全身治疗组,46例疾病进展的患者中有10例(22%)仅出现新的转移灶,30例(65%)仅出现原有病灶进展,6例(13%)患者两者兼有。
全身及局部治疗组至出现新的转移灶的中位时间较全身治疗组更长,分别为16.8个月vs.12.3个月(P=0.0075)。亚组分析显示,大多数亚组中,全身及局部治疗组相较于全身治疗组的PFS显著获益。在79例疾病进展的患者中,40例(51%)接受局部治疗,全身及局部治疗组18例(55%),全身治疗组22例(48%)。
研究者在进行本次分析时,共观察到57例死亡事件,其中,全身及局部治疗组24例(45%),全身治疗组33例(65%)。全身及局部治疗组中位OS未达,全身治疗组中位OS为18.6个月(分层HR 0.42,分层对数秩P=0.0020)。
在数据截止时,全身及局部治疗组的51例患者中有44例(83%)的累计93个病灶达到局部控制,全身治疗组的53例患者中有13例(26%)的累计96个病灶达到局部控制。全身及局部治疗组未达到局部控制的中位持续时间,全身治疗组局部控制的中位时间为6.1个月(HR 0.11,分层对数秩P<0.0001)。全身及局部治疗组的93个可评估病灶中,15个(16%)病灶稳定,42个(45%)病灶部分缓解,28个(30%)病灶完全缓解。全身治疗组的96个可评估病灶中,8个(8%)病灶稳定,9个(9%)病灶部分缓解,6个(6%)病灶完全缓解。
在一项仅限于化疗患者的事后分析中,全身及局部治疗组的PFS显著延长,全身及局部治疗组30例患者中有22例(73%)疾病进展,中位PFS为12.0个月,全身治疗组28例患者中有28例(100%)疾病进展,中位PFS为3.4个月(HR 0.49,对数秩P=0.044)。在接受免疫治疗的患者中,全身及局部治疗组的PFS同样显著延长,全身及局部治疗组20例患者中有12例(60%)疾病进展,中位PFS为18.0个月,全身治疗组23例患者中有19例(83%)疾病进展,中位PFS为9.6个月(HR 0.49,对数秩P=0.044)。在单纯化疗亚组人群中,全身及局部治疗组未达到中位OS,全身治疗组的中位OS为15.1个月(HR 0.40,对数秩P=0.0054)。在免疫治疗亚组中,全身及局部治疗组的中位OS为30.7个月,全身治疗组的中位OS为20.6个月(HR 0.57,对数秩P=0.19)。
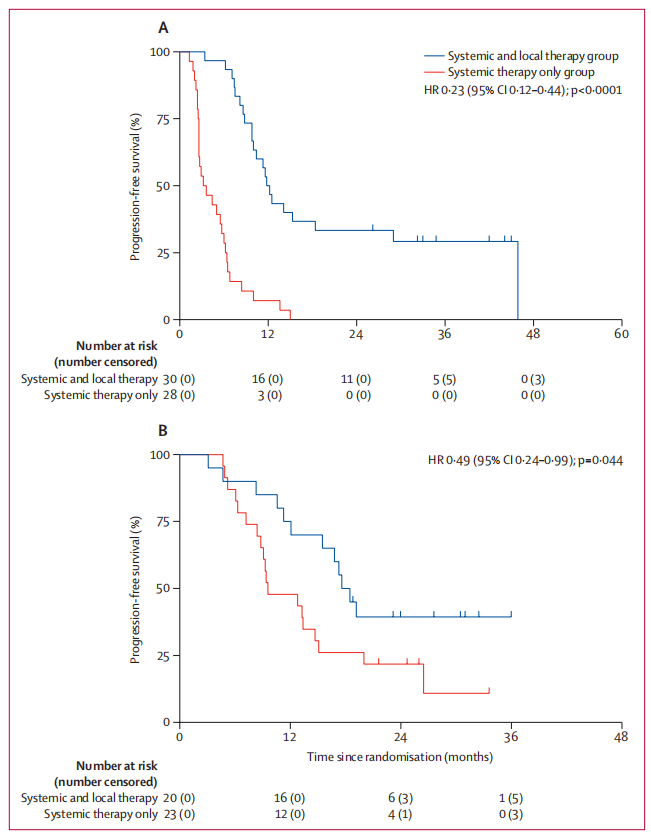
图3.基于化疗或免疫治疗分层的PFS亚组分析
两组最为常见的治疗相关不良事件衰弱(全身+局部组为44例、83%,全身组为36例、71%)、中性粒细胞计数减少(全身+局部组为23例、43%,全身组为23例、45%)、白细胞计数减少(全身+局部组为26例、49%,全身组为24例、47%)。全身及局部治疗组中25例(47%)患者治疗开始后总体健康状况显著改善(P=0.010)。
本试验是首个评估寡转移性ESCC接受全身治疗联合局部治疗vs.仅全身治疗的随机对照试验,旨在解答临床实践中关键性问题:复发性或转移性ESCC患者首选治疗策略是否仍是全身治疗?本试验得出结论,无论是以化疗还是免疫治疗为基础的全身治疗,对于寡转移灶进行以放疗为主的局部治疗联合全身治疗可显著改善转移性ESCC患者的PFS,而不增加3级及以上治疗相关不良事件。研究者认为,局部治疗联合全身治疗的疗效显著优于仅全身治疗,且该疗效可转化为长期获益。然而,值得注意的是,该结论仍待Ⅲ期试验结果进一步探索与验证。
1.Liu, Q. et al. Systemic therapy with or without local intervention for oligometastatic oesophageal squamous cell carcinoma (ESO-Shanghai 13): an open-label, randomised, phase 2 trial. The Lancet Gastroenterology & Hepatology 9, 45–55 (2024).
2.袁立功 & 梅新宇. 2023年第一版《食管胃癌寡转移的定义、诊断和治疗:欧洲Delphi共识研究》解读. 中国胸心血管外科临床杂志 30, 936–938 (2023).
排版编辑:肿瘤资讯-Astrid











 苏公网安备32059002004080号
苏公网安备32059002004080号


