
由于起病隐匿,大多数肝细胞癌(hepatocellular carcinoma,HCC)患者在初诊时已属于中晚期(CNLC‑Ⅱb期、Ⅲa期和Ⅲb期);绝大多数中晚期患者已不宜首选手术切除,而应接受以非手术局部治疗和系统治疗为主的治疗[1]。其中,免疫检查点抑制剂联合抗血管生成靶向药物在晚期HCC治疗中已显示出较高的有效率,显著延长了患者的生存期,也为序贯根治性手术提供了可能性[2]。另一方面,肝动脉化疗栓塞(TACE)、肝动脉灌注化疗(HAIC)等局部治疗手段也通过技术和药物的改进、与其他治疗方式的联合,为提升中晚期肝癌的治疗效果、改善患者生存作出了重要贡献[1]。本期由广东医科大学附属第二医院肝胆胰外科林晖医生为大家分享并解读一则病例,该病例为替雷利珠单抗联合靶向药物及HAIC、TACE治疗IIb期不可切除HCC使患者获得手术机会,并在术后抗肿瘤治疗中使患者长期获益的真实案例,目前患者总生存期(OS)已达22个月。
专家介绍
广东医科大学附属第二医院
肝胆胰外科 科副主任 副主任医师
毕业广东医科大学,一直在广东医科大学附属二院普外科工作,从事消化外科疾病临床、教学和科研工作二十余年,专注消化系统肿瘤的外科及综合治疗。
湛江医学会第一届微创外科学会副主任委员
湛江医学会第一届消化肿瘤外科学会副主任委员
湛江医学会外科学委员会第八届常委
广东省基层医药学会肝癌防治专业委员会粤西地区第一届委员会常委
湛江医学会胃肠外科学会常委
广东省基层医药学会肝胆胰微创分会第一届委员
广东省临床医学会微创外科专业委员会第一届委员
广东省临床医学会肿瘤微创诊疗委员会第一届委员
广东省临床医学会结直肠外科专业委员会第一届委员
广东省医师协会结直肠外科医师分会第一届委员
广东省医学教育协会普通外科专业委员会第一届委员
世界内镜医师协会肝胆胃肠微创外科理事会理事
病例详情
01基本情况
患者男性,71岁。
主诉:右中上腹疼痛2天,加重1天。
现病史:患者2天前无明显诱因突发右中上腹疼痛,呈持续性闷痛,伴腹胀,无恶心、呕吐,无发热、寒战。当时未正规诊治,1天前上述症状较前明显加重,遂来院就诊,门诊查腹部超声示:肝右叶高回声团。门诊CT(2021-12-06)示:肝右叶低密度影伴包膜下少量积液,考虑肿瘤性病变可能。为求进一步诊治,特以“肝右叶占位性病变”为诊断收入院。
既往史:既往有“糖尿病”病史,具体不详,1年前因“高血压病、脑血管意外”导致右侧肢体偏瘫。
体格检查:BP:180/103mmHg,神志清,右上腹部轻压痛,无反跳痛,肝区叩击痛,移动性浊音阴性。右侧肢体肌力下降,3级,肌张力增高。
02辅助检查
入院(基线)实验室检查:
肿瘤指标:AFP:>6050μg/L,CA19-9:35.53U/mL。
乙肝相关检查:HBsAg(+)。
血糖:14.6mmol/L,血氨:22.80umol/L。
入院后(2021-12-07)腹部增强CT示:1、肝右叶低密度影伴包膜下少量积液,肝内病灶融合成片,范围约43mm×99mm×105mm,考虑肿瘤性病变可能;2、腹主动脉、髂动脉硬化;3、腰椎退行性变。
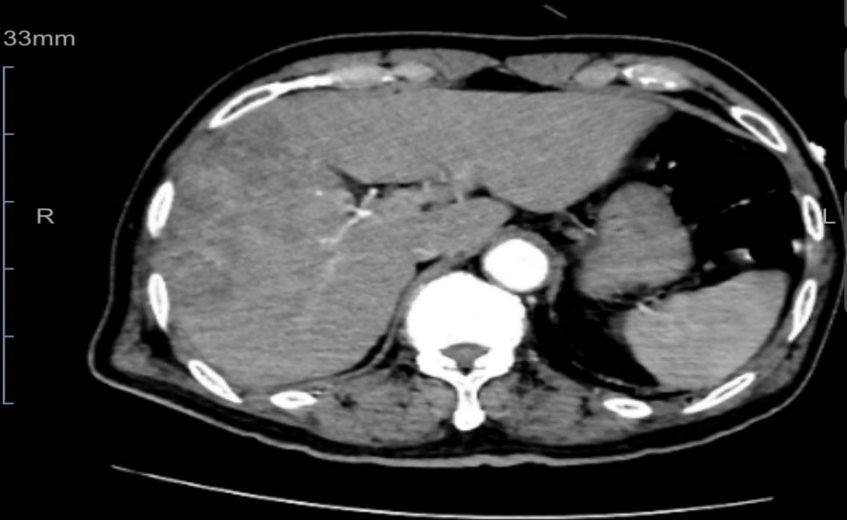 2021-12-07腹部增强CT检查影像
2021-12-07腹部增强CT检查影像
2021-12-09进一步行腹部增强MR检查示:肝右叶占位性病变,见多个结节融合成片,伴包膜下少量积液,考虑肝细胞癌可能性大。
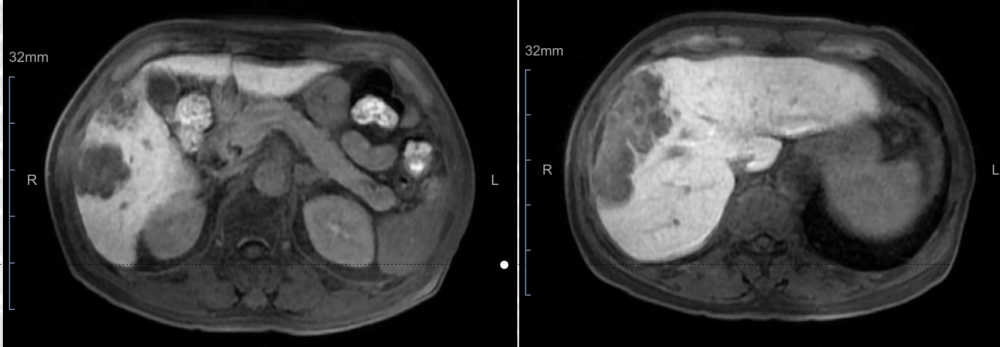 2021-12-09腹部增强MR检查影像
2021-12-09腹部增强MR检查影像
03临床诊断
(右叶)肝细胞癌(CNLC IIb期);
2型糖尿病;
高血压病 3级 极高危;
右侧肢体偏瘫;
脑卒中后遗症。
04治疗经过
该患者为老年男性,身体一般情况较差(合并糖尿病、高血压等基础疾病,且存在右侧肢体偏瘫),目前处于肝癌中晚期状态(CNLC IIb期),多发结节性块状瘤灶融合范围较大(43mm×99mm×105mm),经多学科会诊(MDT)讨论,认为患者属于不可切除肝癌,拟定整体治疗方案为:先给予“免疫治疗+靶向药物”为基础的多模式转化治疗,争取手术切除机会,然后根据手术情况再决定下一步治疗方案。
1、转化治疗阶段
于2021-12-14启动靶免联合治疗,具体用药为:仑伐替尼8mg po bid,D1-14 + 替雷利珠单抗200mg ivgtt q3w,D1;同时施行一次HAIC(采用FOLFOX化疗方案,奥沙利铂150mg、CF0.6、5-FU4.6g)。
2022-01-12腹部CT平扫+增强示:原病灶范围较前略缩小,目前约36mm×80mm×104mm。瘤灶内局部见小片液性密度区,提示肿瘤坏死。
 2022-01-12腹部CT平扫+增强影像
2022-01-12腹部CT平扫+增强影像
考虑治疗有效,予继续当前靶免联合方案(替雷利珠单抗+仑伐替尼),治疗5个周期后,于2022-05-07复查腹部MR示:原瘤灶较前明显缩小,未见新增瘤灶。
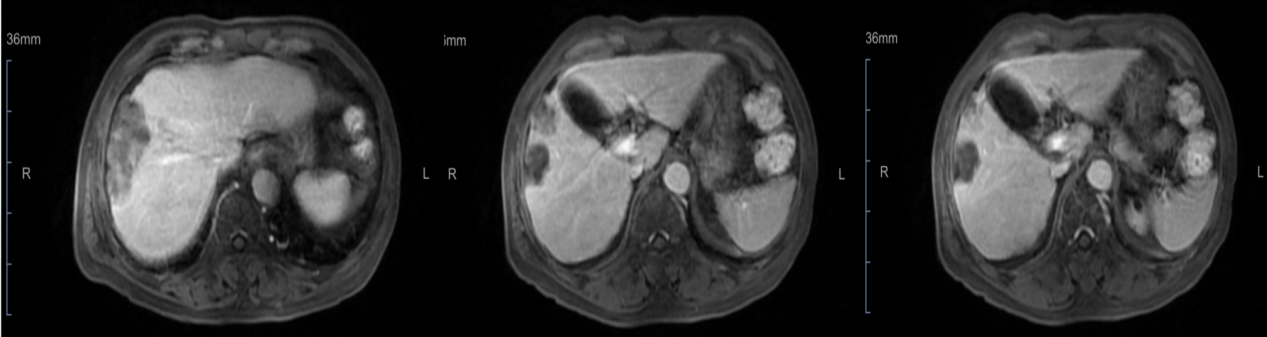 2022-05-07腹部MR影像
2022-05-07腹部MR影像
2、手术治疗阶段
经MDT讨论,认为患者目前已具备实施手术切除肿瘤的时机,遂于2022-05-13进行“腹腔镜下肝部分切除术+胆囊切除术”,手术过程顺利,未出现明显的手术并发症。
2022-05-16病理化验结果示:符合中分化肝细胞癌,见大片肿瘤细胞坏死,存活癌细胞约占20%;距主瘤体1cm内见约52个卫星结节,未见明确微血管癌栓;癌局部紧邻肝脏表面被膜(约0.3mm),手术切缘电灼变形处局部见坏死肿瘤细胞(约1mm)。
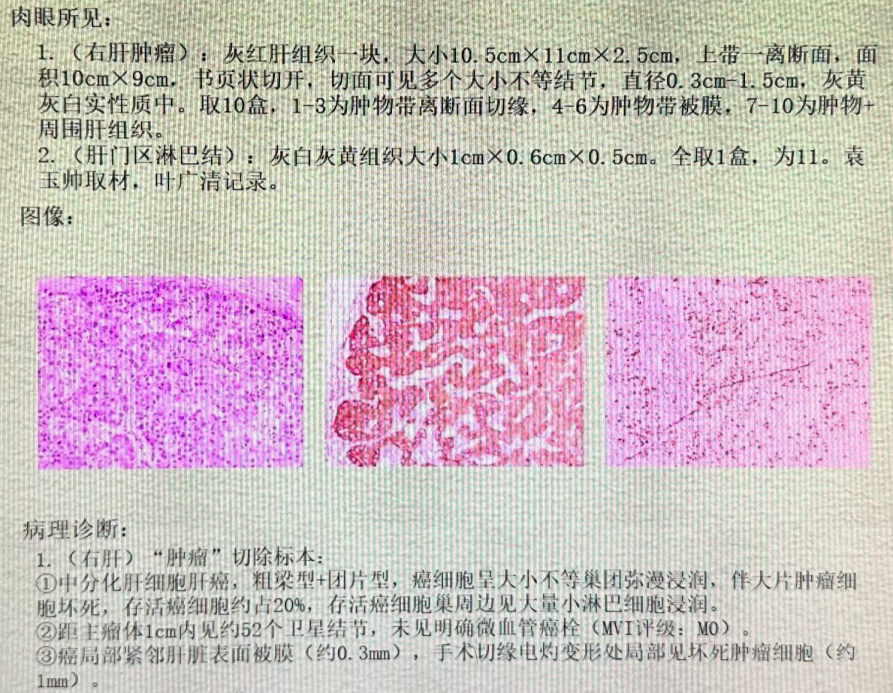
病理报告单截图
鉴于病理化验提示患者未能达R0切除,术后肿瘤复发转移风险较高,遂决定术后继续应用靶免方案为主的治疗方案来延缓肿瘤复发转移。
3、术后靶免联合治疗阶段
于2022-06-29启动术后靶免治疗,具体用药为:仑伐替尼8mg po bid,D1-14 + 替雷利珠单抗200mg ivgtt q3w,D1。
于2022-08-19行上腹部平扫+增强CT示:肝右前叶术后改变;肝内多发低密度灶,考虑肝内多发转移,其中较大者病灶截面大小约22mm×16mm。
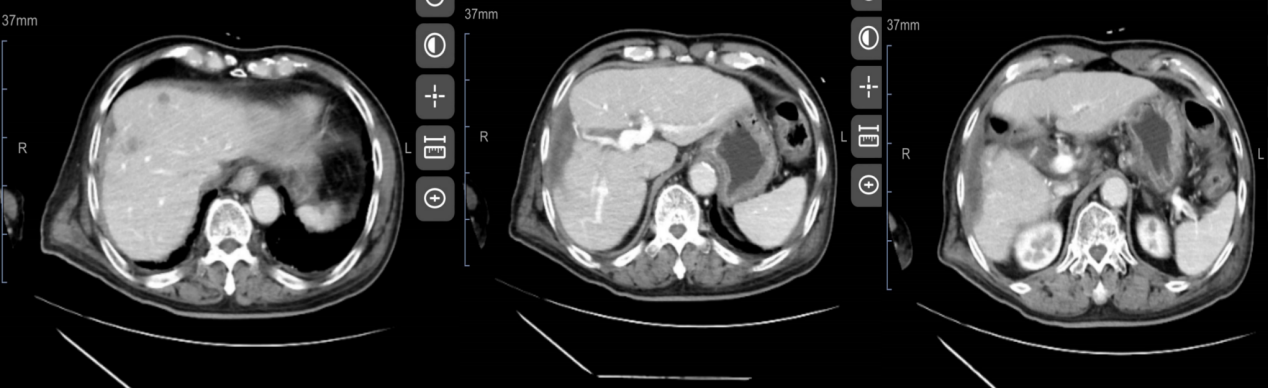 2022-08-19上腹部平扫+增强CT影像
2022-08-19上腹部平扫+增强CT影像
经MDT讨论,认为患者术后发生病情进展,遂决定在原靶免方案基础上,于2022-08-24加用一次HAIC(采用FOLFOX化疗方案,奥沙利铂150mg、CF0.6、5-FU4.6g)、于2022-10-20给予加用“TACE+HAIC”来加强抗肿瘤治疗。
后续于2023-02-14更改靶免方案为:替雷利珠单抗200mg ivgtt q3w,D1+多纳非尼0.2 po bid,D1-14。
采用“替雷利珠单抗+多纳非尼”靶免方案治疗2个周期后,于2023-04-18复查腹部CT示:肝内多发低密度灶,考虑肝内多发转移,病灶较前稍增大,最大者截面大小约24mm×17mm。
因见患者病情仍无改善,呈继续进展趋势,遂于2023-05-22在“替雷利珠单抗+多纳非尼”靶免方案基础上,加用TACE及HAIC。
经总共4个周期的以“替雷利珠单抗+多纳非尼”为主的抗肿瘤方案治疗后,于2023-06-26查腹部CT平扫+增强示:肝内多发低密度灶,考虑肝内多发转移,部分病灶较前缩小,最大者截面大小约16mm×8mm。
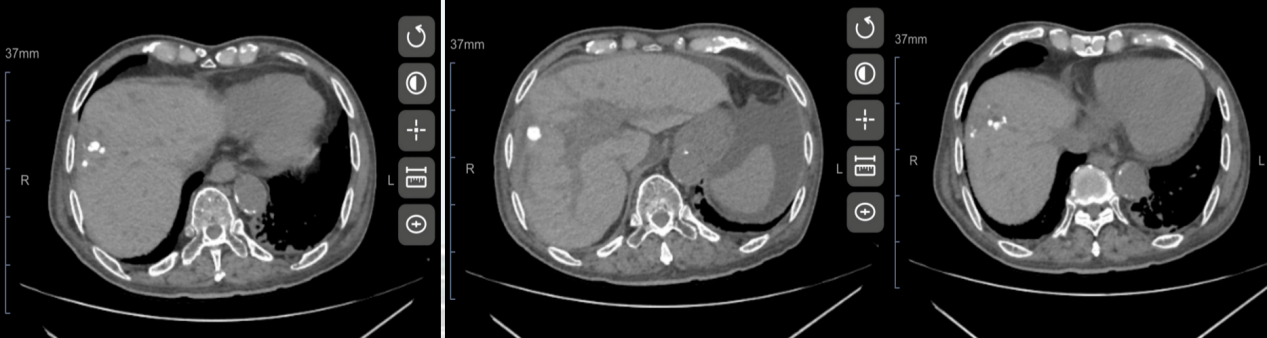 2023-06-26腹部CT平扫+增强影像
2023-06-26腹部CT平扫+增强影像
患者目前抗肿瘤治疗有效,后续计划长期维持靶免治疗。
目前(截至2023-10-10)患者AFP已降至44.1μg/L,影像学检查未见疾病进展表现,患者总体病情稳定,仍在用药观察中。
整个治疗期间患者AFP呈波动性下降趋势。
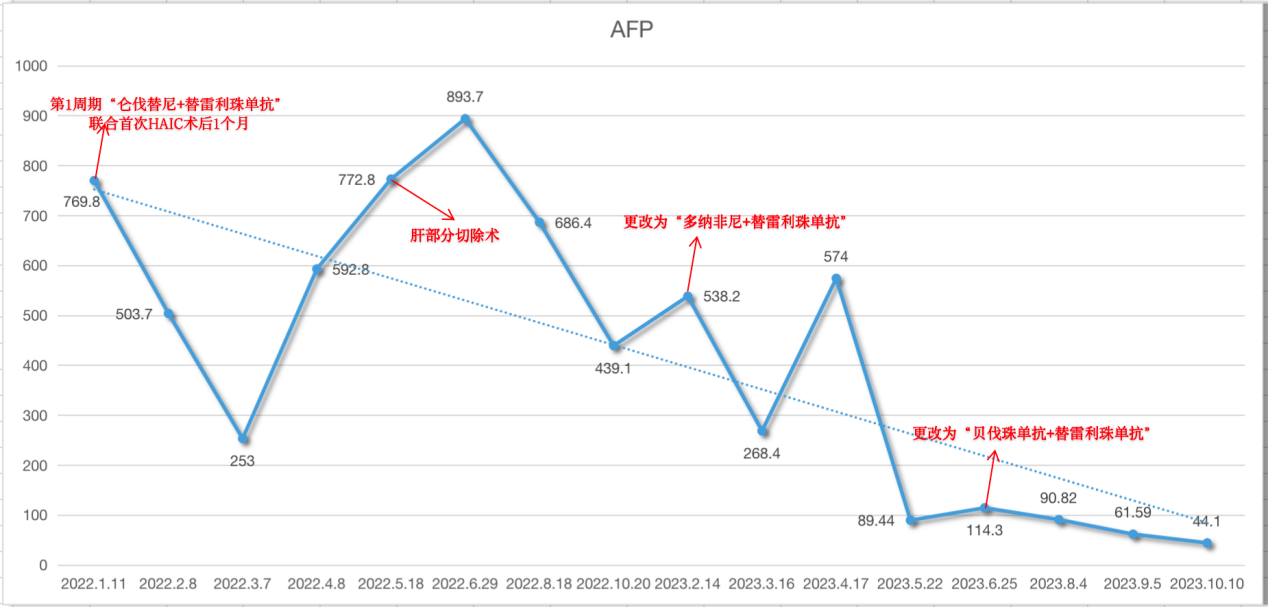 治疗期间患者AFP变化趋势
治疗期间患者AFP变化趋势
疗效评估:替雷利珠单抗联合靶向药物及HAIC、TACE治疗IIb期不可切除HCC成功使患者获得手术机会,并在术后抗肿瘤治疗中使患者长期获益,目前患者OS已达22个月。
不良反应:治疗期间,患者未出现任何明显的药物相关不良反应。
病例总结
肝切除术仍是目前HCC治疗最常用的潜在根治性治疗手段,然而由于首诊时中晚期患者比例较高等原因,我国只有少数HCC患者有机会接受根治性手术[1,3]。当前系统抗肿瘤治疗与综合治疗取得了长足进步,系统抗肿瘤治疗和/或局部治疗控制肿瘤的效果可以为中晚期HCC患者行根治性切除、降低术后复发和改善预后提供更多可能[4]。特别是抗血管生成药物与免疫治疗的联合,当前研究认为,这一靶免联合方案可以取得协同抗肿瘤效果[4],其用于晚期或不可切除HCC的治疗可获得 30% 左右的客观缓解率,患者中位生存期也提高到20 个月左右[1]。基于此,对于本例CNLC IIb期HCC患者,我们经MDT讨论后,制定了基于“靶向药物+免疫治疗”系统治疗的综合治疗方案,以期尽可能地延长患者生存期。
在免疫治疗药物的选择上,国产PD-1免疫检查点抑制剂替雷利珠单抗因疗效突出、安全性可靠、可及性高等多方面优势而成为我们许多临床医生的优选。RATIONALE-301研究数据显示,替雷利珠单抗单药治疗组患者的中位总生存期(mOS)达15.9个月,客观缓解率(ORR)为14.3%,其中完全缓解(CR)率是索拉非尼组的10倍(2.9% VS 0.3%);替雷利珠单抗组持续缓解时间(DoR)高达36.1个月,是索拉非尼组(11.0个月)的3倍之多[5]。表明替雷利珠单抗单药对于HCC具有深度、持久抗癌的作用。BGB-A317-211研究则表明:替雷利珠单抗联合靶向药物治疗下,不可切除HCC患者的ORR约38.7%,疾病控制率高达90.3%,中位无进展生存期(mPFS)达9.6个月;且两药联合≥3级TRAEs发生率仅为28.1%[6]。充分证实了替雷利珠单抗与靶向药物联合方案用于不可切除HCC治疗的有效性和安全性。近期一项关于“替雷利珠单抗+仑伐替尼+HAIC”方案转化治疗BCLC B/C期HCC患者的回顾性研究还显示:治疗后所有患者肿瘤均缩小,ORR高达94.4%;61.1%的患者经影像学评估转化治疗成功,38.9%的患者顺利接受根治性切除术,其中57.1%的手术患者术后评估达pCR;且该联合治疗方案的安全性可控[7]。该研究进一步验证了替雷利珠单抗与靶向药物、局部治疗等多模式联合治疗中的重要价值:不仅具有强劲而持久的缩瘤抗癌能力,且药物安全性和患者耐受性良好。
对于本案例中的IIb期不可切除HCC患者,基于以上证据和相关指南、共识推荐,我们选择了以替雷利珠单抗联合靶向药物的治疗方案为基础的转化治疗方案,成功使患者获得手术切除的机会。由于患者术后病理见距主瘤体1cm内见约52个卫星结节,手术切缘电灼变形处局部见坏死肿瘤细胞(约1mm),这意味着术后复发转移风险较高,遂术后继续应用靶免方案为主的治疗方案来延缓肿瘤复发转移。尽管整个治疗过程患者病情出现多次波动,但经过坚持免疫治疗用药,适时调整靶向治疗药物,以及必要时联合TACE、HAIC等局部治疗方案,最终有效控制住了患者病情、实现了长期获益,且整个用药治疗过程未发生任何明显的药物相关不良反应,患者耐受性、依从性良好。目前患者OS已达22个月,期待在后续进一步治疗随访中,见证该患者更远期的生存获益,同时也希望替雷利珠单抗能够助力我国更多的中晚期HCC患者,重获手术切除和长期生存的希望。
[1]中国抗癌协会肝癌专业委员会转化治疗协作组, 樊嘉. 肝癌转化治疗中国专家共识(2021版)[J]. 中华消化外科杂志, 2021, 20(6):600-616.
[2]中华预防医学会肝胆胰疾病预防与控制专业委员会,中国抗癌协会肝癌专业委员会,北京医学会外科学分会肝脏学组,等.基于免疫联合靶向方案的晚期肝细胞癌转化治疗中国专家共识(2021版)[J].中华肝胆外科杂志, 2021, 27(4):241-251.
[3]国家科技部传染病防治重大专项课题《病毒性肝炎相关肝癌外科综合治疗的个体化和新策略研究》专家组, 陈孝平, 沈锋,等. 肝细胞癌肝切除术后复发预防和治疗中国专家共识(2020版)[J]. 中国实用外科杂志, 2021,41(1):20-30.
[4]中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(4):367-388.
[5]Masatoshi Kudo, et al. Final analysis of RATIONALE-301: Randomized, phase III study of tislelizumab versus sorafenib as first-line treatment for unresectable hepatocellular carcinoma. 2022 ESMO.LBA36.
[6]Minshan Chen, et al. Efficacy and safety of tislelizumab (TIS) plus lenvatinib (LEN) as first-line treatment in patients (pts) with unresectable hepatocellular carcinoma (uHCC): a single-arm, multicenter, phase II trial. 2022 ESMO IO Abstract 165P.
[7]Zhong JH, et al. Efficacy and safety of tislelizumab combined with lenvatinib and FOLFOX4-HAIC in conversion therapy of middle-advanced stage hepatocellular carcinoma(HCC): A realworld retrospective study.2023 ASCO. Abstract e16137.
排版编辑:肿瘤资讯-Riddy











 苏公网安备32059002004080号
苏公网安备32059002004080号


