十月风凉, 吹落一地枯黄, 随着十月的结束, 风中寒意开始显现。又到了每月一期的文献速递时刻了, 在过去的一月中留下了哪些值得关注的临床研究? 在此, 小编特精选过去一个月内各大顶级血液学期刊中值得重点回顾的研究动态, 带您一睹为快!
belantamab mafodotin单药vs 泊马度胺+低剂量地塞米松在复发/难治多发性骨髓瘤(RRMM)治疗中疗效和安全性研究
Meletios Athanasios Dimopoulos教授等开展了一项开放标签的随机III期研究 (DREAMM-3) , 325例RRMM患者以2:1分配至belantamab mafodotin 2.5 mg/kg单药 (每21天1次,n=218) 及泊马度胺4.0mg/d (d1~d21) +低剂量地塞米松40mg/周 (若年龄>75岁剂量为20mg/周, n=107) 进行治疗,主要研究终点为无进展生存 (PFS) 。中位随访11.5个月, 结果显示: ①belantamab mafodotin单药组的中位PFS为11.2个月, 泊马度胺+低剂量地塞米松方案的中位PFS为7.0个月(HR=1.03 [0.72~1.47]; p=0.56)。②belantamab mafodotin单药组最常见的3~4级不良反应为血小板减少 (23%) 和贫血 (16%) , 泊马度胺+低剂量地塞米松方案的3~4级不良反应为中性粒细胞减少 (33%) 和贫血 (18%) , 严重的不良反应(SAEs) 发生率分别为43% (belantamab mafodotin单药组) 和39% (泊马度胺+低剂量地塞米松组) 。
该研究表明, 较之于泊马度胺+低剂量地塞米松这项RRMM标准方案,belantamab mafodotin单药并未能改善RRMM患者的PFS, 毒副作用也相似。
GRIFFIN研究: 在来那度胺+硼替佐米+地塞米松基础上加入daratumumab治疗适合移植的新诊断多发性骨髓瘤患者
Peter M Voorhees教授等开展了一项开放标签、随机II期研究,纳入207例适合移植的新诊断多发性骨髓瘤患者, 其中104例接受D-RVd(daratumumab-来那度胺+硼替佐米+地塞米松)治疗, 103例RVd方案 (来那度胺+硼替佐米+地塞米松) 治疗, 旨在比较RVd方案上加入daratumumab能否改善疗效,主要的研究终点为严格意义的完全缓解(sCR),次要终点为无进展生存(PFS)和总体生存(OS)。
中位随访49.6个月。结果显示:①D-RVd能提升患者的sCR, 分别为67% vs 48%(HR=2.18 [95% CI 1.22~3.89],p=0.0079,D-RVd为前者,后续亦如此); 4年PFS分别为87.2% vs 70%(HR=0.45 (95%CI:0.21~0.95,p=0.032); 两组方案患者的OS均为达到(HR=0.90 [95%CI:0.31~2.56],p=0.84)。该研究表明,在RVd方案基础上加入daratumumab能提升缓解的深度和无进展生存。
First-MIND研究Ib期: R-CHOP联合tafasitamab±来那度胺一线治疗DLBCL的疗效及安全性研究
抗CD19的免疫治疗药物tafasitamab联合来那度胺可用于不适合移植的复发/难治弥漫大B细胞淋巴瘤(R/R-DLBCL)患者的治疗,其在DLBCL一线治疗中的作用有待研究。近期,David Belada教授等开展的一项研究发表于BLOOD期刊上,探讨了R-CHOP联合tafasitamab±来那度胺在DLBCL一线治疗中的疗效和安全性。
最终共纳入66例初治DLBCL患者, 1:1接受R-CHOP+tafasitamab(T组)或R-CHOP+tafasitamab+来那度胺(T/L组)治疗6个周期, 主要研究终点为安全性,次要终点为治疗结束后的客观缓解率(ORR)和完全缓解率(CR)。
结果显示: ①所有患者均出现治疗相关不良反应(AEs), 大多数为1~2级,≧3级的中性粒细胞减少和血小板减少的发生率分别为57.6%和12.1%(T组), T/L组则分别为84.8%和36.4%; ②疗效方面, T组的ORR为75.8%,CR 72.7%; T组ORR为81.8%, CR 66.7%。T组的24个月PFS和OS分别为72.7%及90.3%;T/L组则为76.8%和93.8%。
该研究表明, R-CHOP+tafasitamab±来那度胺这种新联合方案在初治DLBCL患者中显示出一定的疗效, 安全性较前方案相似。
来那度胺联合利妥昔单抗在老年、虚弱弥漫大B细胞淋巴瘤患者初始治疗中的应用: FIL_ReRi研究II期
老年弥漫大B细胞淋巴瘤(DLBCL)的治疗存在较大的挑战,尤其是老年虚弱患者。Guido Gini教授等开展了一项FIL_ReRi研究, 利用一组Chemo-Free(无化疗)的治疗方案(即来那度胺+利妥昔单抗,R2)治疗老年虚弱患者,旨在探索该方案的疗效及安全性,主要研究目标为6周期治疗后的客观缓解率(ORR)以及3~4级非血液系统毒性。
结果显示: ①ORR达到50.8%,其中完全缓解率(CR)为27.7%,中位随访24个月发现,中位无进展生存(mPFS)为14个月,2年时有64%的患者仍维持缓解状态 。②在安全性方面, 有34例患者出现了3~4级非血液系统毒性。该研究表明,来那度胺+利妥昔单抗(R2)组成的无化疗方案在老年虚弱MM患者中有中等疗效, 安全性可控。
更高剂量Venetoclax联合阿扎胞苷(基于MRD指导下停药)在新诊断AML治疗中的应用研究
对于不适合强化化疗的新诊断AML患者而言,Venetoclax联合阿扎胞苷是其标准方案之一,而如何优化该联合方案成为研究者致力的方向,Jonathan A. Gutman教授等开展了一项研究以验证提出的两个假设: 1.应用更高剂量的Venetoclax,患者仍能耐受且更为有效; 2. 当患者达到深度缓解,基于MRD情况可停用阿扎胞苷。
42例新诊断AML患者纳入该研究, 接受1~3周期Venetoclax+阿扎胞苷诱导治疗, 其中Venetoclax剂量为600mg/d (高于标准剂量的400mg/d),然后根据MRD状态分别接受不同的维持治疗方案, MRD阳性组患者接受阿扎胞苷+venetoclax 400mg/d维持治疗; MRD阴性组则接受venetoclax 400mg/d单药维持。
结果显示: 更高剂量venetoclax+阿扎胞苷 (HiDDAV)与标准剂量venetoclax+阿扎胞苷在安全性方面相似, 无显著差异。②更高剂量venetoclax+阿扎胞苷(HiDDAV)能使患者的客观缓解率(ORR)达到66.7%;缓解持续时间(DOR)为12.9个月;无事件生存(EFS)和总体生存(OS)分别为7.8和9.8个月;流式细胞术(FCM)检测到的MRD阴性率为64.3%。
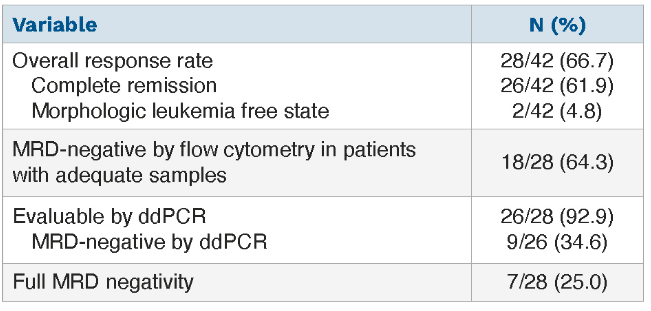
该研究表明, venetoclax剂量>400mg/d+阿扎胞苷治疗的耐受性良好,毒副作用与标准剂量相似。另外,更高剂量venetoclax能带来更深度的缓解,这似乎带来了临床获益。但在缺乏足够的对照数据之前,不推荐常规应用venetoclax 600mg/d。
1. https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(23)00243-0/fulltext
2. https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(23)00217-X/fulltext#%20
3. https://ashpublications.org/blood/article/142/16/1348/496604/Safety-and-efficacy-of-tafasitamab-with-or-without
4. https://ashpublications.org/blood/article-abstract/142/17/1438/496752/Lenalidomide-plus-rituximab-for-the-initial?redirectedFrom=fulltext
5. https://haematologica.org/articlE/view/haematol.2023.282681.
排版编辑:Cherry











 苏公网安备32059002004080号
苏公网安备32059002004080号


