前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,也是全球男性癌症死亡的第二大原因[1]。我国前列腺癌发病率呈逐年上升趋势[2],约40%的患者为可手术治疗的局限性前列腺癌[3]。根治性前列腺切除术(radical prostatectomy,RP)是前列腺癌的重要治疗手段,RP不仅用于T1~T2期前列腺癌,在局部进展(T3~T4期)甚至转移性前列腺癌中的应用也逐渐增多[4, 5]。临床中,对于高危或局部进展性前列腺癌单纯接受RP的效果不佳,这与术后病理切缘阳性、包膜侵犯、精囊侵犯等不良病理因素相关,造成术后生化复发率高。高危前列腺癌患者接受RP后,5年内生化复发率大于50%[6]。因此,在临床实践中,需要探索多模式联合治疗策略,以提高远期疗效,改善患者预后。
科主任、达芬奇机器人手术中心主任、象湖院区大外科主任
中国抗癌协会腔镜与机器人分会﹒副主任委员
中国老年医学学会泌尿外科分会﹒副会长
中华医学会泌尿外科分会 ﹒机器人学组秘书长
中国医师协会泌尿外科分会﹒委员
海峡两岸医药交流协会泌尿外科分会﹒常委
江西省医师协会泌尿外科医师分会﹒会长
江西省医学会泌尿外科分会﹒候任主任委员
国家科技进步二等奖1项,国际最佳手术奖1项
省部级科技进步一等奖1项,二等奖4项,三等奖2项
江西省“千人"计划首批科技创新高端人才
江西省卫健委有突出贡献中青年专家
江西省百千万人才工程人选
江西省青年五四奖章
主要从事泌尿生殖系统肿瘤、泌尿系结石、前列腺疾病的诊治,发表多篇SCI论文
前列腺癌新辅助内分泌治疗的初步探索
术前实施新辅助治疗是多模式联合治疗策略的重要研究方向之一,基于前列腺癌发生、发展往往存在雄激素依赖性的分子机制,雄激素剥夺疗法(androgen deprivation therapy,ADT)是晚期前列腺癌治疗的基石,也是最早尝试用于前列腺癌术前新辅助内分泌治疗的方案。
对10项新辅助ADT用于局限性和局部晚期前列腺癌的随机临床对照试验进行系统回顾和荟萃分析,结果显示,术前ADT显著降低了切缘阳性率(RR=0.49, 95% CI 0.42-0.56, p < 0.00001)和淋巴结阳性率(RR=0.49, 95% CI 0.42-0.56, p < 0.02),但未提高总生存率或无疾病生存率[7]。该结果提示,RP术前应用ADT,可以通过减少切缘阳性率、包膜侵犯及淋巴结阳性率提高手术切除率,降低手术难度,但是并未转化为生存优势。单纯新辅助ADT无法获得更好肿瘤学预后,可能与血清睾酮水平的下降与组织内雄激素下降并不一致有关,组织内可能存在雄激素的残留,此外ADT无法抑制肾上腺来源雄激素。尽管进行了药物去势,前列腺组织内残留的雄激素可能仍处于能够激活雄激素受体(androgen receptor,AR)并上调雄激素相关基因表达的水平[8]。此外,术前应用ADT具有副作用,可能导致激素水平变化以及心血管疾病、糖尿病、骨质疏松发生等。
出于平衡新辅助治疗临床获益与安全性的考量,目前欧洲泌尿外科协会(EAU)前列腺癌指南[9]、美国国立综合癌症网络(NCCN)前列腺癌指南[10],以及中国泌尿外科和男科疾病诊断治疗指南[11]等国内外指南,均未推荐ADT作为常规的RP术前新辅助治疗选择。
EAU指南对新辅助ADT建议的实践情况
尽管指南未建议在RP前使用新辅助ADT治疗,但这种做法在临床实践中仍然存在。近年来,随着新型内分泌药物不断更新发展,以及临床对不良事件管理日趋完善,从改善高危患者RP术后高复发的角度出发,临床实践中新辅助治疗的必要性值得进一步探讨。
近期,欧洲指南实施与教育影响评估小组对EAU指南中 “前列腺癌患者手术前不需要进行新辅助ADT”这一建议的实践情况进行了调查[12]。这项观察性横断面研究纳入了来自欧洲31个国家187家医院的6598例前列腺癌患者。纳入标准:(1)经组织学证实的前列腺癌患者;(2)有治疗需求而接受RP治疗的患者。排除标准:转移性疾病患者、放疗或放疗以外的其他治疗方案后的复发性前列腺癌患者。研究采用描述性统计和多层次模型来分析不同地区和医院ADT实践之间的差异,对低、中、高危患者以及局部晚期前列腺癌患者进行了亚组分析,并收集了不依从指南的原因[12]。
研究结果显示:
(1) 指南依从性:98%的患者(6466/6598)按照指南进行治疗。68%的医院指南依从率为100%,中位指南依从率为100%,最低指南依从率为69%(图1)。
(2) 按医院类别分层分析指南依从情况:高手术量医院(年RP手术量>50)和低手术量医院(年RP手术量<50)、公立医院和私立医院的指南依从性差异无统计学意义(图2A-B)。多数国家学术型医院和社区医院之间的依从性差异无统计学意义,仅第60号国家学术型医院和社区医院之间存在显著差异(图2C)。
(3) 按疾病风险分层分析指南依从情况:低危患者(1057例)、中危患者(3011例)、高危患者(1706例)和局部晚期患者(772例)中,指南依从率分别为99.5%、99%、97%和93%(图3)。
(4) 术前接受ADT治疗的原因分析:在132例对指南建议不依从性的病例中,64例(48%)给出一个或多个原因,包括试图改善预后、缩小肿瘤体积、缩小前列腺体积、降低手术切缘阳性率、患者等待手术时间长、以及患者的偏好等(图4)。
综上,该研究结果显示,在临床实践中,治疗低或中危前列腺癌患者通常会遵循EAU指南建议,但高危或局部晚期前列腺癌患者中依然存在部分与EAU指南建议不一致的新辅助ADT应用。深入了解泌尿科医生在何种情况下愿意违反指南建议进行治疗,值得进一步研究,这将有助于从临床实践出发,筛选新辅助治疗获益人群,为降低RP手术切缘阳性率及术后复发率提供更多治疗选择。
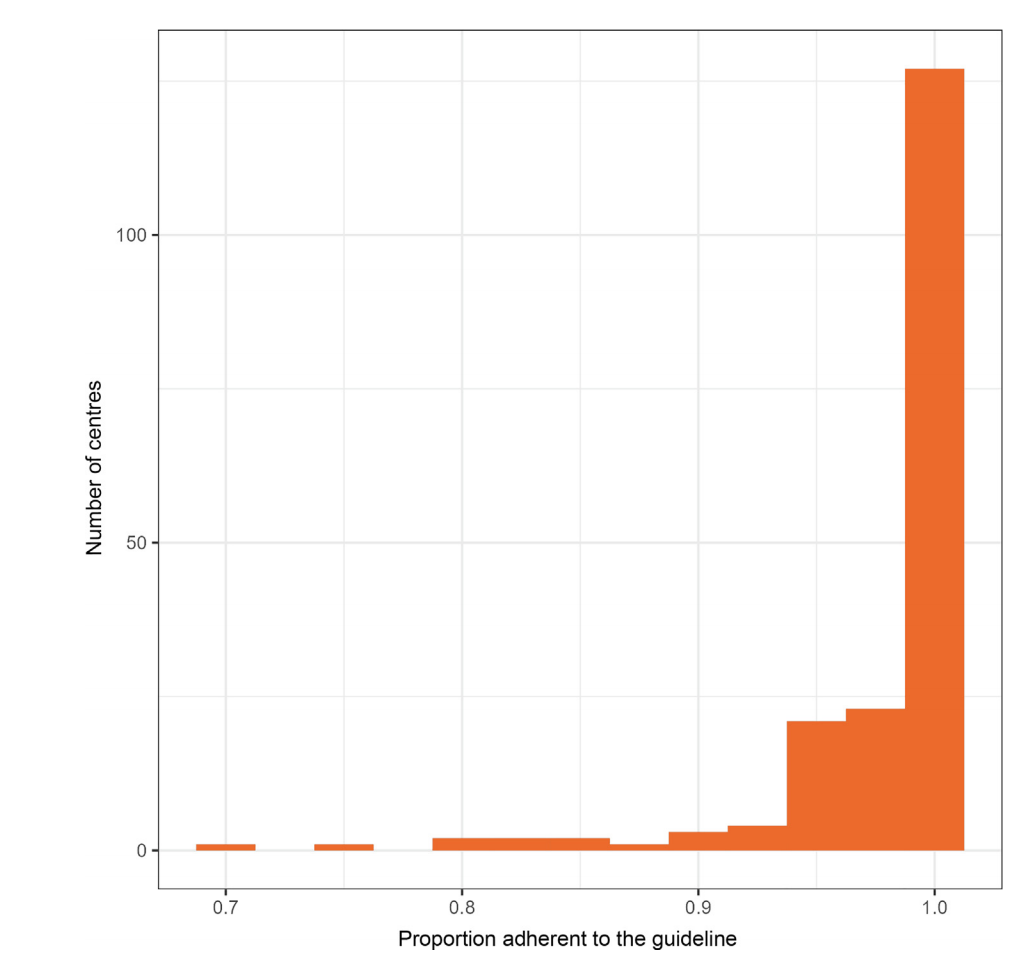
图1 各医院指南依从率分布情况
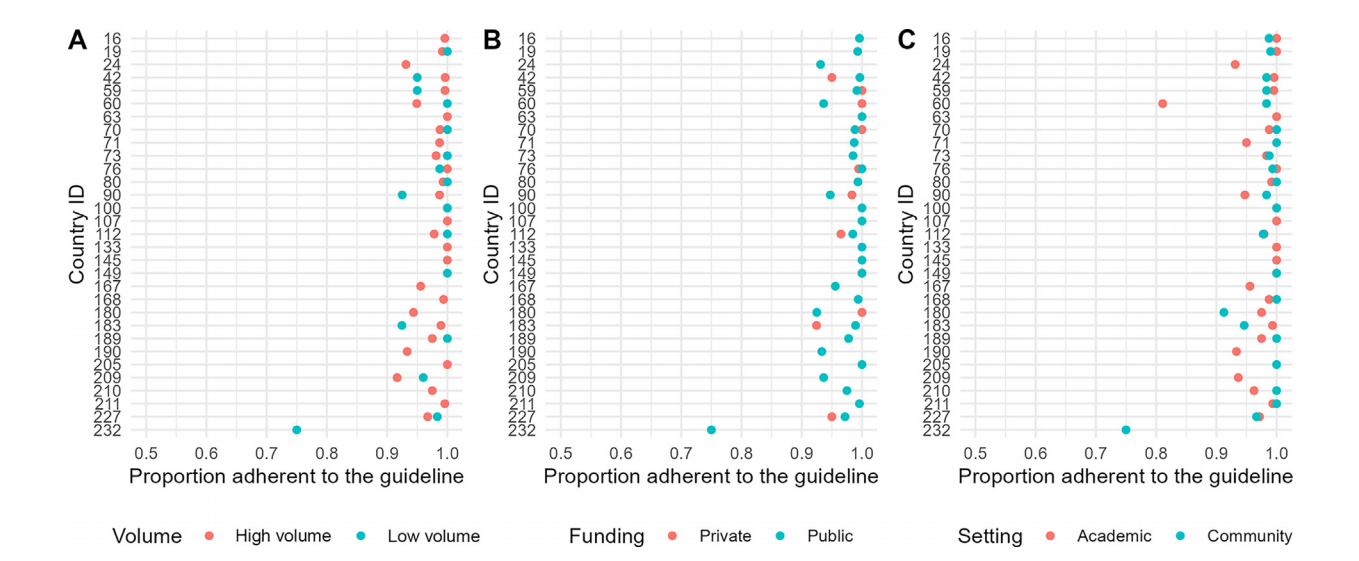
图2 每个国家(A)高/低手术量医院,(B)私立/公立医院,(C)学术型/社区医院指南依从率情况
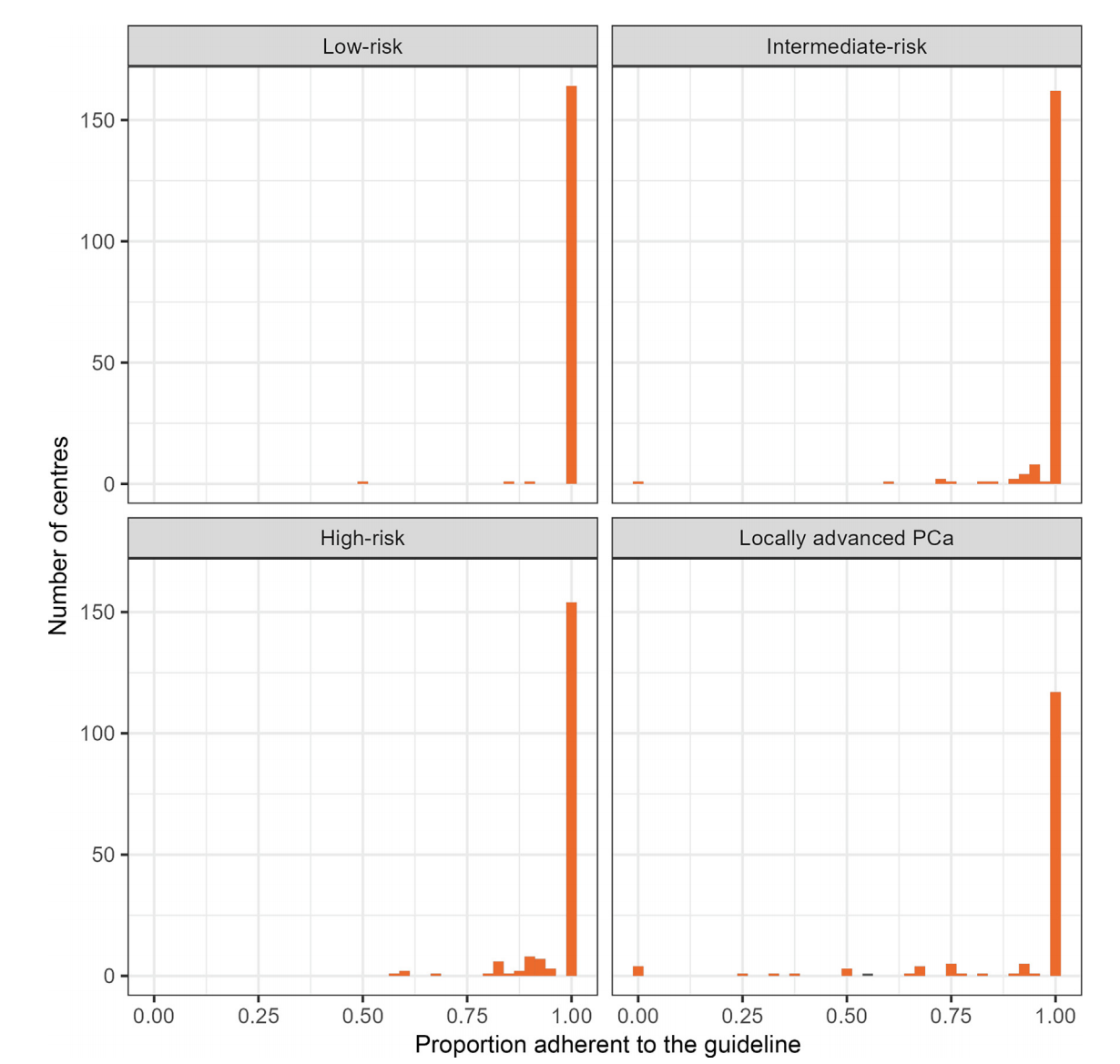
图3 按疾病风险分层指南依从率分布
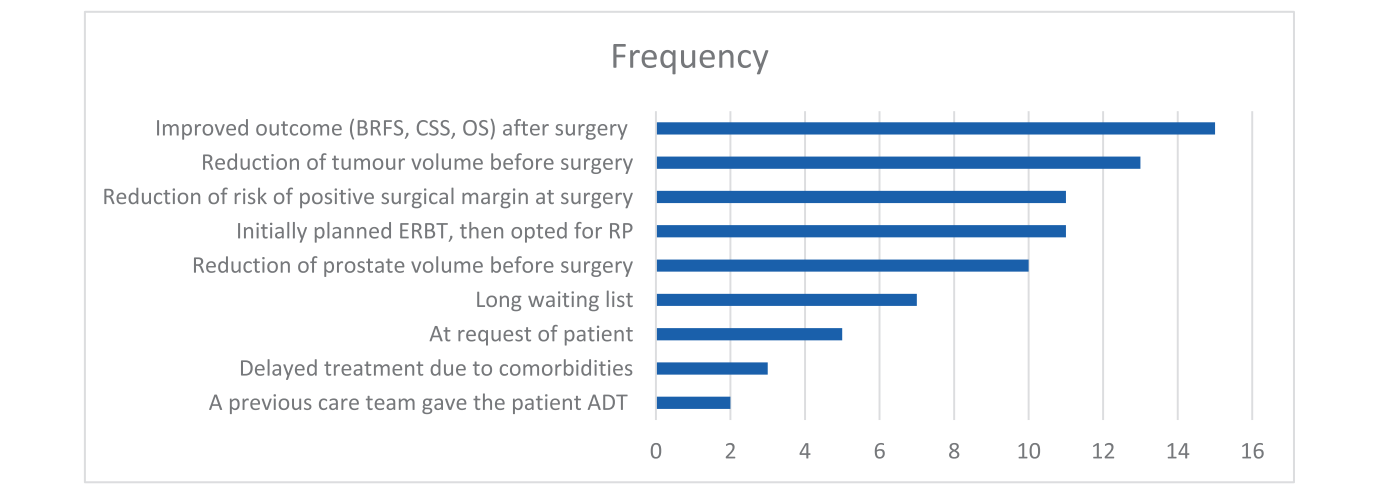
图4 术前行ADT治疗原因及频次
ADT联合新型内分泌药物在新辅助治疗中的探索持续展开
从EAU指南实践情况可以看出,对部分高危或局部晚期前列腺癌患者,仍有一部分医生平衡风险和获益后,在临床实践中采用新辅助ADT治疗方案。对前列腺癌进行风险分层管理至关重要,针对高危患者在根治性切除手术基础上,实施新辅助治疗有利于降低肿瘤分期,缩小肿瘤体积并提高手术切除率,提前控制可能存在的肿瘤微转移病灶,进一步降低肿瘤转移和术后复发的风险。近年来,随着阿比特龙、阿帕他胺、恩扎卢胺、达罗他胺等新型内分泌药物的出现,以ADT为基石的新辅助内分泌治疗展现出新的机会。
新一代雄激素通路抑制剂(androgen receptor signaling inhibitors,ARSI)通过靶向细胞色素P450 17α-羟化酶(CYP17A1)抑制雄激素合成,或直接靶向AR以抑制AR信号通路。ADT+ARSI可以更完全地抑制组织内雄激素水平,在既往新辅助单用ADT、化疗±一代抗雄、化疗+ADT失败的经验中继续向前探索,有望实现前列腺癌新辅助治疗的突破。值得注意的是,在新辅助阶段,ADT仍然是基石。以恩扎卢胺新辅助治疗为例,恩扎卢胺单药治疗组和恩扎卢胺+亮丙瑞林+度他雄胺联合治疗组分别治疗6个月后行RP,联合治疗组微小残留病灶率(残留肿瘤直径≤3 mm)为73.9%,单药治疗组36%,提示单纯应用ARSI不联合ADT对肿瘤控制并不足够有效[13]。
目前,新辅助ADT联合ARSI的研究正在陆续开展中。一项II期试验比较ADT+阿帕他胺和单用ADT治疗后行RP的疗效差异,结果显示,ADT+阿帕他胺组患者达到微小残留病灶(残留肿瘤负荷≤0.25 cm3)的比例显著高于对照组(38% vs.9.1%;P=0.002)[14]。该研究初步表明,ADT联合新型内分泌药物的新辅助治疗较单纯ADT治疗能够获得更好的肿瘤反应,也为后续探索ADT联合ARSI的新辅助治疗提供了重要参考。ADT联合其他ARSI的多中心临床研究也在陆续开展中。未来期待进一步看到ADT联合ARSI对长期生存获益的研究结果。
总结
对前列腺癌进行风险分层管理至关重要,从EAU指南实践情况可以看出,对部分高危或局部晚期前列腺癌患者,仍有一部分医生平衡风险和获益采用新辅助ADT治疗方案。针对高危患者在根治性切除手术基础上,探索多模式联合治疗策略,有助于提高远期疗效、改善预后。随着新型内分泌药物的发展,以ADT为基石的新辅助内分泌治疗展现出新的机会,可能成为前列腺癌新辅助治疗的重要选择。
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[2] Liu X, Yu C, Bi Y, et al. Trends and age-period-cohort effect on incidence and mortality of prostate cancer from 1990 to 2017 in China [J]. Public Health, 2019, 172: 70-80.
[3] Chen R, Ren S, Chinese Prostate Cancer C, et al. Prostate cancer in Asia: A collaborative report [J]. Asian J Urol, 2014, 1(1): 15-29.
[4] Costello A J. Considering the role of radical prostatectomy in 21st century prostate cancer care [J]. Nat Rev Urol, 2020, 17(3): 177-88.
[5] Heidenreich A, Pfister D. Radical cytoreductive prostatectomy in men with prostate cancer and oligometastatic disease [J]. Curr Opin Urol, 2020, 30(1): 90-7.
[6] Kane C J, Presti J C, Jr., Amling C L, et al. Changing nature of high risk patients undergoing radical prostatectomy [J]. J Urol, 2007, 177(1): 113-7.
[7] Shelley M D, Kumar S, Wilt T, et al. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma [J]. Cancer Treat Rev, 2009, 35(1): 9-17.
[8] Mostaghel E A, Page S T, Lin D W, et al. Intraprostatic androgens and androgen-regulated gene expression persist after testosterone suppression: therapeutic implications for castration-resistant prostate cancer [J]. Cancer Res, 2007, 67(10): 5033-41.
[9] EAU Guidelines on Prostate Cancer. 2023. http://uroweb.org/guidelines/prostate-cancer
[10] Schaeffer E M, Srinivas S, Adra N, et al. NCCN Guidelines(R) Insights: Prostate Cancer, Version 1.2023 [J]. J Natl Compr Canc Netw, 2022, 20(12): 1288-98.
[11] 中国泌尿外科和男科疾病诊断治疗指南,2022版.
[12] Maclennan S, Azevedo N, Duncan E, et al. Mapping European Association of Urology Guideline Practice Across Europe: An Audit of Androgen Deprivation Therapy Use Before Prostate Cancer Surgery in 6598 Cases in 187 Hospitals Across 31 European Countries [J]. Eur Urol, 2023, 83(5): 393-401.
[13] Montgomery B, Tretiakova M S, Joshua A M, et al. Neoadjuvant Enzalutamide Prior to Prostatectomy [J]. Clin Cancer Res, 2017, 23(9): 2169-76.
[14] Devos G, Tosco L, Baldewijns M, et al. ARNEO: A Randomized Phase II Trial of Neoadjuvant Degarelix with or Without Apalutamide Prior to Radical Prostatectomy for High-risk Prostate Cancer [J]. Eur Urol, 2023, 83(6): 508-18.
排版编辑:肿瘤资讯-momo











 苏公网安备32059002004080号
苏公网安备32059002004080号


