数字病理学的发展和计算机视觉算法的进步推动了人工智能技术在肿瘤病理学领域的应用。目前,人工智能病理在肿瘤诊断、指导治疗策略选择、疗效评估以及预后预测等方面均已显示出良好的应用前景。人工智能技术在肿瘤病理学中的应用有助于提高病理诊断的客观性、准确性,有效减轻病理学家的工作量,为实现疾病精准诊疗和患者个体化管理奠定了良好基础。在此,本文概述了如何将人工智能病理融入肿瘤精准医疗的工作流程,并讨论了将人工智能技术应用于肿瘤病理领域所面临的挑战、机遇和相应的应对策略。

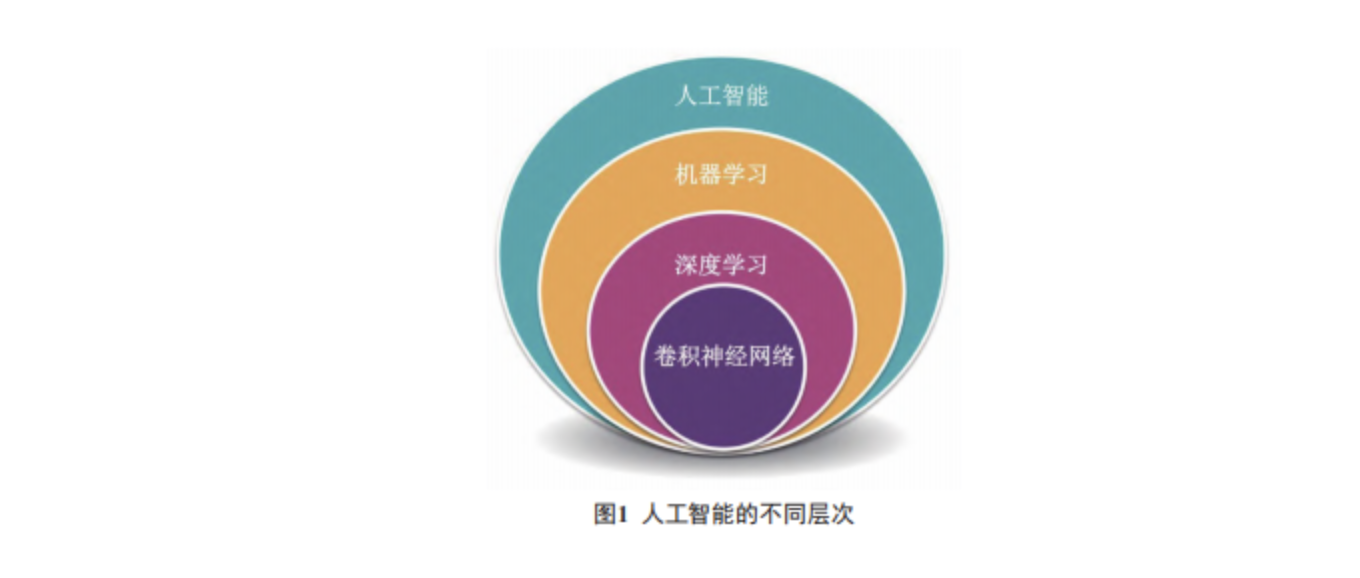
恶性肿瘤是危害人类健康的重大疾病。客观、精准、高效地识别恶性肿瘤早期病变以及判断肿瘤恶性程度、表征分子特征、预测患者预后并提供个体化治疗决策指导对于提高恶性肿瘤的诊治效果至关重要。随着计算机技术的发展、互联网的普及和智能设备的进步,人工智能 (artificial intelligence,AI) 已经渗透至人类生活的方方面面。“人工智能在恶性肿瘤诊断和监测中的潜力”被认为是人类癌症研究领域的里程碑式进展之一。目前,病理学仍是恶性肿瘤诊断的“金标准”。传统病理组织形态的判读多依赖于病理医师的经验,对于各种形态信息、分子信息、组学信息的高效整合、提炼需要更客观、更高通量的方法来辅助实现。病理大数据和人工智能的结合将促进精准诊疗的实现 [1],减少病理医师的重复性工作,实现跨地域的病理诊断资源共享。为了更好地理解人工智能的当前角色和未来前景,与其密切相关的两个重要术语需要加以区别 :机器学习和深度学习。机器学习是一个通用概念,表明计算机从数据中学习的能力,从而改进分析模式和模型 [2]。深度学习则是一种机器学习方法,它利用复杂的神经网络来创建学习系统,从大型数据集中学习特征表示 [3-6],最终得到具有高度可预测性能的模型 [7-8]。在人工智能病理领域,使用最广泛的神经网络是卷积神经网络 (convolutional neuralnetwork, CNN)。值得注意的是,这两个概念也是癌症患者管理中人工智能革命的核心 ( 图 1)。
在此,我们回顾了人工智能病理在肿瘤精准医疗中的最新进展,阐述了人工智能向临床转化面临的挑战,提出了通过人工智能实现恶性肿瘤精准诊疗的前景和策略。
1. 人工智能病理学发展历程、意义及前景
病理人工智能依赖于数字图像。随着新颖的成像系统和全视野数字切片图像 (whole slide image,WSI)扫描仪的日趋成熟,病理医师通过 WSI 诊断的方式正在逐渐取代传统的显微镜下阅片。目前,基于 WSI的远程病理诊断已成为日常病理诊断的一部分。有些国外病理机构甚至已经停止使用实体切片。病理组织人工智能虚拟染色技术的发展使得不染色而直接获得数字病理切片成为可能。非标记成像生成的图像经过计算机图像处理,虚拟“染色”成病理科医生熟悉的传统生化染色图像,所生成的病理图像也具有更好的均一性,不易受到染色条件不同的干扰,同时只需一张切片即可实现多种染色,有望大幅提高病理诊断的准确性。数字切片取代实体病理切片是将来发展的趋势 [5]。
1.1 人工智能病理学发展历程
病理人工智能是指通过人工智能算法,对数字化的病理切片进行诊断,其中数字病理技术是病理人工智能的基础,模型的构建是病理人工智能的关键。数字扫描仪领域的进展为病理人工智能提供了硬件支撑。1997 年,Bacus Laboratoties Inc. 发布了第一台全切片成像病理扫描仪,此后病理切片扫描仪进入快速发展阶段。2003 年,我国首个病理全切片成像系统由麦克奥迪公司生产,并于 2009 年通过卫生部鉴定。2017 年 4 月,飞利浦 IntelliSite 病理解决方案 (PIPS) 被美国 FDA 批准上市,这是全球首个被FDA 批准的病理全切片成像系统。癌症AI 诊疗公司 Paige 的联合创始人 Thomas Fuchs 首次将计算病理学 (computational pathology) 定义为研究以完全概率的方式处理一般病理学中的科研和临床流程,即将实验设计、统计模式识别和生存率分析组合到一个统一的框架中,以解答病理学中的科学和临床问题。计算病理学的发展使得人工智能技术正进入病理学领域,以机器学习或者深度学习的方式建立的自动人工智能系统不仅可以实现计算机辅助诊断,即服务于病理医师的辅助诊断系统,还可以实现诊断的客观性、均质化及标准化。
1.2 人工智能病理学的发展将大幅提高疾病诊断效率、客观性和定量指标判读准确性
随着数字病理学的到来,计算机辅助分析从定性转变为定量。人工智能模型能够对高通量数据进行快速整合分析,提高病理诊断效率,诊断标准更加客观、结果一致性好,能够很好地消除病理医生之间的主观判读差异。此外,人工智能病理模型构建的成本低于培养病理医师的成本,且可不间断工作,更加快速、高效,最大限度解放病理医生的劳动力。
1.3 未来肿瘤病理诊断新模式:数字化远程病理诊断系统
全切片数字化图像改变了传统病理诊断的阅片方式,实现了可视化数据的永久储存和不受时空限制的同步浏览处理。目前,国内很多三甲医院病理科都建立了全数字化病理切片档案库,实现了远程病理诊断。COVID-19 疫情给医疗行业带来了巨大的挑战和深远的影响,鉴于严峻的防控压力,人员流动受控,病理科借助于诊断流程数字化进行远程诊断也成为了应对疫情的新举措 [9]。2020 年 2 月至4 月,中华医学会病理学分会、中国医师协会病理科医师分会、吴阶平医学基金会病理学部等病理学术组织开展了病理诊断远程义诊,有效解决了疫情期间疑难病理会诊不及时的问题,也促进了数字化远程病理诊断系统的快速发展。
2. 人工智能病理在恶性肿瘤诊治方面的研究及应用现况
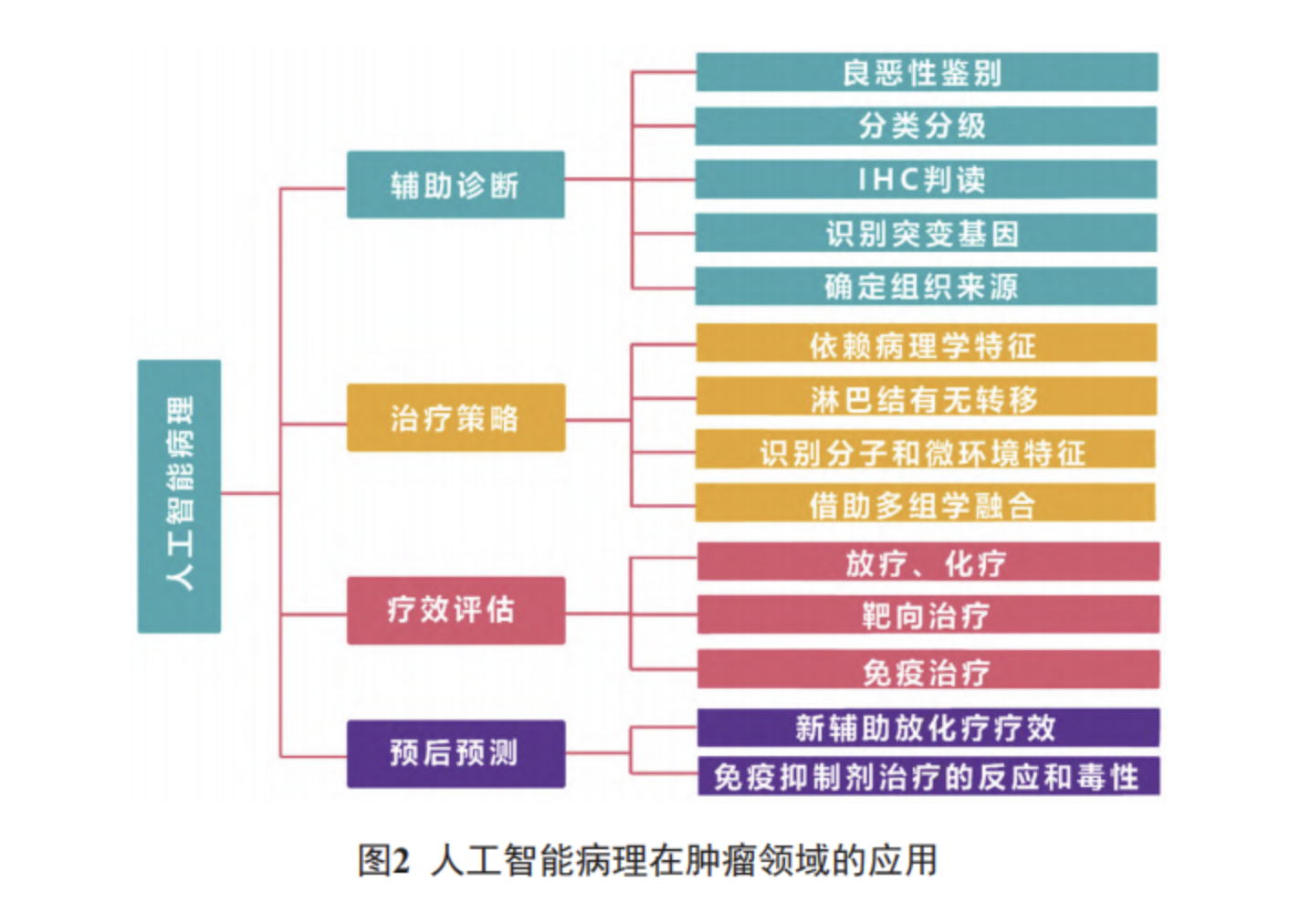
目前人工智能病理在肿瘤领域的应用涵盖了辅助诊断、指导治疗策略选择、评估治疗效果和预测预后等方面 ( 图 2)。
2.1 人工智能病理辅助诊断
在病理学领域,人工智能在诊断癌症和提供新的疾病见解方面取得了重大进展 [5, 10-14],所针对的肿瘤类型以乳腺癌、肺癌、前列腺癌、胃肠肿瘤、神经系统肿瘤居多。
2.1.1 乳腺癌
乳腺癌领域是研发病理人工智能最早的领域之一。CAMYLEON16 竞赛共有来自 23 个团队的32 种算法和 11 位病理医师参加,排名前 5 的人工智能算法在判读乳腺癌淋巴结微转移方面的平均准确度优于病理医师 [15]。随后,使用相同的数据集取得了更好的性能,准确率可达到 99%[16]。Araujo等 [17] 运用CNN 对乳腺癌的组织图像进行了分类,四分类 ( 正常组织 、 良性疾病 、 原位癌和侵袭癌 )的准确度为77.8%,二分类 ( 癌和非癌组织 ) 的准确度为 83.3%,肿瘤检出的敏感度为 95.6%。乳腺癌免疫组织化学染色评分也是病理人工智能研发的热点。2016 年举办的 PathSoc 大会组织了基于人工智能的自动人表皮生长因子受体 2 (human epidermalgrowth factor receptor-2, HER2) 评分比赛,结果证明人工智能的 HER2 评分优于病理专家 [18]。2020年,该系统诊断浸润性导管癌区域的精确性、敏感性和特异性分别是89.44%,85.05% 和 95.23%,自动计算浸润性肿瘤区域 Ki67 阳性率的精确度为99.4% [19]。
2.1.2 肺癌
在肺癌人工智能病理诊断方面,Ocampo 等 [20]利用 TCGA 获得的数字病理切片图像训练了深度学习算法 Inception V3,识别癌组织和正常组织的准确率达到 99%,区分腺癌和鳞癌的准确率达到 97%,同时训练该算法预测腺癌中十个最常见的突变基因,发现其中 6 个(STK11、EGFR、FAT1、SETBP1、KRAS 和 TP53) 可以从病理图像中预测,准确率能达到 73%~86%。此外,Ardila 等 [21] 提出了一种深度学习算法,通过对肺癌低剂量计算机断层扫描(low-dose computed tomography, LDCT) 图像和病理图像的端对端学习,实现病灶的准确定位和良恶性判断,减少了肺癌漏诊率。
2.1.3 前列腺癌
在前列腺癌病理学中采用深度学习已经做出了很大的努力。Pantanowitz 等 [22] 通过多层卷积神经网络算法,对病理学专家标记的 100 多万张前列腺活检组织切片的图像进行学习,此算法可判断肿瘤分级、大小和周围神经的侵犯,在检测前列腺癌方面显示出 98% 的敏感性和 97% 的特异性。在另一项研究中,CNN 模型被应用于 225 张 WSI 上以检测前列腺癌,受试者工作特征曲线下的面积 (areaunder receiver operating curve, AUC) 达到 0.99[23]。Gleason分级是前列腺癌病理学中最活跃的领域之一。Bulten等 [24] 研发出基于深度学习的前列腺癌 Gleason 评分系统,鉴定良性病变和恶性病变的准确率为99%。
2.1.4 消化系统肿瘤
消化系统肿瘤诊断的人工智能研究主要集中在胃癌和结直肠癌方面。Sharma 等 [25] 采用多种深度学习方法对胃癌数字切片进行分类,准确性较高的胃癌分类算法的准确度达 69.9%,对坏死灶判读的精确度可达 81.4%。由于弥漫型腺癌的癌细胞通常是单一的,在结缔组织增生和炎症背景下不明显,因此常被误认为是多种非肿瘤性病变,包括胃炎或肉芽组织中可见的反应性内皮细胞。Kanavati 和Tsuneki [26] 训练深度学习模型,从数字切片中对胃弥漫型腺癌进行分类,获得了 0.95~0.99 范围内的AUC。其他研究也已经证明了深度学习在胃和结肠肿瘤活检中区分腺瘤和腺癌的潜力 [27]。
2.1.5 神经系统肿瘤
受激拉曼成像 [28]、近红外荧光成像 [29]、多光子显微镜成像 [30]、傅里叶变换红外显微镜成像 [31]等非标记的成像方法已被成功应用于脑组织病理样品。这些技术方法的应用可以简化样品制片,达到快速成像,甚至可实现自动阅片与智能诊断。Jin等 [32] 利用深度学习技术,按照 2016 年版 WHO 中枢神经系统肿瘤分类概述的标准,结合 IDH 和1p/19q 状态,成功地对胶质瘤图像进行 5 大类分型诊断。Zadeh Shirazi 等 [33] 对数字化胶质母细胞瘤组织切片中的前沿、浸润性肿瘤、细胞肿瘤、细胞肿瘤微血管增生区、细胞肿瘤坏死周边区、细胞肿瘤坏死周围区和细胞肿瘤坏死区 7 个不同的肿瘤区域进行图像语义分割。结果发现,不同肿瘤区域的微环境细胞能够调控该区域基因表达,而不同区域的基因表达特征可有效预测患者预后。
2.1.6 细胞学诊断
Zhu 等 [34] 通过多中心收集了超过 81 000 个宫颈液基细胞学样本,严格依据 TBS 诊断要求进行分类标注,整合多种模型开发出一套完整的人工智能辅助宫颈液基细胞学 TBS 分类诊断系统(AIATBSsystem)。经多中心前瞻性验证结果证实,AIATBS系统在保持高速和高特异度的同时,又表现出优于高年资细胞病理医师的敏感度,并能够适应不同制片、染色及扫描的涂片样本。在另一项研究中,Kaneko 等 [35] 开发了一个基于人工智能的尿液细胞学分类系统,将图像分类为阴性 ( 良性 ) 或阳性( 非典型或恶性 ),准确率均高于 90%,并取得了优于细胞技术人员所取得的最高水平。
2.1.7 针对泛癌症的人工智能病理诊断策略
近年来,已有多项研究运用人工智能同时诊断多种癌症。例如,Khosravi 等 [36] 研发出一种基于卷积神经网络的计算模型,分别用于正常组织和癌症组织之间、2 种肺癌亚型之间、4 种膀胱癌生物标志物和 5种乳腺癌生物标志物之间的区分以及膀胱癌和乳腺癌的免疫组织化学染色的评分判读,在区分不同癌组织、同种癌的不同亚型、生物标志物和评分方面的精确度分别达到 100%、92%、95%和 69%。Lu 等 [37]仅利用最简单的苏木素伊红染色(Hematoxylin-Eosin, HE) 病理切片,通过人工智能识别,就可以分辨肿瘤是原发灶还是转移灶,然后再对它们的组织学来源进行预测,总体准确度接近85%。
2.2 人工智能病理诊断在治疗策略选择和疗效评估方面的应用
运用人工智能技术可以对患者的治疗效果进行预先评估,进而选择更适合患者的个性化治疗方案,包括传统的放疗化疗、靶向治疗,或者新型的免疫治疗等。
2.2.1 人工智能病理诊断与治疗策略选择
2020 年,Skrede 等 [38] 收集了包含 1 200 多万张结肠癌病理图片的 4 个不同数据集,利用人工智能进行训练,提取出可有效预测预后的图像特征,并成功选择出 II~III 期结肠癌中无需辅助化疗者,避免了过度治疗。新辅助化疗在 40%~70% 的乳腺癌患者中引起病理完全缓解,所有局部肿瘤已被清除,这些患者可能并不需要手术 [39]。然而,影像学或真空辅助活检等非手术方法无法准确识别乳房或腋窝无残留癌的患者 [40-41]。2022 年,Pfob 等 [42] 训练并验证了一种机器学习算法 ( 智能真空辅助活检 ),利用患者影像学、肿瘤和真空辅助活检的变量,可靠地检测并排除早期乳腺癌术前全身新辅助治疗后的残留肿瘤( 病理肿瘤或原位癌或淋巴结阳性 ),避免了不必要的手术。
人工智能病理诊断策略还可用于预测病毒感染及是否适合使用相应的治疗策略。致癌病毒,如人乳头瘤病毒 (HPV) 或 Epstein Barr 病毒 (EBV) 等的存在可影响患者治疗策略选择。比如,EBV 相关的胃腺癌对免疫治疗有良好的反应 [43]。既往多通过分子检测分析是否存在此类病毒感染 [44]。近年,研究者可利用深度学习方法通过数字切片对头颈部肿瘤中的 HPV 和胃癌中的 EBV 感染进行预测,为治疗策略选择提供了便捷的判断方式 [45-46]。
近年,针对免疫检查点的疗法,如抗程序性细胞死亡受体 1 (PD-1)、抗程序性细胞死亡配体 1(PD-L1) 以及抗细胞毒性 T 淋巴细胞抗原 4 (CTLA-4) 等,已被多个临床试验证实可有效延长多种实体瘤患者的预后 [47-48]。基于图像的方法也被用来描述肿瘤浸润淋巴细胞的空间排列,提取空间分布特征之后,可以训练机器学习分类器来区分对抗 PD-1 单克隆抗体 nivolumab 有反应或无反应的非小细胞肺癌患者 [49-50]。Corredo 等 [51] 使用类似的工作流程,通过机器学习来对免疫细胞和肿瘤细胞进行分类,并描述两者之间的空间相互作用(SpaTILs 评分 ) 和肿瘤浸润淋巴细胞簇的密度模式,结果证实这些评分可用于提高预测复发和辅助治疗成功率。
2.2.2 人工智能病理诊断与治疗疗效评估
既往报道的人工智能模型预测直肠癌新辅助放化疗疗效的研究,大多基于小样本、单中心、回顾性数据以及影像组学单一模态图像,因而无法全面捕获疾病的特征。针对这些问题,Feng 等 [52] 研发了全新的整合影像组学和病理组学“两层面”模态特征的直肠癌新辅助放化疗疗效预测模型 (RAPIDS),并在多中心外部数据集和前瞻性临床试验中完成出色验证,为临床上直肠癌个体化治疗提供了新颖手段。鉴于免疫检查点抑制剂治疗 (ICIs) 在临床上的广泛应用,需要预测性分析关键生物标记物,以确定该种治疗对哪些患者有效。多项研究使用数字评分和人工智能算法对 PD-L1 进行了评估,在来自非小细胞肺癌 [53]、乳腺癌 [54] 和胃癌 [55] 样本的多项配对试验中,观察到人工智能和手动评估 PD-L1 在肿瘤与免疫细胞上的表达之间存在高度相关性。此外,基于图像的技术可用于确定免疫细胞对免疫治疗的反应,如 CD8 淋巴细胞、巨噬细胞 [56] 或调节性 T细胞 (Treg) 对实体瘤核心肿瘤区域的淋巴细胞浸润 [57] ;反过来,这些也可以作为预测 ICIs 有效性的指标 [58]。因此,非侵入性生物标记物的开发在免疫治疗中具有潜力。在另一项初步研究中,Dawood等 [59] 对治疗前黑色素瘤患者身上切除的转移性黑色素瘤淋巴结和正常淋巴结进行了研究,具体流程为首先通过卷积神经网络区分转移性和正常淋巴结,然后针对两项任务对模型进行训练,一方面预测治疗的完全 / 部分反应与疾病进展,另一方面预测治疗是否存在严重毒性。这表明深度学习还可能预测患者对抗免疫检查点抑制剂疗法的反应和毒性。
2.3 人工智能病理诊断在预测患者预后中的应用
2.3.1 基于病理学特征的预后预测策略深度学习
基于病理学特征的预后预测策略深度学习可以用来检测整个切片图像上预定义的病理特征。Wang 等 [60] 通过测量描述肺腺癌数字图像上的 22 个特征来表征肿瘤形态,开发了结合最佳特征的预后模型。在另一个 I 期肺腺癌和肺鳞癌 [61] 以及肾细胞癌 [62]、结直肠癌 [38, 63] 和乳腺癌 [64]队列中也采用了类似的方法,成功评估了患者的预后。除了肿瘤细胞,胶质瘤的间质微血管特征也广受关注。Li 等[65] 开发了一种自动化判断微血管的人工智能算法,发现微血管特征能够有效识别胶质瘤组织学类型、分子亚型,并可预测患者预后。
2.3.2 识别淋巴结转移的人工智能病理策略
淋巴结有无转移是评估预后和分期的癌症治疗决策中一个决定性因素。目测完整淋巴结的全切片是目前病理学家用于计算转移性淋巴结 (metastaticlymph node, MLN) 数量的主要方法。Wang 等 [66] 提出了一个深度学习的框架,用于分析淋巴结全切片图像,以识别淋巴结和肿瘤区域,然后揭示肿瘤面积与 MLN面积的比率 (tumor-area-to-MLN-area ratio,T/MLN)。经过训练后的模型,肿瘤检测性能与经验丰富的病理学家相当,并在两个独立的胃癌队列中得到了验证。
2.3.3 基于分子病理特征及微环境特征的肿瘤预后
预测人工智能模型数字病理学初创公司 PathAI 的研究人员提出了一种利用可解释的图像特征(human-interpretableimage features, HIFs)预测临床相关分子表型的方法,证明这些 HIFs 与肿瘤微环境标志物相关,并能预测不同的分子特征,包括免疫检查点蛋白的表达和同源重组缺陷 [67]。基于 HE 染色数字切片定量分析还可以预测结直肠癌微卫星不稳定 [10, 68],并能够量化肿瘤细胞和免疫细胞间的空间关系,展现肿瘤细胞在不同免疫微环境中的演进方向,从而评估非小细胞肺癌的预后 [69]。在来自 TCGA 的13 种癌症类型的 5 202 张玻片上,Saltz 等 [70] 绘制了 TIL 模式,并将其与分子亚型和预后相关联。此外,结合免疫细胞和空间组织的预测模型与癌症预后相关,在结直肠癌 [63, 71]、肝癌 [72] 和黑色素瘤 [73]中均得到证实。
2.3.4 多组学融合的人工智能预后预测方法
多组学融合的人工智能预后预测方法随着人工智能技术与医疗大数据的融合不断深入,基于影像、病理及基因等的大数据挖掘新方法发展迅速,多组学融合为全面量化肿瘤异质性,实现恶性肿瘤精准预后预测开拓了新思路 [38]。有研究基于 981 例局部进展期结直肠癌新辅助治疗前多参数磁共振和数字病理图像,构建新辅助治疗疗效预测模型,结果显示双模态模型预测性能显著高于基于单一模态信息模型[74]。另外,基于术前 CT 影像组学特征融合临床病理信息的人工智能算法可有效预测结直肠癌患者术后的无疾病生存期 [75]。Cesselli等 [76] 纳入临床信息、神经影像学、手术情况、组织病理学、分子病理信息,研发出一种预测预后的算法,可预测 II 级胶质瘤的生存期。Mobadersany等 [77] 利用 TCGA 的 769 例胶质瘤样本,建立了联合分析数字病理切片图像和分子病理信息的生存卷积神经网络 (SCNNs) 模型,发现此软件能够有效预测胶质瘤患者生存期。基于多任务、多模态特征选择方法可从组织病理图像和基因表达数据中筛选出具有病理 - 基因互相关的肿瘤预后标志物,并成功泛化到其他肿瘤 [78]。
3. 机遇和挑战
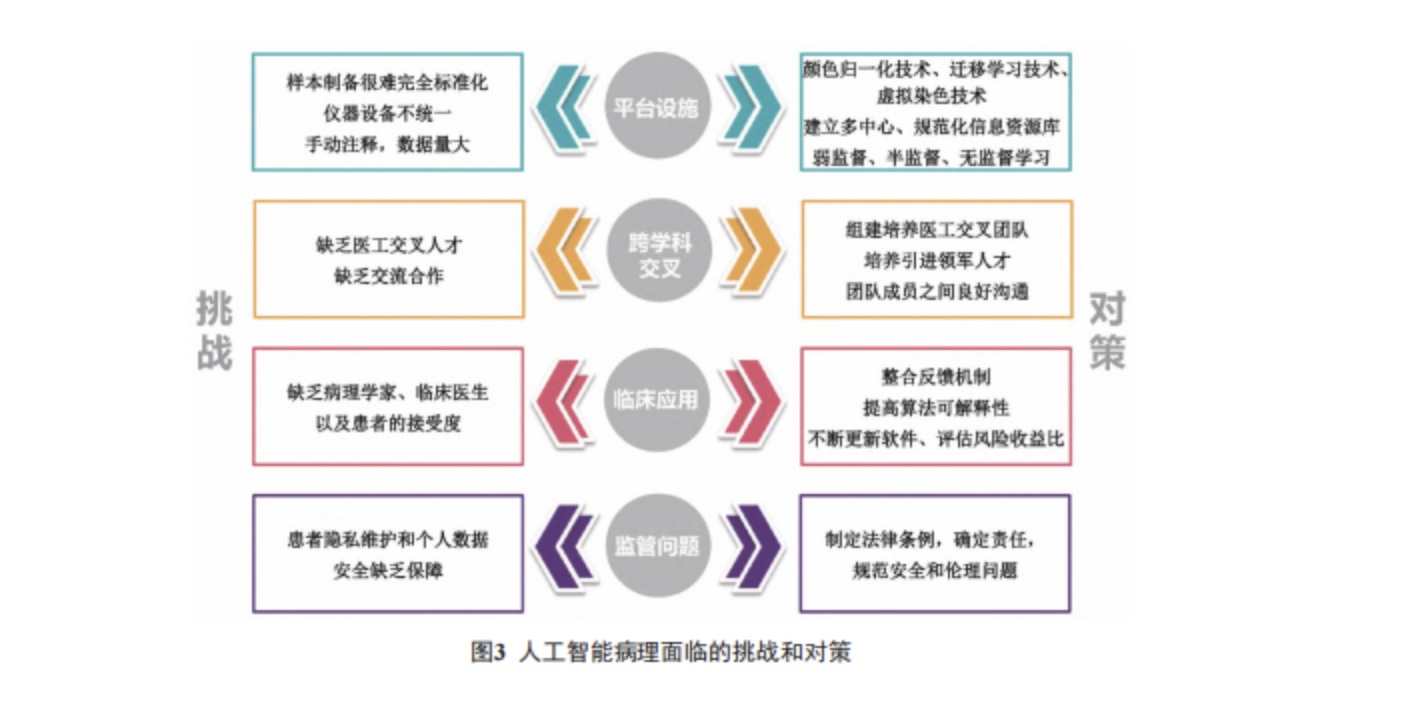
人工智能应用于肿瘤病理领域极大促进了本领域的进步。尽管目前诸多研究结果显示,人工智能的表现在某些任务中可以与人类专家相媲美,但真正实现人工智能病理诊断的应用仍然面临诸多挑战( 图 3)。
3.1 平台设施
组织学制备和染色过程往往很难完全标准化,不同的切片扫描仪生成的整张图像也可能具有不同的分辨率、颜色偏差、特定图像压缩协议的专用文件格式等,这使得在不同的数据集上推广模型变得困难。为了解决这一问题,Niazi 等 [79] 提出了一些颜色归一化技术,以及将模型从一个数据集泛化到另一个数据集的迁移学习技术。经过计算机图像处理,将未染色的病理切片虚拟“染色”成病理医生熟悉的传统生化染色图像,具有更好的均一性,不易受到染色条件不同的干扰,每个组织样本仅仅需要较短的处理时间,大大节省了时间和成本 [80]。因此,人工智能病理诊断应重视肿瘤病理信息的规范化、标准化,包括建立多中心、规范化的临床病理信息资源库,规范病理切片染色、扫描质量,完善分子病理检测要求及流程,探索并制定人工智能肿瘤病理诊断行业标准及共识。
病理人工智能模型训练需要非常大的数据量,当前的病理人工智能主要基于有监督学习,然而有监督学习依赖于海量的标注数据,这严重制约了人工智能系统的开发和落地。在这方面,弱监督或半监督学习开辟了一条新的途径。Campanella 等 [12]通过弱监督学习训练人工智能系统,对前列腺癌、基底细胞癌和腋窝淋巴结转移乳腺癌的 AUC 值均高于 0.98。中南大学基础医学院医工交叉团队首次应用半监督学习方法建立专家级的肠癌识别模型,实验证明,当少量标注图像时,半监督学习的肠癌模型明显优于相同标注数量的有监督学习模型,并且采用 10% 标注数据训练的半监督模型,与海量数据训练的有监督模型无显著性差异 [81]。另外,无监督学习涉及从没有任何标注的数据中学习,使模型能够找到新的模式和类别,而不像监督范式那样局限于现有的标注 [82-84]。例如,聚类算法通过将相似的数据分组来组织未标记的数据,已被应用于乳腺癌 [11] 和子宫内膜异位症 [85] 等疾病中,识别出具有临床意义的患者亚群。而对于如何通过无监督机器学习的方法进行深度表型分析,发现和定义新的疾病亚类,识别具有相似病因机制及临床结局的同质患者亚群,使患者能按更细化的风险划分,并识别对特定治疗的反应差异,这是未来需要解决的重要科学问题。
3.2 跨学科交叉
目前国内工智能肿瘤病理诊断策略研究多采取医学专业人员和计算专业、人工智能专业人员单独研发的方式,尚缺乏医工交叉人才。计算病理学(computational pathology)不仅在医学研究中很重要,而且在实践中也需要解决临床问题 [86]。为了实现这一目标,需要组建或培养医工交叉复合型研究团队,培养和引进人工智能医疗相关领域的领军人才。其中,病理学家在向开发团队介绍医学问题和临床应用以及触发下游产业发展方面发挥着关键作用 [87]。在计算病理学中,病理学家的新角色不仅需要扎实的临床知识和经验,还需要统计分析和数据挖掘的知识来弥合临床医学和人工智能之间的差距 [88]。团队成员之间的良好沟通,还可以帮助设计更高效的算法。而人工智能病理通过将器官、组织和细胞层面的形态学特征与组学数据的分子信息相结合,为实验病理学提供了极好的工具。
3.3 临床应用
所有的诊断报告都为临床医生提供服务,为患者制定合适的干预方案。在现实环境中,人工智能的结果应该得到临床医生的理解和信任。反馈机制应该整合到平台的设计中,以确定薄弱点和改进界面的机会[89]。随着临床数据流变得更加相互关联,识别支持算法预测的生物学或临床原理变得越来越困难,缺乏可解释性对人工智能的临床应用构成了巨大的障碍 [90]。幸运的是,不断更新的成果和技术致力于研究可解释性问题,以便于阐明人工智能预测原理的某些方面 [91]。此外,将算法转化为临床应用的解决方案需要强大的信息技术支持服务,这可能需要临床机构和部门的专门投资。最后,目前的人工智能诊断系统依赖于计算机,其软件更新非常快,加之肿瘤的分类和诊疗标准更新也很快,在人工智能产品使用的过程中需要及时跟进,这可能需要重新评估产品的风险受益比。
3.4 监管问题
人工智能病理诊断产品的研发需要使用大量患者的样本资源和个人信息,目前人工智能产品多采用云平台和云计算的数据管理方式,参与这些决策过程的专家很可能不再仅仅是病理学家。取而代之的是,决策小组将包括其他专家,如统计学家和生物信息学家,在数据的分析和储存过程中,这可能存在个人隐私泄露、数据被非法利用等风险,进而引起伦理问题 [92]。围绕着严格保护患者隐私和个人数据的政策为人工智能病理访问健康数据库设置了障碍,需要创建更全面的训练数据集。2018 年 5 月,欧盟颁布了《通用数据保护条例》,强调了用监管图3人工智能病理面临的挑战和对策生命科学方法来规范人工智能相关的安全和伦理问题 [93],有助于实现合法、道德和稳健的人工智能解决方案 [94-95]。进一步,2021 年 5 月,欧洲政策研究中心发布了《人工智能与网络安全 :技术、治理和政策挑战》报告,根据欧盟数字战略的目标,提出了建设性和具体的政策建议,以确保人工智能的安全应用。
4. 前景展望
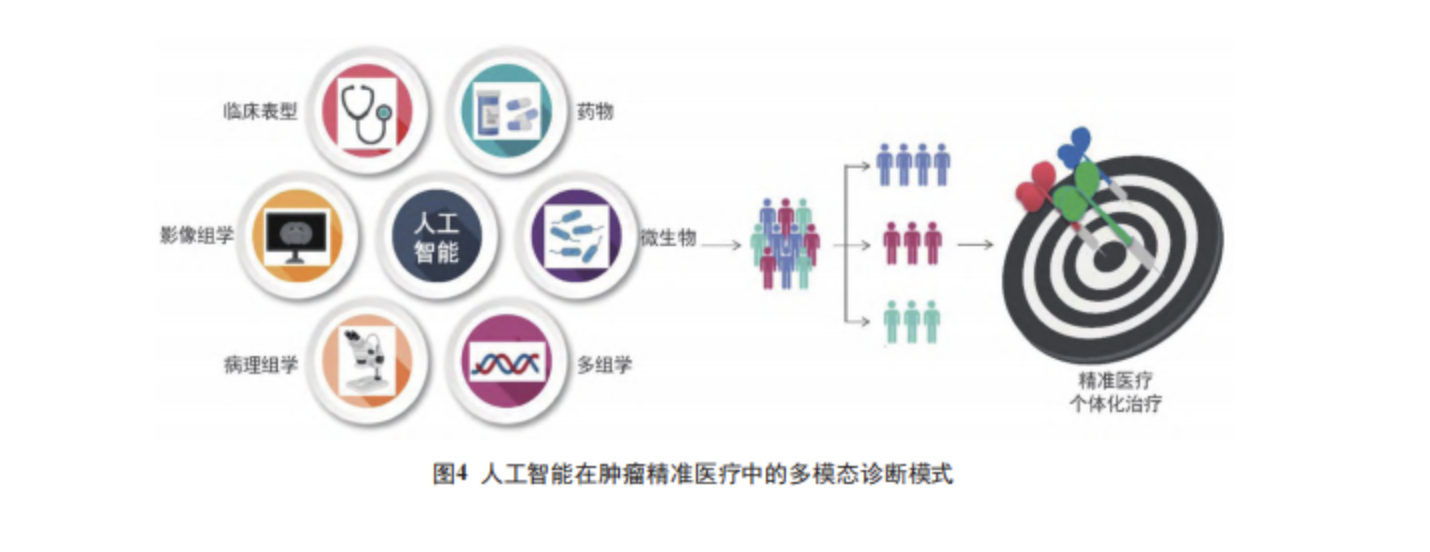
随着数字病理学、分子病理学和信息病理学的迅速发展,计算病理学越来越多地涉及到肺、肾、胃肠道、神经病学和妇科病理学等多个分支学科。不断增长的医疗数据,不再局限于影像图像及数字切片,丰富的组学数据为系统地描述分子机制和开发相关生物医学应用提供了前所未有的数据信息。对现有大样本、覆盖精细临床表型、全基因组学测序、表观遗传组学、转录组学、蛋白质组学、代谢组学、微生物组学等全维度专病多组学大数据均可进行分析。数字病理学和人工智能之间的协同作用被认为是未来几年肿瘤学和精准医学的重大进步 [5, 79, 96-98]( 图 4)。首先,人工智能在基因组学领域取得了长足的进步,当应用于外周血循环的细胞游离 DNA (cellfree DNA, cfDNA) 的数据时,人工智能实现了非侵入性的肿瘤筛查、预后评估和肿瘤起源识别 [99-100]。已被证明与单模态和分子方法相比,使用深度网络将 HE 图像与mRNA 测序和微小 RNA (microRNA,miRNA)测序数据相结合可改善结果预测和分层[101]。
空间转录组学能够很好地与病理组织切片进行关联分析,以获取高分辨率的基因表达异质性 [102]。在代谢组学领域,机器学习开拓了早期肿瘤检测及筛查的高效策略 [103-104]。基于人工智能的微生物转录组数据分析已被用于快速检测病原体中的抗生素耐药性 [105]。此外,人工智能还推动了生物化学领域的最新进展 [106-109] 和药物的研发设计 [110-111]。因此,人工智能肿瘤诊断系统正在逐步向着多组学融合的多模态诊断模式发展 [112]。沿着这条路线,美国医学遗传学学会(American College Of Medical Genetics)2015年发布的序列变异解释标准和指南 [113] 促进了新一轮的人工智能发展,为精准肿瘤学带来了创新机遇。整合临床资料、血液检查指标、影像学图像、病理组织形态、分子病理指标和组学信息的多模态诊断模式将是今后人工智能肿瘤诊断系统的发展方向,引领迈进“下一代诊断病理学 (next-generationdiagnostic pathology)”时代 [114]。
5. 总结
数字病理学的进步促进了人工智能病理学,包括提高准度和精度、数字图像上传和多个病理学家远程审查的能力,以及大型和复杂数据集的获取和处理。尽管存在挑战和障碍,但基于深度学习的人工智能方法在数字病理学方面前景看好。构建多维度、多模态肿瘤人工智能病理诊断系统,完成可信度和可靠性测试,实现临床应用,提升肿瘤诊断、预后判断及个体化治疗策略指导的精准度是前进的方向。人工智能已经进入肿瘤临床实践,仍需要不断地努力,让其发挥全部潜力。创建多学科的发展观,持续支持并保证其生长,是目前完成肿瘤学“人工智能革命”最重要的挑战。
教育部“长江学者奖励计划”特聘教授、国家杰出青年科学基金项目获得者、国家自然科学基金委“创新研究群体”和国家创新人才推进计划“重点研究领域创新团队”学术带头人。
主要从事肿瘤病理特征、发生机制及精准诊疗相关研究。研究成果以第一或通讯作者身份发表于Nature、Science、Cell、Cell Stem Cell、Nature Immunology、Nature Neuroscience、ScienceTranslational Medicine 等期刊。
以第一完成人获国家科技进步奖一等奖 1 项、重庆市自然科学奖一等奖 2 项、中华医学会科技奖一等奖 1 项、中国抗癌协会科技奖一等奖 1 项、何梁何利基金科学与技术进步奖 1 项。
排版编辑:肿瘤资讯-tcz











 苏公网安备32059002004080号
苏公网安备32059002004080号


