本文精选5篇在2023年9月份发表的结直肠癌领域文献,部分研究邀请到浙江大学附属第一医院方维佳教授进行深入解读。
专家介绍
香港大学 访问学者
美国印第安纳大学 访问学者
国家卫健委能力建设及继教肿瘤专委会 委员
中国临床肿瘤学会 理事
中国抗癌协会 青年理事
中国临床肿瘤学会肝癌专家委员会 常委
中国临床肿瘤学会胆道肿瘤专家委员会 常委
中华医学会肿瘤分会胰腺肿瘤学组 委员
欧美同学会医师协会肝胆分会 常务委员
Journal of Clinical Oncology 中文版 编委
Annals of Oncology 中文版 编委
一项nofazinlimab(抗PD-1单抗)治疗晚期实体瘤及联合瑞戈非尼治疗转移性结直肠癌的首次人体I期研究1
研究者在实体瘤患者中对抗PD-1单抗nofazinlimab进行了探索,并特别关注了nofazinlimab联合瑞戈非尼在转移性结直肠癌(mCRC)患者中的试验结果。这项1期研究包括了nofazinlimab的剂量递增(1部分1a期)和剂量扩展(1部分1b期),此外对瑞戈非尼剂量也进行了探索(2a部分),使用80或120 mg QD(第1-21天使用,每28天为一个周期)联合300 mg nofazinlimab(Q4W),以确定该方案的安全性、疗效和RP2D。
在1a期(N = 21),nofazinlimab在1-10 mg/kg Q3W的剂量范围内均未发生剂量限制性毒性,最终确定200 mg Q3W为单药治疗的RP2D。在1b期(N = 87),发现nofazinlimab不管是按照400 mg Q6W还是200 mg Q3W的方案使用,效果都是相当的,疗效数据如表1所示。而在2a部分(N = 14),300mg Q4W可被上述两种剂量的PK数据支持为合理的RP2D。本研究显示最常见的治疗相关不良事件(AE)为乏力。在1a期、1b期和2a部分中, nofazinlimab相关所有级别AE发生率分别为71.4%、14.3%和56.3%,而nofazinlimab相关3/4级AE的发生率分别为5.7%、57.1%和21.4%。1a期和1b期的ORR分别为14.3%和25.3%。而在2a部分中,通过影像学未发现患者出现缓解。
表1:肿瘤缓解和生存数据(有效性分析集)
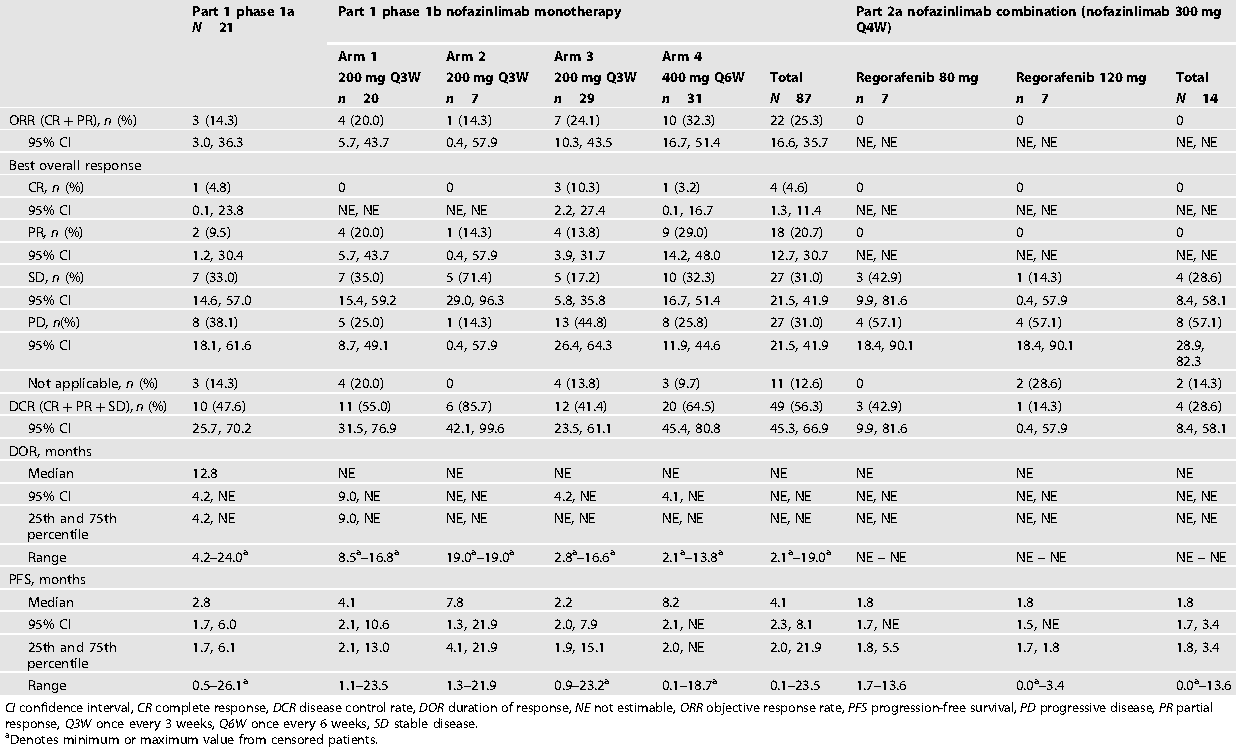
结果显示Nofazinlimab单药的耐受性良好,在多种实体瘤中显示出初步抗肿瘤活性。瑞戈非尼联合nofazinlimab治疗mCRC安全性可控,但未发现肿瘤缓解患者。
方维佳教授:该新药就是此前披露的CS1003,单药有一定的疗效,与大部分既往同类研究的疗效一致;本研究共入组122例,其中1b期为主,有85例;200 mg Q3W 作为推荐二期剂量;另外,2a (300mg Q4W )与瑞戈非尼联合组14例均为MSS,ORR为0.
药物本身与帕博利珠单抗(K药)比较(Acta Pharmacol Sin. 2021 IF:8.2),亲和力参数 KD: 6.13 nM vs 2.59 nM,无 ADCC 或 CDC 效应,可阻断PDL1和PDL2配体与PDL1 受体结合。联想到我们团队2020年关于生物力的研究(Nano Lett. 2020 Jul 8;20(7):5133-5140),在抗体与靶标结合中涉及的有关包括解离常数和更深层次的分子构象都会对最终疗效有着不可忽视的影响力。
本研究另外几个值得关注的点:1. 仅有52.4%的病人明确是MSS,9.5%的病人明确是dMMR,其余错配修复状态未知,且未披露RAS状态;2. 几个分组有效率分别为1a 期14.3%,1b期的不同剂量强度的1-4小组,有效率分别为20%,14.3%,24.1%,32.3%(400 mg Q6W)(图1),看起来单次剂量提升的Q6W 方案似乎比常规或更短间隔时长的方案更有效;3. 因药物相关副反应停药的比例在1a期, 1b期和 2a期分别为:9.5%,2.3%和7.1 %,高剂量组似乎安全性也可以接受,但瘙痒及关节痛发生比例较高。
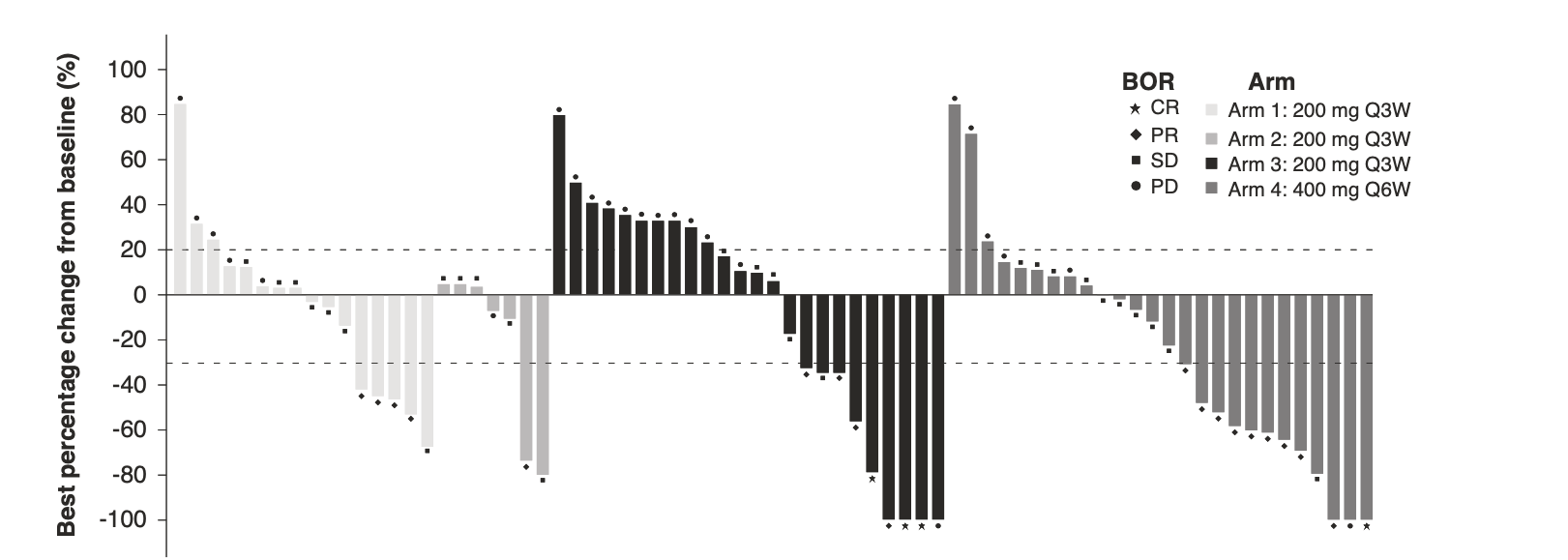
图1:1a期及1b期患者不同组患者的肿瘤缓解瀑布图
Botensilimab联合balstilimab新辅助
治疗局部晚期错配修复完善
结直肠癌的应答模式2
在无远处转移的局部晚期肿瘤患者中,新辅助治疗为新药评价提供了平台。对于错配修复完善/微卫星稳定(pMMR/MSS)的结肠癌和直肠癌,免疫治疗的疗效是有限的。
本文报道了2例pMMR/MSS结直肠癌患者接受botensilimab(BOT;一种Fc段强化的新一代抗CTLA-4抗体)联合balstilimab(BAL;一种抗PD-1抗体)新辅助治疗后,观察到特殊的肿瘤缓解,是一种尚未见报道过的快速免疫应答的组织学模式——“由内向外”(浆膜层至粘膜层)的肿瘤消退(图2)。空间生物学分析(应用RareCyte公司开发的检测平台开展)揭示出了BOT的作用机制,它是一种新型的固有-获得性免疫激动剂。该研究观察到的结果对未来进一步设计新辅助免疫治疗或去化疗的相关临床研究具有潜在意义。

图2:在接受botensilimab联合balstilimab新辅助治疗的结直肠癌患者中观察到的“由内向外”(浆膜层至粘膜层)肿瘤缓解模式——与化疗、靶向治疗和/或放疗观察到的传统缓解模式相比,免疫治疗后残留的肿瘤细胞均局限于管腔表面。这种现象可以描述为一种免疫细胞浸润的浪潮或海啸以及随之而来的肿瘤细胞死亡
方维佳教授:刚读到这篇文章时,以为又要介绍一个ME TOO或者是ME 稍微 BETTER的免免组合新药,但读完这篇重点介绍两例在新辅助治疗背景下接受BOT/BAL方案免疫治疗有效的结直肠癌患者的文章后,才意识到作者是给读者呈现了一个免疫治疗在实体瘤中的新型疗效反应模式,即“由内向外”(浆膜到粘膜)的波浪式或海啸式免疫细胞浸润之下的肿瘤消退模式。也就是说,免疫细胞从真正属于体内(浆膜)开始征服,一直把肿瘤细胞消灭或驱逐到体外,抵达肠癌即粘膜面(体外),直至把肿瘤细胞推下“深渊”即肠腔;从真正意义上说,肿瘤组织被患者自身的免疫细胞从内向外攻击和杀死,留下任何微转移病灶的可能性较小,包括我们常见的淋巴血管侵犯,神经侵犯以及肿瘤出芽等等都消失了。
当然,缓解模式可能不仅是BOT/BAL方案所特有的,而是可推广至pMMR/MSS结直肠癌患者新辅助治疗中应用免疫治疗,文章也展示了很漂亮的多色图片,呈现了间质和肿瘤细胞,以及各个组分的空间关系,这给我们后续继续深入分析尤其是传统的免疫冷肿瘤的免疫治疗突破口提供了研究模版。
“肿瘤标志物发现”程序
揭示西妥昔单抗和贝伐珠单抗
在转移性结直肠癌中的缓解模式3
精准医学为癌症治疗带来了变革,然而有明确临床指导价值的生物标志物仍然很少。为了解决这个问题,作者团队开发了名为“肿瘤标志物发现 (OncoBird)”的程序,用于分析随机对照临床试验中的众多分子和生物标志物。OncoBird程序在独立背景或肿瘤亚型的背景下根据单个基因或者互斥基因的改变来识别生物标志物,最后通过它们与治疗的相互作用评估它们的预测指导价值(图3)。
作者团队利用在转移性结直肠癌患者中开展的两项开放标签、随机III期试验(FIRE-3,AIO KRK-0306)的相关数据,这两项研究中的患者接受了西妥昔单抗或贝伐珠单抗联合FOLFIRI的治疗。最终系统地确定了5个具有预测意义的生物标志物,例如携带chr20q扩增的患者或缺乏ERK通路上互斥信号分子突变的患者,相比于贝伐珠单抗更能从西妥昔单抗中获益。
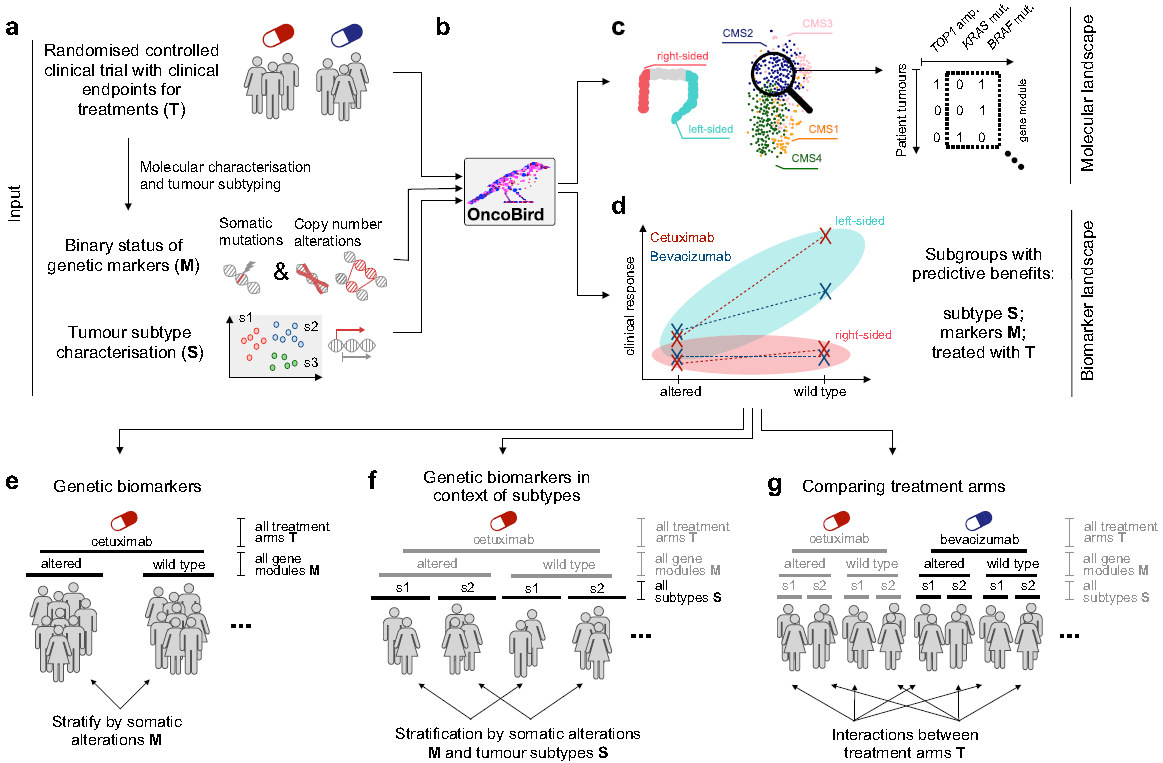
图3:“肿瘤生物标志物发现(OncoBird)”程序的工作流程。临床试验中纳入的患者分别接受两种治疗方案并统计研究终点,随后分析肿瘤基因改变(体细胞突变和拷贝数改变)并确定肿瘤亚型(a)。通过OncoBird程序(b)概述分子总体特征(c)和生物标志物总体特征(d)。对于生物标志物,进一步探索体细胞改变以确定每个治疗组患者的不同预后(e)。对于每个治疗组,继续分析亚型相关的特异性生物标志物(f)。最后分析治疗组之间的相互作用(g)。灰色文字表示上一分析步骤中包含的数据。
OncoBird程序描述了分子的整体特征并指出了其中具有临床价值的生物标志物,这套程序可以在任何包含分子特征描述的随机对照试验中广泛使用。
方维佳教授:作者利用OncoBird框架在FIRE-3研究中评估结直肠癌患者的肿瘤遗传表观,并推导出了对FOLFIRI联合西妥昔单抗或贝伐珠单抗具有预测作用的生物标志物的五项假设。其中具有代表性的是,CMS2型中chr20q扩展和CMS4型中KRAS突变。我们知道,CMS2型在左半比例更高,RAS/BRAF野生型居多,集中了西妥昔单抗的优势人群。这一结果也在2017年ASCO 会议上对CMS分型进行了一项专题报告的道印证,从FIRE-3结果分析中得知,转移性结直肠癌使用西妥昔单抗的ORR数据上在各个分型均优于贝伐珠单抗,在2型和4型更明显,而生存分析发现,CMS1、2、3型在PFS和OS上,西妥昔单抗与贝伐珠单抗均无差异;在对CALGB-80405研究使用CMS分型发现,CMS2型西妥昔单抗OS优于贝伐珠单抗(42.0个月对36.0个月,P=0.048),但PFS无统计学差异。虽然CMS4型肿瘤也多发于左半肠癌,但KRAS基因突变率约为半数,此类人群并不完全适用西妥昔单抗。FIRE-3研究中CMS4型上,西妥昔单抗在PFS(10.5个月对9.0个月)和OS(40个月对21.1个月)上均优于贝伐珠单抗,差异有统计学意义,而CALGB-80405研究中CMS4型两者则并无差异。
可以看出,使用OncoBird框架分析和CMS分型存在一致的地方,均说明了CMS分型在转移性结直肠癌中同样存在较高的预后价值,但也有不一致的地方,我们看到了共识性的内容,如RAS/BRAF的重要性,如CMS分型的部分预测效应,以及特定染色质异常和一些特定亚型,还有提及预测模式在依托人工智能技术和模块方面的应用前景,无疑是在尽力为临床研究和真实世界中的临床决策提供解决方案。
有感于这篇文章基于大样本的成功临床研究在分子机制上做出的探索,我们团队此前也有类似文章发表(Cell Reports Medicine 2023),通过整合转录组学、蛋白质组学和代谢组学数据引入了一个免疫代谢分型即IMS系统,确定了三种亚型对预后不同的CRC患者进行分层,其中C3亚型具有高S100A9+巨噬细胞丰度,与不良预后相关,动物实验表明,采用拮抗该靶点并联合PD1单抗的策略能带来疗效的改善。
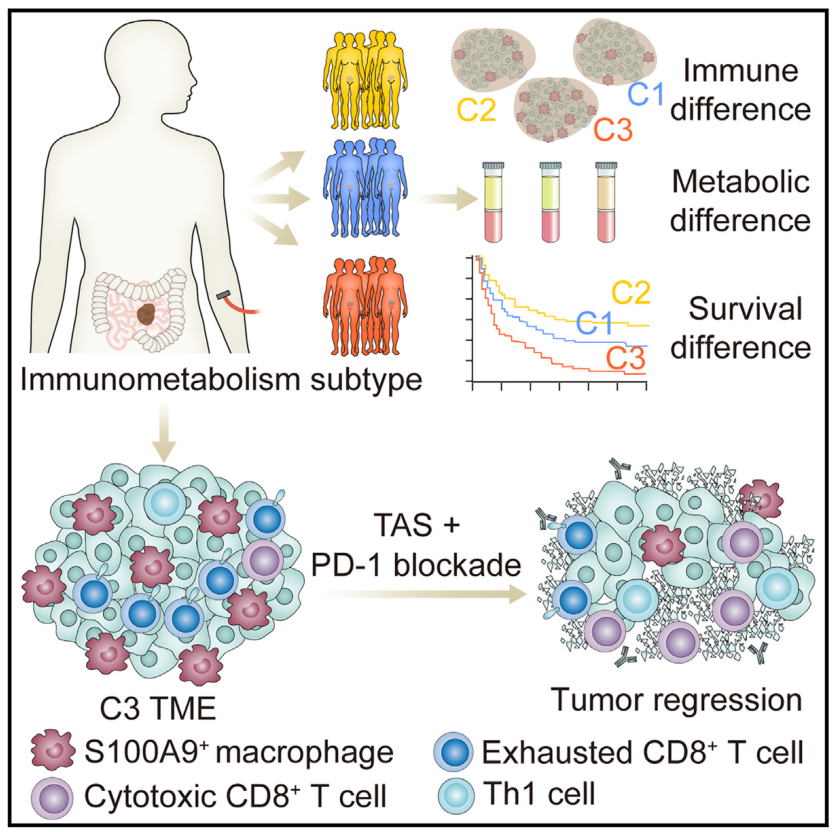
综上,我们期待诸如此类的高水平研究方法,进一步通过高通量分析以及探索性的机制研究,佐证临床治疗的复杂性和个性化的重要,期待更好的推动肠癌精准治疗。
真实世界中肿瘤部位对晚期结直肠癌患者抗EGFR单抗一线治疗疗效的影响-一项全国范围的回顾性分析(RACER)4
抗EGFR抗体联合双药化疗是结直肠癌前线治疗的基石。“RAS和BRAF突变”是此类治疗的阴性预测因素。“原发性肿瘤位于近端结肠(右半结肠)”近来成为了另一个阴性预测因素。该研究汇总了西妥昔单抗或帕尼单抗联合FOLFOX/FOLFIRI一线治疗的转移性结直肠癌患者的人口特征、治疗模式和预后结局等数据,开展了一项基于真实世界数据的多中心回顾性研究。
该研究重点关注了原发性肿瘤位置带来的影响,纳入的842例患者中有126例(15.0%)为右半原发性肿瘤。这些右半患者与诊断时较低的BMI、黏液组织学的病理改变以及腹膜转移有关。不仅如此,与远端原发(左半)患者相比,他们还与较差的治疗结局相关,具体表现在缓解率:59.4% vs 74.22%(右半vs左半,比值比[OR]0.51,95%CI 0.33-0.78,p=0.010);中位缓解深度:-36.7% vs -50.0%(右半vs左半,p=0.038)。相比于左半患者,右半患者的PFS有相对较差的趋势,但无统计学差异(p=0.051)。研究未获得完整的OS数据。
本研究证实了肿瘤原发部位对抗EGFR单抗联合化疗在前线治疗的疗效所产生的影响,并提供了有价值的真实世界人群特征。
抗EGFR单抗在晚期结直肠癌治疗中的应用5
结直肠癌是全球第三大高发肿瘤,发病率在年轻人群中呈上升趋势。包括西妥昔单抗和帕尼单抗在内的抗EGFR抗体已被纳入晚期患者的标准治疗实践当中。
本综述对这些药物的分子特征以及与药物获批相关的临床研究进行了综述。此外,本文还讨论了与治疗选择决策、给药剂量策略和副作用管理相关的生物标志物的临床意义。最后,本文展望了未来的发展并介绍了这些药物目前正在进行的临床研究,尤其是与MAPK通路相关靶向药物的联合以及与免疫治疗的联合,包括EGFR单抗+BRAF v600e抑制剂、EGFR单抗+KRAS G12C抑制剂等(图4)。总体而言,本综述提供了抗EGFR抗体在晚期结直肠癌中过去的历史背景、当前的临床应用和未来的发展方向。
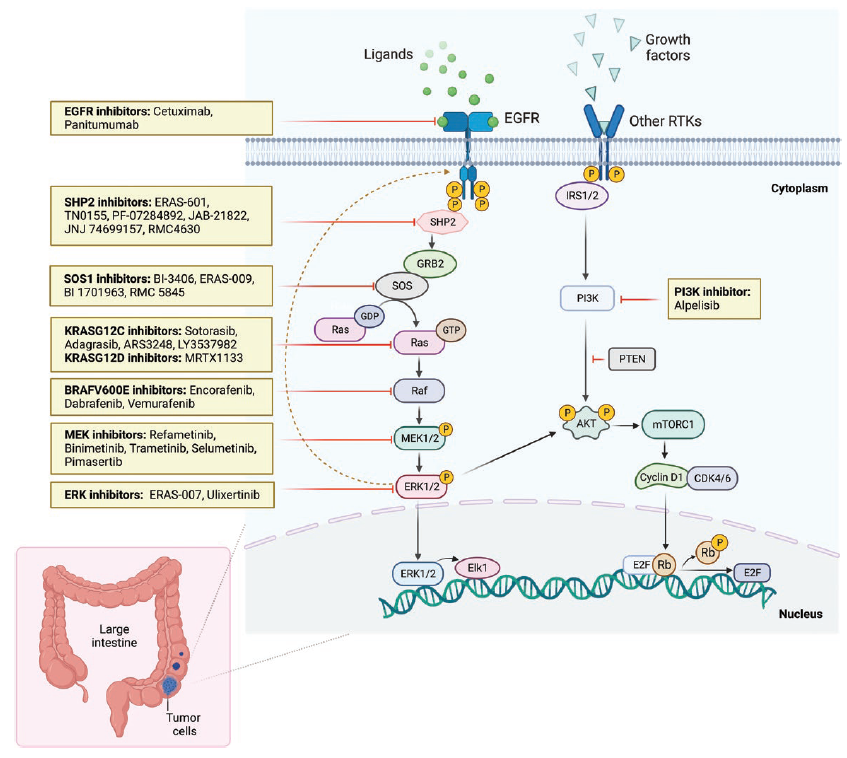
图4:CRC中正在开发的MAPK通路和MAPK靶向治疗方法
本期看点:
1、PD-1单抗nofazinlimab的I期研究,在晚期实体瘤中进行剂量探索显示出初步抗肿瘤活性且未发生剂量限制性毒性。联合瑞戈非尼在mCRC人群中进一步探索,安全性可控但未发现与肿瘤缓解的相关性。
2、新型双免药物联合应用于pMMR/MSS结直肠癌患者新辅助治疗的病例分析,揭示出一种快速免疫应答介导的“由内向外”的肿瘤缓解模式以及新药BOT的作用机制。
3、一项肿瘤生物标志物研究,通过研究者开发的OncoBird程序,举例分析了FIRE-3和AIO KRK-0306研究确立了5种生物标志物可用于预测FOLFIRI联合西妥昔单抗或贝伐珠单抗的缓解,该方法在其他随机对照试验的分析中也具有应用潜力。
4、一项基于真实世界数据的回顾性研究,分析了mCRC左右半原发肿瘤部位对西妥昔单抗或帕尼单抗联合FOLFOX/FOLFIRI的一线治疗疗效的影响。
5、一篇介绍抗EGFR单抗发展历史、当前应用及未来展望的综述,讨论了抗EGFR单抗的分子特征和主要临床试验,同时对相关生物标志物的临床意义进行了分析,还关注了热点的靶靶联合、靶免联合的相关研究。
1、Day D, Park JJ, Coward J, et al. A first-in-human phase 1 study of nofazinlimab, an anti-PD-1 antibody, in advanced solid tumors and in combination with regorafenib in metastatic colorectal cancer. Br J Cancer. 2023;10.1038/s41416-023-02431-7.
2、Kasi PM, Hidalgo M, Jafari MD, et al. Neoadjuvant botensilimab plus balstilimab response pattern in locally advanced mismatch repair proficient colorectal cancer. Oncogene. 2023;10.1038/s41388-023-02835-y.
3、Ohnmacht AJ, Stahler A, Stintzing S, et al. The Oncology Biomarker Discovery framework reveals cetuximab and bevacizumab response patterns in metastatic colorectal cancer. Nat Commun. 2023;14(1):5391.
4、Potocki PM, Wiśniowski R, Haus D, et al. The Impact of Sidedness on the Efficacy of Anti-EGFR-Based First-Line Chemotherapy in Advanced Colorectal Cancer Patients in Real-Life Setting-A Nation-Wide Retrospective Analysis (RACER). Cancers (Basel). 2023;15(17):4361.
5、Kasi PM, Afable MG, Herting C, Lukanowski M, Jin Z. Anti-EGFR Antibodies in the Management of Advanced Colorectal Cancer. Oncologist. 2023;oyad262.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


