
刘珊, 尚晋, 林芸, 等. 双打击型高危多发性骨髓瘤患者临床疗效和预后分析[J]. 中华肿瘤杂志, 2021, 43(11):1209-1214.
DOI: 10.3760/cma.j.cn112152-20200109-00016.
目的
分析双打击型高危多发性骨髓瘤(MM)的临床特征、疗效和预后,探讨高危细胞核型对MM的临床意义。
方法
回顾性分析2011年1月至2019年2月福建省立医院73例高危MM患者的临床资料,采用间期荧光原位杂交法检测染色体核型,根据梅奥mSMART 3.0分期系统的定义,将患者分为双打击组(28例)和非双打击组(45例)。
结果
15例双打击型与26例非双打击型患者接受硼替佐米为主的化疗,中位无进展生存时间(PFS)分别为8.0和22.0个月,中位总生存时间(OS)分别为10.0个月和未达到。10例双打击型与12例非双打击型患者接受RVD方案(硼替佐米+来那度胺+地塞米松)化疗,中位PFS分别为12.0和24.0个月,中位OS分别为14.0个月和未达到。无论接受硼替佐米为主方案或RVD方案化疗,双打击组患者的OS和PFS均短于非双打击组(均P<0.05)。单因素分析显示,细胞遗传学异常、修订的国际分期系统(R-ISS)分期、β2微球蛋白和钙与高危MM患者的PFS有关(均P<0.05),细胞遗传学异常、R-ISS分期和β2微球蛋白与高危MM患者的OS有关(均P=0.001)。多因素Cox回归分析显示,细胞遗传学异常是高危MM患者OS和PFS的独立影响因素,双打击型患者的疾病进展风险是非双打击型患者的3.160倍(95%CI:1.364~7.318),死亡风险是非双打击型患者的2.966倍(95%CI:1.205~7.306);钙是高危MM患者PFS的独立影响因素,钙≥2.75 mmol/L患者的疾病进展风险是<2.75 mmol/L患者的2.667倍(95%CI:1.209~5.883)。
结论
双打击型患者是高危MM中预后很差的一个特殊群体,易早期复发和进展,患者生存时间短。
【关键词】多发性骨髓瘤; 硼替佐米; 预后; 双打击
多发性骨髓瘤(multiple myeloma, MM)是一种单克隆浆细胞恶性增殖性肿瘤,约占血液系统肿瘤的10%,好发于中老年人。细胞遗传学特征反映骨髓瘤细胞的生物学特性,是影响MM预后的关键因素,常见的高危细胞遗传学异常有1q21扩增、p53缺失、t(4,14)和t(11,14)变异等。约30%~50%的MM患者存在高危细胞遗传学异常。虽然以硼替佐米为代表的新药和自体造血干细胞移植的广泛应用显著改善了MM的临床疗效,总体完全缓解(complete response, CR)率达50%~70%,2年总生存率达88%,但高危MM患者CR率仅约为50%,2年总生存率为56%,因此早期识别高危MM患者并改善其临床疗效是MM治疗中亟待解决的关键问题。
近年来,研究者在大样本的MM数据中借鉴并引入淋巴瘤中双打击的概念,旨在区分不同危险度的患者。目前,国际上对双打击型MM的定义尚存在争议。Walker等认为,根据二代测序结果,CKS1B扩增(≥4个拷贝)且国际分期系统(international staging system, ISS)分期为Ⅲ期,或双等位TP53失活的MM为双打击型MM。但该定义未包括1q21扩增和p53缺失或突变以外的其他高危核型。2018年美国梅奥mSMART 3.0分期系统更新,其双打击型MM定义为具有t(4,14)、t(14,16)、t(14,20)、1q21扩增和17p缺失或突变中任意2种高危遗传学异常的MM。由于双打击型MM发生率较低,目前国内外的前瞻性临床研究资料非常有限,亦缺乏明确的治疗指南和共识。在本研究中,我们回顾性分析了73例高危MM患者的临床和随访资料,根据梅奥mSMART 3.0分期系统的定义,分析了双打击型MM的临床特征、疗效和预后,旨在探讨高危细胞核型对MM的临床意义。


1.研究对象纳入标准:
(1)诊断符合2017年MM诊断标准;(2)依据梅奥mSMART 3.0分期系统中的危险分层诊断为高危MM,即具有t(4,14)、t(14,16)、t(14,20)、1q21扩增、17p缺失或突变这些高危遗传学异常中的任意2种;(3)年龄<75岁;(4)有血清学、骨髓细胞形态学、荧光原位杂交(fluorescence in situ hybridization, FISH)的基线检测结果;(5)均接受至少4个疗程硼替佐米伴或不伴来那度胺为主方案的化疗。排除标准:(1)合并严重心、肝、肾等重要脏器功能异常;(2)合并其他恶性肿瘤和自身免疫性疾病。2011年1月至2019年2月在我院血液科就诊的217例初治MM患者中,符合标准的高危MM患者共73例(33.6%),其中男43例,女30例,年龄33~74岁,中位年龄63岁;修订的国际分期系统(revised international staging system, R-ISS)分期为Ⅱ期40例,Ⅲ期33例;Durie-Salmon(DS)分期为Ⅰ期1例,Ⅱ期16例,Ⅲ期56例。根据梅奥mSMART 3.0分期系统的定义,将73例高危MM患者分为双打击组(28例)和非双打击组(45例)。本研究通过我院伦理委员会批准(K2017-05-001)。
2.间期FISH检测方法:
每例患者抽取15~20 ml骨髓标本,肝素抗凝,1300 r/min密度梯度离心10 min,分离骨髓单个核细胞。每1 ml骨髓加50 μl全血特异性CD138微磁珠,2~8℃混匀25 min。再每1 ml骨髓加入2~5 ml分选缓冲液,离心,洗涤细胞,过柱分离CD138磁珠标记细胞。将纯化的浆细胞低渗固定,-20℃冻存。在标记位置,分别加入RB1、D13S319、p53、1q21、IGH/CCND1、IGH/FGFR3、IGH/MAF和IGH/MYC探针(广州安必平医药公司产品)悬液,变性杂交,4′,6-二脒基-2-苯基吲哚复染镜检。结果判断标准:三色荧光显微镜下观察计数200个间期细胞,参考值按照欧洲骨髓瘤工作组设定标准,13q-、17p-和lq+的阳性阈值为20%,IGH异位阳性阈值为10%。
3.治疗方案:
28例双打击组患者中,接受VD方案(硼替佐米+地塞米松)化疗3例,VCD方案(硼替佐米+环磷酰胺+地塞米松)9例,VTD方案(硼替佐米+沙利度胺+地塞米松)2例,PAD方案(硼替佐米+阿霉素+地塞米松)1例,RVD方案(硼替佐米+来那度胺+地塞米松)10例,3例经VCD方案诱导治疗达CR的患者接受大剂量马法兰为预处理方案的自体造血干细胞移植治疗。45例非双打击组患者中,接受VD方案化疗2例,VCD方案20例,VTD方案3例,PAD方案1例,RVD方案12例,7例经VCD方案诱导治疗达CR的患者接受大剂量马法兰为预处理方案的自体造血干细胞移植治疗。双打击组与非双打击组治疗方案差异无统计学意义(χ2=6.917,P>0.05)。
4.近期疗效评价:
根据2017年版中国多发性骨髓瘤诊治指南评价近期疗效,分为CR、非常好的部分缓解(very good partialre sponse, VGPR)、部分缓解(partialre sponse, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD)。总有效率(overall response rate, ORR)=(CR例数+VGPR例数+PR例数)/总例数×100%。深度缓解率=(CR例数+VGPR例数)/总例数×100%。
5.随访与预后评估:
通过门诊或电话方式对患者进行随访,随访截止到2019年6月,全部患者均获得随访。预后的主要研究终点为无进展时间(progression free survival, PFS),定义为确诊至进展或死亡或末次随访的时间。次要研究终点为总生存时间(overall survival, OS),定义为确诊至死亡或末次随访的时间。
6.统计学方法:
应用SPSS 13.0软件进行统计分析。计数资料的组间比较采用χ2检验或Fisher确切概率法。生存分析采用Kaplan-Meier法,两组间生存率的比较采用Log rank检验,预后影响因素的多因素分析采用Cox比例风险回归模型。检验水准α=0.05。


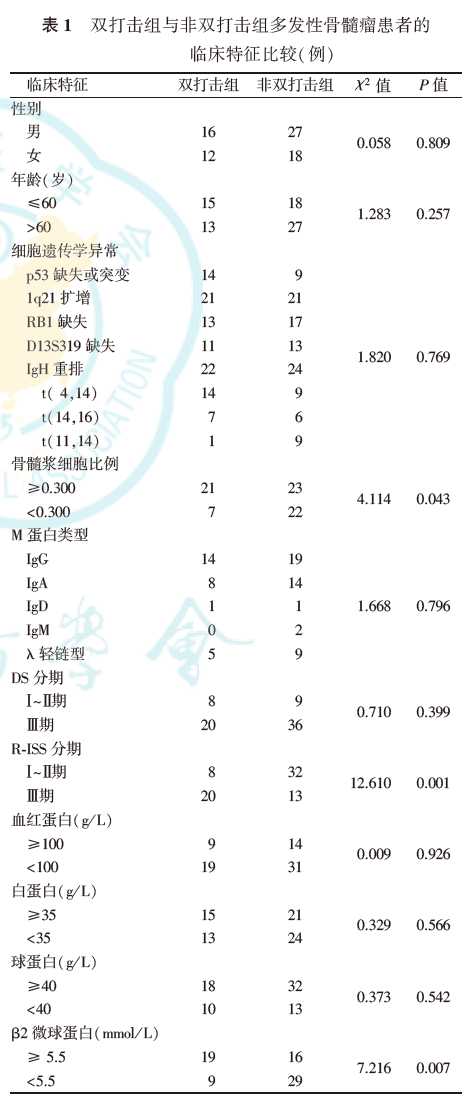
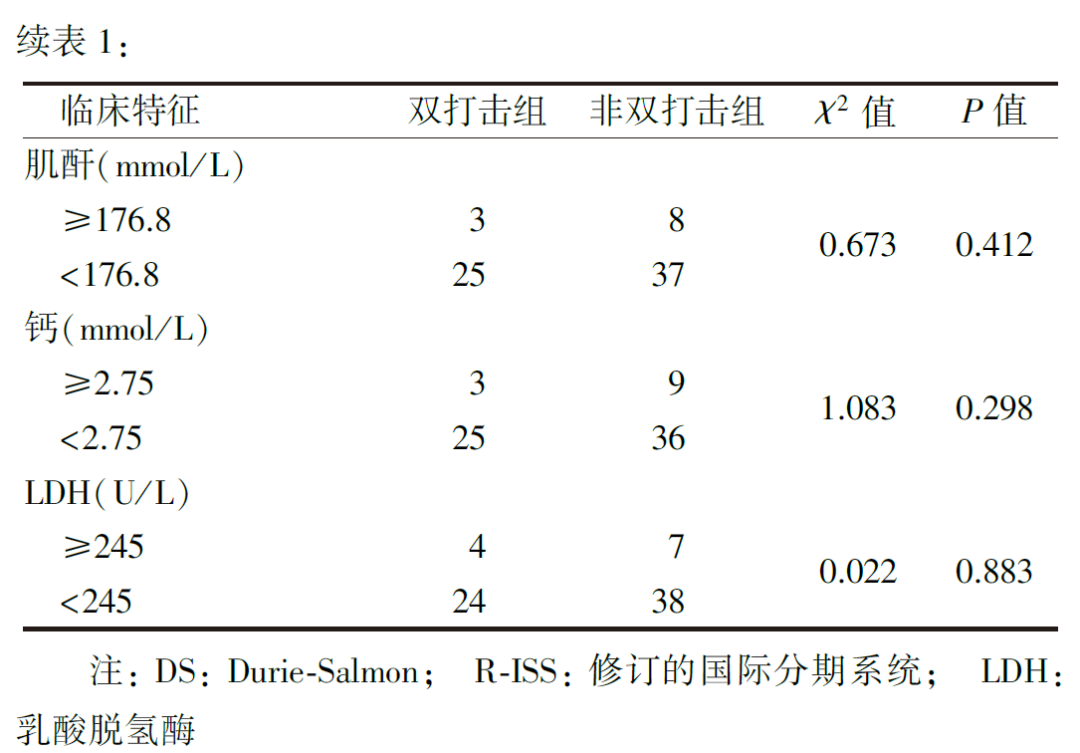
1.双打击组与非双打击组MM患者临床特征比较:
FISH检测结果显示,双打击组患者中1q21扩增合并t(4,14)10例,1q21扩增合并t(14,16)4例,1q21扩增合并p53缺失或突变7例,p53缺失或突变合并t(4,14)4例,p53缺失或突变合并t(14,16)3例。双打击组骨髓浆细胞比例、R-ISS分期、β2微球蛋白均高于非双打击组(均P<0.05),但两组患者的性别、年龄、细胞遗传学异常、M蛋白类型、DS分期、R-ISS分期、血红蛋白、白蛋白、球蛋白、肌酐、钙、LDH差异均无统计学意义(均P>0.05,表1)。
2.双打击组与非双打击组MM患者的近期疗效比较:
行单纯化疗的63例患者中,双打击组15例、非双打击组26例接受硼替佐米为主方案的化疗。其中双打击组患者化疗4.0~9.0个疗程,中位疗程数为5.0个,非双打击组患者化疗4.0~10.0个疗程,中位疗程数为5.0个,两组差异无统计学意义(χ2=0.864,P=0.349)。双打击组CR 2例,VGPR 2例,PR 7例,SD 4例,ORR为73.3%(11/15),深度缓解率为26.7%(4/15);非双打击组CR 6例,VGPR 3例,PR 14例,SD 1例,PD 2例,ORR为88.5%(23/26),深度缓解率为34.6%(9/26)。两组近期疗效差异无统计学意义(ORR: χ2=1.538,P=0.215;深度缓解率:χ2=0.278,P=0.598)。
双打击组10例、非双打击组12例接受RVD方案的化疗。其中双打击组患者化疗4.0~8.0个疗程,中位疗程数为5.0个,非双打击组患者化疗4.0~10.0个疗程,中位疗程数为6.0个,两组差异无统计学意义(χ2=0.417,P=0.515)。双打击组CR 2例,VGPR 1例,PR 3例,SD 3例,PD 1例,ORR为60.0%(6/10),深度缓解率为30.0%(3/10);非双打击组CR 5例,PR 5例,SD 1例,PD 1例,ORR为83.3%(10/12),深度缓解率为41.7%(5/12)。两组近期疗效差异无统计学意义(ORR: χ2=1.497,P=0.348;深度缓解率: χ2=0.321, P=0.675)。
自体造血干细胞移植治疗的10例患者中,双打击组3例,非双打击组7例,在2~4个疗程诱导化疗后疗效均达CR。
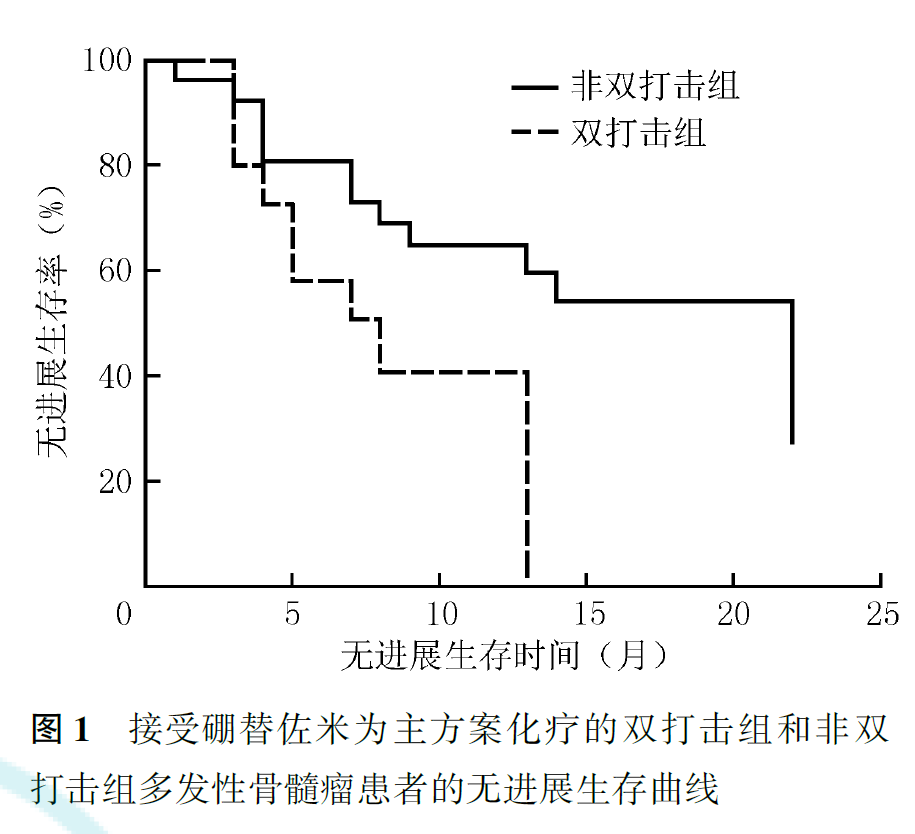
3.双打击组与非双打击组MM患者的预后比较:
在接受硼替佐米为主方案化疗的患者中,双打击组患者中位PFS为8.0个月,中位OS为10.0个月;非双打击组患者中位PFS为22.0个月,中位OS未达到,双打击组患者的PFS和OS均比非双打击组短(PFS: χ2=4.035, P=0.045; OS: χ2=10.716,P=0.001;图1,图2)。
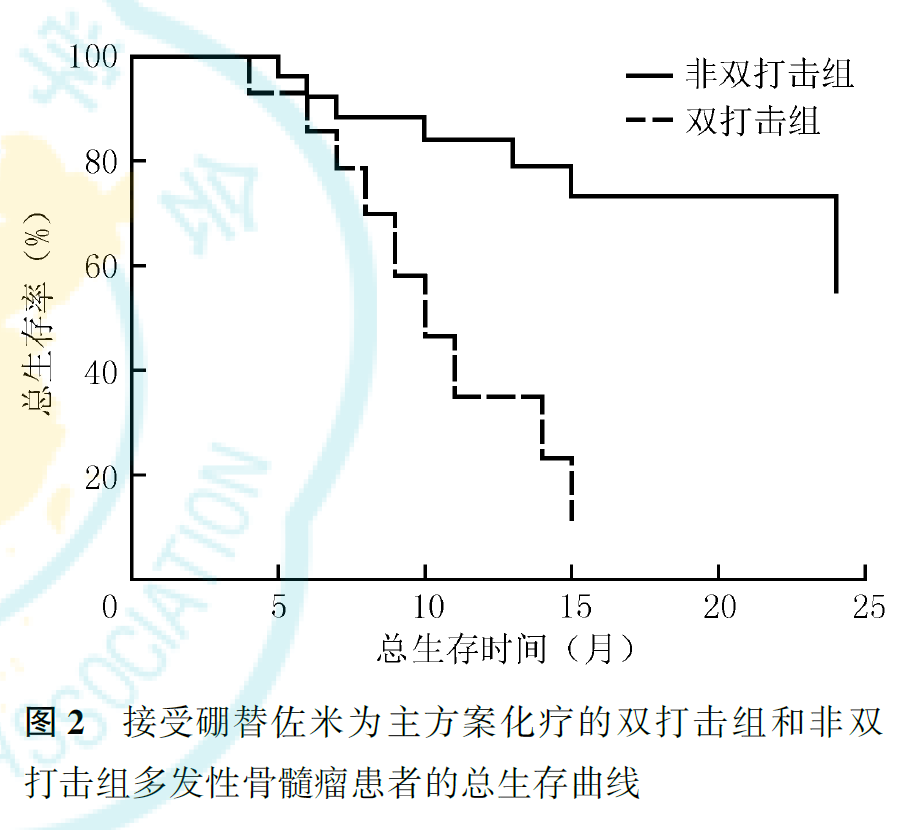
接受RVD方案化疗的患者中,双打击组患者中位PFS为12.0个月,中位OS为14.0个月;非双打击组患者中位PFS为24.0个月,中位OS未达到,双打击组患者的PFS和OS均比非双打击组短(PFS:χ2=12.640,P=0.001;OS: χ2=10.018,P=0.002;图3,图4)。
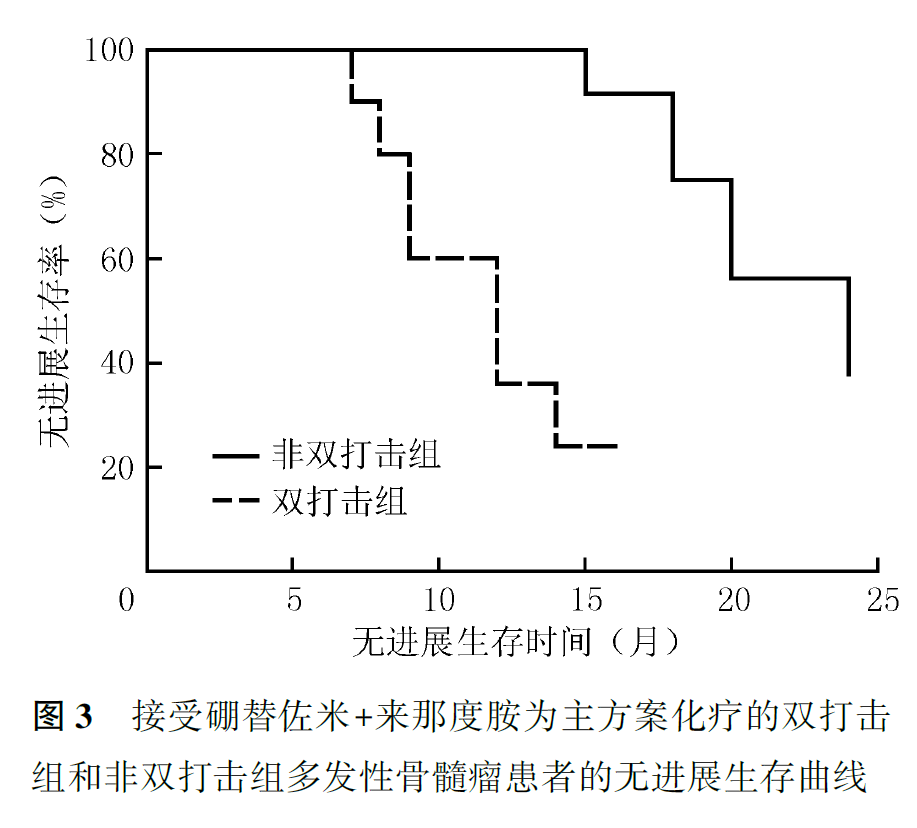
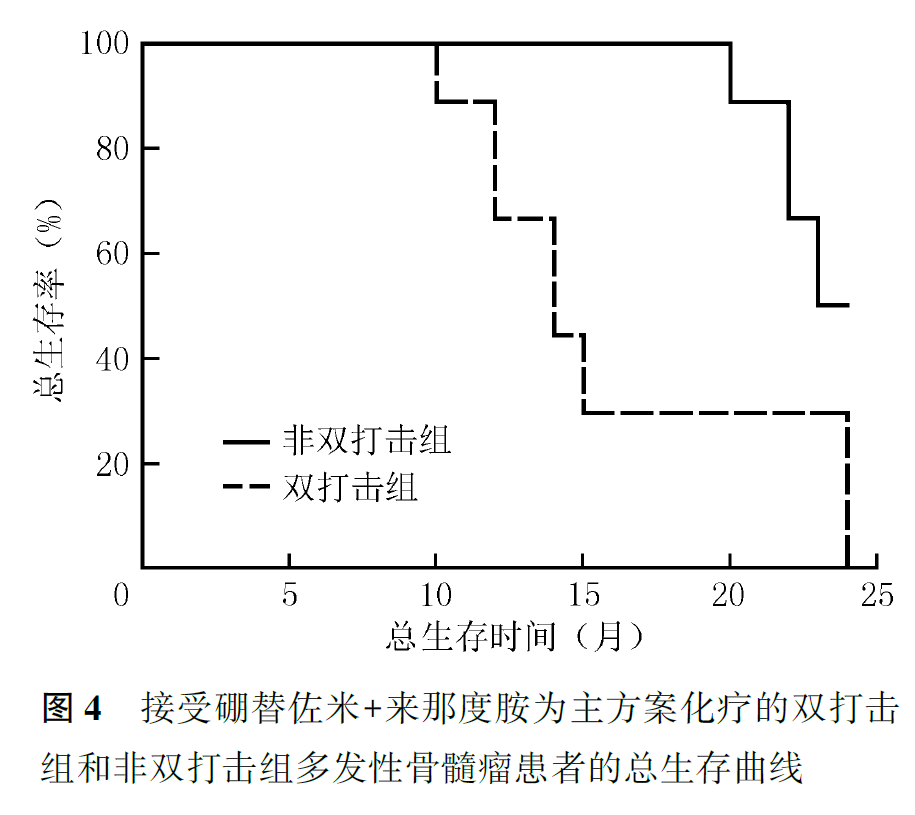
接受自体造血干细胞移植治疗的患者中,双打击组3例患者的中位PFS和OS分别为15个月和未达到,非双打击组7例患者的中位PFS和OS时间均未达到。
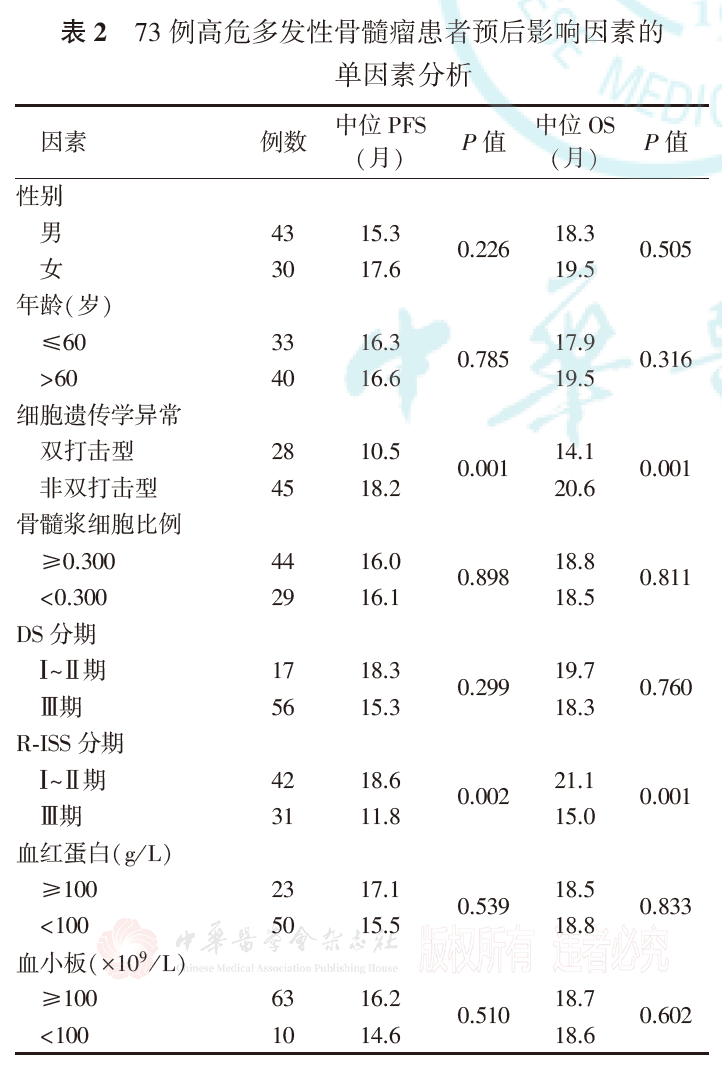
4.高危MM患者预后影响因素的单因素分析:
单因素分析显示,细胞遗传学异常、R-ISS分期、β2微球蛋白和钙与高危MM患者的PFS有关(P值分别为0.001、0.002、0.001和0.034),细胞遗传学异常、R-ISS分期和β2微球蛋白与高危MM患者的OS有关(均P=0.001,表2)。
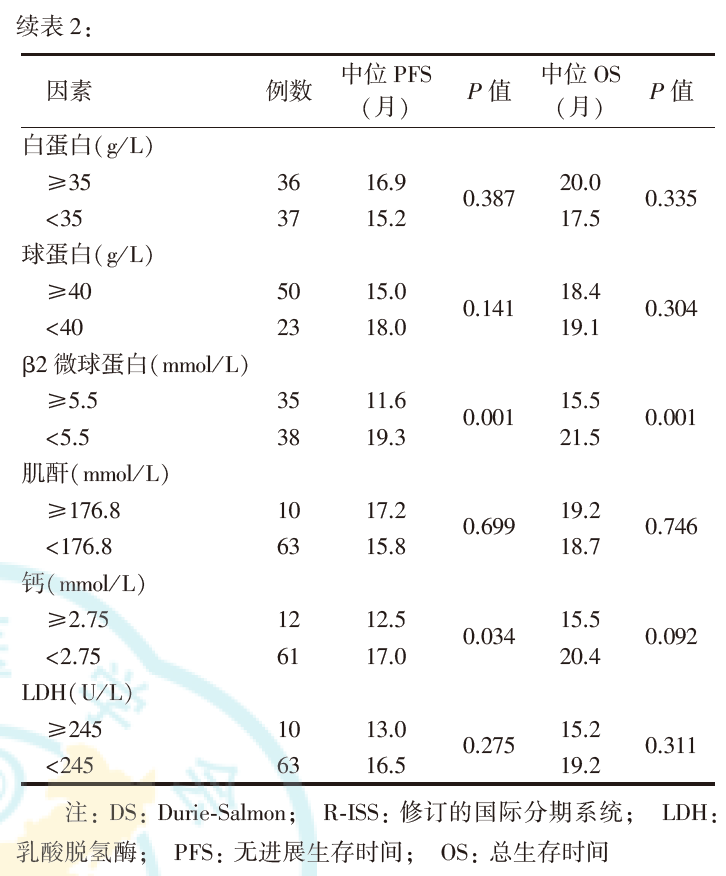
5.高危MM患者预后影响因素的多因素分析:
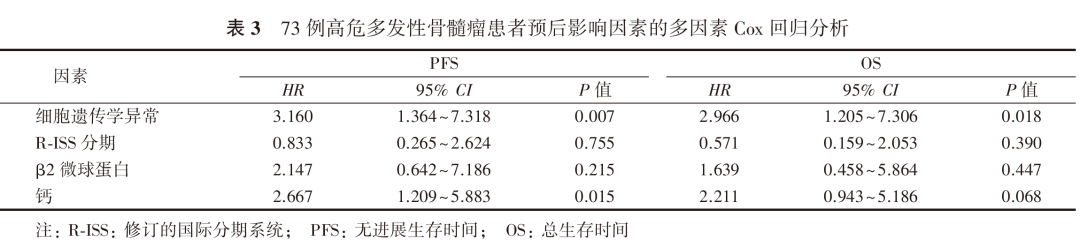
将单因素分析P<0.1的因素纳入Cox回归模型进行多因素分析,结果显示,细胞遗传学异常是高危MM患者OS和PFS的独立影响因素,双打击型患者的疾病进展风险是非双打击型患者的3.160倍,死亡风险是非双打击型患者的2.966倍;钙是高危MM患者PFS的独立影响因素,钙≥2.75 mmol/L患者的疾病进展风险是<2.75 mmol/L患者的2.667倍(表3)。


DS分期和ISS分期是传统MM分期,纳入指标以血红蛋白、M蛋白、β2微球蛋白和白蛋白等为主,DS分期评估肿瘤负荷,ISS分期则反映肿瘤预后。近年有研究显示,细胞遗传学特征是影响MM预后的最重要因素,以细胞遗传学为基础的梅奥mSMART分期比传统DS分期和ISS分期更加强调细胞遗传学分层治疗的重要性。
新型靶向药物和自体造血干细胞移植的广泛应用显著改善了MM患者的临床疗效,但是,细胞遗传学高危MM患者总体有效率和深度缓解率仅为75%和64%,2年总生存率为56%,整体预后并未得到明显改善。
迄今为止最大样本(n=1905)的系列基因组临床数据荟萃分析显示,双打击型MM发生率为6%,中位PFS为15.4个月,中位OS为20.7个月。Shah等报道,双打击型是影响MM患者远期疗效的不良因素,即使采用CVAD方案(环磷酰胺+长春新碱+阿霉素+地塞米松)诱导化疗6周期后联合自体造血干细胞移植巩固治疗,仍有60%的患者在12个月内复发。本组双打击型患者占同期收治MM患者的12.9%(28/217),比较双打击组与非双打击组患者的临床特征显示,双打击组骨髓浆细胞比例、R-ISS分期、β2微球蛋白均高于非双打击组(均P<0.05),表明双打击组患者的临床分期高且肿瘤负荷较大。本研究结果显示,双打击型是影响高危MM患者预后的独立危险因素,双打击型患者的疾病进展风险和死亡风险均比非双打击型患者增加约2倍,表明双打击型是高危MM患者中预后更差的一个特殊群体,对于具有高危核型的MM患者,应进一步排查是否具有双打击型,这对预后评价有重要意义。
在本组单纯化疗患者中,无论是接受硼替佐米为主方案还是硼替佐米联合来那度胺为主方案化疗者,双打击组患者的PFS和OS均比非双打击组患者短,提示两药联合方案并不能改善双打击型MM患者的预后。行自体造血干细胞移植者例数虽少,但也提示自体造血干细胞移植巩固治疗可能不会改善双打击型患者的预后。因此,在新药联合自体造血干细胞移植治疗的时代,双打击型MM患者的预后仍较差,是MM治疗中亟待解决的关键问题。
总之,双打击型患者是高危MM中预后很差的一个特殊群体,易早期复发和进展,患者生存时间短,因此早期识别双打击型MM患者,探讨针对双打击型MM的有效治疗药物和治疗方案,对于改善MM患者的临床疗效非常重要。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


