
冯都都, 陈新华, 郭晶晶, 等. 靶向CS1的第四代嵌合抗原受体T细胞治疗难治或复发性多发性骨髓瘤的初步研究[J]. 中华肿瘤杂志, 2021, 43(6):657-665.
DOI: 10.3760/cma.j.cn112152-20200415-00347.
目的
分析在第二代嵌合抗原受体(CAR)的基础上设计的同时分泌白细胞介素7(IL7)和趋化因子19(CCL19)的第四代嵌合抗原受体T细胞(CAR-T),在多发性骨髓瘤微环境中增殖、趋化、清除肿瘤细胞和持久性等方面的能力。
方法
通过2A自剪切肽技术构建第四代CAR载体质粒,采用第三代慢病毒包装系统制备高滴度慢病毒,通过流式细胞术检测慢病毒转导效率和CAR-T细胞亚型的变化;采用酶联免疫吸附实验(ELISA)检测CAR-T细胞中IL7和CCL19的分泌情况;手工计数法分析CAR-T细胞在培养过程中的增殖活性;Transwell迁移实验验证CAR-T细胞趋化能力;荧光素酶生物发光法检测CAR-T细胞特异性杀伤活性;小鼠异体移植模型验证CAR-T细胞体内抗骨髓瘤活性和安全性。
结果
流式细胞术结果显示,抗CS1 CAR-T和抗CS1-IL7-CCL19 CAR-T细胞CAR的表达率分别为(91.50±0.29)%和(46.70±0.12)%,表明CAR-T细胞构建成功。亚型分析显示,抗CS1-IL7-CCL19 CAR-T细胞中T记忆干细胞(TSCM)的比例为(67.58±0.59)%,高于抗CS1 CAR-T[(50.74±1.01)%,P=0.0001],具有更强的免疫记忆功能,持久性更佳。抗CS1-IL7-CCL19 CAR-T细胞较对照组(MOCK-T)和抗CS1 CAR-T组能够持续分泌IL7和CCL19(P<0.0001)。抗CS1-IL7-CCL19 CAR-T细胞在慢病毒转导后的第9天细胞数达到(22.77±0.79)×106个,高于抗CS1 CAR-T细胞[(9.40±0.79)×106个,P=0.0001],具有更强的增殖能力。Transwell迁移实验中,抗CS1-IL7-CCL19 CAR-T细胞对于反应T细胞的趋化细胞数为(109.00±4.04)个/视野,高于对照组和抗CS1 CAR-T组[分别为(9.33±1.20)个/视野和(7.33±0.88)个/视野,均P<0.0001],具有更强的趋化能力。杀伤实验结果显示,与对照组细胞比较,抗CS1-IL7-CCL19 CAR-T和抗CS1 CAR-T均具有特异性的杀伤效能(P<0.0001)。动物实验表明,抗CS1-IL7-CCL19 CAR-T细胞降低了荷瘤小鼠的肿瘤负担(P<0.0001),并延长了总生存时间(P=0.0061)。
结论
第四代抗CS1-IL7-CCL19 CAR-T细胞在不影响体内外抗骨髓瘤活性的情况下,有着更强的增殖活性、趋化能力和持久性,为克服传统CAR-T细胞存活率低下、持久性差以及受肿瘤微环境抑制等缺陷提供了策略,为第四代CAR-T细胞的临床应用提供了前期实验依据。
【关键词】多发性骨髓瘤; 第四代CAR-T细胞; CS1; 白细胞介素7; 趋化因子19
多发性骨髓瘤(multiple myeloma, MM)是骨髓内浆细胞异常扩增的恶性肿瘤,是第2种常见的血液系统恶性肿瘤,约占所有恶性肿瘤的1%,所有血液恶性肿瘤的10%。目前,针对MM的标准治疗包括免疫调节药物、蛋白酶抑制剂、单克隆抗体和自体干细胞移植,但多数患者在接受多线治疗后仍无法治愈,迫切需要寻求新的治疗方法。嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)疗法是恶性肿瘤治疗的革命性疗法,尤其在血液病的治疗中表现出了显著的效果。CAR是CAR-T的核心部件,其基本构件包括肿瘤相关抗原结合区、细胞外铰链区、跨膜区和细胞内信号转导域,赋予T细胞以人类白细胞抗原非依赖的方式识别肿瘤抗原并进行特异性杀伤的能力。CS1(又名SLAMF-7, CD319)是受体免疫球蛋白超家族信号淋巴细胞激活分子的亚群,介导MM细胞与骨髓基质细胞的黏附。95%以上的骨髓瘤细胞高度表达CS1,且骨髓细胞、造血干细胞和大多数健康组织中几乎检测不到CS1的表达,因此CS1可作为MM CAR-T疗法的重要靶标。
目前,CAR-T已发展到第四代。第一代CAR-T只包含第一信号分子CD3ζ,第二代CAR-T增加了第二信号共刺激分子,包括免疫球蛋白超家族成员(CD28)、肿瘤坏死因子超家族成员(CD40L、OX-40、4-1BB),第三代CAR-T包含2个共刺激域,第四代CAR-T则表达第三信号如细胞因子、趋化因子等。目前,临床试验主要为第二代CAR-T细胞,但其存在存活率低下、浸润性和持久性差等问题,因此,我们在第二代的基础上设计了靶向CS1且同时分泌白细胞介素7(interleukin-7, IL7)和趋化因子19(chemokine C legend 19, CCL19)的第四代CAR-T细胞,以期增强CAR-T细胞在肿瘤免疫抑制微环境中的渗透、增殖、生存和肿瘤杀伤能力,从而提高完全缓解率,为治疗失败的患者提供可能的治疗方法,现将研究结果报告如下。


一、材料
1.细胞株:
人肾上皮细胞系HEK293T细胞购自美国菌种保藏中心(American Type Culture Collection, ATCC),用含有10%胎牛血清的DMEM培养基培养。人MM细胞株MM1S、U266和IM9购自南京科佰生物科技有限公司,Jurkat细胞购自美国ATCC,以上细胞均用含10%胎牛血清的RPMI 1640培养。原代T细胞提取自健康人外周血,用含有5%AB血清和0.01%的重组人IL2的X-VIVO培养基培养。
2.实验动物:
实验动物为6~8周龄的雌性NOG(NOD-Prkdcem26Cd52Il2rgem26Cd22/Nju)小鼠,购自南京集萃药康生物科技有限公司,小鼠饲养于温州医科大学实验动物中心的无特殊病原体级实验室,动物饲养许可证号为SYXK(浙)2015-0009。动物实验严格按照温州医科大学医学实验动物管理委员会制定的动物伦理条例进行相关操作。
3.试剂与耗材:
DMEM、RPMI 1640和胎牛血清均购自美国Gibco公司,X-VIVO购自瑞士Lonza公司,人AB血清购自美国Sigma-Aldrich公司,重组人IL2购自美国PeproTech公司,pLenti-EF1α-CS1-Luc-绿色荧光蛋白(green fluorescent protein, GFP)和pLenti-EF1α-P2A-Luc-GFP表达质粒由温州医科大学检验医学院(生命科学学院)高基民实验室保存,限制性内切酶购自美国New England Biolabs公司,无缝克隆试剂盒购自南京诺唯赞生物科技股份有限公司,质粒抽提试剂盒购自德国Qiagen公司,细胞追踪标志物羟基荧光素双乙酸盐(carboxy fluoroscein succinimidyl ester, CFSE)购自美国Thermo Fisher公司,抗CD3/CD28抗体包被磁珠购自美国Invitrogen公司,IL7酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒购自杭州联科生物技术有限公司,CCL19 ELISA试剂盒购自深圳欣博盛生物科技有限公司。流式细胞术抗体均购自美国BioLegend公司,CS1蛋白购自美国AcroBiosystems公司,D-荧光素购自上海甄准生物科技有限公司。聚合酶链反应(polymerase chain reaction, PCR)仪、电泳装置、凝胶成像系统均购自美国Bio-Rad公司,FACS AriaⅡ流式细胞仪购自美国BD公司,DynaMag TM-5磁力架、CO2恒温细胞培养箱、酶标仪等购自美国Thermo Fisher公司,超速离心机购自美国Beckman公司,荧光显微镜、超净工作台等购自德国Eppendorf公司,IVIS生物发光成像仪购自美国PerkinElmer公司。
二、实验方法
1.质粒构建和慢病毒包装:
CS1抗体的单链可变区(single-chain fragment variable,scfv)和IL7-CCL19的核苷酸序列均源自Genebank数据库,通过苏州金唯智生物科技有限公司合成。抗CS1 CAR由CS1抗体的scfv、CD8α、41BB和CD3ζ构成。抗CS1 CAR以SmaⅠ和MluⅠ-HF限制性酶切位点为克隆位点,将载体pLenti-EF1α-P2A-Luc-GFP用Sma Ⅰ/Mlu Ⅰ-HF双酶切后将二者进行T4连接获得第二代CAR-T载体质粒。第四代CAR-T以引物F1(5′-TCGTGAGCTAGCCCCGGGATGGCCCTGCCC-GTGACCGCTCT-3′)和R1(5′-AAGTTGGTGGCGCC-GCTGCCTCGGGGGCAGGGCCTGCATAT-3′)进行扩增得到抗CS1 CAR片段,以引物F2(5′-GGCAG-CGGCGCCACCAACTTTTCTTT-3′)和R2(5′-TGTT-TAAACACGCGTTCAGGAGCTCCTCCTCTTCATCTTA-3′)进行PCR扩增得到-P2A-IL7-P2A-CCL19-片段,再以上述2个片段为模板,以F1和R2为引物,进行重叠PCR得到抗CS1 CAR-P2A-IL7-P2A-CCL19目的片段,以SmaⅠ和MluⅠ-HF限制性酶切位点为克隆位点,将抗CS1 CAR-P2A-IL7-P2A-CCL19片段以无缝连接技术克隆至上述酶切载体获得第四代CAR-T载体质粒。质粒构建完成后送苏州金唯智生物科技有限公司测序。分别以测序正确的2种CAR质粒作为目的质粒,以PLP1、PLP2、PMD2G作为包装质粒,共同转染至HEK293T细胞,48 h后收集上清并补加培养基,72 h后再次收集上清,将其与48 h上清混合,经0.45 μm滤膜过滤,超速离心获得病毒浓缩液。
2.CAR-T细胞制备:
提取人外周血单个核细胞(peripheral blood mononuclear cell, PBMC),使用抗CD3/CD28抗体包被磁珠分选并活化CD3+T细胞,24~48 h后,以感染复数(multiplicity of infection,MOI)为40加入相应体积病毒转导T细胞,以未转导病毒的T细胞作为对照组,37℃、5% CO2进行培养,分别于慢病毒转导后的第5、9和13天取适量细胞,经生物素标记的CS1蛋白和别藻蓝蛋白(allophycocyanin, APC)标记的链霉亲和素先后染色,流式细胞术连续检测T细胞表面CAR的表达率。
3.CAR-T细胞亚型分析:
分别于慢病毒转导后的第7、9和11天取适量细胞,用生物素标记的CS1蛋白(1∶200)4℃避光孵育15 min。经FACS溶液[由含1%胎牛血清的磷酸缓冲盐溶液(phosphate buffer saline, PBS)配制而成]洗涤细胞后,再经由藻红蛋白(phycoerythrin, PE)标记的链霉亲和素(1∶400)、APC/Cy7标记的抗人CD3抗体(1∶200)、PE/Cy7标记的抗人CD4抗体(1∶400)、Pacific Blue™标记的抗人CD8a抗体(1∶200)、Alexa Fluor® 488标记的抗人CD45RO抗体(1∶200)、APC标记的抗人CD45RA抗体(1∶200)、PerCp/Cyanine5.5标记的抗人CD62L抗体(1∶200)配制的混合抗体,4℃避光孵育15 min。洗涤后用FACS溶液重悬细胞,通过流式细胞仪分析CAR-T细胞的5种亚型,即初始T细胞(naïve T cells, TN)、T记忆干细胞(stem memory T cells, TSCM)、中央记忆T细胞(central memory T cells, TCM)、效应记忆干细胞(effector memory T cells, TEM)和效应细胞(effector T cells, TEFF)。
4.ELISA法检测CAR-T细胞分泌IL7和CCL19的能力:
在慢病毒转导T细胞后第5天和第7天留取细胞培养上清,离心半径为6 cm,1500 r/min离心5 min去除细胞碎片,用IL7 ELISA试剂盒和CCL19 ELISA试剂盒分别检测上清中IL7和CCL19的表达量。
5.CAR-T增殖能力检测:
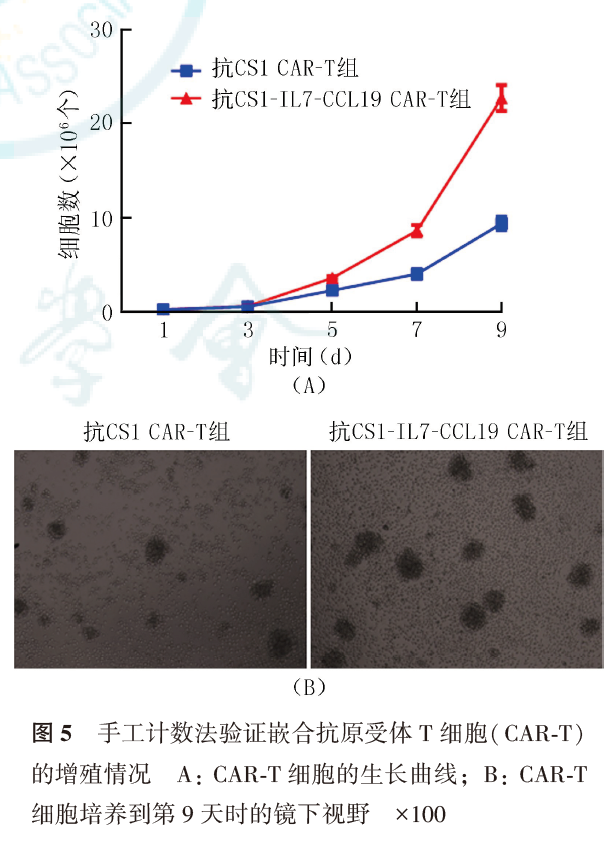
将按MOI为40转导病毒的抗CS1 CAR-T细胞和抗CS1-IL7-CCL19 CAR-T细胞铺于96孔板中,每孔设置2×105个细胞,每组设置3个复孔。在CAR-T培养的第3、5、7、9天利用牛鲍氏计数板分别计数抗CS1 CAR-T和抗CS1-IL7-CCL19 CAR-T细胞的绝对数量,用显微镜记录CAR-T培养到第9天时的镜下视野,并绘制细胞生长曲线,比较抗CS1 CAR-T和抗CS1-IL7-CCL19 CAR-T细胞的增殖能力。
6.Transwell迁移实验检测CAR-T细胞的趋化能力:
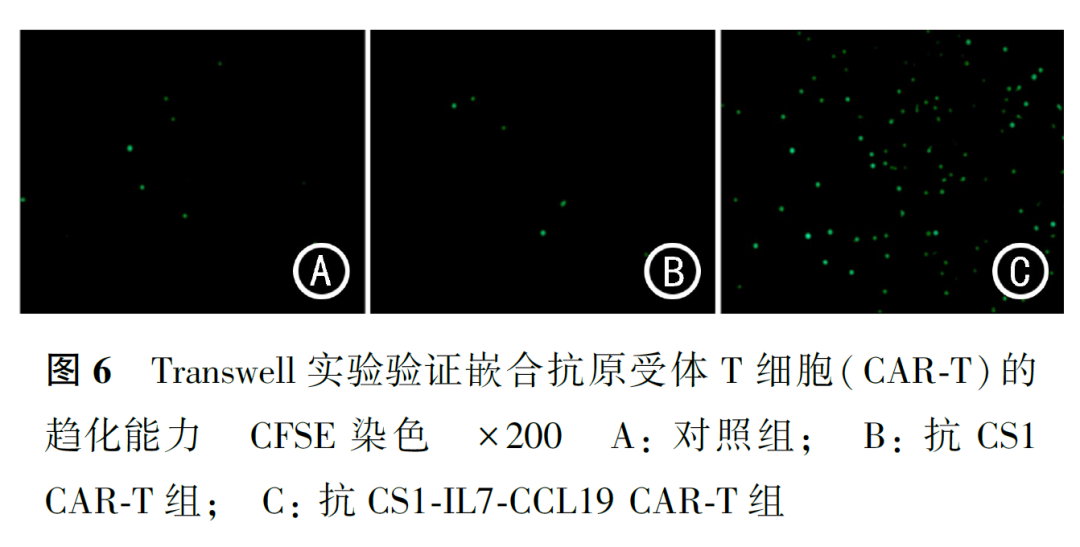
取部分T细胞,经脱磁后用PBS洗涤3次,用稀释好的5 μmol/L CFSE染液重悬,在旋转混匀器上避光孵育10 min,加入1 ml完全培养基终止染色,并用PBS洗涤3次。完全培养基重悬计数,将细胞密度调整为2×105个/100 μl。收集慢病毒转导后第5天CAR-T细胞培养上清400 μl于24孔板中,取CFSE染色的T细胞于Transwell小室中,将小室置于24孔板中,37℃ 5% CO2培养3 h,荧光显微镜下观察细胞迁移情况,随机选取3个视野,拍照计数。
7.过表达荧光素酶和GFP的MM细胞系和K562细胞系的构建:
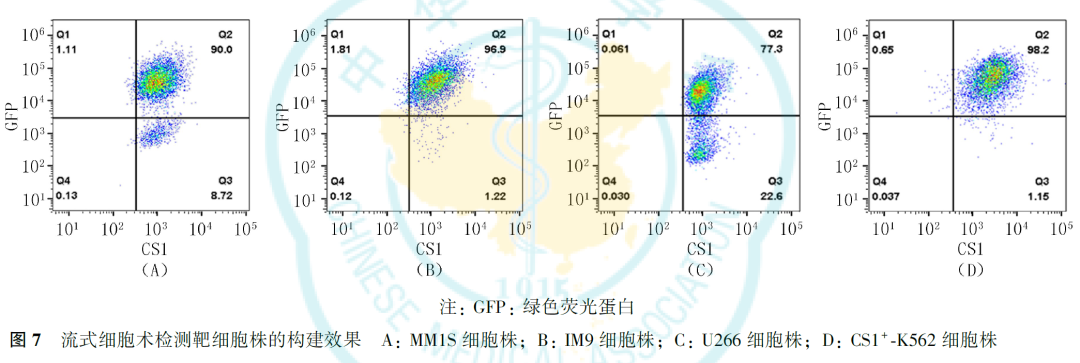
以pLenti-EF1α-CS1-Luc-GFP和pLenti-EF1α-P2A-Luc-GFP作为目的质粒,以PLP1、PLP2、PMD2G作为包装质粒,分别转导MM1S、IM9、U266和K562细胞,流式细胞术分选出GFP和CS1均为阳性的单个细胞,并扩大培养,通过流式细胞术验证细胞表面GFP和CS1抗原的表达。
8.荧光素酶生物发光法检测肿瘤细胞裂解率:
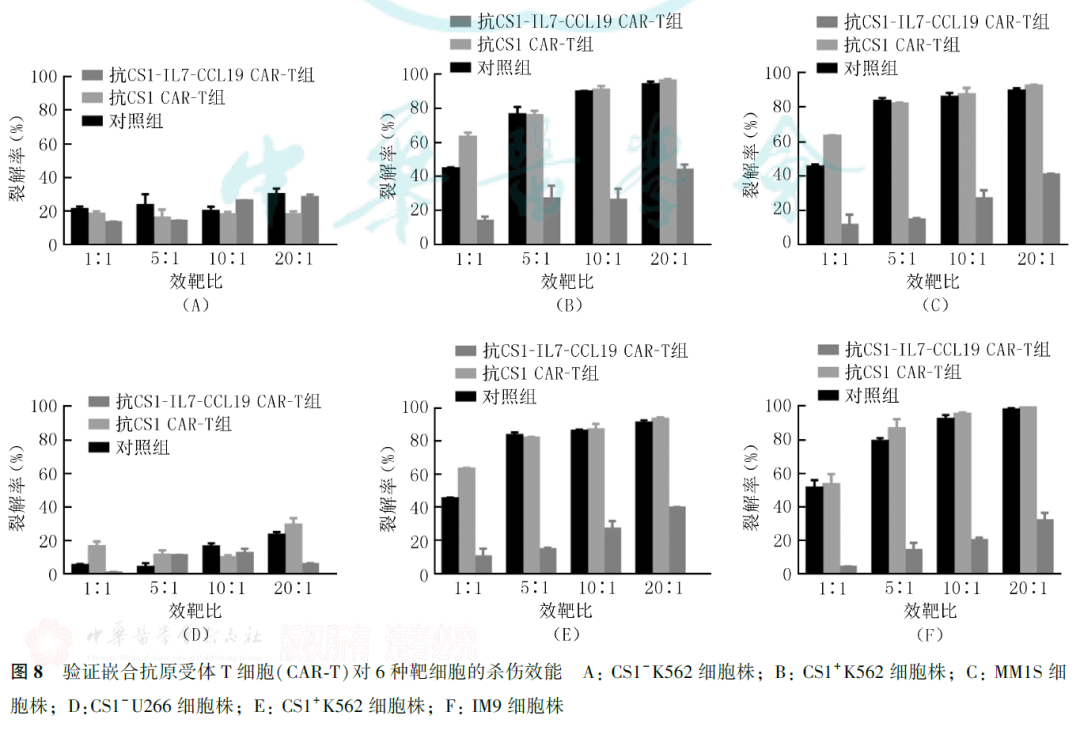
CAR-T细胞经脱磁后计数,用MOCK-T将CAR表达率调成一致,选用CS1+K562、CS1+IM9、CS1+MM1S、CS1+U266细胞和CS1-K562、CS1-U266细胞作为靶细胞(均表达Luc和GFP),按1∶1、5∶1、10∶1、20∶1的效靶比与CAR-T细胞进行共孵育,同时设置阴性对照(靶细胞+蒸馏水)与阳性对照(靶细胞+培养基),每组3个复孔,37℃孵育4 h后,离心弃上清,PBS洗涤3次,以1∶200加入荧光素酶底物D-荧光素,酶标仪检测靶细胞裂解情况。
9.MM动物模型检测第四代CAR-T细胞的体内有效性:
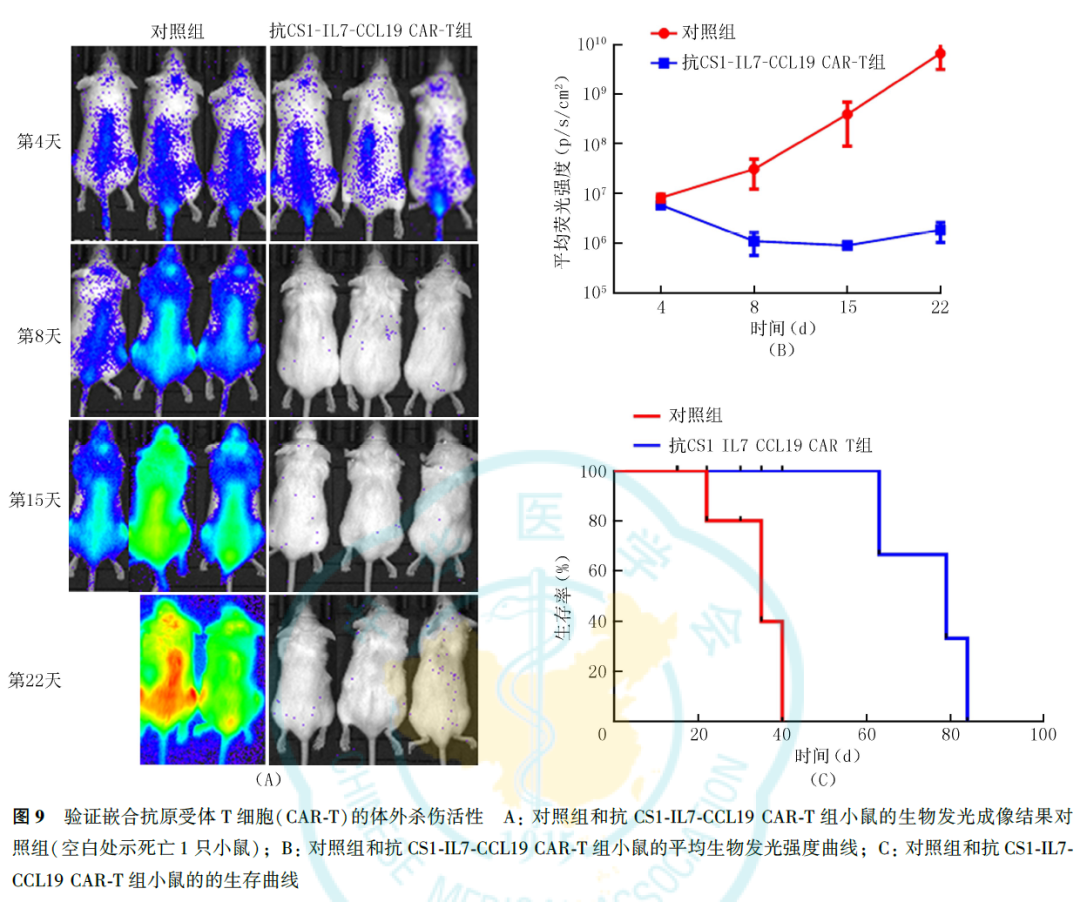
以稳定表达Luc-GFP的MM1S细胞作为靶细胞,用PBS洗涤3次,第0天将2×106个MM1S细胞经尾静脉注射入NOG小鼠体内,第4天通过生物发光成像确定初始肿瘤负荷。将小鼠随机分成2组,分别经尾静脉注射5×106个MOCK-T细胞(对照组)和抗CS1-IL7-CCL19 CAR-T细胞(实验组),每组3只,分别在第8、15和22天通过活体成像监测生物发光强度,绘制小鼠的生物发光曲线。每天监测小鼠生存状态,绘制小鼠生存曲线。
三、统计学方法
所有体外实验均独立重复3次,实验数据以均数±标准差表示,两组间比较采用独立样本t检验,数据统计分析和图表制作均采用GraphPad Prim 6.0软件,检验水准为α=0.05。


1.成功构建慢病毒表达载体:
慢病毒表达载体的质粒结构如图1所示,经测序验证序列正确。

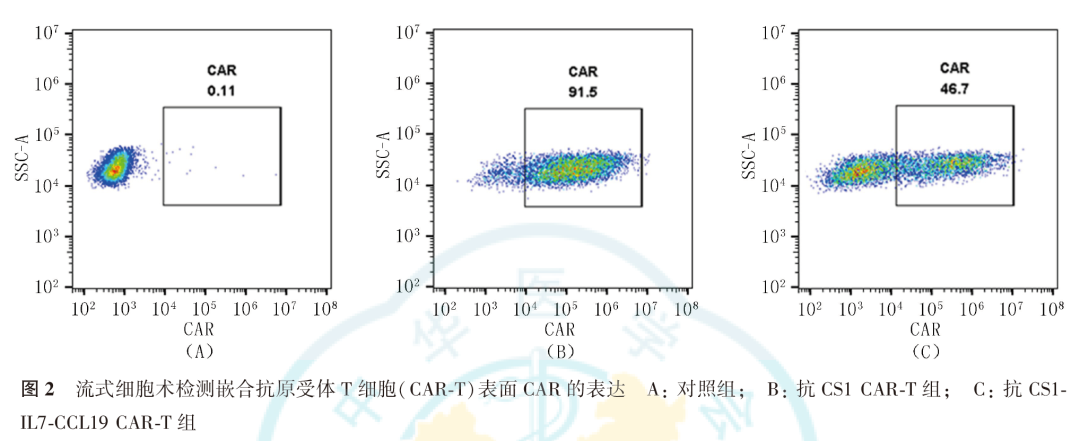
2.成功构建抗CS1 CAR-T和抗CS1-IL7-CCL19 CAR-T细胞:
流式细胞术检测结果显示,CAR分子可在T细胞上表达,抗CS1 CAR-T细胞的表达率为(91.50±0.29)%,抗CS1-IL7-CCL19 CAR-T细胞的表达率为(46.70±0.12)%,连续监测结果显示,CAR表达稳定,CAR-T细胞制备成功(图2)。
3.抗CS1-IL7-CCL19 CAR-T细胞具有增强的持久性:
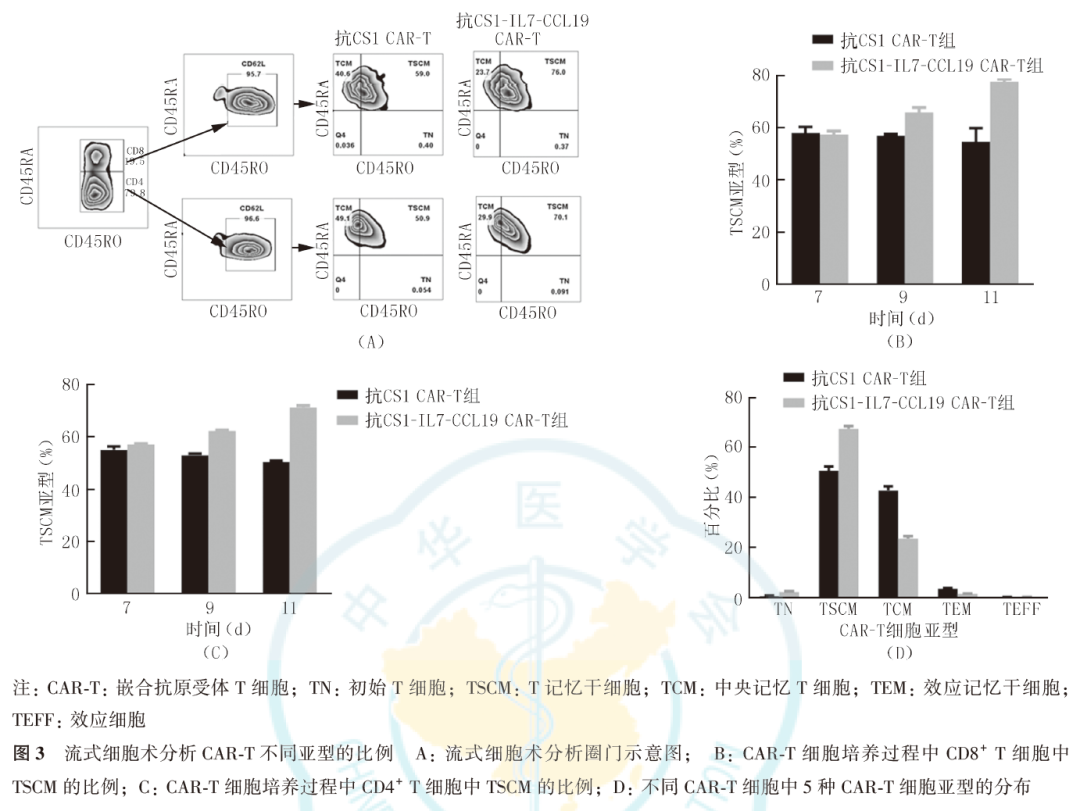
流式细胞术检测结果显示,在病毒转导后的第7天,抗CS1 CAR-T和抗CS1-IL7-CCL19 CAR-T中CD4+或CD8+T细胞中TSCM的比例差异无统计学意义(P>0.05)。在第9、11天时,抗CS1-IL7-CCL19 CAR-T中CD4+T细胞的TSCM比例分别为(62.34±0.25)%和(71.34±0.48)%,抗CS1 CAR-T中CD4+T细胞的TSCM比例分别为(53.56±0.27)%和(50.56±0.27)%,抗CS1-IL7-CCL19 CAR-T中CD8+T细胞的TSCM比例分别为(65.99±1.09)%和(77.67±0.68)%,抗CS1 CAR-T细胞中CD8+T细胞的TSCM比例分别为(57.10±0.33)%和(54.75±3.00)%。抗CS1-IL7-CCL19 CAR-T中TSCM细胞在CD4+和CD8+T细胞中所占的比例均高于抗CS1 CAR-T细胞(均P<0.05)。在CAR-T培养的第11天对5种亚型进行分析,结果显示,抗CS1-IL7-CCL19 CAR-T中TN、TSCM、TCM、TEM和TEFF的比例分别为(2.14±0.25)%、(67.58±0.59)%、(23.56±0.53)%、(1.44±0.08)%和(0.20±0.01)%,抗CS1 CAR-T细胞中TN、TSCM、TCM、TEM和TEFF的比例分别为(0.59±0.08)%、(50.74±1.01)%、(42.91±0.91)%、(3.53±0.02)%和(0.12±0.01)%,其中抗CS1-IL7-CCL19 CAR-T细胞中TSCM的比例高于抗CS1 CAR-T细胞(P<0.0001),而TCM则恰恰相反(P<0.0001,图3)。表明抗CS1-IL7-CCL19 CAR-T细胞终端分化有所减缓,抗CS1-IL7-CCL19 CAR-T细胞具有良好的免疫记忆功能,持久性更佳。
4.抗CS1-IL7-CCL19 CAR-T可有效分泌IL7和CCL19:
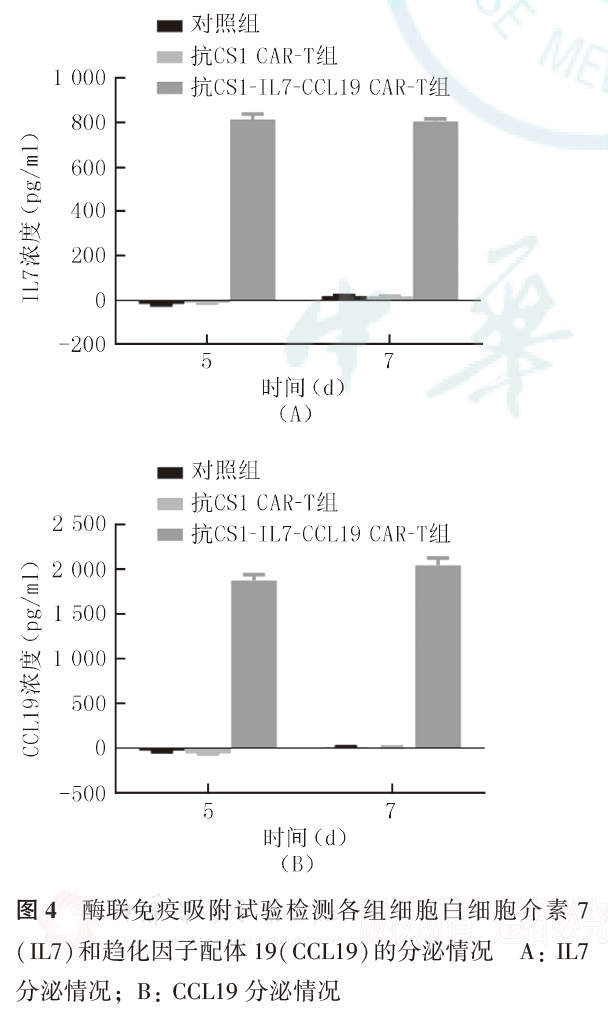
ELISA法检测结果显示,与对照组和抗CS1 CAR-T细胞比较,抗CS1-IL7-CCL19 CAR-T细胞可稳定分泌IL7和CCL19(P<0.0001,图4)。
5.抗CS1-IL7-CCL19 CAR-T具有更强的增殖能力:
CAR-T细胞计数结果显示,抗CS1-IL7-CCL19 CAR-T细胞在慢病毒转导后的第9天细胞数达到(22.77±0.79)×106个,超过抗CS1 CAR-T细胞[(9.40±0.79)×106个,P=0.0001],且镜下成团生长更明显(图5),表明抗CS1-IL7-CCL19 CAR-T细胞分泌的IL7加快了CAR-T细胞的增殖,即抗CS1-IL7-CCL19 CAR-T具有更强的增殖能力。
6.抗CS1-IL7-CCL19 CAR-T具有更强的趋化能力:
Transwell实验结果显示,抗CS1-IL7-CCL19 CAR-T细胞对于反应T细胞的趋化细胞数为(109.00±4.04)个/视野,高于对照组[(9.33±1.20)个/视野,P<0.0001]和抗CS1 CAR-T[(7.33±0.88)个/视野,P<0.0001,图6],提示抗CS1-IL7-CCL19 CAR-T细胞分泌的CCL19能够发挥其趋化作用,即抗CS1-IL7-CCL19 CAR-T具有更强的趋化能力。
7.成功构建过表达荧光素酶和GFP的MM细胞系和K562细胞系:
流式细胞术检测结果显示,所构建靶细胞株MM1S、IM9、U266、K562细胞表面GFP和CS1双阳性表达率分别为90.0%、96.9%、77.3%和98.2%(图7),提示细胞株构建成功。
8.抗CS1-IL7-CCL19 CAR-T具有特异性肿瘤细胞杀伤活性:
荧光素酶生物发光法检测结果显示,在效靶比为20∶1时,抗CS1-IL7-CCL19 CAR-T对CS1+ MM1S、IM9、U266、K562的裂解率分别为(92.55±0.21)%、(99.32±0.10)%、(93.55±0.48)%和(98.79±0.11)%,与抗CS1 CAR-T[分别为(89.62±0.77)%、(98.16±0.36)%、(91.29±0.82)%和(96.82±0.97)%]比较,差异无统计学意义(P>0.05),均达到85%以上,而未转导CAR的对照组[分别为(40.48±0.36)%、(32.01±0.26)%、(39.81±0.48)%和(31.54±3.32)%]细胞则无有效裂解作用(P<0.0001, 图8)。即抗CS1 CAR-T细胞和抗CS1-IL7-CCL19 CAR-T细胞均可特异性识别杀伤抗原阳性的细胞株,而对抗原阴性的细胞株无杀伤作用。
9.抗CS1-IL7-CCL19 CAR-T细胞具有高效的体内抗骨髓瘤活性:
生物发光成像结果显示,成功构建MM的小鼠动物模型,经不同T细胞治疗后,实验组小鼠肿瘤几乎完全消退,而对照组肿瘤细胞持续增长(P<0.0001),且抗CS1-IL7-CCL19 CAR-T细胞延长了荷瘤小鼠的总生存时间(P=0.0061,图9)。即抗CS1-IL7-CCL19 CAR-T细胞可显著降低肿瘤负荷,从而延缓肿瘤生长,延长生存时间,具有高效的体内抗骨髓瘤活性。


CAR-T疗法在治疗前B细胞急性淋巴细胞白血病或B细胞淋巴瘤患者的早期临床试验中取得成功,为标准治疗无效的患者提供了一种潜在的治疗方法。然而,越来越多的临床结果表明,由于常规CAR-T细胞持久性差和(或)抗原丢失或调节导致的癌细胞耐药性,使相当一部分患者治疗无效或短暂缓解后复发。因此,研究者在二代CAR的基础上添加细胞因子或趋化因子,即所谓的第四代CAR-T,以期促进CAR-T细胞的存活和免疫细胞的浸润,从而提高疗效。
近年来,在CAR-T细胞的免疫治疗中,T细胞功能的差异以及记忆T细胞和效应T细胞的作用被证明是重要的。T细胞包括一系列的效应和记忆亚群,TN被称为未致敏T细胞,可分化为TSCM、TCM、TEM、TEFF,均表现出不同程度的增殖和自我更新能力。虽然TEFF具有较强的溶瘤作用,但只有中心记忆T细胞和分化较低的T细胞子集TSCM在体内能达到长时间的扩增以及较强的增殖能力。较早的记忆亚群的CAR-T产品具有更高的治疗潜力。有研究表明,具有"年轻"表型的CAR-T细胞在体内具有更好的反应性和持久性。干性记忆T细胞作为记忆T细胞的一个子集,有着更优越的自我更新能力,表现出比TCM更持久和有效的抗肿瘤作用。
IL7是淋巴细胞发育和存活所必需的细胞因子,也是T细胞稳态的主要调节因子。本研究结果表明,IL7的添加明显促进CAR-T细胞的增殖,为解决常规CAR-T细胞存活率低下的问题提供了策略。有研究表明,IL7在保留离体扩增CAR-T细胞中TSCM亚群方面更具优势,而TSCM具有更优越的自我更新和多能分化潜力,产生更持久有效的抗肿瘤效应。本研究中,我们证实了IL7的添加提高了第四代CAR-T细胞CD62L、CD45RA和CD45R0高表达的TSCM比例,具有更高的抗肿瘤潜力,为解决常规CAR-T细胞持久性问题提供了依据。CCL19主要由次级淋巴组织和器官的T细胞、趋化幼稚T细胞和成熟树突状细胞表达,是T淋巴细胞和树突状细胞的化学趋化剂,其通过与CCR7配体结合促使免疫细胞(主要是T细胞与自然杀伤细胞)浸润到肿瘤部位发挥免疫作用。本研究结果证明了CCL19的添加促进了对T淋巴细胞的趋化作用,为解决免疫细胞在肿瘤微环境的渗透聚积问题提供了策略。
靶点的选择也是CAR-T治疗的关键,理想的靶抗原应该特异性地表达在MM细胞上,以避免潜在的脱靶效应。MM具有遗传和表型的异质性,表面抗原的表达不尽相同。B细胞成熟抗原是MM的CAR-T疗法中最常用的靶标,但值得注意的是,并不是所有的MM细胞均表达B细胞成熟抗原,导致部分患者CAR-T细胞初治无效。因此本研究中,我们选取了另一个在MM细胞表面高度表达,且在骨髓细胞、造血干细胞和大多数健康组织中几乎检测不到的CS1抗原作为第四代CAR-T的靶标抗原。
综上所述,我们结合IL7和CCL19的功能设计的第四代抗CS1-IL7-CCL19 CAR-T细胞,在一定程度上增强了CAR-T细胞在免疫微环境中的增殖、存活及浸润积聚,并展现出了快速高效的抗肿瘤活性,其良好的趋化性和持续性为第四代CAR-T细胞的临床应用奠定了实验基础。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


