
近日,吴一龙教授团队于国际医学顶刊杂志《自然医学》(IF:82.9)上发表了题为“First-line pyrotinib in advanced HER2-mutant non-small-cell lung cancer: a patient-centric phase 2 trial”的临床试验结果文章,公布了大型伞式研究(CTONG1702)的第七个臂组(HER2-arm)的研究结果和同期开展的观察性真实世界研究(CTONG 1705)的部分数据结果[1]。该研究首次提出了一种对于罕见基因变异患者的全新临床试验模式,为全面收集患者的研究数据、探索最合理的治疗方案开创了一种更高效率、更全面反映药物疗效的临床研究设计方法。该研究方法通过扩展入组标准使得被排除在外的患者也有机会接受前沿的药物治疗,为更广泛患者群体提供药物疗效和安全性信息。
临床试验是一种通过严格筛选,使符合条件的患者有机会接受最前沿的、未上市药物治疗的研究模式。据统计,仅有44.8%的癌症患者有机会参加临床试验,而其中将近一半(21.9%)的癌症患者因为入组标准等限制而被排除在外[2]。严格的入组标准保证了一批条件基本相似的人群接受相同的药物治疗,其结果因为条件基本一致使药物疗效可信度很强。 但过度严格的条件不仅会限制患同一癌症的部分患者接触研究药物治疗,其研究结果也往往无法代表真实世界广大癌症患者的疗效和安全性。在生物标志物驱动治疗的时代,由于罕见突变的发生率较低,携带这类基因变异的患者数量有限,极大的延长了靶向药物的研发周期,使得患者长时间不能接受可能有效的靶向药物,临床试验是这类患者接触最前沿药物的宝贵机会。
国家药品监督管理局药品审评中心于2022年8月发的《以患者为中心的临床试验设计技术指导原则(征求意见稿)》指出,申办者在临床试验设计中应落实“以患者为中心”(patient-centric)的理念[3]。“以患者为中心”的药物研发(Patient-Centric Trial,PCT)是指以患者需求为出发点、视患者为主动参与者、以临床价值为最终目的,该理念已成为当前药物研发的核心指导思想。该意见稿明确表示,临床试验的开展不应没有任何科学理由地排除特定人群,包括儿童、老年人、孕妇、器官功能损伤的患者等,并且应从各方面促进受试者人群的代表性。美国食品药品监督管理局也发布了相关指导原则,临床试验应该从提升临床研究创新性设计、扩大临床试验参与人群等多维度切入,建议拓宽入组合格标准,避免不必要的临床试验排除,并应用于治疗少(罕)见疾病或罕见基因变异靶向药物临床试验 [4]。非常遗憾的是,至目前为止,世界上还没有一个这样设计的临床研究。
深化以患者为中心的临床试验可以在临床试验开展的各个阶段(包括设计、启动、入组、数据收集、结束和结局报告)中优先考虑患者需求。然而,目前的以患者为中心的临床试验主要是通过数字技术,如远程医疗、远程监测,提高患者参与研究的机会、或者提高患者体验,很少涉及到研究整体的设计[5]。
研究设计
为了加速罕见靶点药物的研发,贯彻实践“以患者为中心”的理念,广东省人民医院吴一龙教授团队牵头下联合全国数家医疗机构,于2018年开创性同期启动了一项由研究者发起、以患者为中心的II期大型伞式研究(CTONG1702)和一项观察性真实世界研究(CTONG 1705)[6]。
患者提供肿瘤组织标本进行二代基因测序,获得基因变异结果。符合CTONG1702研究严格入组标准的患者进入“严格入排队列”;携带罕见靶点、但不符合入组标准的患者,可以通过同情用药的方式接受药物治疗,进入“同情用药队列”。CTONG1702研究的主要研究终点为客观缓解率,次要终点包括无疾病进展生存期,总生存期,疾病控制率,缓解持续时间和安全性。由于各种原因不愿入组CTONG1702研究、携带罕见靶点的患者,进入观察性真实世界研究CTONG1705(真实世界队列),接受临床常规治疗(图1)。
HER2突变在肺癌中的发生率为2%-4%,目前尚未有获批的一线靶向药物。Pyrotinib(吡咯替尼)是一种靶向表皮生长因子受体(EGFR)、 HER2和HER4的不可逆泛HER酪氨酸激酶抑制剂,已在中国被批准用于HER2阳性乳腺癌。此次文章发表报道了初治HER2突变型晚期NSCLC患者接受吡咯替尼的疗效和安全性,以及接受临床常规治疗的临床结局。
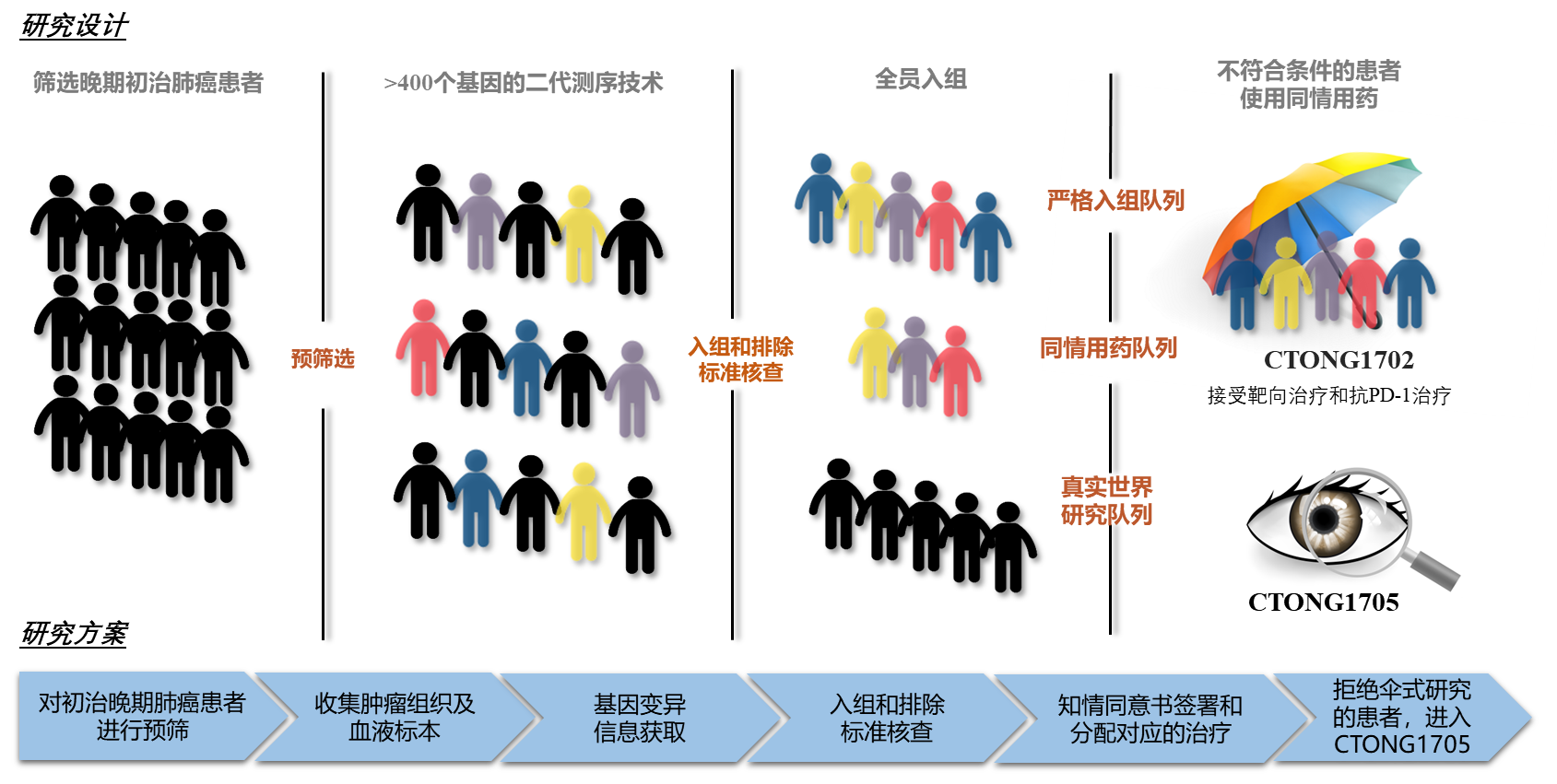
图 1 CTONG1702和CTONG1705研究设计
研究结果
截至2021年12月,研究共筛选出48例HER2突变型晚期初治肺癌,严格入排队列、同情用药队列以及真实世界队列分别入组28例、12例和8例患者(图2)。
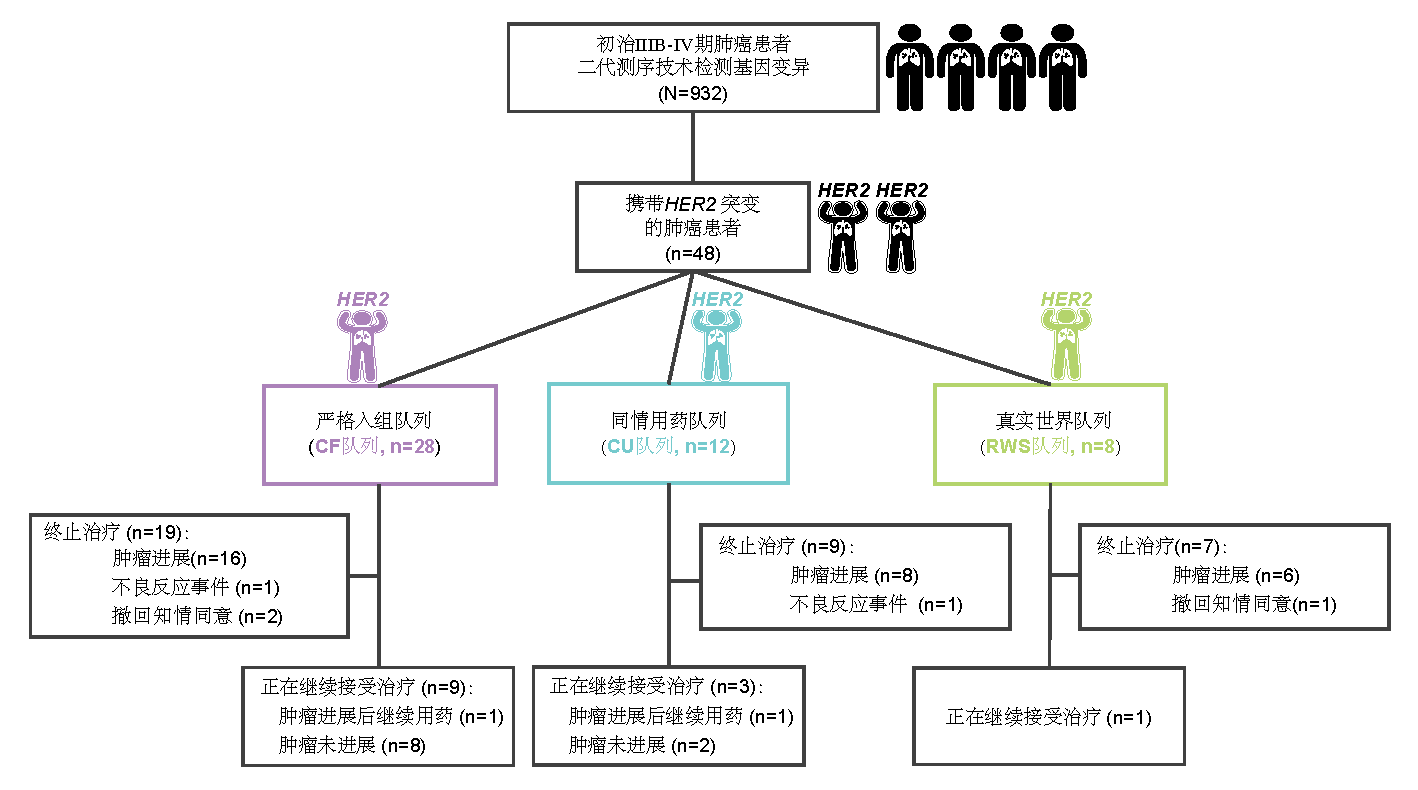
图 2研究流程图
疗效数据
严格入排队列(28例患者)达到了预设主要终点,吡咯替尼的有效率为35.7%。次要终点疾病控制率为89.3%,中位无进展生存时间为7.3个月,中位总生存时间为14.3个月(图3)。
同情用药队列(12例患者)接受吡咯替尼治疗的有效率为16.7%,疾病控制率为83.4%,中位无进展生存时间为4.7个月,中位总生存时间为14.2个月。
真实世界队列(8例患者)接受了一线抗肿瘤治疗(2例接受化疗;4例接受免疫治疗;2例接受靶向治疗),没有一例显示出抗肿瘤疗效,疾病控制率为75.0%,中位无进展生存时间和中位总生存时间分别为3.0个月和12.2个月。
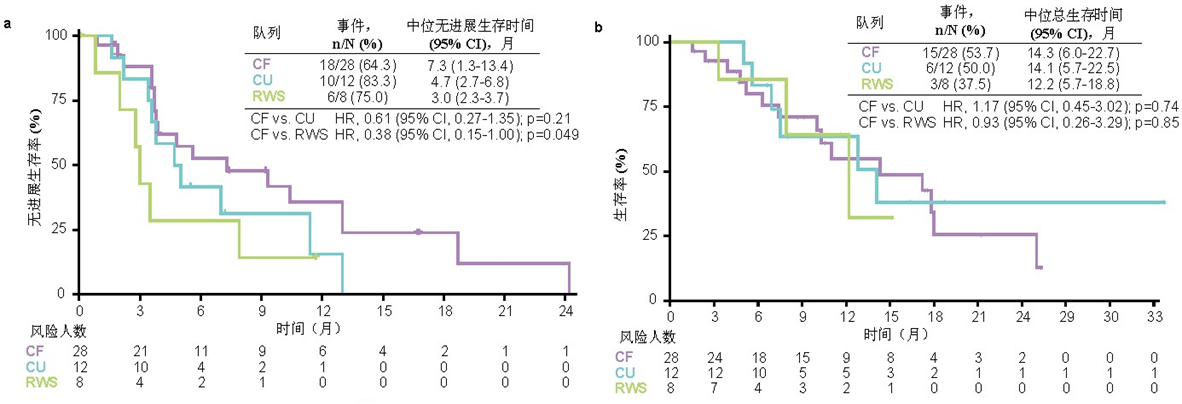
图 3 严格入排队列、同情给药队列和真实世界队列的Kaplan-Meier生存曲线(左:无进展生存时间;右:总生存时间)
在药物安全性方面,正如预期的一样,严格入排队列的大于等于3级的严重副作用比较少,只有10.7%的发生率,而同情用药组严重副作用几乎翻了两倍,达到33.3%,但这两组中均没有因为副作用需要永久停药的。副作用基本和其他靶向药物的副作用类似,属于可控的。
研究意义
本研究病例数不很多,药物疗效也并不特别惊艳,之所以会被国际排名第11位的顶级期刊《自然医学》看中刊发,完全在于研究设计的新颖性。这是首个在同一时间段内入组、但又是非直接比较的、能够全面显示一个药物在同一个靶点上的有效性和安全性的研究(严格入排队列和同情给药队列),也和不接受精准靶点治疗的人群有了间接的比较(真实世界队列)。这为以后罕见靶点的临床研究提供了一个案例,也为全面评价一个研究药物提供了全新的角度,其前瞻性和实用性非常强。
另外,本文也首次报导了吡咯替尼在HER2突变阳性初治晚期NSCLC患者的临床疗效和安全性。通过应用当前的以患者为中心的研究设计,不仅扩大了罕见基因突变患者接受多种新治疗的机会,还提高了包括吡咯替尼在内的研究药物在更广泛人群中的普适性。类似的研究设计模式(如针对ALK融合的CTONG2203)也正在广东省人民医院如火如荼地筹备当中。
本文第一作者为暨南大学附属第一医院刘思阳博士后、广东省人民医院肺癌研究所涂海燕主任医师、广东省人民医院肺癌研究所魏雪武博士,通讯作者为广东省人民医院肺癌研究所吴一龙教授、广东省人民医院肺癌研究所周清教授、暨南大学李扬秋教授。

1. Si-Yang Maggie Liu, Hai-Yan Tu, Xue-Wu Wei, Hong-Hong Yan, Xiao-Rong Dong, Jiu-Wei Cui, Zhen Zhou, Chong-Rui Xu, Ming-Ying Zheng, Yang-Si Li, Zhen Wang, Xiao-Yan Bai, An-Na Li, Yue-Li Sun, Jie Huang, Jia-Xin Lin, EE Ke, Bing-Fei Xu, Chang Lu, Yingying Du, Yuan Chen, Rui Ma, Bu-Hai Wang, Shun-Dong Cang, BinChao Wang, Hua-Jun Chen, Jin-Ji Yang, Yangqiu Li, Qing Zhou, Yi-Long Wu. First-line pyrotinib in advanced HER2-mutant non-small-cell lung cancer: a patient-centric phase 2 trial [J]. Nat Med. 2023; doi: 10.1038/s41591-023-02461-x.
2. Unger JM, Vaidya R, Hershman DL, Minasian LM, Fleury ME. Systematic Review and Meta-Analysis of the Magnitude of Structural, Clinical, and Physician and Patient Barriers to Cancer Clinical Trial Participation[J]. J Natl Cancer Inst. 2019;111(3):245-255.
3. NMPA. 以患者为中心的临床试验设计技术指导原则(征求意见稿)[EB/OL]. (2022-08-09).https://www.cde.org.cn/main/att/download/a4dd4d9bca97f5e8971f4161c62fb84e.
4. FDA. Enhancing the Diversity of Clinical Trial Populations — Eligibility Criteria, Enrollment Practices, and Trial Designs Guidance for Industry [EB/OL]. (2020-11-09). https://www.fda.gov/media/127712/download.
5. Li BT, Daly B, Gospodarowicz M, Bertagnolli MM, Brawley OW, Chabner BA, Fashoyin-Aje L, de Claro RA, Franklin E, Mills J, Legos J, Kaucic K, Li M, The L, Hou T, Wu TH, Albrecht B, Shao Y, Finnegan J, Qian J, Shahidi J, Gasal E, Tendler C, Kim G, Yan J, Morrow PK, Fuchs CS, Zhang L, LaCaze R, Oelrich S, Murphy MJ, Pazdur R, Rudd K, Wu YL. Reimagining patient-centric cancer clinical trials: a multi-stakeholder international coalition [J]. Nat Med. 2022;28(4):620-626.
6. Liu SM, Yan HH, Wei XW, Lu C, Dong XR, Du Y, Cui JW, Chen Y, Ma R, Wang BH, Zhou Z, Cang SD, Yang JJ, Tu HY, Zhang XC, Zhong WZ, Zhou Q, Wu YL. Biomarker-Driven Studies With Multi-targets and Multi-drugs by Next-Generation Sequencing for Patients With Non-Small-Cell Lung Cancer: An Open-Label, Multi-center, Phase II Adaptive Umbrella Trial and a Real-World Observational Study (CTONG1702&CTONG1705) [J]. Clin Lung Cancer. 2022;23(7): e395-e399.











 苏公网安备32059002004080号
苏公网安备32059002004080号


