引言

目前冒烟型多发性骨髓瘤(SMM)的治疗标准在临床试验之外主要是密切的监测,研究者们正在努力了解导致SMM发展为活动性多发性骨髓瘤(MM)的病理过程。随着更新的和更有效的治疗手段出现,一个越来越被问及的问题是:对SMM患者进行早期干预是否会改变其自然病程?本综述提供了SMM相关的研究数据,包括风险因素和疾病进展的风险模型,以及对SMM治疗相关的临床试验。
冒烟型多发性骨髓瘤(SMM)是一种无症状的浆细胞克隆增殖疾病,可进展为多发性骨髓瘤(MM)。它在1980年首次被描述,之后人们开始研究SMM进展为MM的实验室和影像学标记物。第一个确定的进展风险标记物包括轻链蛋白尿和浆细胞增殖指数。SMM定义为存在血清M蛋白≥3 g/dL(或≥500mg /24h尿)或骨髓克隆浆细胞≥10%,并且没有骨髓瘤定义事件。
SMM患者具有相当大的异质性,包含三类患者群体:一类在生物学上类似于MGUS,一类缓慢进展为MM,另一类是“进化中的骨髓瘤”,将在2年内进展为MM。进展为MM的风险随着时间的推移而降低:前5年进展的总体风险为每年10%(5年内进展风险为50%),之后的5年为每年3%(10年内进展风险为65%),此后为每年1%(与MGUS进展的风险相似)。大约有25%的SMM患者不会进展为MM。
高危SMM (HR-SMM)是一组目前被认为应该积极治疗的人群,但是这个群体能被可靠地识别出来吗?目前有几种进展为MM的风险模型,但这些风险模型目前尚未统一。考虑到MM早期死亡率高于10%,以及与骨病相关的不可逆转的肾脏损伤、脊髓压迫、骨折和慢性疼痛的风险,对SMM早期干预的需求逐渐上升。理想的治疗策略是不过早治疗以避免治疗毒性,不太晚治疗以避免不可逆的并发症,找到这个“最佳点”是一个挑战。
由于低危或标危SMM发展为MM可能需要很多年,针对这部分患者目前的共识是暂不治疗。目前对SMM患者的管理标准是积极监测直到进展为MM, FDA/EMA没有批准治疗SMM的药物这一事实也反映了这一点。2014年, IMWG修改了MM的诊断标准,首次推荐对进展风险非常高(2年内80%进展)的无症状患者进行治疗。指南建议对具有1个或1个以上进展标记物的患者进行治疗,即所谓的 “骨髓瘤定义事件”(骨髓浆细胞≥60%,sFLC比值≥100(只有在尿液单克隆蛋白为>200 mg/d时才有意义),MRI发现1个以上局灶性病变)。在新的标准下,大约15%的SMM可被划分为活动性骨髓瘤。
了解推动SMM进展为MM的遗传因素,可以帮助识别那些可能受益于早期干预的患者。在HR-SMM中,大多数引起MM的基因改变已经出现。然而,进展为MM的确切机制尚不清楚。经过验证的模型显示了特定的基因组畸变(丝裂原活化蛋白激酶通路的改变,MYC和DNA修复通路帮助对SMM患者进行风险分层。另一种可能的解释是与骨髓微环境相互作用的改变导致免疫调节功能的丧失。
目前SMM治疗中的争议点主要包括:开始治疗的理想时间是什么时候?哪些患者群体应该接受治疗?何种治疗模式对SMM最有益?治愈 vs 控制?SMM应该治疗多久? SMM临床试验的最佳终点是什么?
评估SMM疾病进展的风险分层模型
基于回顾性队列研究,我们评估了多种预测进展的参数,包括M蛋白的类型、数量和上升水平、受累sFLC比值和dFLC、免疫不全麻痹、骨髓中克隆浆细胞的比例、尿轻链、循环浆细胞和FISH异常。SMM进展的一个重要标准被定义为在间隔3个月的随访中,连续2次血清M蛋白持续升高。
有几种模型用于评估SMM进展的风险(表1)。西班牙PETHEMA风险模型基于两个标准:多参数流式细胞术(MFC)检测的异常骨髓浆细胞≥95%,以及免疫不全麻痹。MFC用于识别免疫表型异常浆细胞的应用并不广泛,这限制了该风险模型的广泛引入;
2008年Mayo临床模型根据3个标准将SMM分为3个风险类别:血清M蛋白≥3 g/dL,克隆骨髓浆细胞(BMPC)≥10%,sFLC比值>8或<0.125;
2018年Mayo临床模型根据3个标准将SMM进行风险分层:克隆BMPC >20%,M蛋白>2g/dL, sFLC比值>20(20/2/20);
IMWG风险模型验证了2018年梅奥临床模型,包括相同的三个参数,并增加了细胞遗传学异常。
表1 常用的冒烟型多发性骨髓瘤(SMM)风险分层模型

sFLC:血清游离轻链;BMPC:骨髓浆细胞;FISH异常:t(4;14), t(14;16), 1q gain, del 13q/ 13单体.
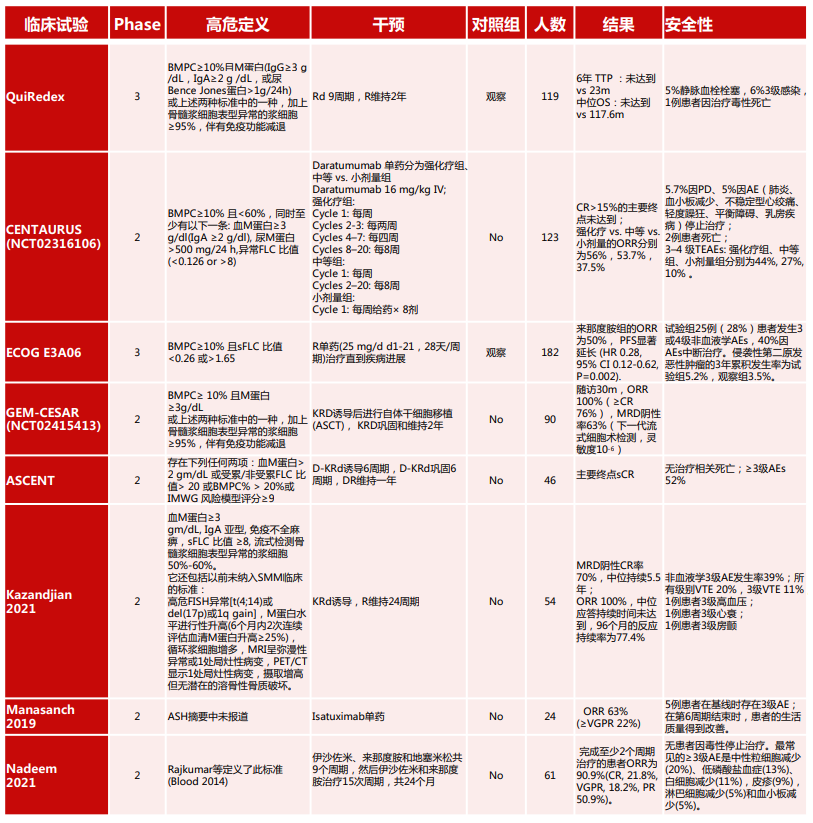
这些风险模型存在一定的局限性。在QuiRedex和ECOG试验中,两个随机的3期试验显示对HR-SMM进行治疗可使患者获益,但是两个研究使用了不同的标准对高危人群进行定义。一项研究显示,在不同研究中被定义为高危人群的一致性仅为29%。在PETHEMA模型归类为HR-SMM的38人中,只有4人被Mayo 2018模型归类为高危人群。
再者,上述的风险模型并不是一个动态模型,而是基于单个时间点的结果对患者进行分层。这些标准是否可用于让无症状患者在一次门诊就诊的基础上就开始接受持续治疗仍有待进一步研究。监测期间能反映标记物变化情况的动态风险模型应该在更大的队列中得到验证,对患者来说基于某个时间点的检查结果来决定开始治疗并不合适。我们认为最好是密切监测SMM患者的血红蛋白、肌酐、M蛋白和所累及的sFLC的动态变化,不基于单一时间点的实验室检查结果进行治疗,除非是在临床试验中。
总而言之,在试验之外,我们不会使用这里提到的任何一种模型,因为我们不会基于任何一种模型来治疗病人。我们密切监测病人、评估每个患者的疾病生物学,试图为患者提供一种个性化的管理手段。
SMM的治疗干预
对50名无症状骨髓瘤患者在诊断vs 进展阶段使用马法兰和强的松治疗的前瞻性研究中,首次提出了在MM出现症状之前对其进行治疗的概念。这种干预并没有推迟进展至MM的时间,也没有改善OS。
HR-SMM的治疗目前有两个理念:控制(旨在推迟至终末器官损害时间的低强度治疗)和根除(旨在根除恶性克隆和潜在治愈疾病的强化治疗)。唯一表明干预使OS获益的临床试验是QuiRedex研究。这是一项III期多中心试验,119例患者随机进入来那度胺和地塞米松(Rd)组和观察组。在6年的长期随访中,中位TTP为未达到和23月(HR=0.24),治疗组的中位OS未达到,观察组为117.6个月(HR=0.43)。尽管本研究证明了早期治疗有OS和PFS的获益,但它也有局限性。这项研究进行时,PET-CT, MRI等成像技术并未广泛使用,导致部分骨髓瘤骨病患者很有可能被纳入本研究,观察组的高进展率(10个月21%)也提示了这一点。再者,进展仅使用CRAB的标准来定义,并不包括血红蛋白轻度但稳定的下降或肌酐、血钙水平增加,M蛋白上升速度,或轻链改变的进展标准。此外,本研究并未进行定期的骨成像,所以观察组一些新发骨病变的无症状患者直到骨病变发展到非常疼痛才会开始治疗,可能导致了观察组的结果更糟。这项研究的重要性在于,它是第一个支持进一步研究新药治疗高危SMM的临床试验。
另一个重要的III期试验是ECOG E3A06。该试验将182名中高危SMM患者在病情进展前给予单药来那度胺治疗和单纯观察进行对比。ECOG E3A06研究的基线评估使用了MRI,47%的患者提示MRI异常。主要终点为PFS,进展的定义包括生化进展。来那度胺组ORR为50%,PFS明显延长。但是观察组在24个月后只有24%的患者出现进展,远低于预期的50%,这表明这不是一个真正的高危人群。根据2018年的Mayo标准,有58名患者被评估为低危,所以此研究结果仍需谨慎对待。
ASCENT和GEM-CESAR试验探索了在高危SMM的治疗中,使用MRD阴性作为OS的替代终点。ASCENT试验中患者接受了6个周期的D-KRd(达雷妥尤单抗卡非佐米、来那度胺和地塞米松)诱导治疗,D-KRd巩固6个周期,DR维持1年,没有观察到治疗相关的死亡。GEM-CESAR是一项II期试验,评估KRD诱导、自体干细胞移植(ASCT)、KRD巩固和维持2年的疗效。随访30个月,ORR为100%(≥CR 76%), MRD阴性为63%。3年PFS率为93%,与使用单药来那度胺的ECOG E3A06研究相似。
一项II期单中心研究报告了54例患者接受8个周期的KRd治疗后接受24个周期的来那度胺维持治疗的结果。在基线时进行了脊柱MRI和PET-CT。纳入的患者还包括了以前未纳入SMM临床试验的标准:高危FISH异常,M蛋白水平进行性升高,外周血循环浆细胞增多,MRI弥漫性异常或1处局灶性病变,PET/CT有一处局灶性病变或摄取增加而无潜在的溶骨性骨质破坏。本研究的主要终点是70%患者的MRD阴性CR率。只有2例发生MM(治疗结束后均有溶骨性病变),6例患者符合生化进展标准。这是首个同时使用CT和MRI作为筛查工具排除活动性骨髓瘤患者的SMM研究。
在考虑对SMM患者进行早期治疗时除了需考虑疗效外,还需要关注药物的不良反应。接受硼替佐米治疗的患者可能面临终生的神经病变负担;接受来那度胺治疗的患者经常出现疲劳、腹泻、静脉和动脉血栓形成,ASCT后发生第二原发性恶性肿瘤的风险增加一倍;卡非佐米的心脏毒性可能危及生命,并且各种治疗方法也有可能会增加感染风险。
表2总结了目前SMM中的2期和3期临床试验。
表2 冒烟型多发性骨髓瘤(SMM) 2期和3期临床试验汇总
临床试验终点
在SMM研究中另一个重要的概念是PFS2,它被定义为从随机化到下一次治疗进展或因任何原因死亡的时间。它显示了SMM治疗对后续治疗效果的影响。在引用的临床试验中,患者似乎对诱导反应良好。然而,这些研究都没有报道PFS2,这是一个重要的终点,因为它在反驳早期干预治疗可能导致耐药克隆在疾病进展时出现这一概念上是至关重要的。我们认为,在评估HR-SMM早期干预的临床试验中,最重要的终点是OS、MRD阴性、PFS2、骨折、肾功能损害和生活质量。
未来展望
在SMM的风险分层和治疗方面仍需要进一步探索。基于监测过程中反复评估的遗传标记的动态模型将有助于预测进展为MM的风险,并有助于确保入选试验的患者确实具有较高的疾病进展风险。
多项临床试验探讨了SMM的治疗方法。表3总结了SMM正在进行的2期和3期临床试验。DETER-SMM试验(NCT03937635)将患者随机分为DRd和Rd两组,而ITHACA试验(NCT04270409)将患者分为Isatuximab +Rd和Rd两组,这是两个3期RCT研究。AQUILA试验(NCT03301220)将390名患者随机分配至接受达雷妥尤单抗vs 观察。2期E-PRISM (NCT02279394)研究评估了elotuzumab+Rd疗效,初步结果显示ORR为71%,且没有进展为MM。另一项2期试验评估的是伊沙佐米、来那度胺和地塞米松的“全口服”方案(NCT02916771),其ORR为91%。可能是通过刺激免疫系统来阻止MM的进展。一项1/2b期研究评估了PVX-410多肽疫苗±来那度胺在22名SMM患者中的使用情况,这种干预是安全的,并产生持续增加的CD8+记忆T细胞(92)。
下一步可能是根据基因来定制治疗,例如,评估venetoclax靶向治疗在预防t(11;14)HR-SMM患者进展中的有效性。
表3 正在进行的SMM 2期和3期临床试验

专家简介
李菲 教授
主任医师 教授 博士生导师
南昌大学第一附属医院血液病诊治中心主任
江西省血液病临床医学研究中心主任
南昌大学淋巴肿瘤疾病研究所主任
江西省委组织部“远航工程”人才
江西省主要学术和学科技术带头人-领军人才
江西省青年科学家培养对象
国家教育部博士论文评审专家;国家自然科学基金评审专家;美国血液学会会员;江西省医学会血液学分会候任主委;中华血液学杂志通讯编委;中华医学会血液学分会淋巴疾病学组委员;中国CSCO抗淋巴瘤联盟委员;中国抗癌协会血液肿瘤专委会委员;中国慢淋专家组委员;中国整合医学会血液学分会委员;中国医药教育协会造血干细胞移植和免疫治疗分会常委。
牵头成立江西省血液专科医联体、江西省整合医学会血液学分会、江西省噬血细胞综合征协作组、江西省造血干细胞移植和细胞免疫治疗专委会、江西省罕见血液病协作组。
参考文献:Vaxman I, Gertz MA. How We Approach Smoldering Multiple Myeloma [published online ahead of print, 2022 May 16]. Blood. 2022;blood.2021011670. doi:10.1182/blood.2021011670












 苏公网安备32059002004080号
苏公网安备32059002004080号


