在2021成功举办“广东大会诊”的基础上,为了汇聚更大范围内的专家智慧,更广泛地推广肺癌多学科专家诊疗模式,广东省医学会肺部肿瘤学分会及广东省临床试验协会/中国胸部肿瘤研究协助组(GACT/CTONG)牵头,于2022年2月起组织开展“中国胸部肿瘤大会诊”活动。我们邀请全国各地胸部肿瘤治疗领域各专业专家组成会诊决策团队,每个月定期针对有代表性的肺癌疑难病例进行多学科会诊,集众人智慧之利剑,拾循证医学之护盾,为中国肺癌诊治攻坚任务贡献力量。


本场大会诊病例


NO.1
病例介绍
▶病史概要
患者,男,48岁,吸烟指数:45包年,PS =1分。
主诉:因“咳嗽、咳痰伴右上胸痛1月余”至广东省人民医院就诊。
入院后查PET/CT:右肺尖肿物(81×58mm),伴肺门纵隔淋巴结肿大(图1)。EBUS活检不能耐受,后行肺穿刺活检提示肺恶性肿瘤。
免疫组化结果:TTF1(-),Napsin A(-),P40(-),P63(-),LCA(-),CAM5.2(-),CgA(-),Syn(-),CD56(-),Ki67(约80%+),CK7(-),EMA(-),Vimentin(++),NUT(-),ERG(-),HHF35(-),SMA(-),Desmin(-),MyoD1(-),Myogenin(-),S100(-),CD34(-),CD99(-/+),CD117(-),FLI-1(-),CDK4(-),STAT6(-),INI-1(+,未缺失),TLE-1(个别弱+),Melan A(-),HMB45(-),P504s(-),MUC4(-),Bcl2(-)。(右肺)恶性肿瘤,结合免疫组化结果,考虑为间叶源性恶性肿瘤可能性大,目前免疫组化未能提示明确来源,穿刺组织受取材局限,建议待大体标本进一步明确。
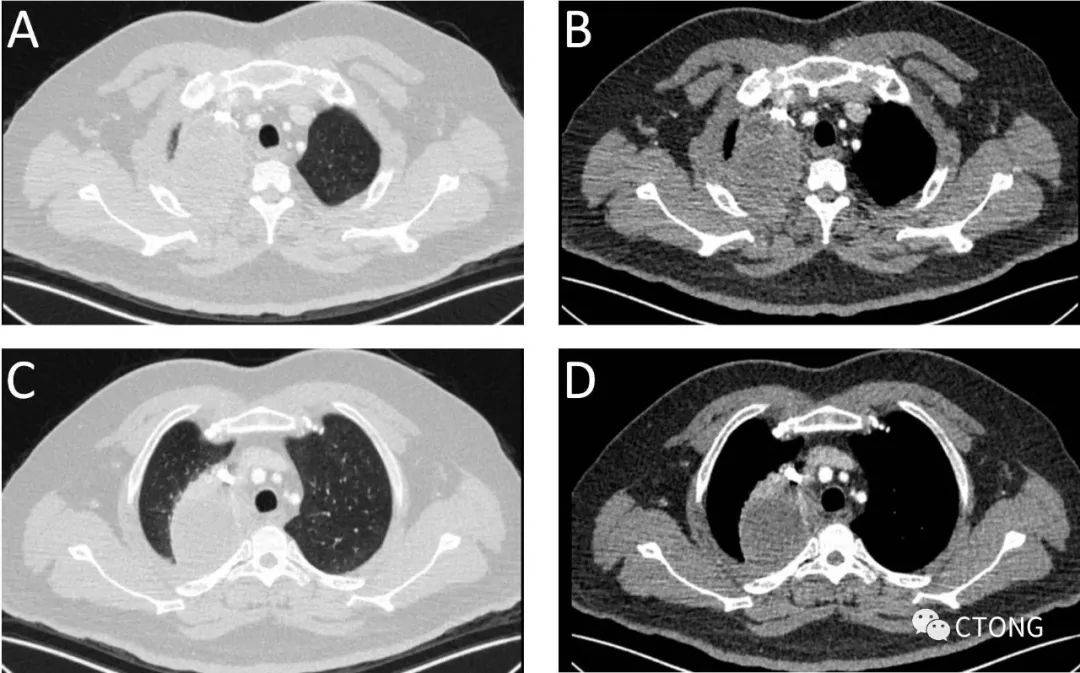
图1. 初诊时PET/CT所示右上肺肿瘤,肿瘤累及第二肋后缘(A,B),肿瘤下缘(C,D)
诊断:右上肺尖间叶源性肿瘤 cT4N2M0 IIIB期。
患者于2021年12月至2022年2月行“紫杉醇+卡铂+纳武利尤单抗”三周期治疗,治疗后胸痛症状缓解,复查PET,肿瘤缩小53.6%。
疗效评价:PR(图2,3),治疗前后NSE变化如图4所示。
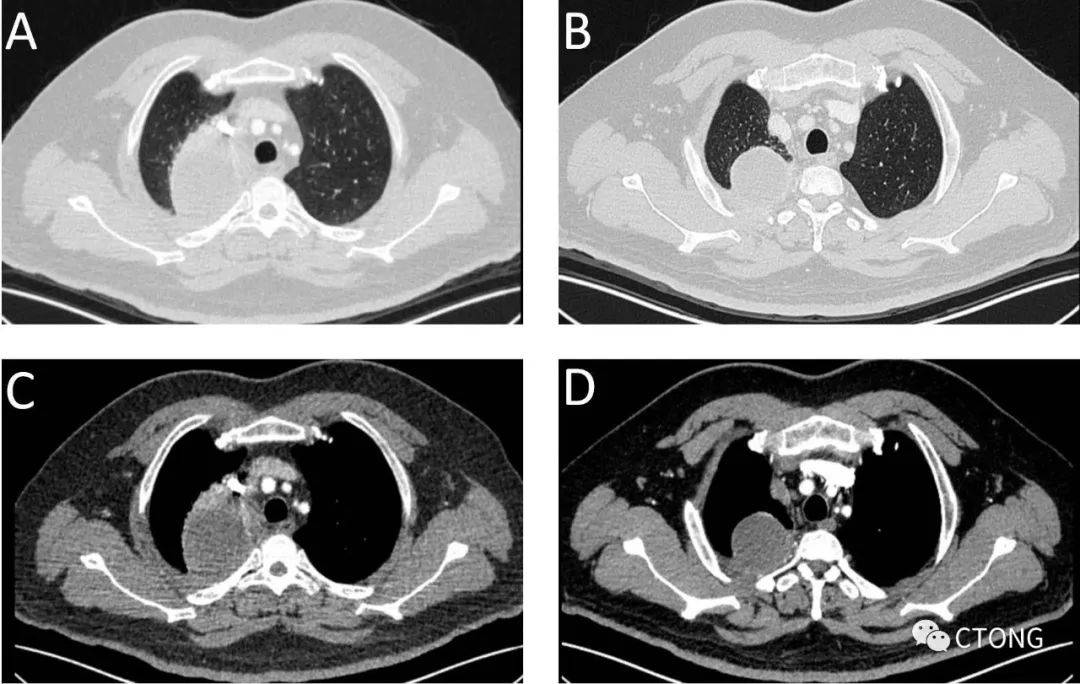
图2. 免疫+化疗治疗前后对比,肺窗(A,B),纵隔窗(C,D)

图3. 三维重建示肿瘤侵犯第二后肋,评估可手术切除

图4. 治疗前后NSE曲线动态变化
2022-03-04行右上肺叶切除+第二后肋部分切除+纵隔淋巴结清扫术,并行术中放射治疗(图5)。

图5. 术中探查示肿瘤累及胸顶后部(A),术中自肩胛下方切口置入放射源(B),患者肩胛下切口(C)
术后病理示:(右肺上叶)恶性肿瘤,肿瘤全部取材,仅见多灶小灶肿瘤细胞,肿瘤最大径约4.8cm;肿瘤未侵犯肋骨;清扫肺门纵隔淋巴结阴性;免疫组化结果:CK(-),Vimentin(-),CD68(灶性非特异着色),CD30(-),ALK(ALK1)(-),CD138(-),CD21(-),MPO(灶性非特异着色)。
特殊染色结果:粘液卡红染色(-)。术后病理疗效评价达MPR,术后一月复查,患者诉右侧肢体无汗,偶有疼痛,余无不适。

病史小结
患者,中年男性,2021年12月确诊:右上肺尖间叶源性肿瘤 cT4N2M0 IIIB期;
2021-12至2022-2月行“紫杉醇+卡铂+纳武利尤单抗” 三周期治疗,影像学疗效评价:PR(-53.6%),治疗后胸痛症状缓解;
2022-03-04行右上肺叶切除术(联合肋骨切除)+ 纵隔淋巴结清扫术 + 术中放射治疗;
术后病理疗效评价肿瘤达MPR,未见侵犯肋骨,切缘阴性,淋巴结阴性。
▶诊治时间轴

图6. 诊治时间轴

NO.2
病史补充
颜黎栩医生:
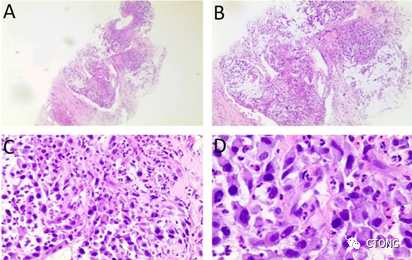
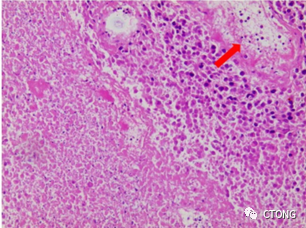
该患者2022年3月右肺上叶新辅助治疗后手术切除肿瘤最最大径4.8cm,共44张切片,其中有7张是有小灶的活性肿瘤细胞残留(图8),有活性的肿瘤细胞占比极低(图9)。

图8.
上图为代表性视野,左侧低倍镜下肿瘤有比较粗大的血管供血,有厚壁的动脉和薄壁的静脉(A),两个动脉之间可见小灶的活性肿瘤细胞,如箭头所示(B),高倍镜下血管之间的小灶活性肿瘤细胞,×200(C),肿瘤细胞细胞核核膜清晰,胞浆结构清晰完整,为活性肿瘤细胞,×400(D)。
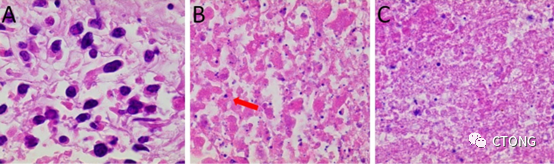
图9.
术后病理活性肿瘤细胞对比图,标准的活性肿瘤细胞,细胞核与胞浆结构均清晰可见(A),细胞内可见核固缩和核碎裂,可见点状核碎片,如箭头所示,仅存细胞轮廓(粉染胞浆)(B),更彻底的肿瘤细胞坏死,细胞轮廓已完全消失(C)。
对比观察可发现邻近血管周围的肿瘤细胞为新发坏死,距离血管越远,坏死发生的越早,说明肿瘤非常依赖于血液供应(图10)。
最后总结一下:该患者术后肿瘤组织切片共44张,其中7张存在活性肿瘤细胞,最终计算得到活性肿瘤细胞比例为0.5%,参考目前使用的非小细胞肺癌新辅助治疗的评价标准,本患者新辅助治疗疗效评价可达MPR(目前暂无肉瘤新辅助治疗疗效评价标准)。
杨衿记医生:
潘燚医生:
杨衿记医生:
杨学宁医生:
术前无淋巴结病理确认,N可能有降期,T无降期。主要看术中病理,从传统意义讲,该患者应切掉第一肋骨,本次术中见肿瘤明显缩小且距离第一肋骨距离较远,术后冰冻切缘也为阴性,所以保留了第一肋骨。

NO.3
病例讨论环节
问题一:针对此病例,肺上沟瘤新辅助治疗后疗效达到PR,下一步首选?
投票结果:
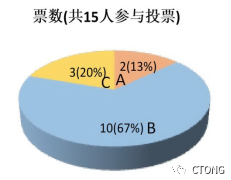
包勇医生:
我选择A放疗,首先,因为肿瘤最大径超过7cm,应该诊断为T4;其次,此患者术前未行MR检查,对于胸壁或肺尖部肿瘤一般应行术前MR检查,评估病灶具体范围,判断侵犯位置,这是我们放疗通常需要做的一步;最后,本次病例有特殊性,肺上沟瘤一般认为是肺尖部癌侵犯到胸壁,本患者病理诊断为肉瘤,那么肿瘤是起源于肺还是胸壁需要进一步去探索。
从化疗后肿瘤缩小情况及术中切除时胸壁的浸润情况来看,为肺起源的可能性会更大,对于肉瘤或软组织肿瘤,若为癌,则会做术前放化疗,但本病例特殊,先行新辅助化疗加免疫肿瘤明显缩小,再手术切除并术中放疗,我认为局部的处理是非常到位的,但是,对于肉瘤,扩大切除是一种治疗方式,借鉴肢体肉瘤的处理方式即扩大切除加术后放疗,本患者做了诱导化疗,手术切除时做了术中放疗,现在患者无明显残留,相当于R0切除,那么对于R0切除,再去做扩大切除的手术,可能对病人的创伤比较大,而通过局部的放疗,对于亚临床的病灶控制是可行的,所以个人认为术后放疗就可以解决问题。
赵明芳医生:
想请问病理专家,术后切片显示是纯肉瘤成分的间叶来源还是肉瘤样癌?新辅助化疗加免疫治疗后疗效为MPR,术后病理残留肿瘤细胞为0.5%,是非常好的结果,肉瘤中有一部分特殊病人PD-L1的表达会很高,那患者在治疗前后的PD-L1的表达如何?
颜黎栩医生:
本患者治疗前肺穿刺活检标本和手术标本病理形态均为梭形细胞的形态,做了多个上皮标记包括CK、CAM5.2和EMA等,均为阴性,所以支持肉瘤诊断而不是癌,PD-L1表达为阴性。
吴一龙医生:
想请教包勇医生,你选择术后放疗,这个病人术中已经做了放疗,你认为术后还要做放疗吗?
包勇医生:
因为术中放疗使用的是蔡司光子射线照射技术,体表剂量深度较浅,通常不超过5mm,所以很多时候是外照射和术中放疗互相结合的,术中放疗单次的大剂量主要集中在手术的切缘表面,如果肿瘤继续往椎管、椎体或胸壁浸润,外照射会比术中放疗更可靠。
吴一龙医生:
本例患者病理结果显示:肿瘤残留非常少,我同意你的观点,有一些病例需要术后加放疗,特别是肿瘤残留,但是对于这个患者,肿瘤残留非常少的情况下,你还是认为要做术后放疗吗?
包勇医生:
我还是认为要做术后放疗,因为肿瘤往外浸润的情况以及是否还有残留,我们是不清楚的,如果一定要做胸壁的扩大切除术来证实是否还有浸润也是可行的,但创伤会比较大,并不是因为肿瘤有明显残留才去做辅助治疗,而是因为有可能会有更深的浸润,所以做辅助治疗去增加局部控制的把握。
陈建华医生:
我觉得术前的新辅助治疗是不能达到根治目的的,所以术后的放疗是有必要的。
周蓉蓉医生:
像这种肉瘤患者我们一般会做术前的新辅助放疗,再去手术,我们医院暂时没有术中放疗设备,如果需要肋骨切除,我们会先做术前放疗,因为术前放疗比较好勾画靶区,其次如果没有手术,肿瘤血运良好,放疗会比较敏感,所以我可能会选择术前放疗。
韩光医生:
我也是比较支持包勇医生的意见,这种蔡司术中放疗照射范围一般用于胃肠道肿瘤或者乳腺肿瘤,因为主要针对残留区,但这个患者属于肉瘤,外放范围比较大,不仅是靶区,如靠近肋骨,那么术后病理仅取部分点活检,不可能在大范围内都看见肿瘤侵犯程度,所以,一般肉瘤比较支持术后放疗,也比较推荐术前同步放化疗。
刘春玲医生:
我选择B,本患者肿瘤部位虽在肺尖部,但病理类型为肉瘤,新辅助治疗是按照非小细胞肺癌来治疗的,所以想请教一下,这种情况应该按照肉瘤的诊疗规范还是肺癌的诊疗规范进行诊治?
吴一龙医生:
肺上沟瘤是非常特别的,没有限制必须是鳞癌或者腺癌才是肺上沟瘤,肺上沟瘤的定义是发生在锁骨切迹范围的、侵犯肋骨的肿瘤都是肺上沟瘤,所以肺上沟瘤可以包括各种各样的病理类型,非小细胞肺癌中除了常见的腺癌和鳞癌之外,有一些不是腺癌和鳞癌的肿瘤发生在肺的时候,也可以称为非小细胞肺癌,所以这个患者应作为肺癌来进行处理。
潘燚医生:
(3)根据术后病理考虑,术中已经做了放疗,所以我认为术后没有必再做放疗。
赵明芳医生:
我选择B,本患者肿瘤为单纯间叶来源的肉瘤样低分化/微分化肿瘤,初诊分期为T4N2,对于肺上沟瘤,新辅助放化疗或新辅助化疗加术后放疗,这两种治疗方式的总体生存率OS没有差别,但是对于肉瘤样癌则无类似的研究,本患者为特殊病例,我认为其主要的获益可能来自于免疫治疗,我们也做了一些病例收集,观察到一些肉瘤样癌的患者对单药免疫或免疫加化疗是可以获益的,此外,NCCN指南对于T3/4局部外侵肿瘤手术的标准是受累结构的整块切除及边缘阴性,所以我认为切除比放疗的疗效更确切。
杨衿记医生:
本患者病理诊断为肉瘤,而不是肉瘤样癌,所以与肉瘤样癌的诊疗措施可能不一致。
范朝晖医生:
我认为应该保留肋骨,第一,如果术中病理能够证实肋骨骨膜未受侵犯,术后病理也是MPR的话,再切除局部肋骨是没有必要的,尤其是加了术中放疗后,所以用另外一个局部治疗手段结合肺叶切除,是更合理的,术后放疗也是可行的。
C. 不确定
投票结果:
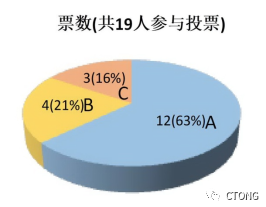
郭卉医生:
我选择影像学观察,更多的是考虑排他性的选择方式。首先,肉瘤整体免疫治疗的获益还不是很确定,前期的一些研究显示免疫治疗在骨肉瘤和其他未分化肉瘤中的有效率是非常低的,本患者新辅助治疗的疗效是来自于化疗还是免疫治疗,这一点还不是非常确定,这是我不选择免疫治疗维持的原因;其次,患者新辅助治疗的疗效达到了MPR,且进行了扩大的根治性切除,目前对未分化肉瘤的术后辅助治疗没有一个标准的方案,也不能确定辅助治疗一定能为患者带来获益,所以我选择影像学观察。
刘春玲医生:
我也选择影像学观察,我与郭医生意见相同,按照目前软组织肉瘤的诊疗规范,本患者已经做了新辅助化疗和手术扩大切除及术中放疗,所以应该进行影像学观察,虽然基于CheckMate-816来看,新辅助免疫联合化疗是可以做的,根据患者获益情况,术后免疫也是可以考虑的,但是CheckMate-816是针对原发性肺癌,肺癌的定义是发生于肺支气管黏膜或腺体的恶性肿瘤,所以本患者可能还是要按照肉瘤的诊疗规范来治疗,所以选择影像学观察。
范朝晖医生:
我选择不确定,不可否认前期新辅助治疗的疗效,但应该搞清楚前期新辅助的疗效是来自于化疗还是免疫治疗,在我接触的患者中,前期化疗加免疫治疗时,病人处于高免疫应答状态,这种情况下,术后病理可以看到瘤床中间大量充斥着炎性细胞,本患者术后病理分析并未见此情况,所以本患者疗效获益可能主要来自于化疗,未必是免疫治疗,所以不支持免疫维持治疗,需要进一步展示瘤床中炎性细胞浸润的病理结果再做决定,如果瘤床中存在大量的炎性细胞,那么可以确定前期的获益主要来自于免疫治理,在这种情况下,术后免疫维持治疗是比较合理的。
颜黎栩医生:
本例患者首诊和术后病理结果均显示较低的淋巴细胞浸润,肿瘤瘤床内未见淋巴细胞浸润,瘤床周围有少量的泡沫状细胞和纤维母细胞,为反应性的肿瘤细胞坏死后吞噬细胞碎片而产生的,所以,从病理学角度推测,前期新辅助获益可能主要来自于化疗。
范朝晖医生:
基于病理科医生的补充,我认为术后免疫维持治疗不是一个很好的策略,术后放化疗可能是一个更好的选择。
C. 不确定
投票结果:
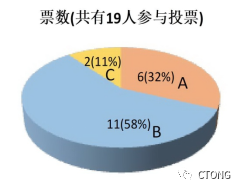
包勇医生:
我选择不确定,对于软组织肿瘤,有回顾性研究结果表示,放化疗加手术治疗疗效是最好的,本患者病理诊断为肉瘤,是软组织肿瘤的一部分,根据刚刚的病理评估淋巴细胞浸程度,推断新辅助获益可能主要来自于化疗;软组织肿瘤除了局部复发还有高转移的风险,虽然术后MRD为阴性,但是不能排除风险,所以个人建议是否需要更充足的化疗方案,选项里没有这个选项,所以我选择不确定。
刘春玲医生:
基于IMpower010临床试验的结果来看,MRD阴性的患者治疗与不治疗的效果都比MRD阳性的患者结局好,在MRD阴性的患者中,治疗组和观察组间有差别,但是HR值未达到阳性结果,所以本患者继续给予免疫治疗的获益不大,应该影像学观察。
杨学宁医生:
患者病理诊断为肉瘤,在新辅助化疗加免疫治疗后疗效达到MPR是很少见的,虽然病理结果推断肿瘤可能在免疫治疗下未见很明显的获益,对于这个患者而言,一旦复发,没有很好的二线治疗方案,所以我认为给予毒性较小的免疫维持是可以接受的方案。
吴一龙医生:
那么MRD阴性和阳性都要免疫维持治疗,是不是就不需要再做MRD的检测呢?
杨学宁医生:
我认为至少对于肉瘤而言可以这样做,MRD目前在肉瘤里的预后价值证据较少,一旦失败,后果更严重,患者目前治疗可以获益且毒性较小,所以可以继续维持免疫治疗。
潘燚医生:
我选择B,目前在肺癌、结肠癌甚至所有肿瘤里面MRD阴性的患者预后都非常好,生存率接近90%,和MRD阳性的患者有明显差别,所以MRD是一个非常好的预后因素,这个患者如果术后MRD阴性,那么他可能不能从后续治疗获益,本身预后就很好,不易复发,所以我选择继续影像学观察。
C. MRD动态监测
投票结果:

赵明芳医生:
如果术后MRD阳性,我会选择继续免疫维持治疗,肉瘤的亚分类是非常复杂的,要做后续的分子分型,肉瘤对化疗的疗效并不是非常好,化疗药物以蒽环类为主,跟肺癌化疗药物交叉很少,但是腺泡样的软组织肉瘤免疫治疗的效果较好,所以这个患者在前面的治疗获益较好且MRD阳性的情况下,可以选择免疫治疗,MRD阴性可以选择影像学观察。
范朝晖医生:
我选择不确定,基于术后病理结果,个人认为前面的获益可能更多的来自于化疗而非免疫治疗,MRD是否可以准确的判断预后,前期MRD研究均为小样本,所以我认为还不能够完全用MRD的观点来衡量这个病例。
吴一龙医生:
目前,我们只能说MRD是一个非常明显的预后因子,预测因子只体现在MRD阳性的病人,综合来讲,虽然有争论,但是根据这些数据资料,我们可以得出非常明显的三个结论:1.新辅助化疗免疫治疗加手术后,达到了完全切除,N降期,治疗可以到此为止,后面可以继续观察;因此再结合MRD结果,若患者术后MRD为阴性可考虑继续影像学观察;2.若患者术后MRD为阳性,则需要进一步的辅助治疗。
△上述内容由讨论现场录音整理,经与会专家确认

NO.4
MDT小结

该病例采用新辅助免疫化疗+手术和术中放疗,总体上治疗策略合理、成功。建议监测MRD状态,若MRD一直保持阴性,则继续影像学观察随访,若MRD阳性,则继续免疫维持治疗。

参考文献:
[1] Rusch, Valerie W. “Management of Pancoast tumours.”The Lancet. Oncology vol. 7,12 (2006): 997-1005. doi:10.1016/S1470-2045(06)70974-3
[2] Kunitoh H, Kato H, Tsuboi M, et al. Phase II trial of preoperative chemoradiotherapy followed by surgical resection in patients with superior sulcus non-small-cell lung cancers: report of Japan Clinical Oncology Group trial 9806 J Clin Oncol. 2008;26(4):644-649.
[3] Kernstine KH, Moon J, Kraut MJ, et al. Trimodality therapy for superior sulcus non-small cell lung cancer: Southwest Oncology Group-Intergroup Trial S0220. Ann Thorac Surg. 2014;98(2):402-410.


文稿整理 | 高玲玲(广东省肺癌研究所)
指导 | 董 嵩(广东省肺癌研究所)
责编 | Icy
以上信息转自CTONG官方微信平台
-End-











 苏公网安备32059002004080号
苏公网安备32059002004080号


