我依稀记得,当年我刚入门肺癌的时候,我的老师针对肺癌发病,给了我一个非常形象的比例,就是1比1比1。
就是如果把全部初诊肺癌患者分为三份?
那么有1份是早期肺癌,可以直接手术;
有1份发生了局部进展,虽然做不了手术,但可以做放化疗;
有1份发生了远处转移,连放化疗都做不了,只能做化疗。
但是经过多年推广的肺癌筛查活动,现在早期肺癌的比例越来越多。
2022年第十一届广州肺癌论坛上,天津市胸科医院胸外科主任张逊教授就分享了这么一组数据,即在可手术肺癌患者1958例中,病理一期占比59.1%。
其中,IA期占比41.9%,IB期占比16.7%。
不知不觉间,早期肺癌已经成为最大的那个群体。
毫无疑问,肺癌发现越早,效果越好。
在多年和早期肺癌相持的过程中,我们也逐渐反思,是否必须要采用最传统的肺叶切除进行治疗。
毕竟因为一个一两厘米的癌结节就切掉整个肺叶,确实有点于心不忍。
那到底能不能在确保疗效的情况下,实现最大程度的肺功能保留呢?
于是我们有了JCOG系列研究,发现在基于肿瘤最大径与实性成分百分比筛选的合理人群,开展亚肺叶切除也是完全可以保证疗效的。
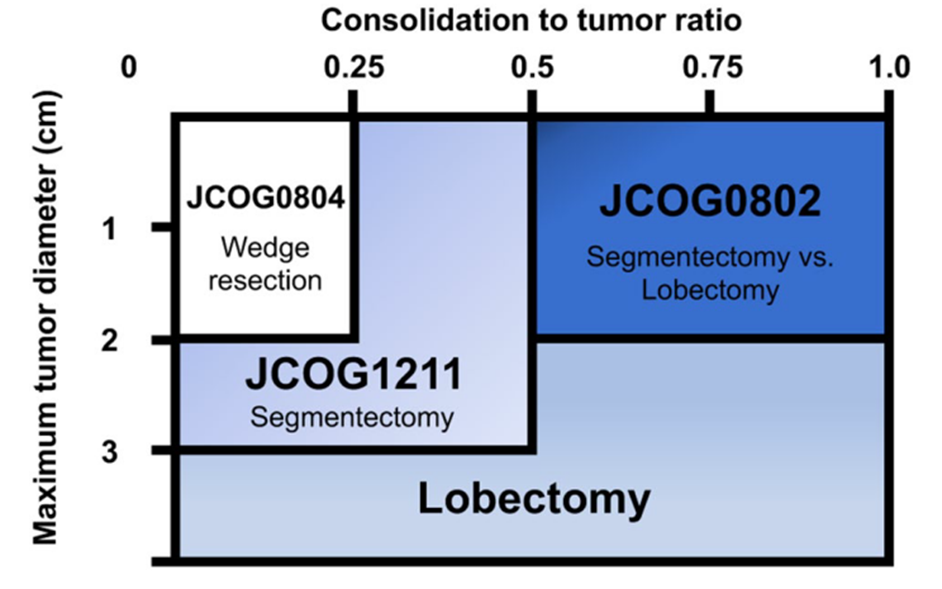
这时,就有人会问这么个问题:
面对早期肺癌,如果亚肺叶切除可以保证疗效,那热消融是不是也可以?
于是我今天来尝试分析一下。
研究分享
#1 2020 <Int J Hyperthermia>

第一个研究是2020年发表于国际热疗杂志的一项回顾性研究,探讨磨玻璃肺癌在微波消融治疗下的有效性。
研究纳入103个磨玻璃结节,其中,纯磨玻璃84枚,混合磨玻璃结节19枚,全部采用微波消融进行治疗。
最终,在平均18个月的随访期内,没有发生局部进展或复发。
#2 2020 <J Interv Med>

第二项研究是2020年发表于介入医学杂志上的一项回顾性研究。
已经纳入20个磨玻璃肺癌,采用热消融治疗(包括微波和射频),最终,在平均16个月的随访期内,没有发生肿瘤的局部进展或复发。
#3 2014 <J Vas Interv Radiol>

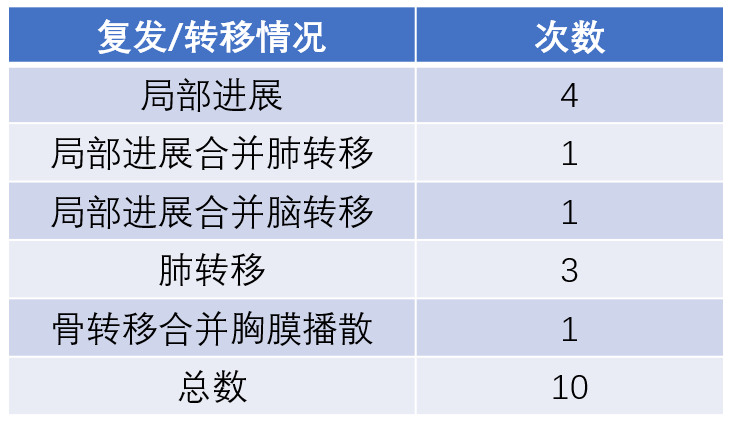
第三项研究是2014年发表于血管与介入放射学杂志的一项回顾性临床研究。
研究纳入33名患者携带42枚磨玻璃为主型肺结节(14枚纯磨玻璃,19枚混杂磨玻璃),采用射频消融进行治疗。
最终,在平均42个月的随访期内,有6个肿瘤出现了局部进展,其中四枚通过再次的消融治疗得到控制。
直至随访结束,33名患者中,有31名没有肿瘤迹象。
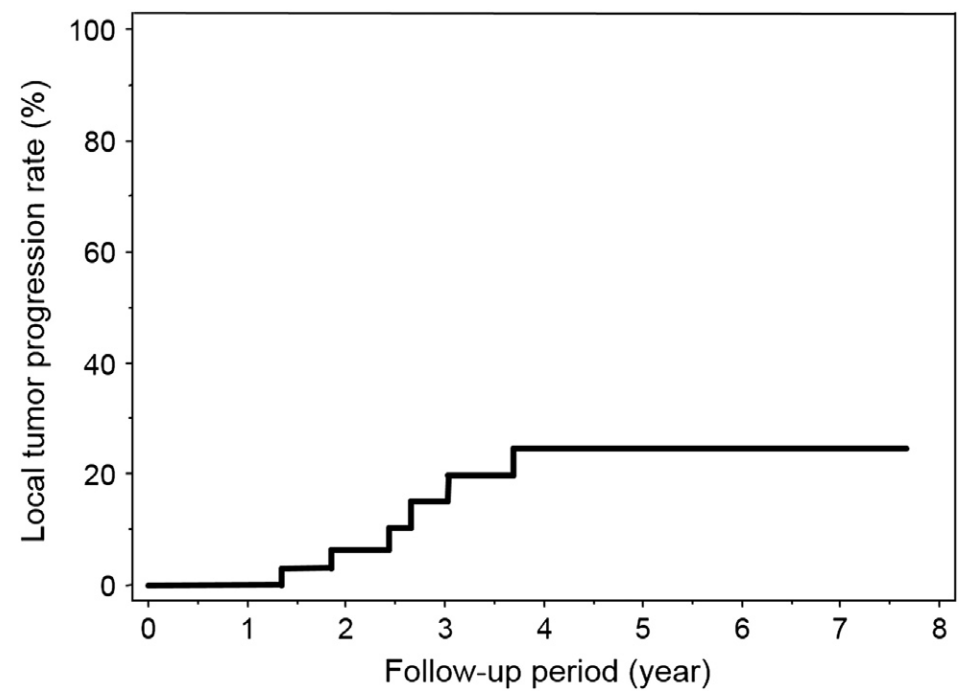
基于患者复发绘制的复发曲线显示,总体患者的1年复发率0%,3年复发率15.1%,5年复发率24.5%。
#4 2020 <J Vas Interv Radiol>

第四项研究是2020年发表于,血管与介入影像学杂志的一项回顾性研究。
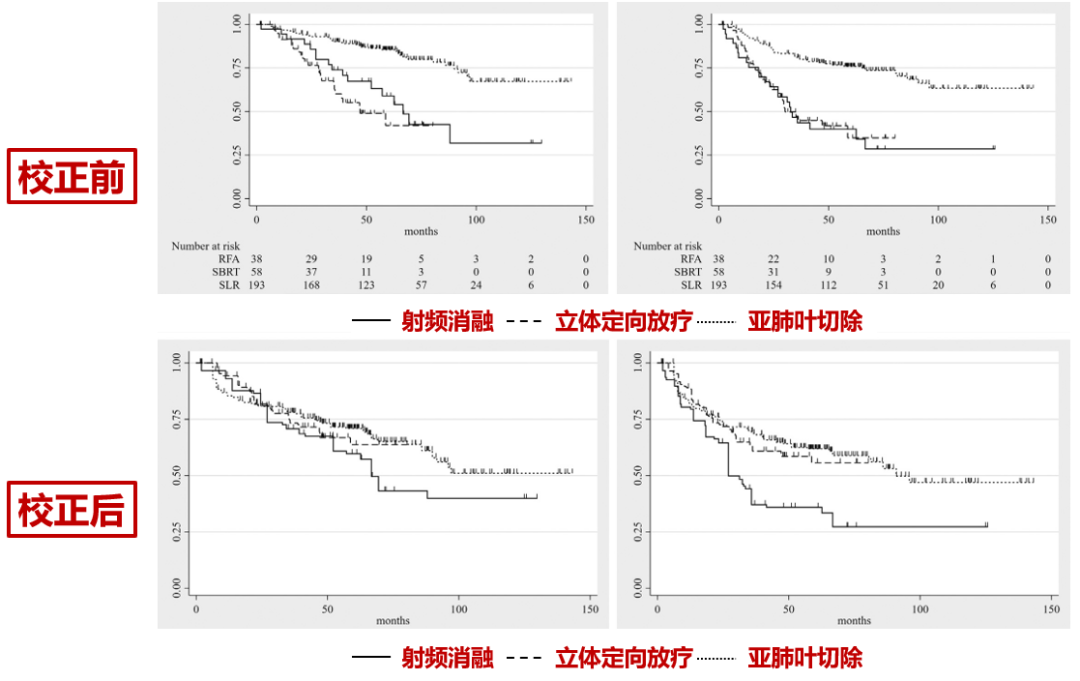
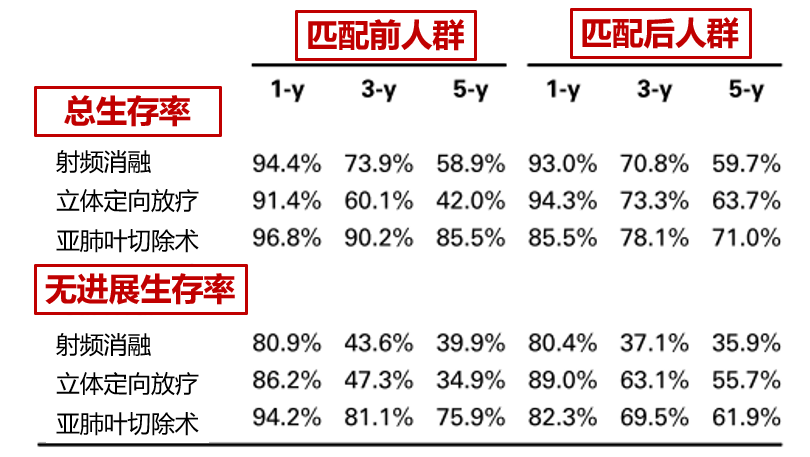
研究纳入289名临床I期非小细胞肺癌患者,其中,193名给与亚肺叶切除,58名给予立体定向放疗技术(SBRT),38名给予射频消融。
旨在是比较不同治疗手段的远期疗效。
在随访时间方面,手术组平均分发时间53个月,立体定向放疗平均随访40个月,射频消融术平均随访时间53个月。
生存分析显示,手术组的疗效普遍优于立体定向放疗和射频消融。
5年生存率:手术 vs 立体定向放疗 vs 射频消融=85.5% vs 42.0% vs 58.9%;
5年无进展生存率:手术 vs 立体定向放疗 vs 射频消融=75.9% vs 34.9% vs 39.9%
但后续的比较发现,组间基线并不匹配。
相比手术治疗组,接受立体定向放疗和射频消融的患者一般状况更差,而且肿瘤更大。
于是,作者基于倾向性评分匹配,对三组患者的基线进行了校正。
校正后发现,手术依然代表着最好的五年生存率和无进展生存率,但是组间的差异已经没有那么明显。
5年生存率:手术 vs 立体定向放疗 vs 射频消融=71.0% vs 63.7% vs 59.7%;
5年无进展生存率:手术 vs 立体定向放疗 vs 射频消融=61.9% vs 55.7% vs 35.9%
热消融技术存在的问题
热消融技术毫无疑问是一种非常有效的局部治疗手段,可以实现良好的肿瘤控制效果。
但是跟手术相比,这个技术不论在临床开展还是数据研究,都比较局限。
热消融技术,依然存在诸多问题亟待解决。
这里面首当其冲的就是,到底是什么在影响着热消融技术的治疗效果。
#5 2022 <J Vas Interv Radiol>

2022年10月发表于血管与介入放射学杂志上的一项研究,就指出太小的消融边界距离会干扰射频消融术的治疗效果。
研究中,作者指出,针对射频消融患者,在消融后应该立即开展CT扫描以观察他们的消融有效范围。
因为消融治疗后往往会导致肺组织充血而形成CT上的磨玻璃表现。此时,若磨玻璃范围完整的包绕肺结节,可以认定消融完全;而若磨玻璃范围不能完整包绕肺结节,则认定消融不完全。
所谓消融边界距离,就是消融后的磨玻璃边界和肺结节边界之间的最小间距。
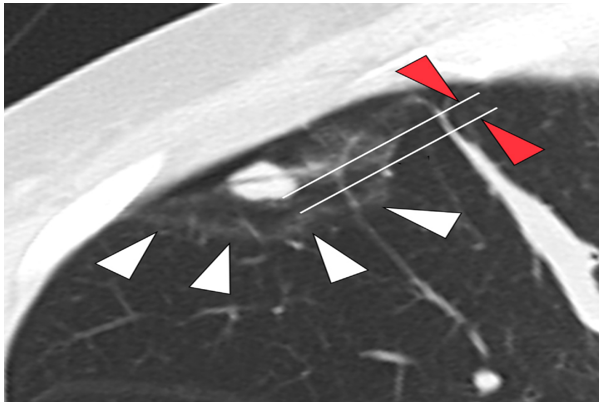
基于此定义,作者纳入接受射频消融治疗的肠癌肺转移患者进行分析。
发现在纳入的95名患者中,在消融后的6到19个月之间,有6例出现了局部复发。
进一步的分析发现,较小的消融边界距离是导致他们复发的关键所在。
在切缘距离不足2毫米的群体中,局部的复发率将明显增高,而多因素的分析也进一步证实了这个观点。

#6 2018 <Int J Hyperthermia>
另一项研究是2018年发表于国际热疗杂志上的一项真实世界研究。
研究纳入68例已经提前知道病理类型的非小细胞肺癌患者,其中I-IIIA期35例,IIIB-IV期33例。
在微波消融后立即开展粗针穿刺病理组织活检,并将穿刺病理与提前揭晓的组织病理进行匹配,基于匹配结果分为四个亚组。
A组,穿刺取到相同的组织学类型(n=19)。
B组,穿刺取到贴近的组织学类型,但伴有烧灼后的组织降解表现(n=28)。
C组,穿刺组织无法确定具体病理类型(n=41)。
D组,穿刺组织明确未见癌细胞(n=10)。
最终分析发现,D组患者生存时间最长,中位无进展生存时间为26.6个月,中位总生存时间为29.8个月。
而其他患者(A+B+C组)中位无进展生存时间只有11.7个月,中位总生存时间只有15.9个月。
尽管受限于D组患者较小的样本量,最终的差异未达统计学意义(P=0.395),但这个研究无疑给我们一个很好的反思,即肿瘤消融治疗后的病理反应是否也会影响治疗效果。
而如果这个假定是存在的,那我们又用什么手段去确保每次消融都能达到那种最佳的病理反应状态呢?
毕竟,消融不同于手术,治疗以后的病灶依然长存于体内。
第二个问题是,早期肺癌的热消融技术的效果是否足够可靠。
针对这个问题,对应证据是前文提到的,编号为1、2、3的临床研究。
尽管在前两篇2020年发表的研究中,都发现热消融可以在磨玻璃结节群体中取得非常满意的治疗效果,截至末次随访无一例复发,但这背后可能源自其较短的随访周期(平均随访时间,No.1-18个月,No.2-16个月)。
而当随访时间延长以后,在第三篇2014年发表的那项研究中,42个磨玻璃肺癌采用热消融技术,有6枚肿瘤出现局部进展,3年复发率15.1%,五年复发率24.5%(平均随访时间,42个月)。
从目前来看,要确定热消融技术在早期肺癌的具体疗效,我们还需要更多的临床数据,尤其是多中心、长随访的前瞻性临床研究。
第三个问题,早期肺癌热消融技术能否实现跟手术相当的治疗效果。
在这个问题目前没有头对头的临床对照研究,但从前面分享的编号为4的那项研究中,我们可以窥得一二。
那项研究中,作者纳入289名临床I期非小细胞肺癌患者,分别给予亚肺叶切除术、立体定向放疗(SBRT)和射频消融治疗。
在相对较长的随访间期后,比较了三种治疗手段的远期疗效。
数据显示,在总体患者中,手术依然代表着最优的治疗效果
5年生存率:手术 vs 立体定向放疗 vs 射频消融=85.5% vs 42.0% vs 58.9%;
5年无进展生存率:手术 vs 立体定向放疗 vs 射频消融=75.9% vs 34.9% vs 39.9%
即便在匹配后的患者中,手术的治愈率依然最高。
5年生存率:手术 vs 立体定向放疗 vs 射频消融=71.0% vs 63.7% vs 59.7%;
5年无进展生存率:手术 vs 立体定向放疗 vs 射频消融=61.9% vs 55.7% vs 35.9%。

第四个问题,微波和射频应该如何选择。
微波和射频,都是热消融的有效方式,都是通过诱导凝固性坏死的方式使细胞死亡。
在技术层面,两者存在诸多区别:
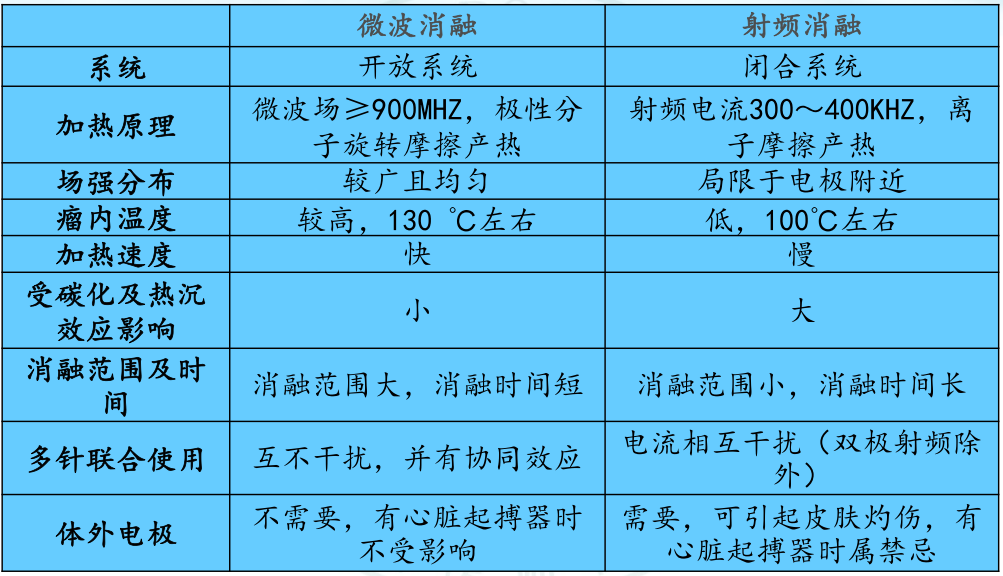
从研究数据来看,在编号#1研究中,总共有103个磨玻璃结节,采用微波消融,最后在18个月随访期内没有复发;
而在编号#3和#4研究中,针对磨玻璃肺癌采用射频消融治疗后,在较长的随访周期内,都出现了复发事件。
从技术层面看,微波消融可以在更段时间凝集更大的能量,也似乎更有助于杀灭核心区肿瘤细胞。
但是,在2017年<肿瘤靶点(Oncotarget)>研究中,曾有研究者回顾分析了2007年接受热消融治疗的75名肺部肿瘤患者资料,包括射频消融术43例和微波消融32例。比较发现,两种治疗手段在肿瘤退缩率、总生存期和无进展生存期方面,并无明显差异。
所以,尽管有一系列研究提示微波消融比射频消融更具优越性,但截至目前,尚无有效的临床数据可以证实该观点。
热消融技术的专家共识
2021年5月,《中国肺癌杂志》刊载了《热消融治疗肺部亚实性结节专家共识(2021版)》,描述了热消融治疗的适应人群和禁忌状况。
共识指出,针对周围型磨玻璃结节患者,在出现以下情况后,可以考虑采用热消融技术:1.因心肺功能差或高龄无法耐受手术;2.本身拒绝手术治疗; 3.手术切除以后又出现新的病灶或遗漏病灶,患者无法耐受再次手术或拒绝再次手术;4. 多发磨玻璃结节;5. 各种原因导致的重度胸膜粘连或胸膜腔闭锁;6. 一侧肺缺如;7. 重度焦虑经心理或药物治疗无法缓解。
共识指出,在出现以下情况后,禁忌开展热消融技术:1. 血小板<50*10^9/L; 2. 有严重的出血倾向、短期内不能纠正的凝血功能障碍(凝血酶原时间大于18秒,凝血酶原活动度小于40%);3. 严重的肺纤维化和肺动脉高压;4. 抗凝治疗和或抗血小板药物在消融前停用未超过5~7天,贝伐珠单抗末次使用间隔未超过1个月。
写在最后

毫无疑问,热消融技术是一个充满光明发展前景的技术。
其优异的肺功能保护和良好的局部控制效果,让他们可以成为,很多因各种原因而无法接受手术治疗的人群的,备选治疗选择。
但我们也应该看到,热消融技术还需要进一步的成熟。
在这个过程中,它还要堆砌更多的临床数据,积累更多的临床经验,摸索更加透明的可量化的评估标准。
她是一颗坚硬的子弹,可以射穿任何铠甲。
但要把她射准,我们需要更加娴熟的技能训练,更加稳定的枪身构造,以及更加可靠的瞄准准心。












 苏公网安备32059002004080号
苏公网安备32059002004080号


