“泌见前腺”是由默沙东医学部发起,国内外泌尿、肿瘤、放疗、影像、核医学等多学科专家共同参与,针对泌尿肿瘤领域前沿进展和临床热点问题,进行沟通、讨论、分享和展示的线上平台。该平台依托丰富的学术和领域资源,与各位专家一起驱动泌尿肿瘤诊疗的标准化和全程管理,为广大青年医师提供广阔的学习空间,造福更多的中国患者。
2022年前尿路上皮癌治疗领域已有多项重要研究公布结果,推动不同疾病阶段的治疗模式改变。本期专题特邀北京医院泌尿外科张耀光教授和马宏教授盘点尿路上皮癌治疗进展并展望未来探索方向。
专家简介
北京医院泌尿外科副主任
中华医学会泌尿外科分会(CUA)尿控学组委员兼秘书
中国医师学会神经调控委员会泌尿脏器功能调控学组副组长
中国医师协会内镜医师分会第一届泌尿腔镜专业委员会(学组)委员
北京医学会泌尿外科分会尿控学组副组长
《中华泌尿外科杂志》、《现代泌尿外科杂志》 通讯编委,《泌尿外科杂志(电子版)》 编委
北京医院泌尿外科副主任医师
北京肿瘤防治研究会泌尿肿瘤委员会副主委
北京抗癌协会泌尿肿瘤青年委员
北京中西医结合男科分会青年委员
中国研究型医院学会泌尿及男科冲击波学组委员
北京大学医学部优秀教师
台大医院,柏林夏洛蒂医院访问学者
免疫治疗年度盘点
近年来,尿路上皮癌治疗方案正在快速演变,免疫治疗为化疗不耐受患者带来更多治疗选择,在膀胱癌不同疾病阶段均展示出出色的治疗潜力。免疫治疗在尿路上皮癌中的优势患者人群选择,不同疾病阶段的应用,如何与其他药物联合应用等问题仍有待研究进一步探索。
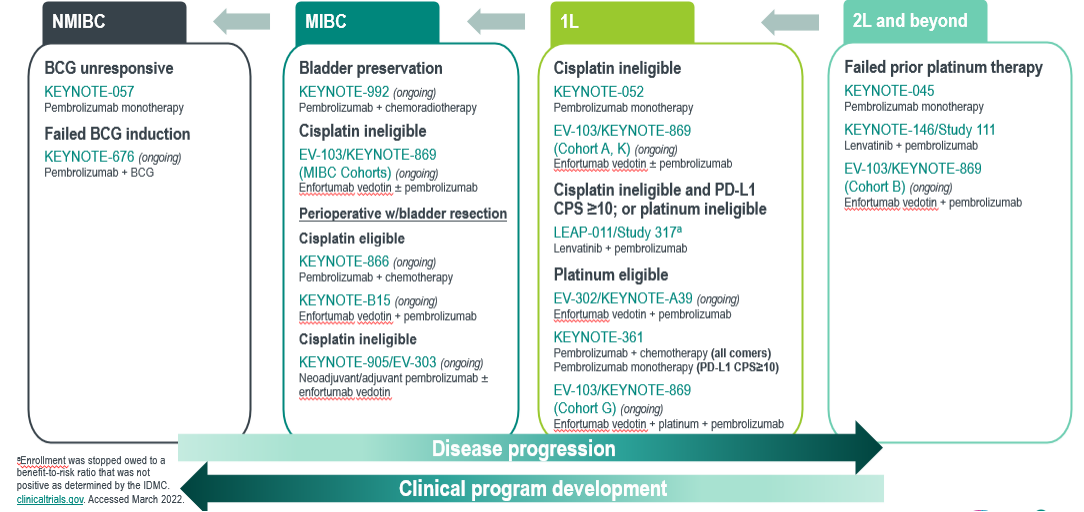
帕博利珠单抗在尿路上皮癌研究布局
1. 帕博利珠单抗一线治疗晚期尿路上皮癌KEYNOTE-361和 KEYNOTE-052研究的汇总事后分析[1] [2]
KEYNOTE-361研究是一项比较帕博利珠单抗单药或联合铂类药物化疗 vs 单独化疗一线治疗晚期尿路上皮癌患者的全球、随机、开放的3期临床试验。KEYNOTE-052则是使用帕博利珠单抗单药一线治疗顺铂不耐受的局部晚期或转移性尿路上皮癌患者的2期临床试验。在今年ASCO-GU大会上研究者对这两项研究进行了汇总事后分析。汇总人群中位总生存期为12.5个月(95% CI 11.2-14.6),两年生存率为34.2%。分析结果显示,在治疗起始9周时获得完全应答(CR)和部分应答(PR)的患者中位整体生存期达51.4个月,疾病稳定(SD)的患者中位生存期为17.5个月,而第9周出现疾病进展(PD)的患者整体中位生存期仅为5.9个月。在治疗9周时获得客观缓解(CR或PR)与帕博利珠单抗在晚期尿路上皮癌治疗的长期生存获益显著相关。此外,多变量分析还发现了多个因素,如PD-L1阳性状态(CPS≥10),仅淋巴结转移,更好的ECOG PS评分,与更好的生存获益结局相关。
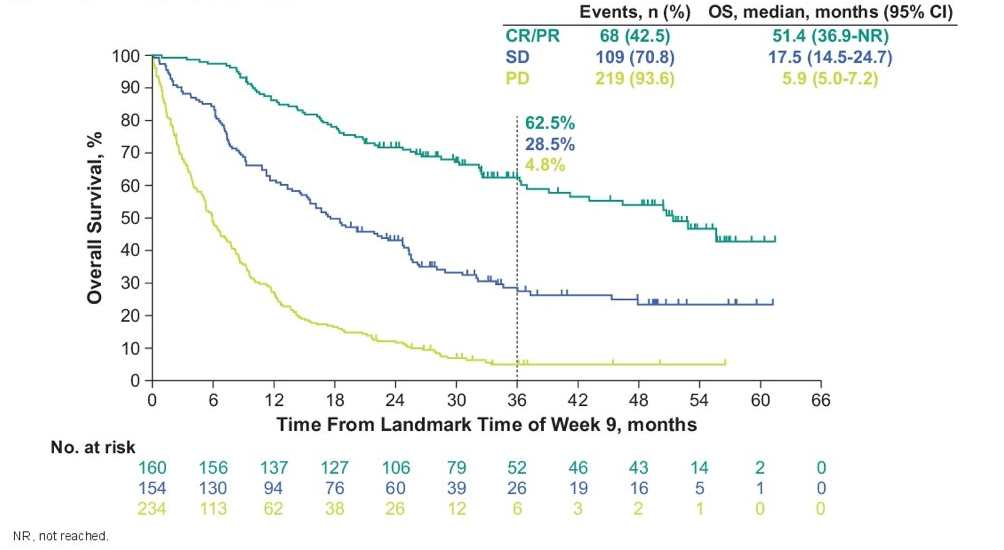
根据第9周客观缓解对患者进行整体生存分层分析
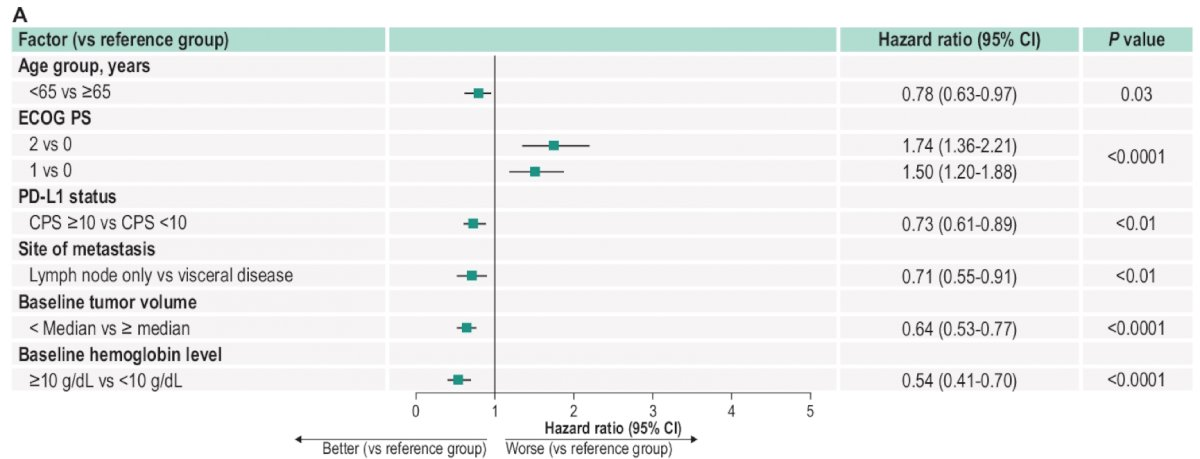
多变量分析显示多个独立因素与改善OS显著相关
2. KEYNOTE-052研究:帕博利珠单抗一线治疗局晚/转移性尿路上皮癌的健康相关患者生存质量(HRQoL)数据更新[3]
KEYNOTE-052是一项2期研究,旨在评估帕博利珠单抗单药一线治疗顺铂不耐受的局部晚期或转移性尿路上皮癌患者的疗效和安全性。研究结果显示,主要终点客观缓解率为: ORR为28.9%,中位整体生存为11.3个月,在PD-L1表达CPS≥10的患者中ORR达47.3%,OS达18.5个月[4]。今年该研究更新了其健康相关患者生存质量(HRQoL)数据。结果显示自第9周后,患者EORTC QLQ-C30 GHS/QoL生活质量评分(24.5%)和EQ-5D VAS体能状态评分(39.2%,图中未表现)均有较基线明显改善,另有39.9%和23.1%的患者分别处于上述评分的稳定状态。
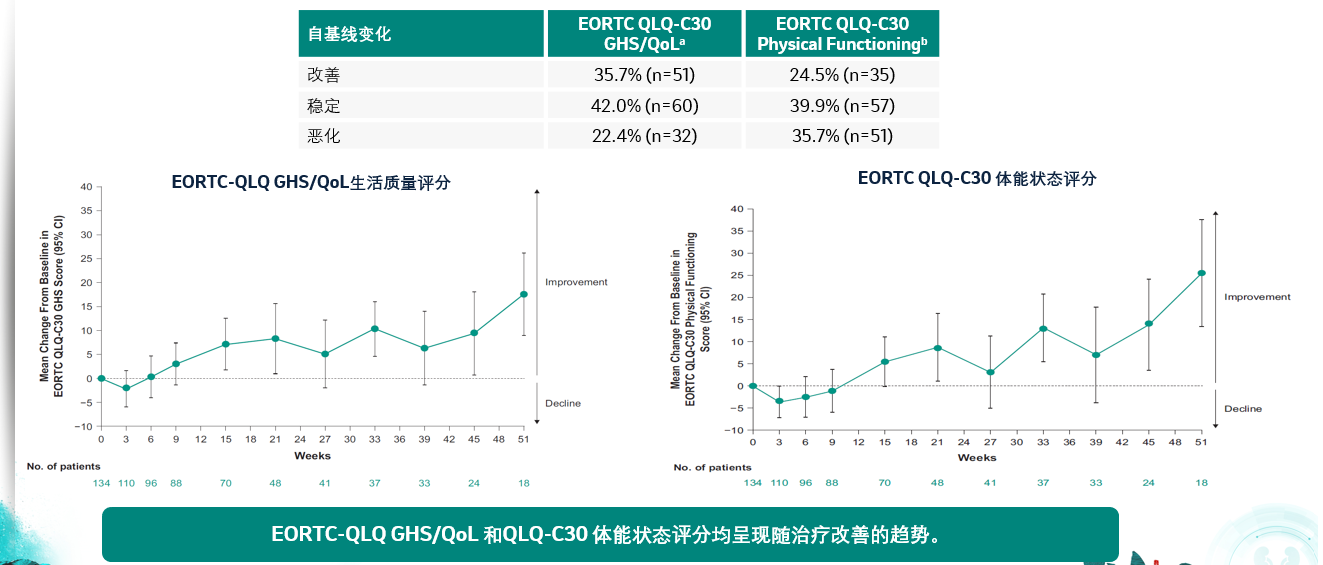
生活质量和体能状态均随帕博利珠单抗治疗进行改善
在KEYNOTE052联合LEAP-011研究(帕博利珠单抗在铂类不耐受尿路上皮癌)的合并分析中显示[5]无论铂类化疗不耐受标准如何,转移性尿路上皮癌对帕博利珠单抗单药治疗均有应答,各亚组的中位OS及安全性基本一致,且与总人群相似。

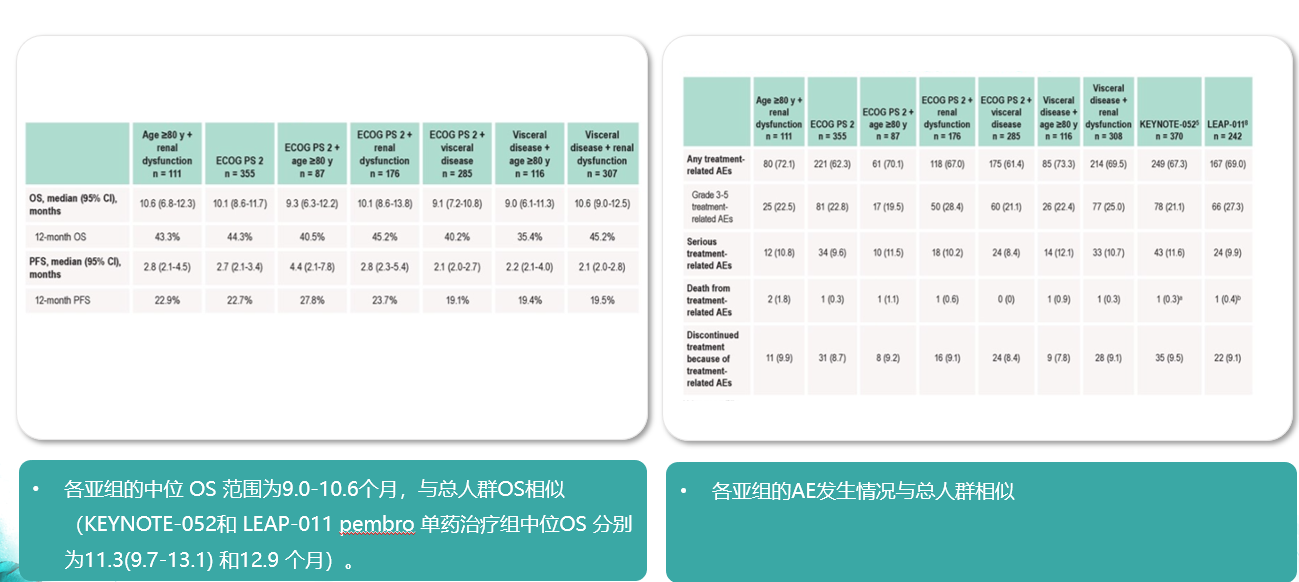
帕博利珠单抗治疗疗效未受铂类不耐受定义影响
3. COSMIC-021研究队列3,4,5:阿替利珠单抗联合卡博替尼治疗尿路上皮癌[6]
此前COSMIC-021研究队列2已经证实阿替利珠单抗联合卡博替尼在铂类化疗经治晚期尿路上皮癌的抗肿瘤效应。今年ASCO大会上公布了COSMIC-021研究的队3(一线顺铂不耐受),队列4(一线顺铂耐受),和队列5(既往免疫治疗)的疗效和安全性数据。结果显示研究队列3、4和5中位OS分别为14.3(8.6-NE)、13.5(7.8-23.2)和8.2个月(5.5-9.8);中位PFS分别为5.6(3.1-11.1)、7.8(1.6-13.8)和3.0个月(1.8-5.5)。阿替利珠单抗联合卡博替尼方案整体安全性尚可,3个队列中3/4级TRAE发生率分别为63%、43%和45%,无5级AE发生。腹泻、皮疹是最常见不良反应。
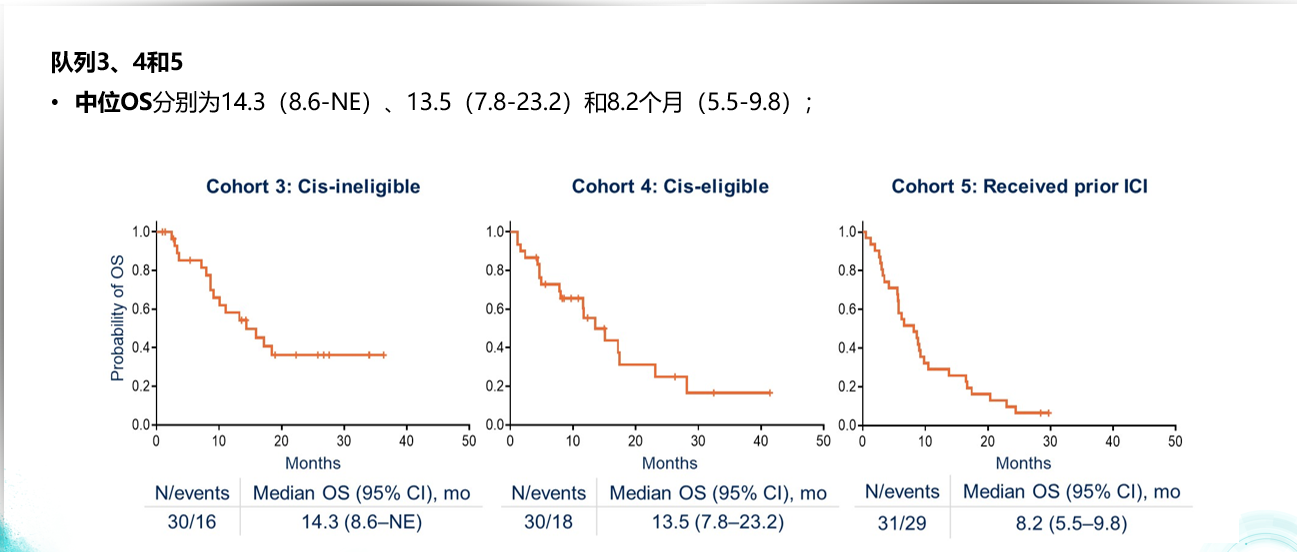
联合方案在3个队列中位OS分别为14.3、13.5和8.2个月
4. TRUCE-02研究:替雷利珠单抗联合白蛋白结合紫杉醇治疗高危非肌层浸润性膀胱癌( non-muscle invasive bladder cancer,NMIBC)的2期研究[7]
TRUCE-02研究是一项替雷利珠单抗联合白蛋白结合紫杉醇治疗高危NMIBC开放标签、单臂、2期研究,纳入膀胱黏膜多点切除发现>2个区域,且>3处病理符合上述改变的高危NMIBC患者,使用替雷利珠单抗200 mg联合紫杉醇200 mg方案,以评估该方案的疗效和安全性。结果显示23名患者达到晚期缓解(55%, 95%CI, 43.6%-74.4%),ORR达60%,33名患者仍未接受膀胱切除手术 (78.6%, 95%CI, 66.2%-91%)。最常见治疗相关不良反应为脱发,3-4级AE发生率低于2%,无5级AE发生。生物标志物探索性分析显示疗效和PD-L表达无明显相关性。
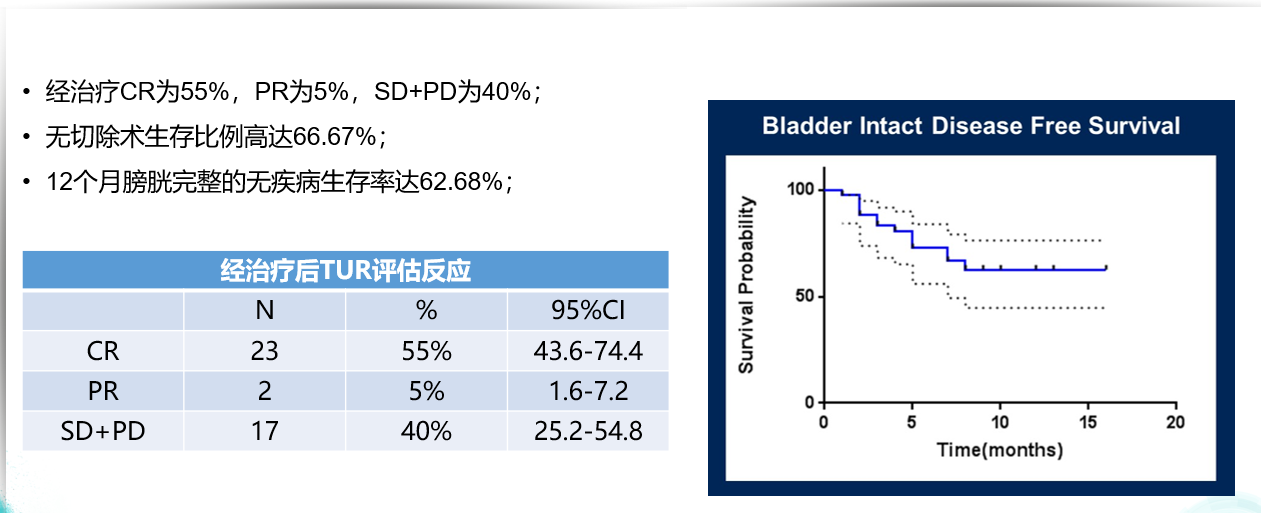
替雷利珠单抗联合紫杉醇完全缓解率达55%
5. PURE-01研究:帕博利珠单抗根治性膀胱切除术(RC)前使用帕博利珠单抗新辅助治疗MIBC患者的3年随访数据 [8]
PURE-01研究是一项开放标签、单臂 II 期研究,纳入适合并计划接受膀胱切除术的MIBC患者,患者接受帕博利珠单抗作为新辅助治疗。该研究此前报道了病理缓解和早期生存结果。意向治疗(ITT)人群包括155例患者,而接受新辅助帕博利珠单抗和RC治疗(没有额外化疗)的患者共125例。无事件生存期(EFS)定义为从接受帕博利珠单抗治疗的第一个周期开始,直到出现影像学疾病进展的时间,如RC、开始使用新辅助化疗(NAC)、RC后复发或任意原因导致的死亡等。2022年ESMO更新结果显示,经过39个月的随访, 3年EFS率为74.4%(95% CI:67.8~81.7), 36个月OS率为83.8%(95% CI:77.8~90.2)。PD-L1联合阳性评分(CPS)≥10和<10的患者3年EFS率分别为83%(95% CI:76~92)和63%(95% CI:53~77)。PURE-01研究的更新数据体现了根治性切除前应用帕博利珠单抗新辅助治疗在MIBC患者中的临床价值。
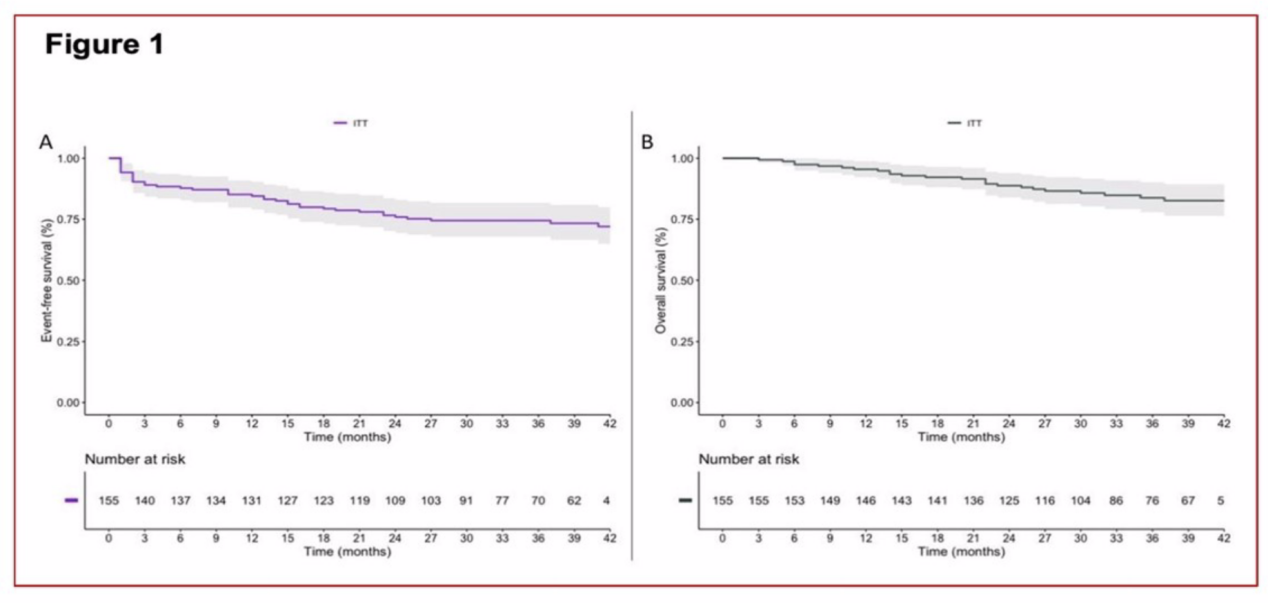
ITT人群的无事件生存EFS和总生存OS
马宏教授小结:
帕博利珠单抗在la/mUC一线治疗研究的汇总事后分析(KEYNOTE-052,KEYNOTE-361)为患者人群选择和临床研究设计提供了更多数据支持。KEYNOTE-052研究的QoL数据更新表明帕博利珠单抗能够保证晚期或转移性尿路上皮癌患者的生活质量。今年年底帕博利珠单抗还公布了两项重要研究的5年随访数据:KEYNOTE-045研究(铂类化疗进展后mUC使用帕博利珠单抗单药对比标准化疗的三期研究)显示,帕博利珠单抗组对比化疗组2年OS为16.7% vs 10.1%,2年PFS率为9.5% vs 2.7%,DOR为29.7个月 vs 4.4个月;KEYNOTE-052研究(见上文)5年随访确定ORR 28.9%,中位DOR 33.4个月[9] 。
卡博替尼已在FDA获批联合纳武利尤单抗治疗晚期肾癌患者,卡博替尼与阿替利珠单抗机制上的协同作用和现有数据表明了TKI抑制剂和ICI联合在晚期膀胱癌治疗中的潜力。
目前,多发或面积广泛的NMIBC病灶不易经TURBT完全切除,临床上可行根治性膀胱切除术,但手术创伤较大,术后也有相关并发症。此前KEYNOTE-057研究已证实帕博利珠单抗在高危NMIBC中的疗效与安全性,但尚缺乏PD-1/PD-L1抑制剂联合化疗在NMIBC中应用数据。TRUCE-02研究很好的补充了这部分空白,给我们未来的研究方向带来更多启示。
ADC药物治疗年度盘点
近年来抗体偶联药物(ADC)的相关研究备受关注。在尿路上皮癌治疗领域,ADC类药物表现出巨大潜力。在转移性尿路上皮癌的后线治疗,免疫治疗或化疗不耐受人群,以及联合免疫治疗等诸多方面,ADC类药物以其独特的机制展现出显著疗效。
ADC与免疫治疗改变了晚期UC的治疗格局
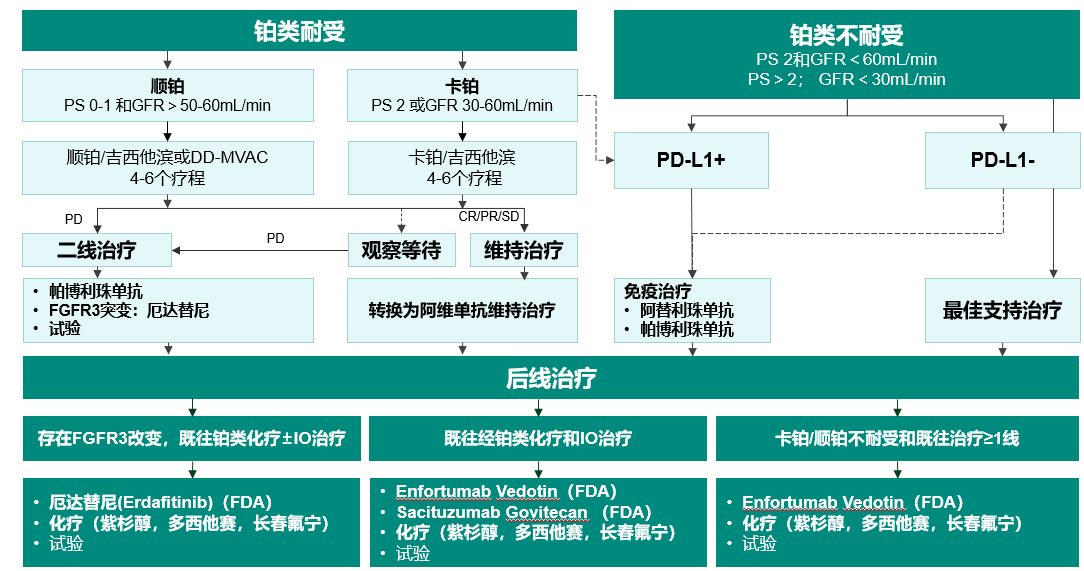
1. TROPHY-U-01 队列3 :Sacituzumab Govitecan (SG)联合帕博利珠单抗在铂类化疗进展mUC患者中的疗效和安全性[10]
SG是靶向TROP-2且负载SN-38的ADC,目前FDA获批治疗既往铂类化疗及PD-1/L1经治的局部晚期或转移性尿路上皮癌[11]。TROPHY-U-01是一项多队列研究,旨在探讨la/mUC不同治疗阶段中SG单药或联合的疗效性和安全性。其中队列3入组人群为铂类化疗经治且未接受过免疫治疗的局晚/转移尿路上皮癌患者,共入组41名患者。SG联合帕博利珠单抗治疗的ORR为34%,其中完全缓解率为2%,治疗中位时间2个月,6个月PFS率为47%。最常见不良反应为腹泻,恶心,贫血,中性粒细胞减少等。SG联合帕博利珠单抗表现出显著的抗肿瘤活性和整体可控的安全性。
SG联合帕博利珠单抗治疗的ORR为34%
2. EV-103研究数据更新:队列H[12]和队列K[13]
Enfortumab Vedotin(EV)是靶向Nectin-4的ADC,目前已FDA获批用于既往铂类化疗及PD-1/L1抑制剂经治的la/mUC和顺铂不耐受及既往治疗≥1线的la/mUC [10]。EV-103研究是探索EV在尿路上皮癌不同阶段与不同药物组合的Ib/II期研究,其中队列H是探索EV单药新辅助治疗顺铂不耐受的MIBC,共22名患者接受了EV新辅助治疗。EV作为新辅助治疗表现出较好的疗效和安全性。

36.4%的患者达到pCR,50%pSD
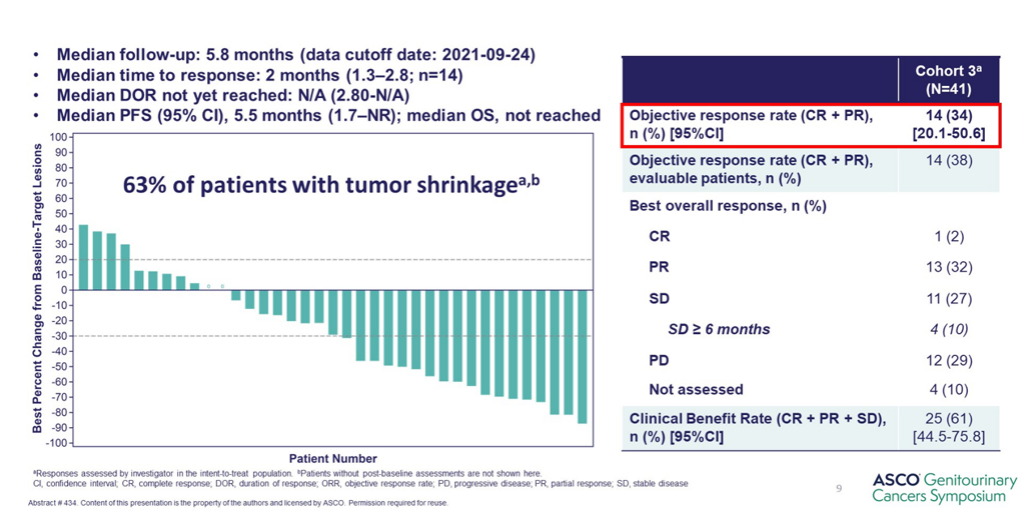
此前,EV-103研究中队列A已证实EV联合帕博利珠单抗在未经治疗及不耐受化疗的患者中具有较好的疗效和安全性,队列K则探索了EV单药对比EV联合帕博利珠单抗(EV+P)在未经治疗的顺铂不耐受的la/mUC患者中的抗肿瘤活性。结果显示EV+P组的ORR为64.5%(95%CI:52.7~75.1),中位DOR未达到;EV组的ORR为45.2%(95%CI:33.5~57.3),中位DOR为13.2个月(95%CI:6.1~16.0)。与治疗相关的AESIs多为2级及以下。EV+P在顺铂不耐受的la/mUC一线治疗中具有较高的ORR,并且安全性可控,与既往报道的EV+P数据相一致,为EV联合帕博利珠单抗一线治疗提供更充足的依据。
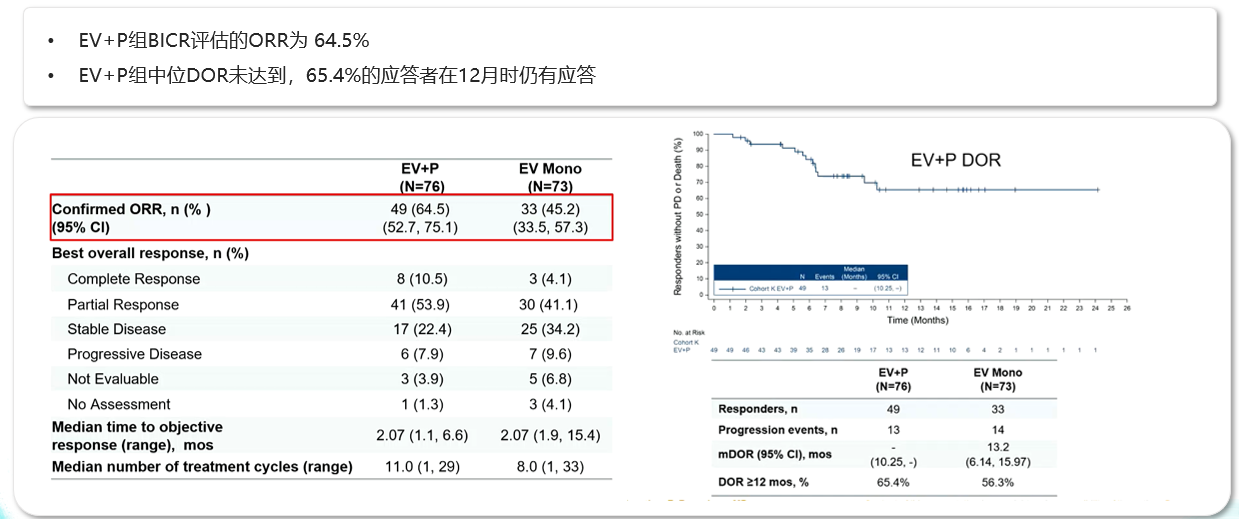
在铂不耐受La/mUC人群中帕博利珠单抗联合EV的ORR达64.5%
3. EV-301长期随访: EV vs 化疗在既往经治晚期UC患者3期研究的2年结局[14]
EV-301是一项全球、开放标签、III期研究,旨在进一步探索针对既往接受过含铂化疗且PD-1/L1抑制剂治疗进展的局部晚期或转移性尿路上皮癌(la/mUC)患者使用EV治疗的疗效和安全性。2022年ASCO该研究公布了2年随访数据,EV治疗组 vs标准化疗组(SC)整体生存为12.91个月 vs 8.94个月(HR = 0.704;P = 0.00015)。EV组ORR为41.3%,较对照组(18.6%)应答率更高。
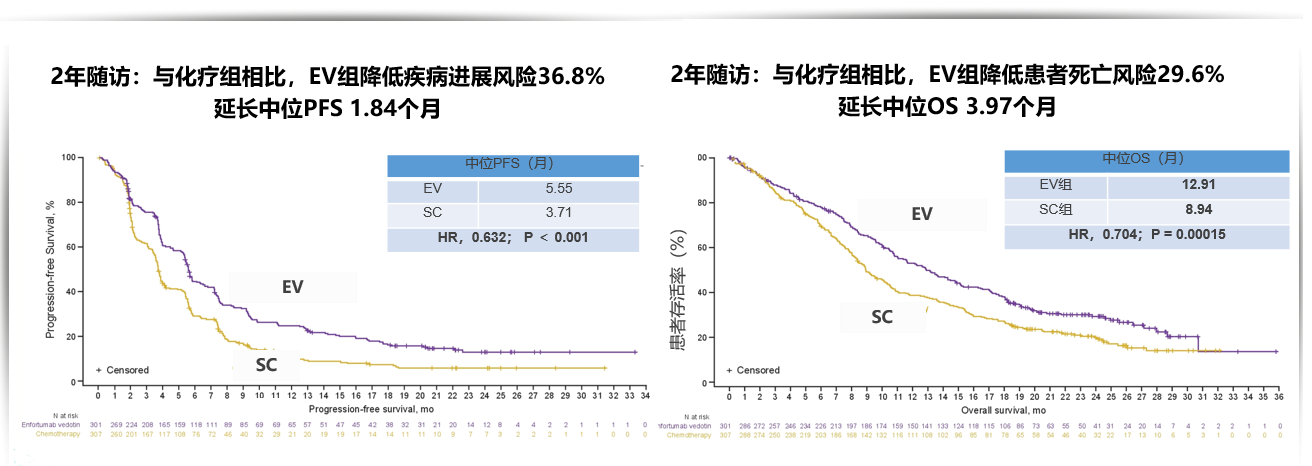
2年随访: PFS和OS获益与首次分析一致
4. 维迪西妥单抗(RC48-ADC): RC48-C014 研究[15]、RC48-C011研究[16]、RC48-C005和RC48-C009研究汇总分析[17]
RC48-ADC (Distamab Vedotin, DV)是一种新型人源化抗HER2抗体偶联药物。
RC48-C014是一项Ib/II期研究者发起的临床研究(IIT),用于评估RC48-ADC(DV)联合特瑞普利单抗在la/mUC中的安全性和疗效。患者接受维迪西妥单抗(RC48-ADC)剂量为1.5或2mg/kg(每两周一次的剂量递增队列),联合3mg/kg特瑞普利单抗。维迪西妥联合免疫治疗显示出理想的抗肿瘤效应,中位PFS 为 9.2 个月,中位OS未达到。
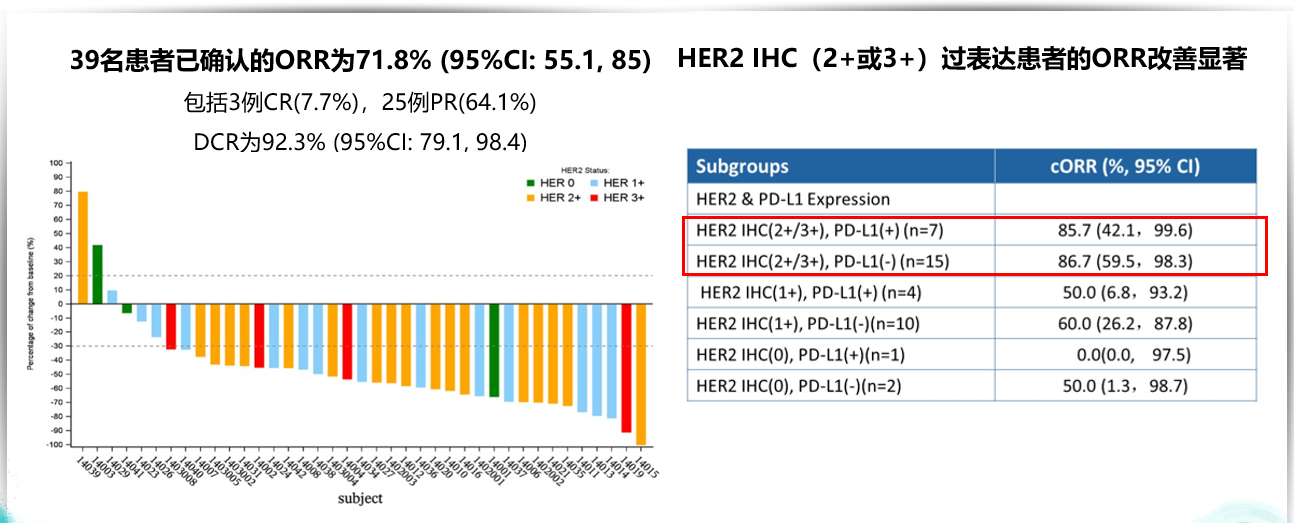
维迪西妥联合免疫治疗显示出理想的抗肿瘤效应
RC48-C011是维迪西妥单药治疗HER2阴性Ia/mUC的II期研究。共纳入19名患者,其中近80%接受2线以上治疗,68.4%接受过免疫治疗。研究结果显示ORR为26.3%,中位PFS为5.5个月,中位OS为16.4个月。
在RC48-C005和RC48-C009研究设计相似,均为使用RC48-ADC在HER2过表达(免疫组化检查结果为2+或3+)la/mUC患者中的单臂II期临床研究,二者汇总分析结果显示维迪西妥单抗可延长患者的PFS和OS,总体确认ORR为50.5%(95%CI:40.6%,60.3%),其中HER2 IHC2+&FISH+或IHC3+人群的ORR数值最高为62.2%,既往PD1/PDL1治疗受试者的ORR为55.6%。
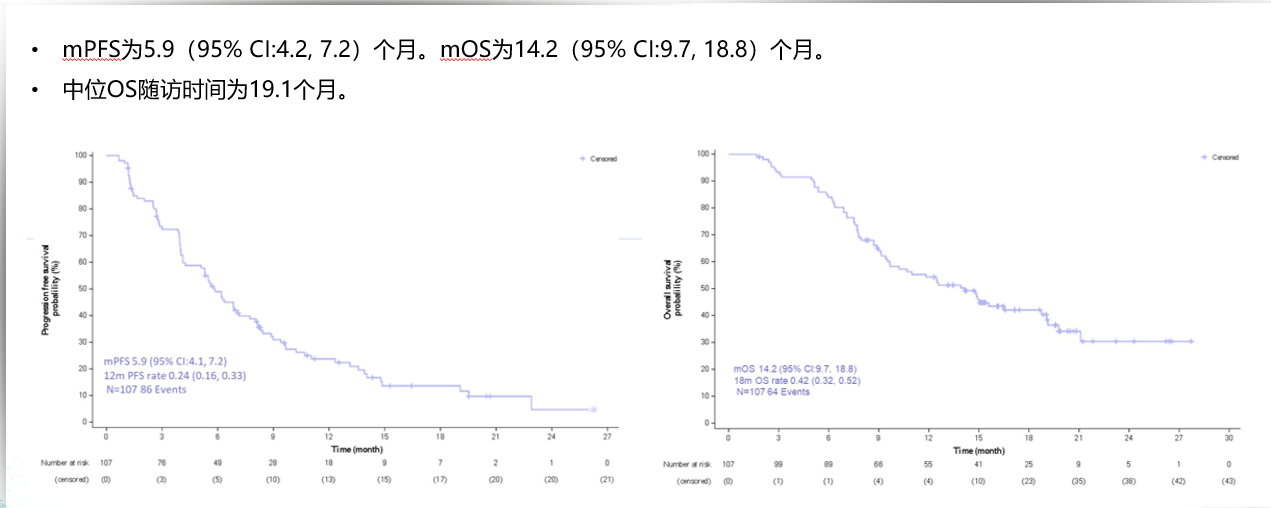
维迪西妥单抗可延长患者的PFS和OS
张耀光教授小结:
ADC药物蓬勃发展,随着临床研究不断深入,目前国际上已有多个ADC药物在UC治疗领域开展临床研究并获批临床使用。TROPHY-U-01研究队列3,EV-103研究队列K和RC48-C014研究分别证明了SG,EV和RC-48联合免疫治疗在la/mUC患者中的抗肿瘤疗效,为后期临床试验和应用打下坚实基础。ADC药物的研究同时在疾病更早期探索,如EV-103研究队列H,预示着ADC药物的无限潜力。我们同时也应看到,由于药物作用机制,ADC药物疗效也部分依赖于癌细胞靶向抗原的表达情况。在不久的将来,我们期待ADC药物在尿路上皮癌领域有更多进展和突破。
PARP抑制剂治疗年度盘点
1. ATLANTIS研究卢卡帕利队列:卢卡帕利在mUC患者化疗后维持治疗的随机、双盲、生物标志物选择2期研究[18]
ATLANTIS研究是一项根据生物标记物评估mUC一线化疗后维持治疗方案的2期研究,其中BRCA和HRD+(≥10% 杂合缺失和/或体系DRD相关基因突变)人群使用卢卡帕利 600 mg BID或安慰剂治疗。在BRCA和HRD+人群中,卢卡帕利相较对照组明显改善mUC患者的rPFS。卢卡帕利组最常见的治疗相关AEs(所有级别)为疲乏,恶心和皮疹。
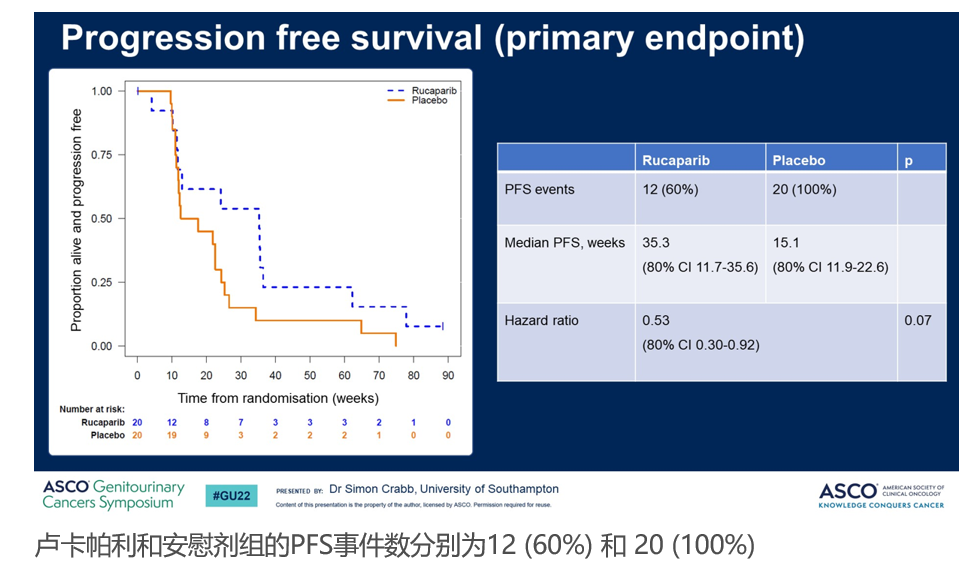
卢卡帕利维持治疗显著改善HRD+mUC患者的rPFS
2. BAYOU研究:奥拉帕利联合度伐利尤单抗在铂不耐受4期UC患者一线治疗的多中心、随机、双盲2期研究[19]
BAYOU研究是使用度伐利尤单抗联合奥拉帕利对比度伐利尤单抗单药一线治疗铂类化疗不耐受IV期尿路上皮癌的2期临床研究。研究共入组154例患者(试验组78例,对照组76例),其中20%为HRR突变阳性。虽然整体人群中位rPFS试验药物组和对照组无明显差异,携带HRR突变亚组奥拉帕利联合组中位PFS为5.6个月,相比度伐利尤单抗单药为1.8个月。
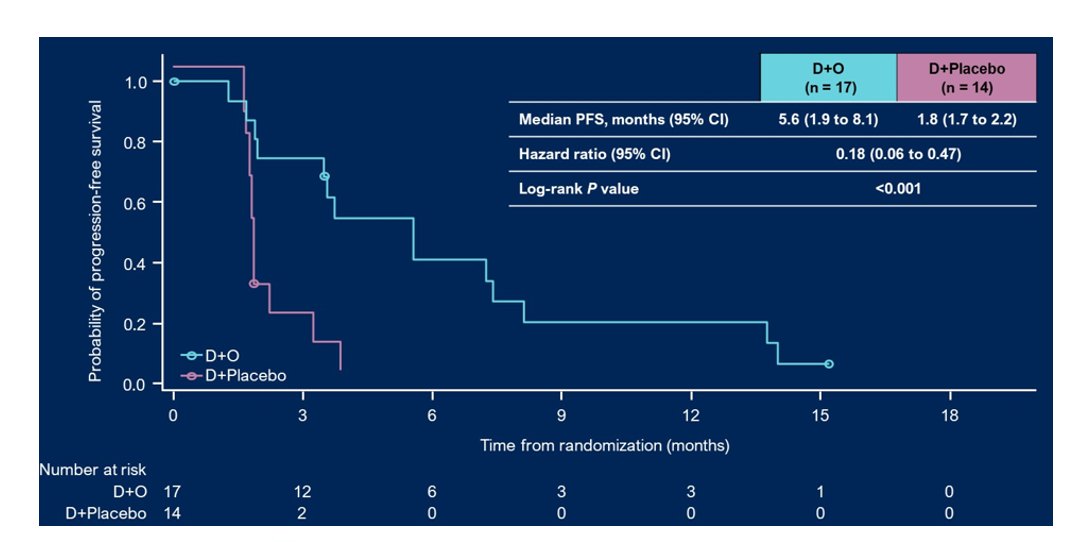
奥拉帕利联合治疗组rPFS相较对照组延长3.8月
张耀光教授小结:
奥拉帕利目前已在携带HRR突变且既往接受过新型内分泌治疗的mCRPC患者中获批使用。HRR突变在尿路上皮癌中同样占相当比例,ATLANTIS研究提示我们PARP抑制剂或可在携带HRR突变的膀胱癌患者中带来更多获益。奥拉帕利通过激活STING通路,增强T细胞抗肿瘤活性并增加肿瘤细胞表面PD-L1表达,与免疫治疗形成协同作用[20],BAYOU研究证实了这一协同机制的临床疗效。PARP抑制剂有希望进一步推进尿路上皮癌精准治疗进程。
2016年以来,免疫治疗在晚期UC治疗领域的研究取得了巨大成功,彻底改变了晚期UC以化疗为主的治疗格局。免疫治疗在晚期UC一、二线治疗中高歌猛进,取得多项临床研究的成功,免疫治疗的探索也继续向更早期疾病进行探索。免疫联合治疗作为MIBC的新辅助治疗已开展多项研究,将会为免疫治疗在尿路上皮癌领域提供更多循证医学证据。
在UC免疫治疗不断取得突破的背景下,探索更加精准的治疗策略成为目前研究的方向。ADC类药物单药或联合免疫治疗已经在晚期尿路上皮癌取得优异成绩。ADC类药物在尿路上皮癌整体治疗格局中的地位以及其优势人群仍在不断探索,以PARP抑制剂为代表的创新疗法也不断在尿路上皮癌精准治疗的方向上前进。2022年即将落幕,我们期待着明年尿路上皮癌药物治疗领域能带来更多突破,给临床医生提供更多选择,给广大患者带来更大获益。
1. J Clin Oncol. 2022.40.6_suppl.519
2. J Clin Oncol. 2022.40.6_suppl.521
3. J Clin Oncol 40, 2022 (suppl 16; abstr 4561)
4. O’Donnell PH et al. Presented at ASCO 2019; abstract 4546
5. Annals of Oncology (2022) 33 (suppl_7): S785-S807.
6. J Clin Oncol 40, 2022 (suppl 16; abstr 4504)
7. J Clin Oncol 40, 2022 (suppl 16; abstr 4507)
8. Clin Cancer Res (2022) 28 (23): 5107–5114.
9. A.V. Balar et al. J Ann Onc.2022.11.012.
10. J Clin Oncol 40, 2022 (suppl 6; abstr 434)
11. Expert Rev Anticancer Ther. 2020 July ; 20(7): 551–561
12. J Clin Oncol 40, 2022 (suppl 6; abstr 435)
13. Annals of Oncology (2022) 33 (suppl_7): S808-S869.
14. J Clin Oncol 40, 2022 (suppl 16; abstr 4516)
15. J Clin Oncol 40, 2022 (suppl 16; abstr 4518)
16. J Clin Oncol 40, 2022 (suppl 16; abstr 4519)
17. J Clin Oncol 40, 2022 (suppl 16; abstr 4520)
18. J Clin Oncol 40, 2022 (suppl 6; abstr 436)
19. J Clin Oncol 40, 2022 (suppl 6; abstr 437)
20. Pantelidou C, et al. Cancer Discov. 2019 Jun;9(6):722-737.
审批编号:MI-PD1-3973-CN
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
排版编辑:肿瘤资讯-Phoebe











 苏公网安备32059002004080号
苏公网安备32059002004080号


