
徐兵河. CDK4/6抑制剂治疗激素受体阳性人表皮生长因子受体2阴性晚期乳腺癌的进展与未来[J]. 中华肿瘤杂志, 2021, 43(4):431-442.
DOI: 10.3760/cma.j.cn112152-20201223-01099
随着肿瘤分子生物学研究的进展,晚期乳腺癌的临床治疗理念逐渐趋向精准化。激素受体(HR)阳性人表皮生长因子受体2(HER-2)阴性乳腺癌在所有乳腺癌中占比>70%,探讨新的治疗策略以突破此类患者面临的传统治疗瓶颈意义重大。HR阳性HER-2阴性乳腺癌的靶向治疗起步较晚,自首个CDK4/6抑制剂哌柏西利于2015年进入临床应用于治疗HR阳性HER-2阴性晚期乳腺癌患者之后,这类分子靶向药物的应用显著改变了HR阳性HER-2阴性晚期乳腺癌的临床治疗模式,患者生存预后也随之获得突破性改善。文章从基础药理机制出发,分析了现有的研究数据,就将来如何在临床实现精准化用药以及未来更广泛的应用前景提出见解。
【关键词】乳腺肿瘤;CDK4/6抑制剂;激素受体;人表皮生长因子受体2;临床试验
乳腺癌是全球女性最常见的恶性肿瘤。虽然乳腺癌患者的总体5年生存率达到90.0%,但转移性乳腺癌患者的生存预后仍不乐观,5年生存率仅为28.1%。
20世纪末以前,传统化疗和内分泌治疗的高耐药率和复发率使得晚期乳腺癌患者生存预后改善达到瓶颈。自2000年以来,随着一系列分子靶向药物的开发和应用,晚期乳腺癌的管理逐渐趋向精准。近年来兴起的以程序性死亡受体1(programmed cell death-1, PD-1)及程序性死亡配体1抗体为代表的肿瘤免疫疗法也已进入晚期乳腺癌治疗领域,为晚期乳腺癌患者提供了新的治疗选择。治疗方法的不断革新很大程度改善了晚期乳腺癌患者的总体生存预后,但乳腺癌是一类异质性较强的肿瘤,不同分子分型的晚期乳腺癌患者可选择的精准治疗方案和治疗效果存在较大差异。一项法国真实世界研究数据表明,2008—2016年间,来自法国18家癌症中心的人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性晚期乳腺癌患者的总生存时间(overall survival, OS)明显延长,三阴性晚期乳腺癌患者的OS也略有改善,尽管化疗、内分泌治疗以及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂等治疗手段已在激素受体(hormone receptor, HR)阳性HER-2阴性晚期乳腺癌治疗中应用多年,但HR阳性HER-2阴性晚期乳腺癌患者的OS无任何改善趋势。
在所有乳腺癌患者中,>70%为HR阳性HER-2阴性肿瘤,探讨新的治疗策略以突破此类患者的治疗困境意义重大。HR阳性HER-2阴性乳腺癌的靶向治疗时代的起步与突破较晚。首个CDK4/6抑制剂哌柏西利于2015年获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准,CDK4/6抑制剂联合内分泌治疗用于HR阳性HER-2阴性晚期乳腺癌患者后,改变了HR阳性HER-2阴性晚期乳腺癌的临床治疗模式,患者生存预后也随之获得突破性改善。基于CDK4/6抑制剂在临床研究中显示的可靠的疗效和良好的安全性,国内外指南一致推荐CDK4/6抑制剂作为HR阳性HER-2阴性晚期乳腺癌患者的一、二线标准用药选择。笔者从基础药理机制出发,系统梳理了CDK4/6抑制剂在HR阳性HER-2阴性晚期乳腺癌治疗领域的现有研究数据,并就将来如何在临床实现精准化用药,以及未来更广泛的应用前景提出见解。
1.CDK4/6抑制剂的药理机制:
CDK是丝氨酸-苏氨酸激酶的大家族,在调节细胞周期进展中发挥重要作用。Cyclin D与CDK4和CDK6相互作用促进视网膜母细胞瘤(retinoblastoma, RB)基因产物的过度磷酸化,继而推动细胞周期通过G1检查点进入S期,因此,Cyclin D-CDK4/6-RB信号通路异常可以导致肿瘤细胞复制失控,与多种恶性肿瘤的发生和发展相关。Cyclin D1-CDK4/6是维持乳腺癌细胞致癌潜力的必要因子,CDK4和CDK6是雌激素受体阳性HER-2阴性乳腺癌发生和进展的关键驱动因子,可作为重要的治疗靶点。
自20世纪90年代开始,研究者们为了研发CDK抑制剂进行了广泛的探索。第一代和第二代CDK抑制剂均为泛抑制剂,第一代CDK抑制剂中的代表药物Alvociclib可同时阻断CDK1/2/4/6/7/9,第二代CDK抑制剂的代表药物Dinaciclib则可同时阻断CDK1/2/5/9。第一代和第二代CDK抑制剂虽然靶点众多,但均因严重的不良反应而无法应用于临床。2009年一项体外研究显示,CDK4/6抑制剂哌柏西利联合他莫昔芬可有效抑制内分泌药物耐药的ER阳性乳腺癌细胞株的生长,由此激发了研究者们对第三代CDK抑制剂即选择性CDK4/6抑制剂的研发热情。自2015年首个CDK4/6抑制剂哌柏西利进入临床用于治疗HR阳性HER-2阴性晚期乳腺癌之后,全球已有3个选择性CDK4/6抑制剂(哌柏西利、阿贝西利和Ribociclib)获批用于初治或既往内分泌治疗或化疗后进展的HR阳性HER-2阴性晚期或转移性乳腺癌患者。
从分子结构来看,哌柏西利、阿贝西利和Ribociclib均是特异性腺苷三磷酸(adenosine triphosphate, ATP)竞争性小分子药物,可结合存在于激酶中的ATP结合袋,从而阻断下游CDK4/6介导的RB磷酸化,使细胞周期停滞于G1期。哌柏西利、阿贝西利和Ribociclib的作用机制也有不同之处。阿贝西利可与激酶中保守的催化残基形成氢键,而这种保守催化残基在不同激酶中很常见。此外,阿贝西利与ATP竞争性结合的方式是在ATP结合袋的后壁上埋藏2个氟原子,而哌柏西利和Ribociclib则存在更大的取代基(Ribociclib的二甲氨基;哌柏西利的甲基酮和相邻的甲基),因此,哌柏西利和Ribociclib更难与其他激酶相容,这些差异可能导致阿贝西利的激酶选择性相比另外2个CDK4/6抑制剂更低。对肿瘤细胞的内源性激酶进行分析,结果显示,除CDK4/6以外,阿贝西利还可作用于CDK9,哌柏西利和Ribociclib则未观察到类似作用。目前,选择性抑制CDK9是否可转化为药物疗效尚不明确,但有研究显示,抑制CDK9可能与阿贝西利特有的肠道毒性有关。此外,阿贝西利同时对CDK5和肿瘤细胞中的CDK16/18等非典型CDK也有抑制作用。
2.CDK4/6抑制剂在HR阳性HER-2阴性晚期乳腺癌中的应用进展:
一系列Ⅲ期临床研究已确认,CDK4/6抑制剂对HR阳性HER-2阴性晚期乳腺癌患者有明确的治疗获益(表1)。
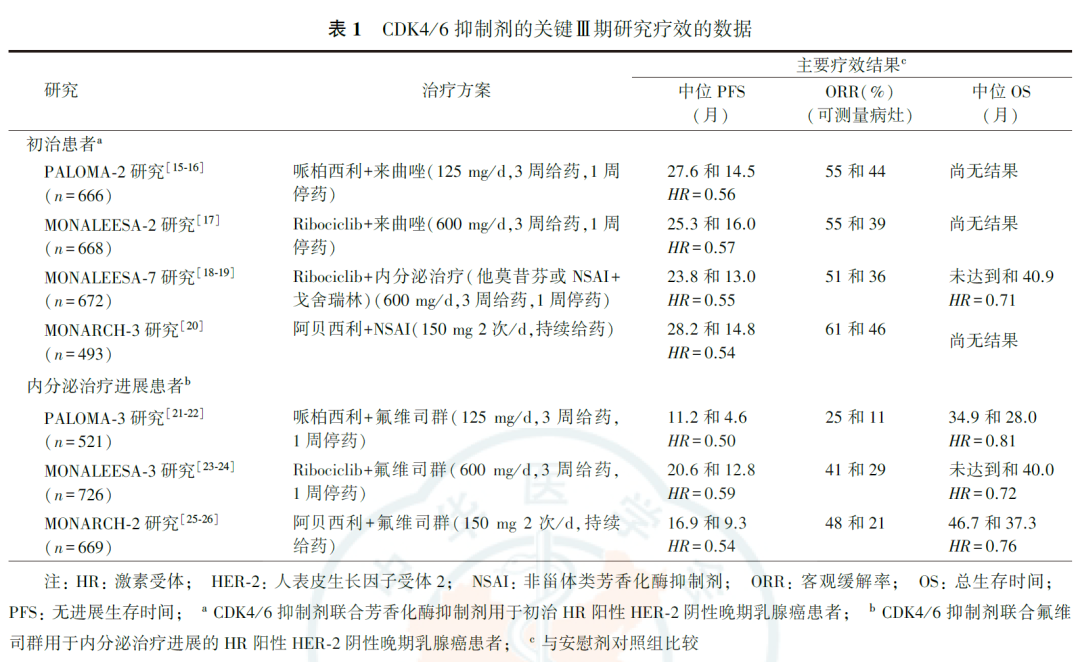
从含CDK4/6抑制剂联合方案用于初治HR阳性HER-2阴性晚期乳腺癌患者的总体人群数据来看,3个CDK4/6抑制剂的无进展生存时间(progression-free survival, PFS)和客观缓解率(overall response rate,ORR)结果相似。除MONALEESA-7研究外,大部分一线治疗研究的OS尚无结果。值得注意的是,MONALEESA-7研究纳入的均为绝经前患者,且允许纳入接受过针对晚期乳腺癌一线化疗的患者,也就是有部分(14.0%)入组患者是二线治疗状态,这可能是该项研究相比同类研究更早达到OS终点的原因。从内分泌治疗进展的HR阳性HER-2阴性晚期乳腺癌患者的研究数据来看,与安慰剂组比较,3个CDK4/6抑制剂治疗组的疗效结果均有明显的改善。与MONALEESA-3研究和MONARCH-2研究相比,PALOMA-3研究的治疗组和安慰剂对照组的PFS、OS、ORR值偏小,这与PALOMA-3研究中接受过多线治疗患者的比例较高有关,其总人群中有34.9%的患者既往接受过两线及以上的治疗,34.0%的患者接受过1种晚期化疗方案。此外,一项Ⅱ期临床研究MONARCH-1中,有学者评价了阿贝西利单药用于接受过多线治疗的HR阳性HER-2阴性转移性乳腺癌患者的治疗结局,结果显示,阿贝西利单药有可靠的治疗活性和安全性。这项研究为探讨CDK4/6抑制剂单药在晚期乳腺癌后线治疗中的应用提供了支持。
哌柏西利、阿贝西利和Ribociclib可能在一些亚组人群中存在疗效差异。PALOMA-2研究的亚组数据显示,所有亚组人群均可从哌柏西利一线治疗中获益,其中仅骨转移患者的获益最为明显,哌柏西利治疗组的中位PFS可达36.2个月(HR=0.41,95% CI:0.26~0.63)。MONARCH-3研究的亚组结果显示,大部分亚组人群可从阿贝西利一线治疗中获益,但具有某些临床特征的患者可能获益有限,包括仅骨转移(PFS HR=0.57, 95% CI:0.31~1.04)、无治疗间期较长(≥3年)(PFS HR=0.69,95% CI:0.44~1.08),以及既往接受过非芳香化酶抑制剂(aromatase inhibitor,AI)内分泌治疗(PFS HR=0.81,95% CI:0.47~1.38)的患者。哌柏西利和阿贝西利的一线和二线临床研究数据均显示,相比非亚裔患者,亚裔患者的治疗获益更大,Ribociclib一线治疗数据也发现了相似的结果,但在Ribociclib二线临床研究MONALEESA-3中,亚组分析中却并未观察到相似获益(PFS HR=1.35,95% CI:0.57~3.19;OS HR=1.42, 95% CI:0.46~4.33)。PALOMA-3和MONARCH-2研究中,有学者分析了原发性内分泌耐药和继发性内分泌耐药患者的疗效,结果显示,原发性内分泌耐药患者使用哌柏西利或阿贝西利治疗均未达OS明显获益(哌柏西利:HR=1.14,95% CI:0.71~1.84;阿贝西利:HR=0.69,95% CI:0.45~1.04);在继发性内分泌耐药的人群中,哌柏西利治疗达到了OS获益(HR=0.72,95% CI:0.55~0.94),而阿贝西利治疗的OS获益则不明确(HR=0.79,95%CI:0.61~1.02),从生存曲线的变化来看,哌柏西利治疗1年就观察到了生存获益,阿贝西利在治疗2年后才呈现生存改善趋势。MONALEESA-3研究中,原发内分泌耐药亚组人群分析结果显示,Ribociclib治疗的生存获益亦不明确(PFS HR=0.62, 95% CI:0.37~1.05;OS HR=0.70,95% CI:0.37~1.33)。需注意的是,上述患者亚组数据来自不同的临床研究,入组患者的基线特征也存在明显的差异,因此不宜进行直接比较。未来还需进一步开展前瞻性头对头研究进行探讨。
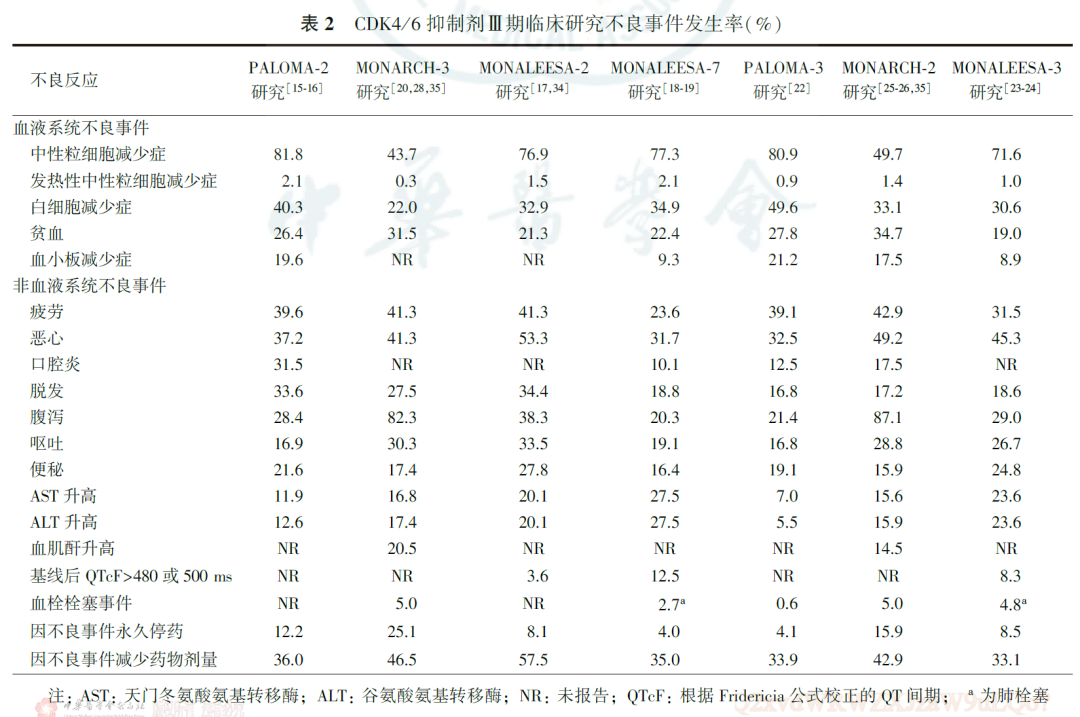
哌柏西利、阿贝西利和Ribociclib的不良反应也存在差异。哌柏西利和Ribociclib的不良反应谱有相似之处(表2),最常见的不良反应事件为中性粒细胞减少症。Ribociclib治疗中值得注意的不良事件还有肝转氨酶升高(发生率为20.1%~27.5%)和心电图检查中根据Fridericia公式校正的QT间期(QT interval corrected by Fridericia′s formula, QTcF)的延长(发生率为3.6%~12.5%)。而阿贝西利的不良反应与哌柏西利、Ribociclib的差异较大,中性粒细胞减少症发生率较低,腹泻发生率(82.3%~87.1%)较高;与Ribociclib相似的是,阿贝西利治疗也可导致肝转氨酶升高,发生率约为15.6%~17.4%;由于阿贝西利可以抑制肾小管分泌转运蛋白,故还可能导致血清肌酐水平升高,发生率约为14.5%~20.5%。需注意的是,阿贝西利治疗还可引发静脉血栓栓塞事件,包括肾静脉血栓和肺栓塞等值得关注的不良事件,在MONARCH-2和MONARCH-3研究中,含阿贝西利治疗方案组的静脉血栓栓塞事件发生率均为5.0%。从不良事件对用药的影响来看,阿贝西利因不良反应导致永久停药的发生率(15.9%~25.1%)较高,在哌柏西利和Ribociclib治疗过程中因不良反应导致永久停药的发生率分别为4.1%~12.2%和4.0%~8.5%。
基于不良反应的差异,美国FDA对哌柏西利、阿贝西利和Ribociclib也提出了不同的安全性注意事项和监测方案建议(表3)。

3.含CDK4/6抑制剂方案治疗进展后的治疗方案选择:
对于CDK4/6抑制剂联合内分泌治疗出现疾病进展后的方案选择,尚无统一的推荐。综合目前的临床实践和研究方向,可考虑选择的方案包括:(1)换用细胞毒性化疗药物或内分泌单药治疗;(2)保留CDK4/6抑制剂,更换联用的内分泌治疗药物或在原有方案基础上加用其他精准治疗药物;(3)换用其他靶向药物与内分泌治疗联用。
在临床实践中,细胞毒性化疗药物是CDK4/6抑制剂治疗进展后的常用后续治疗方案。PALOMA-3研究中,对于哌柏西利联合氟维司群治疗后疾病进展的患者,大部分研究者给予患者化疗。一项真实世界研究显示,在104例经哌柏西利治疗后疾病进展的患者中,大部分后续治疗选择化疗,选择化疗方案最多的为卡培他滨、艾立布林和白蛋白紫杉醇方案。另一项美国真实世界研究也显示,在一线接受含CDK4/6抑制剂方案治疗后疾病进展的患者中,超过1/3(35.6%)的患者二线接受化疗,化疗方案以卡培他滨和紫杉类药物为主。此项研究还显示,二线选择内分泌单药治疗的患者占比更高(38.0%),以氟维司群单药方案为主。校正人口统计学和临床特征后发现,相比后续使用其他方案,后续选择化疗的患者有快速进展复发风险增加的趋势。
关键Ⅲ期临床研究已确认,相比单用内分泌药物,联合CDK4/6抑制剂可达到协同增效的作用。CDK4/6抑制剂无交叉耐药现象,因此有研究者提出,CDK4/6抑制剂联合内分泌治疗出现疾病进展后,保留使用CDK4/6抑制剂(维持原CDK4/6抑制剂药物或换用另一CDK4/6抑制剂),在此基础上更换联合方案中的内分泌药物或加用其他精准治疗药物(靶向治疗或免疫治疗药物)可作为后续选择方案之一。美国的一项多中心回顾性研究显示,对于含哌柏西利或Ribociclib方案治疗后疾病进展的HR阳性HER-2阴性转移性乳腺癌患者,给予阿贝西利单药或联合内分泌治疗(氟维司群、AI、他莫昔芬)仍可获益,中位PFS为5.4个月。另一项小样本单中心回顾性研究同样显示,对于含CDK4/6抑制剂方案治疗后疾病进展的HR阳性HER-2阴性转移性乳腺癌患者,继续使用CDK4/6抑制剂联合内分泌治疗(更换CDK4/6抑制剂的种类或内分泌治疗药物的种类),中位PFS可达11.8个月,仍有一定获益。目前也已有早期临床研究显示,CDK4/6抑制剂联合另一种分子靶向药物[mTOR抑制剂或磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)抑制剂]±内分泌治疗方案在HR阳性HER-2阴性晚期乳腺癌患者中有治疗活性,且安全性可控。有多项尚在进行中的前瞻性Ⅱ期临床研究也对此进行了探讨,颇受关注的有PACE、MAINTAIN和TRINITI-1研究等(表4)。

停用联合方案中的CDK4/6抑制剂,换用其他靶向药物也是后续方案选择之一。PI3K/AKT/mTOR信号通路异常已确认与肿瘤的发生、发展有关。研究显示,PI3K/AKT/mTOR信号通路异常也是HR阳性乳腺癌内分泌治疗耐药的重要机制之一。Ⅲ期BOLERO-2研究证实,mTOR抑制剂依维莫司联合依西美坦与单用依西美坦比较,可改善HR阳性晚期乳腺癌患者的PFS(中位PFS分别为6.9和2.8个月,HR=0.43,P<0.001)。基于BOLERO-2研究,依维莫司已经在全球多个国家获得批准联合依西美坦用于治疗来曲唑或阿那曲唑治疗失败后的绝经后HR阳性HER-2阴性晚期乳腺癌患者。在一项美国真实世界研究中,学者分析了208例经CDK4/6抑制剂一线治疗后疾病进展患者的数据,大部分患者后续接受内分泌单药或联合其他药物治疗,其中14.4%的患者接受的是含依维莫司的治疗方案。Ⅲ期SOLAR-1研究显示,相比单用氟维司群,PI3K抑制剂Alpelisib联合氟维司群可明显改善既往接受过内分泌治疗的HR阳性HER-2阴性、且携带PIK3CA突变晚期乳腺癌患者的PFS(中位PFS分别为11.0和5.7个月,HR=0.65, P<0.001)。基于SOLAR-1研究,2019年美国FDA批准Alpelisib联合氟维司群用于内分泌治疗失败的男性和绝经后HR阳性HER-2阴性、且携带PIK3CA突变的晚期或转移性乳腺癌。Ⅱ期BYLieve研究纳入了一组经一线CDK4/6抑制剂联合AI治疗后出现疾病进展的患者,研究方案是二线接受Alpelisib联合氟维司群治疗,结果显示,患者的中位PFS为7.3个月,6个月无进展生存率为50.4%,提示经一线CDK4/6抑制剂联合AI治疗后出现疾病进展的PIK3CA突变患者,可以考虑Alpelisib联合氟维司群治疗。Ⅱ期FAKTION研究显示,新型AKT抑制剂Capivasertib联合氟维司群方案可改善AI治疗失败的HR阳性HER-2阴性绝经后晚期乳腺癌患者的预后,疾病进展风险降低42%(中位PFS分别为10.3和4.8个月,未校正HR=0.58, P=0.004 4)。然而,FAKTION研究的入组患者不包括CDK4/6抑制剂经治患者,故Capivasertib能否用于经CDK4/6抑制剂治疗出现疾病进展的患者,仍需大型随机临床研究的确认。
值得注意的是,HR阳性HER-2阴性乳腺癌是一类临床表现和分子学特征异质性较强的肿瘤,因此含CDK4/6抑制剂方案的耐药机制可能也有很大的个体差异。因此,未来在临床中的探讨方向应是基于个体化耐药机制和个体化精准选择后续治疗方案。
4.未来晚期研究中需要探讨的问题:
综上所述,HR阳性HER-2阴性晚期乳腺癌患者的靶向治疗起步相对较晚,还有很多问题尚待探讨。
第1个值得探讨的问题是,CDK4/6抑制剂联合何种内分泌药物效果更佳。Ⅱ期FIRST研究和Ⅲ期FALCON研究证实,氟维司群单药治疗HR阳性晚期乳腺癌患者的预后优于AI,那么在与CDK4/6抑制剂的联合方案中,使用氟维司群的疗效是否也会优于AI呢?PARSIFAL研究是第一个对比氟维司群联合CDK4/6抑制剂和来曲唑联合CDK4/6抑制剂的全球多中心头对头研究,其结果显示,来曲唑或氟维司群联合哌柏西利的疗效无差异,在有或无内脏转移以及新发或复发转移患者中均未观察到疗效差异。基于生物标志物检测结果,个体化选择内分泌药物是解答这一问题的重要研究方向。PADA-1研究中,学者旨在探讨雌激素受体α(estrogen receptor alpha, ESR1)突变与AI联合哌柏西利一线治疗疗效及疾病进展后治疗方案选择的相关性,第一阶段研究结果显示,基线时存在ESR1突变与一线使用含AI方案治疗后PFS较短有关;治疗后检出ESR1突变的患者将联合方案中的AI换为氟维司群可能会有获益。PADA-1研究显示,存在ESR1突变早期清除现象的患者(即基线ESR1突变患者在接受AI联合哌柏西利治疗1个月后,循环肿瘤DNA检测ESR1突变的最小等位基因频率<0.1%),相比于无ESR1突变早期清除的患者,前者的PFS相对改善。PADA-1研究提示应重视对ESR1突变的检测。PARSIFAL研究的后续转化研究TransFAL通过探索不同生物标志物来预测未来内分泌治疗联合CDK4/6抑制剂的疗效,或许会为临床医师对不同患者精准选择个体最佳治疗方案提供参考。
第2个值得进一步探讨的研究方向是,在不同人群中比较CDK4/6抑制剂联合内分泌治疗相比传统化疗的疗效和安全性。Young-PEARL研究和PEARL研究的结果在一定程度上对这一问题提供了解答,这2项临床研究均对比了CDK4/6抑制剂联合内分泌治疗与卡培他滨单药用于HR阳性HER-2阴性晚期乳腺癌患者的治疗结局。从疗效来看,2项研究的结果不一致。Young-PEARL研究中位随访17个月后显示,哌柏西利联合依西美坦组患者的中位PFS优于卡培他滨组(20.1和14.4个月,HR=0.659,P=0.046 9);PEARL研究中位随访13.5个月,结果显示,哌柏西利联合氟维司群组的中位PFS相比卡培他滨单药组无改善(7.5和10个月,HR=1.09,P=0.526)。是什么原因导致这两个类似研究的疗效结果如此不一致呢?通过对比Young-PEARL和PEARL研究的研究人群,我们或许能够得到重要启示。Young-PEARL研究中的患者主要为绝经前患者,患者一线治疗占比较大(约50%),且绝大部分(近80%)未在晚期阶段接受过任何化疗,94%的患者仅接受过他莫昔芬内分泌治疗,所有患者均未接受过AI治疗,故对AI治疗相对敏感;而PEARL研究中主要为绝经后患者,其研究人群中的一线治疗患者仅占25%,大部分为经多线治疗后的患者,>70%的患者接受过内分泌治疗,AI耐药患者(包括原发和继发性内分泌耐药)占比达到70%,这些因素都可能导致PEARL研究中的患者对内分泌治疗反应性下降,从而导致疗效方面的阴性结果。值得注意的是,Young-PEARL研究和PEARL研究均显示,哌柏西利联合内分泌治疗组患者的安全性数据优于化疗组,这一点对在临床实践中接受了多线化疗、身体状态和脏器储备功能较差的患者(如内脏危象)有重要意义,目前指南推荐对内脏危象的患者使用化疗,未来可以针对这一患者人群开展CDK4/6抑制剂与化疗药物的临床对照研究。此外,Young-PEARL研究和PEARL研究选择对比的化疗方案均为卡培他滨单药,从临床实践来看,紫杉类和蒽环类等化疗药物也是晚期乳腺癌患者常用的化疗药物。2017年的一篇网络荟萃分析比较了哌柏西利联合内分泌治疗方案和不同化疗方案用于HR阳性HER-2阴性的晚期或转移性乳腺癌患者的治疗结局,结果显示,在一线治疗中,哌柏西利联合来曲唑相比卡培他滨(HR=0.28)或米托蒽醌(HR=0.28)可明显改善PFS或疾病进展时间(time to progression, TTP),与紫杉醇(HR=0.59)、多西他赛(HR=0.51)和其他化疗单药或联合方案(HR:0.24~0.99)相比也有改善趋势。在二线治疗中,哌柏西利联合氟维司群相比卡培他滨(HR=0.28)、米托蒽醌(HR=0.26)、多柔比星(HR=0.19)可明显改善PFS或TTP,相比紫杉醇(HR=0.48)、多西他赛(HR=0.71)和其他化疗单药和联合方案(HR:0.23~0.89)也有改善趋势。因此,将来比较CDK4/6抑制剂联合内分泌治疗与化疗的头对头临床研究也应将紫杉类和蒽环类等化疗药物包括在内。
筛选可从含CDK4/6抑制剂方案中达到最大治疗获益的晚期乳腺癌患者人群也是将来需要探讨的课题。目前针对CDK4/6抑制剂疗效相关生物标志物的研究大部分为探索性研究,且尚未发现与CDK4/6抑制剂治疗预后有明确相关性的特定生物标志物,在这些研究探索的生物标志物中,RB、Cyclin E及胸苷激酶1是相对来说比较具有前景的生物标志物。相比较探讨单个与疗效相关的生物标志物,深入了解与乳腺癌恶性进展相关的复杂分子学通路网络可能更有助于指导晚期乳腺癌患者的个体化治疗。因此,依托大型分子学研究数据,构建中国乳腺癌患者的基因突变全景图谱,进而分析与中国乳腺癌人群接受CDK4/6抑制剂治疗疗效有特异相关性的生物标志物,是我国乳腺癌研究领域将来需要开展的重要课题。
5.CDK4/6抑制剂临床应用的未来前景展望:
CDK4/6抑制剂联合内分泌治疗方案已成为临床治疗HR阳性HER-2阴性晚期乳腺癌患者的标准方案。越来越多的证据表明,以CDK4/6抑制剂为基础的联合治疗模式在不同分子学分型和不同分期乳腺癌患者中均有潜在应用前景。
CDK4/6抑制剂不仅能诱导肿瘤细胞周期阻滞,还可通过上调和拮抗相关的基因表达,或与免疫细胞相互作用来促进抗肿瘤的免疫作用,如上调主要组织相容性复合体Ⅰ类分子表达、抑制调节性T细胞增殖、增强细胞毒性T细胞。这为探讨CDK4/6抑制剂联合免疫治疗方案提供了理论依据。2018年一项临床前研究显示,CDK4/6抑制剂联合PD-1抗体可显著降低肿瘤细胞的增殖能力。在三阴性乳腺癌小鼠模型中,CDK4/6抑制剂可抑制三阴性乳腺癌肿瘤细胞的远处转移,促进三阴性乳腺癌免疫作用,激活相关的上皮间质转化可能是其中一个重要的作用机制。联合CDK4/6抑制剂、PD-1抗体、细胞毒性T淋巴细胞相关蛋白4抗体和PI3K抑制剂方案可明显提高三阴性乳腺癌小鼠模型的肿瘤免疫原性和T细胞毒性,持续肿瘤消退达1年以上。这些证据提示CDK4/6抑制剂联合免疫检查点抑制剂可能发挥协同抗肿瘤作用,有望为三阴性晚期乳腺癌患者提供新的治疗方向,相关临床研究仍有待后续开展。
CDK4/6抑制剂联合抗HER-2治疗方案也为HER-2阳性晚期乳腺癌患者提供了治疗新思路。Cyclin D1/CDK4可能介导ER阳性HER-2阳性肿瘤细胞对抗HER-2治疗耐药,CDK4/6抑制剂单药或联合曲妥珠单抗在ER阳性HER-2阳性肿瘤细胞中有治疗活性,有望成为克服抗HER-2治疗耐药的治疗选择。一项包括36例ER阳性HER-2阳性早期乳腺患者的小型新辅助治疗临床研究进一步支持这一结果。探讨CDK4/6抑制剂联合抗HER-2治疗初治或抗HER-2治疗耐药的HER-2阳性晚期乳腺癌患者的研究已在进行中。Ⅱ期monarchHER研究中位随访19.0个月的初步结果显示,对于晚期阶段已接受了至少两线抗HER-2治疗的HR阳性HER-2阳性晚期乳腺癌患者,相比标准化疗联合曲妥珠单抗,阿贝西利联合氟维司群和曲妥珠单抗方案可明显改善患者的PFS(中位PFS分别为8.3和5.7个月,HR=0.67,P=0.051,预设双侧α为0.2,故差异有统计学意义)。Ⅱ期SOLTI-1303 PATRICIA研究的初步结果则提示,哌柏西利联合曲妥珠单抗用于曲妥珠单抗经治的ER阳性HER-2阳性的PAM50 Luminal A型或B型晚期乳腺癌患者,安全性良好,并有可靠的生存获益(中位PFS分别为Luminal型肿瘤:10.6个月,非Luminal型肿瘤4.2个月,校正HR=0.40,P=0.003)。此外,针对哌柏西利正在进行中的Ⅲ期PATINA研究(NCT02947685)也值得关注。
在乳腺癌患者的新辅助治疗策略中,化疗仍是重要的组成部分。但化疗药物不良反应较大,而且部分患者如Luminal型乳腺癌患者对新辅助化疗的敏感性较低。新辅助化疗后未达病理完全缓解(pathologic complete response, pCR)的患者复发转移的风险可能增加,因此有必要基于肿瘤分子学特征,探讨个体化的新辅助治疗策略。Ⅱ期NeoPAL研究在高风险Luminal型乳腺癌患者中比较了哌柏西利+来曲唑和化疗(5-氟尿嘧啶+表柔比星+环磷酰胺)方案作为新辅助治疗的疗效和安全性,结果显示,哌柏西利联合内分泌治疗组的安全性优于化疗,两组的临床缓解率和保乳手术率相似,但化疗组的治疗后残留肿瘤负荷评分为0或1分的患者比例较高(15%和7.7%)。Ⅱ期PALLET研究和FELINE研究则比较了CDK4/6抑制剂联合内分泌治疗和单用内分泌治疗作为新辅助治疗方案在ER阳性HER-2阴性乳腺癌患者中的治疗结局,结果显示,CDK4/6抑制剂联合治疗组患者的Ki-67下调水平更为显著。含CDK4/6抑制剂新辅助治疗方案有可能在未来成为化疗的替代方案。
基于CDK4/6抑制剂在晚期乳腺癌临床研究中的良好疗效,目前已有多项研究探讨CDK4/6抑制剂作为辅助治疗的应用前景。大型Ⅲ期研究(monarchE研究、PENELOPE-B研究和PALLAS研究)均比较了CDK4/6抑制剂联合内分泌治疗和单用内分泌治疗作为HR阳性HER-2阴性乳腺癌辅助治疗的临床结局。在monarchE研究中,阿贝西利联合内分泌辅助治疗组患者的无侵袭性疾病生存(invasive disease free survival, IDFS)相比单用内分泌治疗组明显改善,中位随访15.5个月时,两组2年无侵袭性疾病生存率绝对差值为3.5%(92.2%和88.7%);中位随访19.2个月时,两组2年无侵袭性疾病生存率绝对差值则减小为3.0%(92.3%和89.3%)。在PENELOPE-B研究和PALLAS研究中,哌柏西利联合内分泌辅助治疗组的主要终点IDFS均未达阳性结果。PENELOPE-B研究中,中位随访时间达到42.8个月,2年无侵袭性疾病生存率绝对差值为4.3%(88.3%和84.0%),而4年无侵袭性疾病生存率绝对差值减小为0.6%(73.0%和72.4%)。入组人群特征和用药时间的差异可能是导致这3项研究结果不同的主要原因。monarchE研究中是具有高危复发因素的HR阳性HER-2阴性早期乳腺癌患者,阿贝西利的治疗时间为2年;PENELOPE-B研究入组的是经新辅助化疗后未达pCR,且经临床病理分期-雌激素及组织学分级评分系统确定的复发风险较高的HR阳性HER-2阴性乳腺癌患者,哌柏西利的治疗时间为1年;PALLAS研究则要求哌柏西利的治疗时长为2年,不同于前2项研究的是,PALLAS研究纳入的是更广泛的HR阳性HER-2阴性早期乳腺癌患者,并不要求这些患者具备高危复发因素,值得注意的是,PALLAS研究中有27.1%的患者因不良事件提前终止治疗,而这一比例在PALOMA-2研究中仅为12.2%。未来还需等待更多研究证据确认CDK4/6抑制剂在乳腺癌辅助治疗中是否可以降低远期复发率或提高OS,以及明确在辅助治疗中的最佳治疗时长及时机等问题。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


