
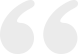
中国临床肿瘤学会神经内分泌肿瘤专家委员会. 中国胃肠胰神经内分泌肿瘤专家共识(2022年版)[J]. 中华肿瘤杂志, 2022, 44(12):1305-1329.
DOI: 10.3760/cma.j.cn112152-20220812-00550
电脑端:
https://share.weiyun.com/gnAjX3dx
手机端:

胃肠胰神经内分泌肿瘤(GEP-NENs)是一种具有高度异质性的肿瘤。根据2019版世界卫生组织消化系统神经内分泌肿瘤的分类和分级标准,GEP-NENs包括分化良好的神经内分泌瘤、分化差的神经内分泌癌和混合性神经内分泌-非神经内分泌肿瘤,根据有无功能分为功能性神经内分泌肿瘤和无功能性神经内分泌肿瘤。中国临床肿瘤学会神经内分泌肿瘤专家委员会专家结合国内外研究进展,对《中国胃肠胰神经内分泌肿瘤专家共识(2016年版)》进行了修订更新,共识的内容包括了GEP-NENs的流行病学、临床表现、生化与影像检查、病理特征以及治疗与随访等。
【关键词】胃肠胰神经内分泌肿瘤;诊断;治疗;专家共识
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是一类起源于干细胞且具有神经内分泌标志物、能够产生生物活性胺和(或)多肽激素的肿瘤。其中,胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs)主要发生在消化道或胰腺,能产生胺类物质和肽类激素,如胰高血糖素、胰岛素、胃泌素或促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)等。中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)神经内分泌肿瘤专家委员会于2013年和2016年制定了《中国胃肠胰神经内分泌肿瘤专家共识》及《中国胃肠胰神经内分泌肿瘤专家共识(2016年版)》,使全国医师对GEP-NENs的认识得到了提高。经过6年的临床实践,结合国内外最新研究进展,专家委员会组织讨论,对《中国胃肠胰神经内分泌肿瘤专家共识(2016年版)》进行了修订更新。本共识共分为两部分,第一部分为胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, pNENs),第二部分为胃肠道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)。
近40年来,随着内镜和生物标志物等技术的进步,NENs的诊断水平不断提高。美国监测、流行病学与最终结果数据库数据显示,NENs的发病率和患病率明显上升,其发病率在过去40年内上升了6倍;截至2012年,NENs发病率为6.98/10万,其中pNENs发病率为0.48/10万,GI-NENs发病率为3.08/10万,胃肠胰神经内分泌癌(gastroenteropancreatic neuroendocrine carcinoma, GEP-NECs)的发病率为0.4/10万,GEP-NENs约占NENs的55%~70%。英国公共卫生署数据显示,2018年NENs发病率约为9/10万,pNENs和直肠NENs发病率上升较为明显,虽然GI-NENs仅占胃肠道恶性肿瘤的2%,但是其患病率仅次于结直肠癌,超过17/10万,居胃肠道肿瘤的第2位。日本国家癌症登记中心数据显示,2016年GEP-NENs发病率为3.532/10万,其中最常见的原发部位为直肠(53%),其次是胰腺(20%)和胃(13%)。国内23家中心共同统计了2000—2010年我国GEP-NENs的流行病学情况,共收集了2010例患者,常见的原发部位是胰腺(31.5%)、直肠(29.6%)和胃(27.0%),而小肠(5.6%)和结肠(3.0%)NENs所占比例相对较小。
东西方NENs的好发部位存在较大差异。美国GEP-NENs最常见的原发部位是小肠,其次是直肠、胰腺和胃。但亚洲小肠原发NENs却十分罕见,如日本小肠NENs仅占所有GEP-NENs的1%。英国GEP-NENs虽然最常见的原发部位也是小肠,但是阑尾位列第3位,发病率为0.95/10万。
pNENs
(一)临床表现
pNENs包括分化良好的神经内分泌瘤(neuroendocrine tumors, NETs)和分化差的神经内分泌癌(neuroendocrine carcinomas, NECs),根据有无功能分为功能性pNENs和无功能性pNENs。由于pNENs类型和分化程度各异,导致pNENs的症状和体征不典型,临床表现多样。
1.功能性胰腺神经内分泌瘤(pancreatic neuroendocrine tumors, pNETs)
常见功能性pNETs有胰岛素瘤和胃泌素瘤,其次为胰高血糖素瘤、生长抑素瘤、血管活性肠肽(vasoactive intestinal peptide, VIP)瘤、分泌ACTH和导致库欣综合征的NETs、导致类癌综合征的NETs、导致高血钙的NETs以及非常罕见的异常分泌黄体类激素、凝乳酶或促红细胞生成素的NETs等(表1)。
(1)胰岛素瘤:胰岛素瘤又称胰岛β细胞瘤,以分泌大量胰岛素而引起发作性低血糖症候群为特征,为器质性低血糖症中较常见的病因。胰岛素瘤约90%为单个肿瘤,也可多发;约90%的肿瘤位于胰腺内,发生在胰头、胰体和胰尾部的各占1/3;肿瘤大多体积较小(82%的肿瘤<2cm,47%的肿瘤<1cm)。99%以上的胰岛素瘤会引起低血糖相关症状,包括对中枢神经系统的影响,如头痛、意识模糊、视觉和行为异常等,或低血糖引起儿茶酚胺过度释放,如出汗、震颤和心悸等。由于症状复杂多样,临床上容易误诊,部分患者在出现症状数年后才能确诊。因此,当患者出现不明原因的清晨昏迷、Whipple三联征(即低血糖症状、血糖水平≤2.2mmol/L、进食或静脉注射葡萄糖后症状能改善)时,应首先考虑排除胰岛素瘤。有研究表明,约18%的患者仅表现为餐后低血糖,21%的患者既往诊断为糖耐量异常或2型糖尿病,即口服葡萄糖耐量试验中胰岛素分泌模式改变。
(2)胃泌素瘤:胃泌素瘤多位于十二指肠或胰腺,包括散发性佐林格-埃利森综合征(Zollinger-Ellison syndrome, ZES)和遗传性的ZES。遗传性ZES即多发性内分泌腺瘤病1型(multiple endocrine neoplasia type 1, MEN1),是一种常染色体显性综合征,约占ZES的20%~30%。ZES主要因胃酸分泌过多产生一系列临床表现,包括单发性和多发性十二指肠溃疡、消化道症状、胃食管反流(gastroesophageal reflux disease, GERD)和腹泻,多数患者是因为长期难治的消化性溃疡(peptic ulcer disease, PUD)和(或)GERD最终才得以确诊。近年来,由于质子泵抑制剂(proton pump inhibitors, PPI)的广泛使用,多发性溃疡已经越来越少见,胃泌素瘤的症状越来越不典型,影响及时诊断,通常从出现症状到确诊需要5.2年。由PUD和(或)GERD引起的腹痛占75%~98%,腹泻占30%~73%,烧心占44%~56%,出血占44%~75%,恶心、呕吐占12%~30%,体重减轻占7%~53%。
(3)罕见的功能性pNETs(rare functional p-NETs, RFTs):胰高血糖素瘤、生长抑素瘤、ACTH瘤、VIP瘤等大部分RFTs诊断时即存在远处转移,5年生存率与肿瘤的生长速度相关,而与激素分泌水平无明显关系。
2.无功能性pNETs(non-functioning pNETs, NF-pNETs)
NF-pNETs约占所有pNETs的60%~90%。在血液和尿液中可能有肿瘤标志物[如嗜铬粒蛋白A(chromograninA, CgA)]或激素水平的升高(如降钙素等),但并不表现出特异的临床症状或综合征。当肿瘤体积增大到一定程度时,可能出现肿瘤压迫的相关症状,如消化道梗阻、黄疸和胰腺炎等,也可能出现转移相关的症状。
3.遗传性NETs
以下遗传性NETs均属于常染色体显性遗传病。
(1)MEN1:约20%的胃泌素瘤、<5%的胰岛素瘤或RFTs为MEN1。MEN1通常以出现甲状旁腺、胰腺、十二指肠和垂体的肿瘤为特征,也常出现支气管和胸腺NETs、肾上腺肿瘤、皮肤病灶、甲状腺疾病和脑膜肿瘤。
(2)视网膜-小脑血管瘤疾病(von hippel-lindau disease, VHL):10%~17%的VHL合并NF-pNETs,可累及多个器官组织,包括肾(肾透明细胞癌)、肾上腺(肾上腺嗜铬细胞瘤)、中枢神经系统(血管母细胞瘤)、眼(视网膜血管母细胞瘤)、内耳(内淋巴囊肿瘤)、附睾(附睾囊腺瘤)及胰腺(浆液性囊性肿瘤和NETs)。
(3)神经纤维瘤病1型(neurofibromatosis 1, NF-1):NF-1也称为Von Recklinghausen综合征(冯·雷克林霍森综合征)、多发性神经纤维瘤综合征。NF-1中有0~10%合并NETs,最常见的是十二指肠生长抑素瘤,也有少部分为pNETs。NF-1常见的临床表现有皮肤出现牛奶咖啡斑(>99%)、多发性神经纤维瘤(>99%)、皮肤褶皱处的雀斑(85%)、虹膜错构瘤(Lisch结节,>95%)、视神经胶质瘤和骨的发育异常;中枢神经系统异常表现为学习障碍、多动症和癫痫。另外,少数患者会出现肾动脉狭窄和嗜铬细胞瘤以及难以控制的高血压。
(4)结节性硬化:少部分结节性硬化患者患有pNETs,主要为结节性硬化症(tuberous sclerosis complex, TSC)1和2的基因突变所致,通常为TSC2突变。患者可出现神经系统症状(癫痫、智力障碍和自闭症)、皮肤改变(面部血管纤维瘤、色素脱失斑、鲨鱼皮斑)以及错构瘤结节(皮质结节、心脏横纹肌瘤、脑室壁室管膜下小结节、肾血管平滑肌脂肪瘤、淋巴管肌瘤病)。
(二)生化指标
血浆CgA是一种由439个氨基酸组成的分子量为48kD的耐热性、酸性、亲水性分泌蛋白,广泛存在于神经内分泌细胞的嗜铬性颗粒内。CgA曾被认为是NENs重要的的标志物,但由于其检测结果受药物或非肿瘤性疾病影响,在NEN诊断与预后判断中的价值有限。神经元特异性烯醇化酶(neuron specific enolase, NSE)也是NENs常用的血清标志物。
少部分pNENs合并类癌综合征时可释放大量5-羟色胺(5-hydroxytryptamine, 5-HT),进一步代谢生成5-羟吲哚乙酸(5-hydroxyindoleacetic acid, 5-HIAA)。测定24h尿5-HIAA是诊断类癌综合征的重要依据。部分不典型类癌综合征的患者血液中5-HT或尿液中5-HIAA水平正常。但目前我国CgA及5-HIAA检测均未应用于临床。
对于功能性NENs,应根据不同的肿瘤类型选择不同的生化指标进行检测,具体如下。
1.胰岛素瘤:应通过72h饥饿试验(有研究认为48h即可)进行诊断,即患者饥饿后出现低血糖症状时,如满足以下6条即可诊断:(1)血糖≤2.22mmol/L(≤40mg/dl),(2)胰岛素水平≥6μU/ml(≥36pmol/l),(3)C肽水平≥200pmol/L,(4)胰岛素原水平≥5pmol/L,(5)β-羟丁酸≤2.7mmol/L,(6)血或尿中无磺脲类药物的代谢产物。上述标准提示,在低血糖状态下,胰岛素分泌没有受到抑制,说明胰岛素瘤在自主分泌胰岛素。目前,推荐采用胰岛素特异性检测方法如放射免疫法、免疫化学发光分析法等。
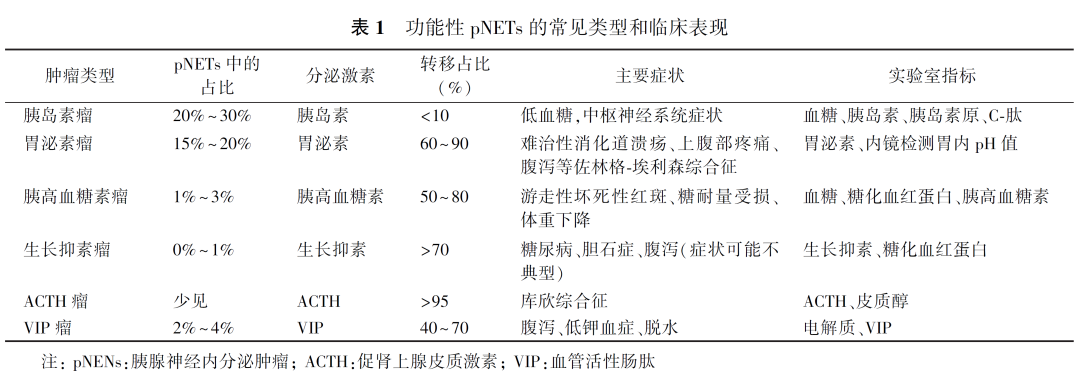
2.胃泌素瘤:98%以上的胃泌素瘤患者空腹血清胃泌素水平升高,但特异度不高,87%~90%的患者胃酸分泌过多,100%的患者胃酸pH<2。怀疑胃泌素瘤的患者,在实验室检查前应当停服PPI,改为服用H2受体阻滞剂,1周后再进行检测。胃泌素瘤的生化诊断流程见图1。少部分胃酸分泌升高的患者,如果胃泌素水平正常、胰泌素刺激试验阴性,应当检测血浆胆囊收缩素水平。
3.RFTs:应当检查相关的激素水平,如怀疑胰高血糖素瘤,应检测血清胰高血糖素;怀疑VIP瘤,应检测血清VIP等(见临床表现部分)。对于pNETs伴有库欣综合征(皮质醇增多症)的患者,除了仔细询问病史并进行体格检查外,应当检测24h尿皮质醇、午夜血浆或唾液皮质醇以及行地塞米松抑制试验。
对于ZES患者,初诊时和每年的随访中均需检查血浆甲状旁腺激素、离子钙和催乳素等,以协助诊断是否伴发内分泌疾病,目的是除外MEN1。对于临床诊断为MEN1等遗传性疾病的pNETs患者,应进行疾病遗传学知识的咨询并作相应的遗传学检测,如对MEN1、VHL、结节性硬化或神经纤维瘤病1型检测相关基因。
(三)影像学检查
pNENs肿瘤生长的位置和转移情况是决定能否根治性切除的关键。推荐的影像学检测手段包括CT、磁共振成像(magnetic resonance imaging, MRI)、生长抑素受体单光子发射计算机断层显像(single photon emission computed tomography, SPECT)及生长抑素受体正电子发射断层显像(positron emission tomography, PET)、18F-脱氧葡萄糖(18F-fluorodeoxy glucose, 18F-FDG)PET-CT、超声检查、超声内镜(endoscopic ultrasound, EUS)、术中超声及选择性血管造影等。
1.常规影像学手段
常规检测手段包括增强CT、MRI、超声检查及EUS等。影像学检查适用于pNENs的诊断、分期、疗效评估及随访等诊疗过程。多数pNENs为富血供肿瘤,其动脉期肿瘤明显强化特征对于定位及定性诊断具有高度提示作用,若无造影剂禁忌证,推荐进行多期增强扫描。北京协和医院的研究结果表明,与常规增强CT比较,胰腺灌注CT以及MRI对于胰岛素瘤诊断的灵敏度和特异度较高,且MRI有助于判断肿瘤与胰管的毗邻关系。因此,如有CT增强扫描禁忌证,建议行MRI检查。MRI因其软组织分辨率高、无辐射,对胰腺、肝脏、脑及骨等特定部位的诊断可酌情考虑使用。当CT怀疑肝转移时,推荐肝脏增强MRI作为进一步检查的手段。有条件者采用肝细胞特异性造影剂,可提高肝转移诊断的灵敏度。对于CT或MRI未能检出的肝脏病灶,可选择超声造影或术中超声。
一般认为,EUS对于pNENs原发灶的检出率较高,但EUS用于检测十二指肠微小肿瘤则灵敏度大大下降。当怀疑患者可能为胃泌素瘤或者胰岛素瘤,而超声检查未能发现肿瘤时,应当采用EUS仔细检查胰腺和十二指肠,必要时在EUS引导下行细针穿刺活检。另外,EUS可以判断肿瘤与胰导管及邻近血管的关系,可评估手术的可行性并决定手术方式。
2.分子影像
(1)生长抑素受体SPECT及PET:生长抑素受体显像因使用的前体化合物、放射性核素以及显像设备的不同,可以包括111In/99mTc-生长抑素类似物(somatostatin analogues, SSA)SPECT显像、68Ga/18F/64Cu-SSA PET-CT或PET-MRI等。生长抑素受体显像用于pNENs定位、辅助诊断及分期,是肽受体放射性同位素治疗(peptide receptor radionuclide therapy, PRRT)选择的必要筛选条件,是SSA类药物应用的参考因素。生长抑素受体显像更适用于NETG1、G2、G3,而NECs因生长抑素受体表达阳性率及阳性程度均较低,且应用SSA类药物以及PRRT治疗的可能较小,不做常规推荐,更适合使用18F-FDG PET-CT。北京大学肿瘤医院的回顾分析显示,100例GEP-NENs SSTR2A免疫组化与生长抑素受体显像结果显示,二者相关性较好,一定程度上可互相补充,优化了生长抑素受体显像的应用。
68Ga/18F/64Cu-SSA(如TATE、TOC和NOC)所标记的是生长抑素受体激动剂类似物,除此之外,生长抑素受体拮抗剂可以特异性结合SSTR2,肿瘤亲和力高,而正常器官组织的生理性摄取较低,对NENs原发灶和转移灶的诊断准确性和特异度得到进一步提高,因此,近年来,68Ga/18F-JR11/LM3生长抑素受体拮抗剂PET也得到了应用。
胰岛素瘤生长抑素受体表达阳性率约为50%~60%,因此生长抑素受体显像诊断胰岛素瘤灵敏度有限,临床可依靠靶向GLP-1及DOPA受体的显像剂进行诊断,相应的显像剂分别为68Ga-Exendin-4及18F-DOPA,其中68Ga-Exendin-4的诊断准确率可以达到90%以上。
(2)18F-FDG PET-CT显像:与其他类型肿瘤相同,18F-FDG反映NENs的葡萄糖代谢水平,分化越差的NENs病灶葡萄糖代谢越高,预后越差。18F-FDG PET-CT显像可用于NENs诊断后的分期、疗效和预后评估,可与生长抑素受体联合显像,全面评估NENs的生物学特点,并为治疗方案制定提供更多依据。
(四)病理学特征
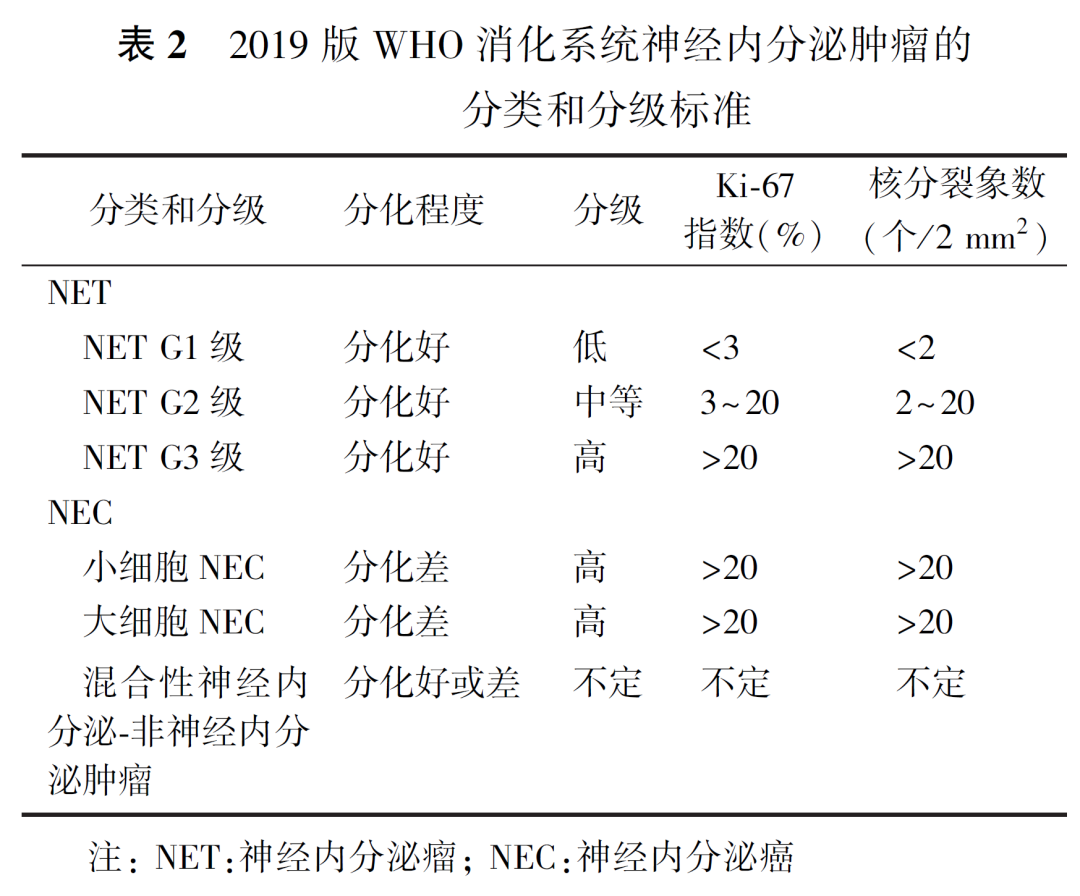
1.组织学特征:pNENs应当按组织分化程度和细胞增殖活性进行分级。增殖活性分级推荐采用核分裂象数和Ki-67指数(表2、3),通常核分裂象数与Ki-67指数呈正相关,少数情况下,两者可能出现不一致,应采纳分级较高的结果。在手术切除的标本中,核分裂象数和(或)Ki-67指数均可使用;在活检小标本中,若计数不足500个肿瘤细胞,依据Ki-67指数评估分级更为可靠;对于细针穿刺行细胞学检查的标本,则难以进行组织学分级。为区分增殖活性达到G3分级,但组织学形态和临床及生物学行为均不同于NECs的一部分NETs,2019版WHO消化系统肿瘤分类正式将它们命名为“高级别神经内分泌瘤(NET G3)”。如遇NET G3诊断和鉴别诊断存疑的患者,需向临床医师沟通说明,通过多学科讨论解决后续诊断和治疗问题,并注意追踪随访以积累诊断经验。
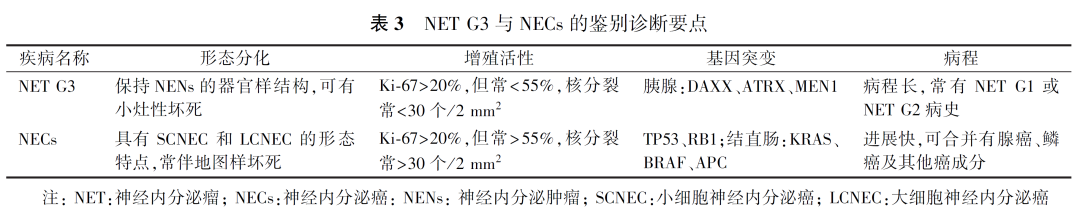
混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasms, MiNENs)是指含有神经内分泌和非神经内分泌成分的混合性上皮性肿瘤,每一种成分在组织学形态和免疫组化上可区分,并且至少占30%。2019版WHO仍然采用了每种成分不少于30%的界值,需要注意的是小灶(<30%)NECs具有重要临床意义,建议在诊断时予以说明各种成分的比例、分化程度、转移成分等。
2.免疫表型特征:免疫组化检查必须包括CgA和突触素(synaptophysin, Syn)、胰岛素相关蛋白1(insulinoma-associated protein 1, INSM1)、Ki-67、SSTR2、ATRX和DAXX,可选项目包括CD56、胰腺特定激素(包括胰岛素、胰高血糖素、胃泌素、生长抑素等);如临床提示有其他激素分泌产生的症状,如库欣综合征,可加染ACTH;如怀疑有腺管瘤栓,可加染淋巴管和血管内皮标志物。ATRX或DAXX蛋白表达缺失与端粒长度改变相关,28%的pNETs原发灶和52%的转移灶发生端粒长度改变,因此表现为ATRX和(或)DAXX表达缺失,而NECs极少见。鉴别NET G3和NECs比较困难的患者,如ATRX、DAXX、menin或p27染色缺失和(或)SSTR2或SSTR5染色阳性,较支持NET G3的诊断;相反,如Rb表达缺失、p53弥漫性阳性或完全缺失以及SSTR2或SSTR5表达缺失,支持诊断NECs。此外,少数NETs可能出现p53的异常表达。鉴于p53和Rb可以作为鉴别NET G3和NECs的标志物,建议病理报告中包括p53和Rb免疫组化阳性细胞百分比和强度。对于原发灶不明的NETs,如果Islet1和PAX8阳性,可以倾向于pNETs。
对于功能性pNENs的临床诊断,应该包括临床症状和诊断性的生化指标变化,特定激素的免疫组化检测有助于进一步证实。如果肿瘤释放入血的激素量较低,无法达到可检测的水平或者未引起相关症状,则不能归为功能性pNETs,但是生长抑素瘤例外,虽然该肿瘤没有特异的临床症状,血中也检测不到生长抑素的异常分泌,仅可通过免疫组化协助确诊,目前仍主张将其归为功能性pNETs。
3.分子变异特征:pNETs常发生MEN1、ATRX和DAXX基因突变,DNA修复基因MUTYH、CHEK2和BRCA2的突变与散发性pNETs相关,而NECs则常具有TP53和Rb基因突变。临床可应用这些基因表型区分pNETs和NECs。
(五)诊断流程
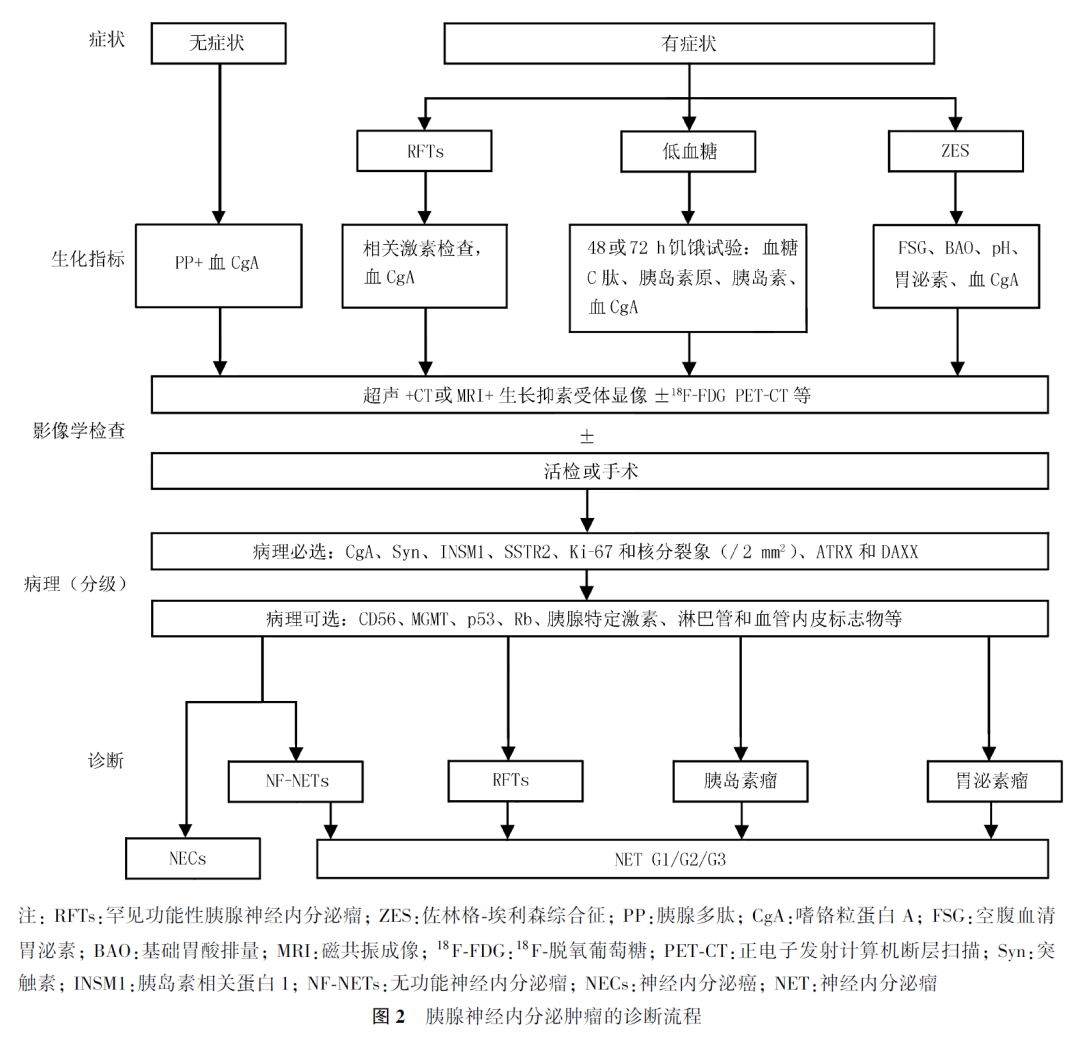
如前所述,对于功能性pNENs的临床诊断应该包括临床症状、与该疾病相关的特殊生化指标如胰岛素瘤、胰高血糖素瘤的血糖水平以及相应激素分泌过多的证据,并通过医学影像学和病理学等检查最终明确诊断。pNENs的诊断流程见图2。
(六)pNENs的治疗
1.手术治疗
(1)局部可切除无功能pNENs
对于局部可切除无功能pNENs,建议手术切除。偶然发现的≤2cm的NF-pNETs是否均需手术切除尚有争议,应全面权衡利弊后慎重做出选择,参考的危险因素包括G2分级、肿瘤>1.5cm、影像学可评估的淋巴结转移和胰管扩张、梗阻性黄疸等。由于无功能pNENs较易出现淋巴结和远处转移,在兼顾手术安全的前提下,积极的外科治疗策略可能改善患者的整体生存。对于>2cm或有恶性临床表现的pNETs,无论是否具有功能,均应行根治性胰腺切除术,包括切除肿瘤及肿瘤侵犯的相邻器官,保证切缘阴性,同时清扫区域淋巴结,最少的淋巴结清扫数目参照胰腺癌手术标准。胰头部的pNETs建议行胰十二指肠切除术,也可根据病灶大小、局部浸润范围等行保留器官的多种胰头切除术;位于胰腺体尾部的肿瘤应行远端胰腺切除术,必要时联合脾切除;位于胰体的肿瘤可在保证切缘阴性的情况下行节段性胰腺切除术。
对于pNETsG3和胰腺神经内分泌癌(pancreatic neuroendocrine carcinomas, pNECs),建议采用胰腺癌的相关标准进行手术治疗。
(2)功能性pNETs
所有功能性pNETs在手术前均需良好控制激素过量分泌引起的临床症状。
①胰岛素瘤:所有胰岛素瘤,无论大小和是否为MEN1,均建议手术切除,85%~95%的患者可能通过手术治愈。手术方式可根据具体情况做出选择。术前应通过CT、MRI和EUS进行精确定位,个别患者需要选择性动脉造影或分段脾静脉采血,术中超声检查也是有效的定位手段。若肿瘤距离主胰管>3mm,可行肿瘤剜除术;如肿瘤位置深,不适合剜除,可根据肿瘤部位行规则性胰腺切除,如胰十二指肠切除或保留脾脏的胰体尾切除,无需常规行淋巴结清扫。术前和术中评估对疑似恶性、出现局部复发或合并肝转移的患者,如有根治性手术可能,原发瘤应当尽可能达到R0切除。
②胃泌素瘤:术前增强CT、MRI、EUS检查有助于胃泌素瘤的精确定位。对于局部可切除胃泌素瘤患者(非MEN1),建议行根治性切除和区域淋巴结清扫。如果紧邻血管或出现血管受侵,建议至专业的胰腺肿瘤中心接受手术。胃泌素瘤合并MEN1或NF-pNETs的患者,如<2cm建议定期随访,>2cm则建议行手术治疗。位于胰头的肿瘤,如远离主胰管,可考虑行剜除术或胰头局部切除,如无法安全剜除,建议行胰十二指肠切除术。在胰体尾部的建议行胰体尾切除术。胃泌素瘤切除手术均需同时行区域淋巴结清扫。由于PPI的疗效显著,现已不推荐常规行胃大部切除术。
③RFTs:所有RFTs的手术治疗原则需根据肿瘤部位和激素过量分泌的临床症状做出综合选择,大多数RFTs较大且易发生肝转移,建议行规则性胰腺肿瘤根治术联合区域淋巴结清扫;对于具有库欣综合征的患者,可考虑行双侧肾上腺切除术。对于胰高血糖素瘤患者,为了避免出现肺栓塞,建议在围手术期进行抗凝治疗。对于VIP瘤患者,术前需纠正低血钾。
(3)局部进展期和转移性pNENs
多学科诊治(multidisciplinary treatment, MDT)在制定手术决策的过程中有重要的作用。对于局部复发、孤立的远处转移或初始不可切除的pNETs经转化治疗后转为可切除病灶,如果患者体力状况允许,应考虑手术切除。神经内分泌肿瘤肝转移(neuroendocrine liver metastases, NELM)的手术治疗部分见肝脏局部治疗部分。对无法达到R0切除的患者,采取转移灶减瘤术或姑息性原发灶切除术是否能够延长生存,目前尚未完全明确。大样本回顾性研究提示,切除原发灶可延长患者生存。在下列情况下,可考虑进行姑息性手术。
① 原发灶切除:为了预防或治疗出血、消化道梗阻以及胆道梗阻等肿瘤相关合并症时,无论pNETs是否有功能,均可考虑原发灶切除。
②减瘤手术(建议切除>90%的病灶):应当认真评估患者的获益风险比。对于有症状的功能性pNETs患者,减瘤手术(切除>90%的病灶)有助于积极控制激素的过量分泌,至于是否可延长生存目前尚有争论。对于NF-pNETs活检证实分级为G1或G2,如果无弥漫性腹膜转移,减瘤术可能有助于延长患者的生存时间。
③ pNETsG3和pNECs:对于pNETs G3和pNECs,同样建议采用胰腺癌的相关标准进行手术治疗。在制定手术决策前需经MDT讨论,全面评估手术的获益风险比。
(4)遗传性pNETs
对于合并MEN1的功能性pNETs,除胃泌素瘤外,均建议手术切除;对于MEN1相关的NF-pNETs,手术原则基本上同散发性pNETs。对多发的pNETs如何切除尚有争议,但出现以下情况应考虑手术切除:①肿瘤在既往6~12个月内生长加速;②肿瘤>1cm。MEN1相关的pNETs即使发生转移,进展也比散发性pNETs慢,部分患者可以观察,不急于行手术治疗。
(5)微创技术用于pNETs
胰腺相关微创技术包括腹腔镜或机器人辅助下远端胰腺切除术、胰十二指肠切除术、剜除术和胰腺中段切除术。与开腹手术比较,微创手术具有术中出血少、术后康复快、住院时间短的优势。虽然目前尚缺乏前瞻性随机对照研究对两者进行直接比较的循证医学证据,然而回顾性病例对照研究表明,两者在手术安全性及围手术期并发症方面差异无统计学意义。患者的肿瘤学获益仍有待更多的临床研究证据支持,建议在有条件的专业胰腺肿瘤中心进行积极探索。
(6)需要注意的问题
进展期pNETs患者手术后若需要长期应用SSA治疗,如患者有胆囊结石,会增加患胆汁淤积和胆囊炎的风险,建议同时行胆囊切除术。合并类癌综合征的患者在术前4天,需静脉应用SSA,如奥曲肽,以防止出现类癌危象。
2.术后治疗
(1)R0或R1切除术后:目前仅有国内回顾性研究结果显示,pNETs术后SSA治疗可降低复发率,改善患者的总生存时间(overall survival, OS)。尚无前瞻性随机对照临床研究证实SSA、化疗或分子靶向药物等用于术后辅助治疗可使pNETs患者获益。部分有高危因素的患者可能在早期发生复发转移,生存时间缩短。常见的复发转移高危因素有G2~G3分级、淋巴结转移、神经或脉管侵犯、梗阻性黄疸等。推荐患者参加辅助治疗的前瞻性临床研究。对于根治术后的pNECs,由于恶性程度高,尽管缺少前瞻性临床研究数据,也推荐患者接受术后辅助治疗,包括全身治疗和(或)局部放疗,辅助化疗推荐采用4~6个周期顺铂或卡铂联合依托泊苷方案。
(2)R2切除术后:对于减瘤术后的患者,应当按晚期pNENs患者的治疗策略进行全身和局部治疗。
3.肝脏局部治疗
NELM可通过手术、射频消融、动脉栓塞及选择性内放射治疗等局部治疗手段控制肝转移灶,有效减轻肿瘤负荷,减少激素分泌,改善患者的生活质量。虽然尚无前瞻性临床研究表明肝脏局部治疗能够改善患者的预后,但在临床实践中,上述局部治疗常与全身治疗联合进行,治疗流程见图3。
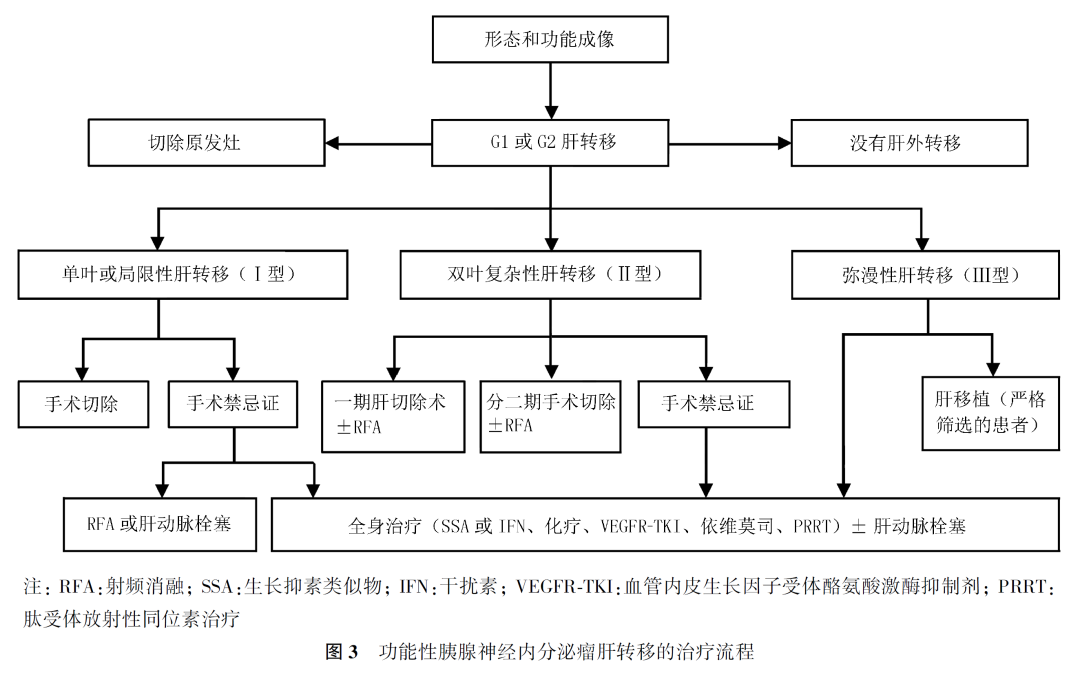
(1)外科手术治疗
外科手术治疗策略主要依据肿瘤分级、原发灶部位、肝转移分型及临床症状决定,确保原发灶可切除(或已切除)、排除肝外转移,功能性残肝体积应≥30%,目标是R0或R1切除。
G1或G2级NELM推荐手术切除(原发灶根治性切除+转移灶R0切除)。NET G3肝转移分化良好,生物学行为更加偏向于NETs,虽然缺乏高级别循证医学证据,但临床上仍推荐手术切除。NECs生物学行为倾向腺癌甚至较腺癌差,肝转移瘤常多发、双叶分布,且术后复发率高,不推荐手术治疗。
2017年欧洲神经内分泌肿瘤学会将肝转移分型分为Ⅰ型(任何大小的单发病灶)、Ⅱ型(孤立转移灶伴较小转移灶,通常累及双叶)和Ⅲ型(转移瘤弥散,双叶分布)。从可切除角度分析,残肝体积足够的前提下(残肝体积≥30%),Ⅰ型归为可切除,通过解剖性肝段切除、联合肝段切除或肝叶切除可达到R0切除;Ⅱ型归为潜在可切除,临床通过单纯手术或联合消融治疗可达到R0或R1切除;Ⅲ型定义为不可切除,不推荐手术治疗。在评估手术安全性的前提下,Ⅰ型和Ⅱ型肝转移可考虑手术切除。
(2)肝动脉栓塞
肝动脉栓塞主要包含单纯经动脉栓塞(transarterial embolization, TAE)、经动脉化疗栓塞(transarterial chemoembolization, TACE)和经动脉放疗栓塞(transarterial radioembolization, TARE)。推荐首选TAE治疗,病理分级比较差、分化较差、肿瘤负荷比较大等情况下可考虑采用TACE。TAE或TACE常用于控制pNENs的肝转移灶,有效率超过50%,有可能延长无进展生存时间(progression-free survival,PFS),但是否能够延长患者的OS尚无定论。对于功能性患者,肝转移无论大小都应行更加积极处理。对于肝转移灶无法切除、伴随的明显症状经SSA治疗也无法控制时,或肝转移瘤在全身治疗后进展、肿瘤负荷量大,可以选择肝动脉栓塞。TARE主要指用发射β射线的放射性核素90Y标记的微球用于选择性内照射。TARE的耐受性好于TAE或TACE,但应警惕远期的放射栓塞导致的肝脏不良反应,例如肝硬化样的形态以及门脉高压,尤其是双叶均接受治疗、随访2年以上的患者。
(3)射频消融治疗(radiofrequency ablation, RFA)
对于<3cm的肝转移瘤可行RFA,症状缓解率达70%~80%,缓解期可持续10~11个月。长径<3cm且数量不多的肿瘤,建议行RFA联合手术切除。
(4)肝移植
当前有小样本的研究证实,不可切除的pNETs肝转移患者可在肝移植后获得长期生存。然而考虑肝移植本身的获益风险比,在术前需经MDT讨论,严格掌握适应证。有研究报道,采用米兰标准行肝移植的患者具有较好的临床获益。对于年龄<60周岁(相对的)、原发灶已切除、同时无肝外转移和分化好的pNETs(G1或G2),当其他手段难以控制临床症状时,肝移植可以作为一种治疗选择。
综上所述,针对pNENs肝脏转移的局部治疗,迄今多为小样本回顾性研究报告,缺乏前瞻性研究,尚无明确的适应证及治疗时机,对于其他部位转移灶的局部治疗也未达成共识。在控制全身病灶的前提下,主诊医师可以根据临床经验考虑局部治疗。
4.pNENs的药物治疗
pNENs患者最常见的转移部位为肝脏,对于低中级别(G1或G2)无法手术切除的局部晚期及远处转移患者,应采取全身治疗联合局部治疗的多学科治疗模式;对于部分无症状的、肿瘤负荷较低同时疾病稳定的患者,可采用观察等待策略;而对于恶性程度较高的NECs,应尽快采取全身治疗。
(1)pNETs G1或G2的抗肿瘤增殖治疗
①生物治疗:SSA包括长效奥曲肽与兰瑞肽水凝胶。安慰剂对照的Ⅲ期CLARINET研究显示了兰瑞肽水凝胶对晚期pNETs的抗肿瘤增殖作用。该研究纳入了204例无功能、生长抑素受体显像阳性、Ki-67指数≤10%的晚期肠胰NETs(pNETs占45%)患者,96%的患者治疗前3~6个月疾病稳定,84%的患者为一线治疗;兰瑞肽水凝胶较安慰剂可显著延长患者中位PFS(分别为未达到和18个月),同时长期使用安全性良好。CLARINET扩展研究也证实了兰瑞肽水凝胶在疾病进展肠胰NETs患者中的疗效(PFS为14个月)。
因此推荐SSA用于生长抑素受体阳性、生长缓慢、Ki-67指数≤10%的晚期pNETs的一线治疗。尽管G2或肝转移瘤负荷>25%的患者也能从SSA的治疗中获益,但SSA治疗的客观有效率(objective response rate, ORR)较低(<5%)。SSA一线治疗Ki-67>10%的pNETs G2是否优于其他治疗方法,缺少随机对照研究数据的支持。
② 分子靶向药物:舒尼替尼与索凡替尼均为口服多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI),可抑制包括血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)在内的多种受体酪氨酸激酶。一项Ⅲ期安慰剂对照随机研究在171例疾病进展的晚期不可切除pNETs患者中比较了舒尼替尼(37.5mg/d)与安慰剂的疗效,舒尼替尼组患者的中位PFS显著延长(分别为11.4和5.5个月,P<0.001),ORR为9.3%(安慰剂组为0);舒尼替尼组患者有OS获益趋势(分别为38.6和29.1个月,HR=0.73,P=0.094)。Ⅲ期SANET-p研究中,索凡替尼治疗晚期疾病进展的pNETs患者(初治患者占34%),中位PFS较安慰剂组显著延长(分别为10.9和3.7个月,P=0.0011),ORR为19%(安慰剂组2%)。
依维莫司是一种口服的mTOR抑制剂。Ⅲ期研究RADIANT-3中纳入410例低、中级别、疾病进展的晚期pNETs患者(40%为初治),依维莫司组患者的中位PFS为11个月,安慰剂组为4.6个月(P<0.001),OS有获益的趋势(分别为44.0和37.7个月,HR=0.94,P=0.30);依维莫司和安慰剂组的ORR分别为5%和2%。Ⅱ期COOPERATE-2研究结果显示,在疾病进展的晚期pNETs患者中,依维莫司联合SSA(帕瑞肽)与依维莫司单药比较,ORR有改善(分别为20.3%和6.2%),但未能延长PFS。因此,目前SSA和分子靶向药物联合通常用于功能性pNETs的症状控制。
Belzutifan为缺氧诱导因子-2α抑制剂。在一项Ⅱ期研究中,61例VHL综合征相关非转移性肾细胞癌且既往未接受过药物治疗的患者口服Belzutifan 120mg/d治疗,在22例合并pNETs的患者中,Belzutifan治疗pNETs的ORR为91%,14%的患者达到完全缓解;患者的中位至缓解时间为5.5个月,中位缓解持续时间未达到(中位随访时间21.8月);常见的3级不良事件为贫血(8%)、高血压(8%)和疲乏(5%)。Belzutifan已获美国食品药物管理局(Food and Drug Administration, FDA)批准用于治疗无需立即手术的VHL相关肾细胞癌、中枢神经系统血管母细胞瘤或pNETs,但尚未于中国上市。
③ 化疗:链脲霉素联合氟尿嘧啶和(或)表阿霉素治疗晚期pNETs G1或G2的ORR为35%~40%,可用于肿瘤负荷较大患者的一线治疗,但链脲霉素尚未获批在我国使用。
回顾性研究结果显示,CAPTEM方案[替莫唑胺(temozolomide, TEM)与卡培他滨联合化疗]治疗晚期pNETs的ORR为54%~70%。一项前瞻性Ⅱ期研究对比了CAPTEM方案和TEM治疗疾病进展晚期pNETs患者(n=145)的疗效,联合治疗(CAPTEM方案)与TEM单药比较延长了PFS(分别为22.7和14.4个月,HR=0.58,P=0.022);TEM与CAPTEM组患者的ORR(分别为34%和40%,P=0.59)与OS(分别为53.8和58.7月,HR=0.82,P=0.42)差异无统计学意义。我国开展的前瞻性随机对照Ⅱ期研究STEM显示,TEM联合替吉奥治疗晚期pNETs(G1~G3)ORR为36.7%,中位随访时间12.1个月,中位PFS、OS均尚未达到。上述两项前瞻性Ⅱ期研究均显示MGMT低表达患者治疗后ORR较高。其他化疗方案还包括达卡巴嗪或奥沙利铂联合氟尿嘧啶类药物的化疗方案。
④PRRT:PRRT是应用治疗性放射性核素标记SSA靶向NENs细胞膜表面的生长抑素受体,利用核素的内照射作用杀伤肿瘤。因此,生长抑素受体显像是PRRT筛选的金标准。2018年美国FDA批准177Lu-DOTATATE治疗分化较好的GEP-NENs。
目前,关于pNETs的PRRT治疗尚无前瞻性、随机对照的Ⅲ期临床研究等高级别证据,美国国立综合癌症网络、欧洲肿瘤学会、CSCO等指南或共识推荐PRRT应用于生长抑素受体表达阳性的pNETs的二线及以上治疗。综合既往的回顾性及前瞻性研究结果显示,PRRT在pNETs中的疾病控制率(disease control rate, DCR)为83%(50%~94%),ORR为58%(13%~73%),PFS为25~34个月,OS为42~71个月。
上述治疗晚期pNETs药物使用的最佳顺序尚不确定,可根据肿瘤生长抑素受体表达、进展速度、肿瘤负荷、患者体力状态与合并症、治疗方法的不良反应及可及性等多种因素制定治疗方案。
(2)pNETs G3抗肿瘤增殖治疗
pNETs G3的治疗缺少大型前瞻性研究数据,回顾性研究采用的治疗方案包括SSA、化疗[CAPTEM方案、FOLFOX方案(奥沙利铂+亚叶酸钙+氟尿嘧啶)、链脲霉素为基础的方案]、分子靶向药物(依维莫司、舒尼替尼)、PRRT等。其中SSA可考虑用于生长抑素受体阳性且肿瘤进展缓慢、肿瘤负荷较小或不适合其他治疗方法的患者。铂类联合依托泊苷治疗pNETs G3的ORR远低于NECs。
(3)pNECs抗肿瘤增殖治疗
NECs一线治疗推荐采用顺铂或卡铂联合依托泊苷方案。回顾性研究及前瞻性随机对照研究显示,顺铂或卡铂联合依托泊苷治疗晚期NECs的ORR为30%~60%,中位OS为11~19个月。一线治疗也可选择IP方案(伊立替康联合顺铂),Ⅱ期及Ⅲ期随机对照研究证实IP方案治疗晚期GEP-NECs与EP方案(顺铂联合依托泊苷)疗效相似,ORR为42%~53%,PFS为5.1~5.8个月,OS为10.2~10.9个月。
目前无公认的NECs二线治疗方案。可考虑采用FOLFOX方案、FOLFIRI方案(伊立替康+亚叶酸钙+氟尿嘧啶)、TEM单药或CAPTEM等化疗方案。如果存在错配修复缺陷(deficient mismatch repair, dMMR)或微卫星高度不稳定(microsatellite instability-high, MSI-H)或高肿瘤突变负荷,可考虑帕博利珠单抗治疗。也有小样本前瞻性研究结果显示,伊匹木单抗联合纳武利尤单抗治疗晚期NECs的ORR为18%~26%,中位PFS为1.9~2.0个月,OS为5.8~8.7个月;
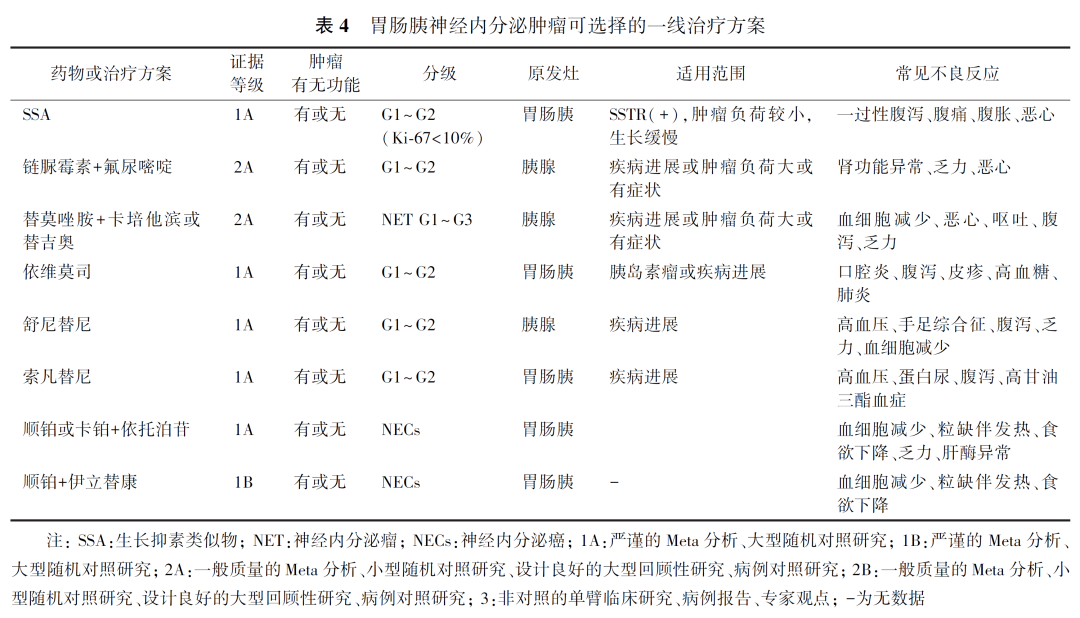
我国学者报道PD-1抑制剂单药治晚期NECs的ORR为18.7%~27.8%。GEP-NENs可选择的一线治疗方案见表4。
(4)控制症状的治疗
①胰岛素瘤:患者可通过少食多餐、静脉输注葡萄糖来调节血糖。二氮嗪(氯甲苯噻嗪)可通过直接作用β细胞抑制胰岛素的分泌,控制患者的血糖水平,但是会引起水钠潴留,需要辅以利尿剂治疗。长效SSA(奥曲肽、兰瑞肽)可控制生长抑素受体阳性胰岛素瘤患者的症状,但在某些患者中可能会加重低血糖,需谨慎使用和严密观察。小样本研究提示,mTOR抑制剂(雷帕霉素、依维莫司)对转移性胰岛素瘤的低血糖症具有一定的疗效。糖皮质激素、干扰素α(interferonα, IFN-α)和PRRT也对控制某些患者的低血糖有效。
②胃泌素瘤:组胺H2受体抑制剂(西咪替丁以及法莫替丁等)和PPI(奥美拉唑、兰索拉唑、泮托拉唑和雷贝拉唑等)能够控制胃酸过量分泌引起的ZES。其中PPI每次给药后的作用时间较长,且长期使用安全性良好,是抑制胃酸分泌的首选药物,推荐起始剂量为奥美拉唑60mg 1次/d口服。H2受体抑制剂同样有效,但所需要剂量较大。虽然SSA也可同时下调胃泌素和胃酸水平,但因非口服制剂而较少使用。长期使用PPI的患者应每年检测维生素B12的水平。长期使用PPI可能会增加骨折尤其是髋骨骨折的风险以及低镁血症。部分患者即使在手术切除肿瘤后仍可能存在胃酸分泌过多,因此PPI的治疗应避免突然中断。
③其他功能性pNETs:SSA对于RFTs的症状控制疗效显著,尤其对于胰高血糖素瘤、生长激素瘤及VIP瘤患者。在某些对SSA疗效不佳的功能性pNETs患者中,IFN-α单药或与SSA联合治疗可用于控制症状。对于有库欣综合征的异位分泌ACTH释放激素或ACTH的pNETs患者,治疗首选药物包括类固醇合成抑制剂,如美替拉酮和(或)酮康唑。难治性库欣综合征的治疗选择包括联合使用肾上腺抑制药物,包括米托坦、依托咪酯、米非司酮或11-β-羟化酶抑制剂Osilodrostat,SSA可能对少数患者有效。此外,肿瘤进展迅速的不可切除患者可以选择双侧肾上腺切除术。
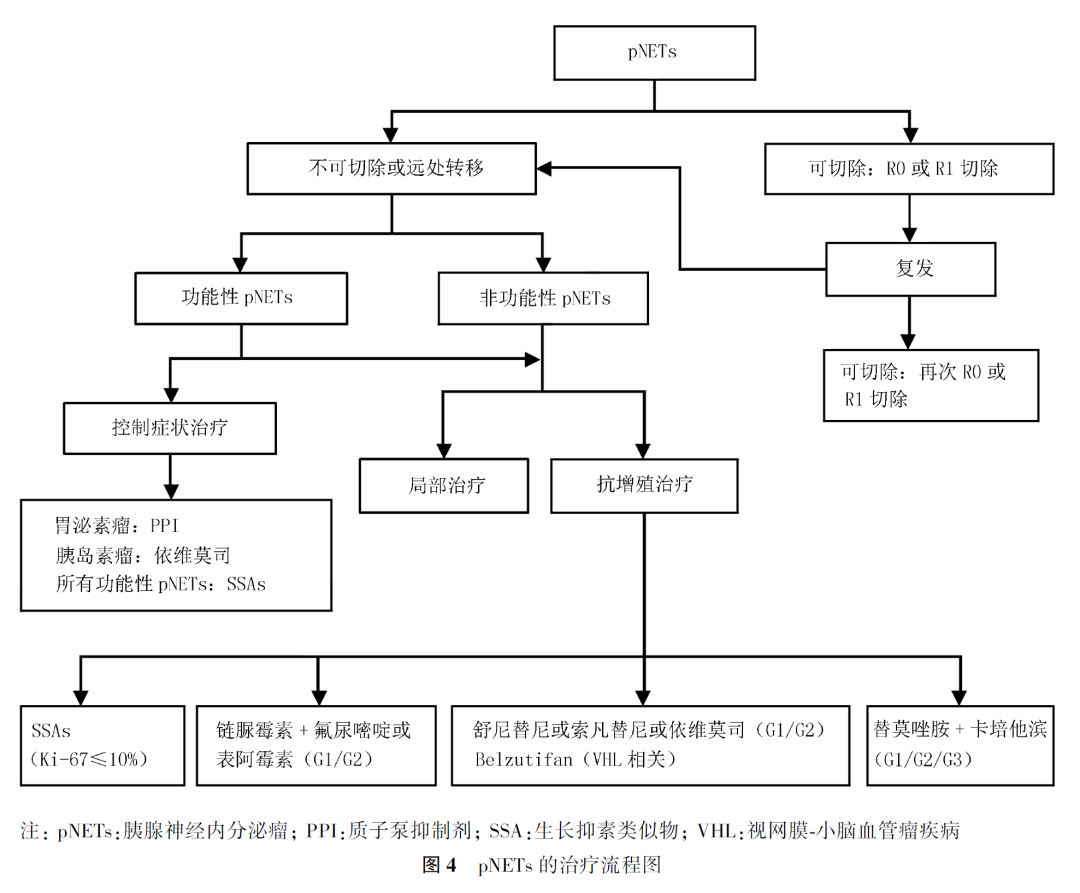
pNETs的治疗流程图见图4。
(七)随访
目前认为,所有的NETs都是具有恶性潜能的肿瘤,应进行终身随访。根治性切除术后的pNETs,Ki-67<5%的患者可每6个月随访1次,Ki-67≥5%的患者每3~6个月随访1次,5年后可延长至1~2年随访1次;若出现症状,应随时复查。对于未手术切除的低危患者,第1年应每3个月随访1次,以后每半年随访1次至少3年,之后每年随访1次。已有远处转移的pNENs患者,应当每3~6个月随访1次。接受治疗的患者随访时间需相应缩短,pNECs患者应按照腺癌的随访要求进行。随访项目推荐CT或MRI和血清CgA、NSE等检查,对于生长抑素受体阳性的pNENs,每12~36个月可结合生长抑素受体显像进行随访。
GI-NENs
(一)临床特征及预后
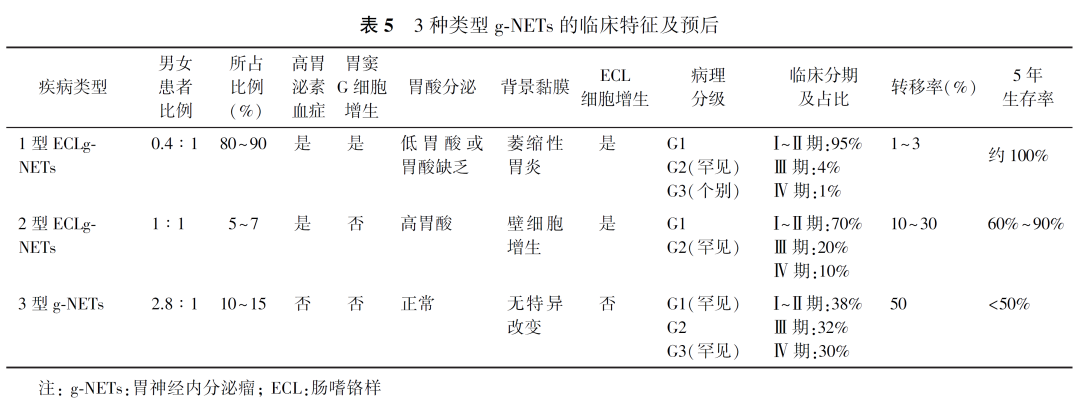
1.胃神经内分泌肿瘤(gastric neuroendocrine neoplasms, g-NENs):分化良好的胃神经内分泌瘤(gastric neuroendocrine tumors, g-NETs)根据病因及发病机制的不同可分为3种亚型,不同分型患者的临床特征及预后不同。1型、2型g-NETs是由高胃泌素血症引起的肠嗜铬样(enterochromaffin-like, ECL)细胞NETs。1型g-NETs较常见,是由(自身免疫性)萎缩性胃炎胃酸缺乏引起,复发率高,临床通常因消化不良、大细胞或缺铁性贫血经胃镜检查时发现,多数预后良好,罕见转移。2型g-NETs的高胃泌素血症则是由于(十二指肠或胰腺)胃泌素瘤引起,患者表现为ZES(烧心反酸、腹痛,或伴腹泻),且多数患者为MEN1。3型g-NETs无背景疾病,血清胃泌素不高,胃酸分泌正常,约50%的患者确诊时有转移(淋巴结或远处转移),多数患者无症状,少数因消瘦、呕血、贫血就医而确诊(表5)。分化差的胃神经内分泌癌(gastric neuroendocrine carcinomas, g-NECs)恶性度高,临床表现及生物学行为类似胃腺癌,预后较差。
2.十二指肠神经内分泌肿瘤(duodenal neuroendocrine neoplasms, d-NENs):75%的d-NENs长径<2cm,大多局限在黏膜层及黏膜下层,虽然>95%的d-NENs分泌GI肽或胺,但90%的患者没有明显的症状,临床上多由于消化不良行胃镜检查时发现。10%的患者可有症状,包括ZES(10%)、类癌综合征(4%)以及其他症状(<1%)。40%~60%的d-NENs伴随区域淋巴结转移。
d-NENs可分为十二指肠胃泌素瘤(约占所有d-NENs的48.3%)、生长抑素瘤(约占所有d-NENs的43%)、无功能性d-NENs(即没有临床症状但免疫组化提示5-HT或降钙素等为阳性的肿瘤)、复合神经节细胞瘤或神经瘤和NEN(旧称节细胞性副神经节瘤)和NECs。散发性ZES胃泌素瘤患者中,d-NENs占50%~88%;MEN1或ZES胃泌素瘤患者中,d-NENs占70%~100%。另外,由于壶腹周围与非壶腹周围的d-NENs的临床、病理学和免疫组化等特征有较大差异,可将d-NENs分为壶腹周围NENs(占所有d-NENs的20%)及非壶腹周围NENs;50%~60%的壶腹周围NENs存在黄疸,易出现疼痛、呕吐及腹泻等不适;壶腹周围NENs更易伴随NF-1(约占18%),且25%~100%患者生长抑素的免疫组化为阳性,但是壶腹周围NENs很少表现出生长抑素分泌相关的临床症状。复合神经节细胞瘤或神经瘤和NENs多位于壶腹周围,肿瘤较大,并侵犯黏膜肌层。
3.空回肠NENs:NETs是美国患者回肠最常见的肿瘤,但在亚洲人群中空回肠NETs发病率低。大多是由于发现转移灶后寻找原发灶或不经意间发现。原发灶引起的最常见的症状为非特异性腹痛,腹痛的主要原因是小肠蠕动障碍、小肠梗阻及肠系膜纤维化引起的肠系膜缺血等。
在转移性小肠NENs中,有20%~30%的患者可表现类癌综合征,其中分泌性腹泻占60%~80%,面部潮红占60%~85%,还有20%表现为类癌心脏病(carcinoid heart disease,CHD)及右心纤维化。95%的肝转移患者表现为类癌综合征,另外腹膜后转移及卵巢转移(约占5%)分泌过量的速激肽或5-HT可越过肝脏直接引起全身性的类癌综合征。此外,肠道缺血也是除类癌综合征外可引起腹泻及腹痛症状的因素。
类癌危象是类癌综合征的严重并发症,通常是由体力活动、麻醉、手术或化疗等引起的潜在致命性的激素大量分泌,临床上常表现为突然出现严重而普遍的皮肤潮红,常持续数小时至数日;腹泻明显并伴有腹痛;严重的支气管痉挛;中枢神经系统症状常见,自轻度头晕、眩晕至嗜睡和深度昏迷;心动过速、心律紊乱、高血压或严重低血压。血5-HT和尿5-HIAA明显增高,激发试验阳性。
4.阑尾NENs:阑尾NENs约占阑尾肿瘤的11%~18%,占肠道NENs的16%~38%;好发年龄约为40岁,70%的肿瘤位于阑尾尖部。由于没有特异的症状,大多系其他原因进行阑尾切除术后病理检查中偶然发现,几乎不合并类癌综合征。肿瘤≤1cm、浸润深度在浆膜下或浸润阑尾系膜<3mm、切缘阴性的患者属于低度恶性,预后较好,阑尾切除术后多无复发风险;而位于阑尾根部、肿瘤>2cm以及深度浸润或切缘阳性的患者复发风险较高。
5.结直肠NENs:早期没有症状,晚期症状与结直肠癌类似,表现为腹痛、肛周坠胀感、贫血及便血等。另外,原发肿瘤或肝脏转移引起的占位效应可引起相应症状。结肠NENs多数为NECs,预后较差,5年生存率约为43%~50%,大部分患者确诊时已出现转移,转移性结肠NENs的生存时间仅为5个月。直肠NENs大多表现为直肠息肉,多数为NETs,总的转移率为2.3%;<1cm直肠NETs发生淋巴结转移概率约为1%~4%,>2cm的息肉以及淋巴血管受侵犯的直肠NENs更易发生转移。
(二)生化指标
与pNENs一样,血浆CgA是常用的肿瘤标志物。类癌综合征的患者肿瘤分泌5-HT,但不建议检测血清5-HT。5-HIAA是5-HT的代谢产物,24h尿5-HIAA检测类癌综合征的灵敏度和特异度分别为90%以上和90%。某些食物和药物会导致血浆5-HIAA水平升高,检测时应严格控制饮食,防止出现假阳性和假阴性的情况。但目前我国CgA及5-HIAA检测均未应用于临床。
必要的生化检测是g-NETs分型诊断的重要依据。1型和2型患者血清胃泌素升高,3型血清胃泌素正常。根据内镜、病理及临床表现特点,怀疑1型g-NETs的患者可化验抗胃壁细胞抗体、内因子抗体、维生素B12水平以协助诊断自身免疫性胃炎。病理诊断为g-NECs的患者无需做血清胃泌素检测,而肿瘤标志物NSE、癌胚抗原(carcinoembryonic antigen, CEA)可能升高。
胃泌素瘤常见于十二指肠和胰腺,因此病理诊断为十二指肠NENs的患者,推荐进行血清胃泌素检测,以排查胃泌素瘤。
血NSE在胃肠道NENsG1或G2中没有诊断价值,但部分晚期患者可见升高,也可用于NECs患者的病情监测。
(三)辅助检查
1.内镜检查及EUS
(1)胃:内镜检查对g-NENs的诊断和临床分型至关重要。1型g-NETs内镜下表现为胃底或胃体的息肉或隆起,75%为多发性病灶,77%肿瘤最大径<1cm,伴萎缩性胃炎内镜表现。需要注意的是,自身免疫性萎缩性胃炎是泌酸区(胃体胃底)萎缩而非泌酸区(胃窦)相对正常,且其萎缩是整个泌酸区同步进行性萎缩,明显有别于幽门螺杆菌感染引起的萎缩性胃炎(萎缩发生是先胃窦再胃体、先小弯再向大弯的进展模式)。怀疑1型g-NETs,镜下活检除了取息肉病灶以外,还要在胃底、胃体和胃窦各取2块黏膜以评估背景疾病。对于少数肿瘤长径≥1cm的患者治疗前应行EUS评估T分期。2型g-NETs内镜表现类似1型,胃底或胃体多发、小息肉样隆起,但背景为肥厚性胃炎样表现,常伴有高胃酸导致的多发性溃疡,胃窦部正常。怀疑2型g-NET时,内镜尽量深入十二指肠至下角,甚至升部,仔细观察,排查十二指肠胃泌素瘤。3型g-NETs和g-NECs内镜下均为单发病灶,可发生于全胃任何部位,胃黏膜正常或各种炎症。
(2)直肠:大多数直肠NETs在体检中偶然发现,常位于直肠中部前壁或侧壁(距离肛门直肠交界处4~8cm),约80%长径<1cm,少数长径>2cm。长径>1cm者,尤其是长径>2cm应警惕淋巴结和远处转移;内镜表现一般为圆形或类圆形扁平隆起,表面黏膜为光滑正常黏膜,色泽常显浅黄色。瘤体可呈亚蒂状、充血伴中央凹陷、糜烂和溃疡等表现,提示肿瘤可能存在浸润及远处转移,但尚无定论。
(3)EUS:内镜下治疗前评估瘤体大小、浸润深度、区域淋巴结转移是关键。研究显示,EUS对NETs病变的浸润深度评估的准确率在91%~100%。
2.影像学检查
常规的影像学手段(CT或MRI)及分子影像的适用要点参见pNENs部分。1型g-NETs无需常规行CT、MRI或生长抑素受体显像,但对于肿瘤长径≥1cm的患者治疗前应行EUS,并行全身影像学检查以明确分期。2型g-NETs由于易合并MEN1,应当行包括垂体、甲状旁腺、胸腹部等部位的全身检查。3型g-NETs和g-NECs应该参照胃腺癌进行全身检查。由于原发灶不明NENs多为小肠来源,CT小肠造影和MRI小肠造影有助于发现和诊断小肠病变,两种成像的价值相当,生长抑素受体PET-CT显像也有助于发现较为隐匿的原发灶。直肠NETs建议行EUS及盆腔MRI判断肿瘤的T、N分期。
(四)病理学特征
胃肠NENs的分级标准与胰腺一致(具体内容参见pNENs病理学特征部分)。
1.g-NENs的病理学特征
g-NENs与胰腺和肠道NENs不同的是高分化g-NETs因其发病机制不同分为3个临床病理亚型。
1型和2型g-NETs在病理上有许多共同之处,两者均来源于胃底和胃体分泌组胺的ECL细胞,故肿瘤只定位于胃底和胃体,呈多发息肉样病变,肿瘤细胞除了表达神经内分泌标志物CgA、Syn、CD56、INSM1外,所有ECL细胞NETs VMAT2、HDC和SSTR2A呈阳性。ECL细胞NETs通常表现为小叶和(或)小梁结构,由分化良好的细胞组成,具有嗜酸性胞浆和均一圆形细胞核,缺乏明显核仁,核分裂象很少,没有坏死,病理分级多为G1或G2,G3罕见。1型和2型g-NETs背景胃黏膜均存在ECL细胞的单纯性增生、线性增生、微结节性增生、腺瘤性增生以及异型增生等各种不同程度的增生性病变。两者不同之处在于基础病因不同所致背景胃黏膜改变不同,1型g-NETs背景黏膜显示胃底和胃体固有腺萎缩,常伴肠化和假幽门腺化生,胃窦黏膜可见胃泌素G细胞增生(Gastrin阳性);而2型g-NETs与之相反,背景胃黏膜显示壁细胞增生,胃窦黏膜胃泌素G细胞不增生(长期使用抑酸药者除外)。
3型g-NETs可以来自胃内各种神经内分泌细胞(例如分泌血清素的EC细胞、分泌胃泌素的G细胞和分泌生长抑素的D细胞,也可以来自ECL细胞),常单发,无部位特异性,病理分级范围为G1~G3,与1型和2型g-NETs不同之处在于背景胃黏膜没有明显萎缩或增生,也没有神经内分泌细胞系列增生现象。
病理医师在诊断g-NETs时,不仅要根据Ki-67指数和核分裂给出明确的病理分级(NET G1、G2、G3),同时还要描述肿瘤周围背景胃黏膜是否正常,是否有萎缩性胃炎或壁细胞增生以及是否有神经内分泌细胞系列增生等改变。可根据肿瘤周围背景胃黏膜改变,并结合胃镜所见及临床病史(胃泌素水平、壁细胞抗体等)对g-NETs提出初步分型诊断。
g-NECs及MiNENs的病理形态特点和诊断标准与胰腺一致(具体内容参见pNENs病理学特征部分)。
2.肠道NENs
(1)组织学特征:肠道NENs具有NENs的组织形态特征,组织分级标准参考2019版WHO消化系统诊断标准。
(2)免疫表型特征:病理组织学诊断应当采用HE染色观察,通过使用几种抗体(CgA、Syn、INSM1)的免疫组化染色来辅助鉴别诊断,各标志物有不同程度的特异度和灵敏度。需要特别指出的是,CgB辅助诊断结直肠NETs,黏液和CEA辅助诊断MiNENs。与pNETs相似,转录因子常用来提示原发部位。中肠NETs表达CDX2,十二指肠NETs还可表达ISL1、PDX1,而来自结直肠的NETs常表达SATB2,后肠NETs也表达PSAP。NECs的发生机制与多种转录因子相关,无器官特异性,目前尚无生物标志物可用于鉴别消化系统NECs的原发部位。
生长抑素受体染色支持NETs诊断,并有助于区分NETs G3和NECs。但在十二指肠产生生长抑素的D细胞NETs中,SSTR2明显缺失,而肿瘤表达SSTR5。
免疫组化Rb和p53见pNENs部分。
(3)分子变异:结直肠NECs也常发生与腺癌相似的KRAS、APC基因变异。20%~50%结直肠NECs发生BRAF V600E突变,右半结肠较多见。可通过下一代测序进行多基因突变分析。对BRAF突变的检测也可采用免疫组化初筛的方法。
在少数结直肠NENs及MiNENs中也发现微卫星不稳定状态。一般而言,dMMR相当于MSI-H,错配修复功能完整相当于微卫星稳定或低度微卫星不稳定。可采用免疫组化初筛,基因检测进一步证实。
(五)GI-NENs的治疗
1.GI-NENs的手术及内镜下治疗
(1)g-NENs
不同分型的g-NENs的治疗原则不同。
① 1型g-NETs:1型g-NETs患者首选内镜下治疗并定期随访。对于<1cm的多发肿瘤,经活检证实后可行内镜下切除或随访观察(长径<0.5cm);对≥1cm的g-NENs,应当行EUS,根据浸润深度和淋巴结转移情况决定内镜下切除还是外科手术切除。1型g-NETs为散在多发,内镜切除难以清除所有病灶,因此胃内复发常见。对于多发性、内镜切除后反复复发的1型g-NETs患者可考虑使用SSA。多个小样本研究结果显示,SSA的使用可减少复发,但具体用法和疗程还缺乏前瞻性的大样本研究。国内研究表明,中药治疗对于1型g-NETs减缓复发及改善症状具有一定作用。
②2型g-NENs:2型g-NENs非常罕见,继发于胃泌素瘤。如胃泌素瘤可切除则建议行外科手术。如原发胃泌素瘤不可切除或伴不可切除远处转移,则建议高剂量PPI联合全身系统性治疗。胃泌素瘤往往与MEN1相关,可能伴发甲状旁腺、垂体等病变,建议对该类患者进行MDT讨论以明确治疗方案。
③3型g-NETs和g-NECs:3型g-NETs患者,当肿瘤侵及固有肌层(T2)及以上或伴淋巴结转移,推荐行根治性切除+淋巴结清扫;如肿瘤<1cm,未侵及固有肌层,病理为NETG1的患者可行内镜下治疗。g-NECs外科手术机会少,切除范围及淋巴结清扫范围同胃腺癌的手术原则。
(2)d-NENs
① 壶腹周围:建议外科手术切除,手术方式主要以胰十二指肠切除为主。对于病理低级别,局限于黏膜层或黏膜下层、长径<2cm的壶腹周围d-NENs,如能保证切缘阴性和手术安全性,可在经验丰富的中心开展局部切除。
② 非壶腹周围:≤1cm的d-NENs,如局限于黏膜或黏膜下层、低级别(G1)且不伴淋巴结转移,建议内镜下切除。对于1cm<肿瘤≤2cm、局限于黏膜或黏膜下层、低级别(G1)且无淋巴结转移的非壶腹周围d-NENs,治疗方式可考虑局部切除或内镜下切除,此部分肿瘤行内镜切除难度较高,并发症相对多见,切缘阳性风险高,建议外科医师与内镜医师充分沟通,谨慎地选择治疗方案。对于肿瘤>2cm或浸润肌层及以上或病理分级G2或G3或伴淋巴结转移,则建议外科手术切除,根据淋巴结转移情况行淋巴结清扫。
经内镜下切除的d-NENs,如术后病理提示肿瘤浸润固有肌层及以上(≥T2)或病理分级G2或G3或切缘阳性,则应根据患者一般情况和意愿决定是否行根治性手术切除。
(3)空回肠NENs
根治性切除+淋巴结清扫(包括肠系膜周围淋巴结)为首选的治疗方式,推荐区域淋巴结清扫数目≥8枚。因小肠NENs有多发倾向,术中必须仔细探查全小肠。由于接受SSA治疗的患者发生胆石症的概率增高,可考虑同时切除胆囊,但目前尚无前瞻性研究证实患者可因此获益。对于存在远处转移的患者,建议通过MDT讨论制定手术方案,无论转移灶可否切除,切除原发灶可能为患者带来生存获益,尤其是有肠梗阻风险的患者。对于有激素分泌症状或者为其他治疗做准备的患者,可考虑行姑息性减瘤手术。
(4)阑尾NENs
阑尾NENs建议外科手术治疗,手术方式包括单纯阑尾切除术和右半结肠切除术+区域淋巴结清扫。≤1cm的阑尾NETs仅行单纯阑尾切除术即可;1cm<肿瘤≤2cm的阑尾NETs,建议行单纯阑尾切除术,如伴有高危因素(R1或R2切除、伴淋巴结转移、肿瘤位于阑尾根部、肿瘤侵犯系膜>3mm、伴有神经血管侵犯、肿瘤分级为G2或G3),则建议行右半结肠切除术+区域淋巴结清扫;>2cm的阑尾NETs或NECs则建议行右半结肠切除术+区域淋巴结清扫。
(5)结肠NENs
结肠NENs建议行根治性手术切除,手术切除范围和区域淋巴结清扫范围参照结肠腺癌。对于肿瘤<2cm、不伴淋巴结转移且病理分级为G1或G2的结肠NENs患者可考虑内镜下切除,内镜下切除切缘阳性者需要行补救性根治性手术(结肠切除术+区域淋巴结清扫)。对伴有不可切除远处转移的结肠NENs,如出现原发部位梗阻、出血或穿孔,则可考虑行姑息性原发灶切除术。
(6)直肠NENs
① <1cm的直肠NETs:分期为T1、不伴淋巴结转移且病理分级为G1或G2,建议内镜下切除;分期为T2、不伴淋巴结转移且病理分级为G1或G2,建议局部切除。
② 1~2cm的直肠NETs:分期为T1、不伴淋巴结转移且病理分级为G1或G2,建议局部切除;分期≥T2或伴淋巴结转移,建议根治性手术切除,手术切除范围和区域淋巴结清扫范围参照直肠腺癌。
③ >2cm或G3直肠NETs:建议行根治性手术切除,手术切除范围和区域淋巴结清扫范围参照直肠腺癌。
④ 直肠NECs:建议行根治性手术切除,手术切除范围和区域淋巴结清扫范围参照直肠腺癌。
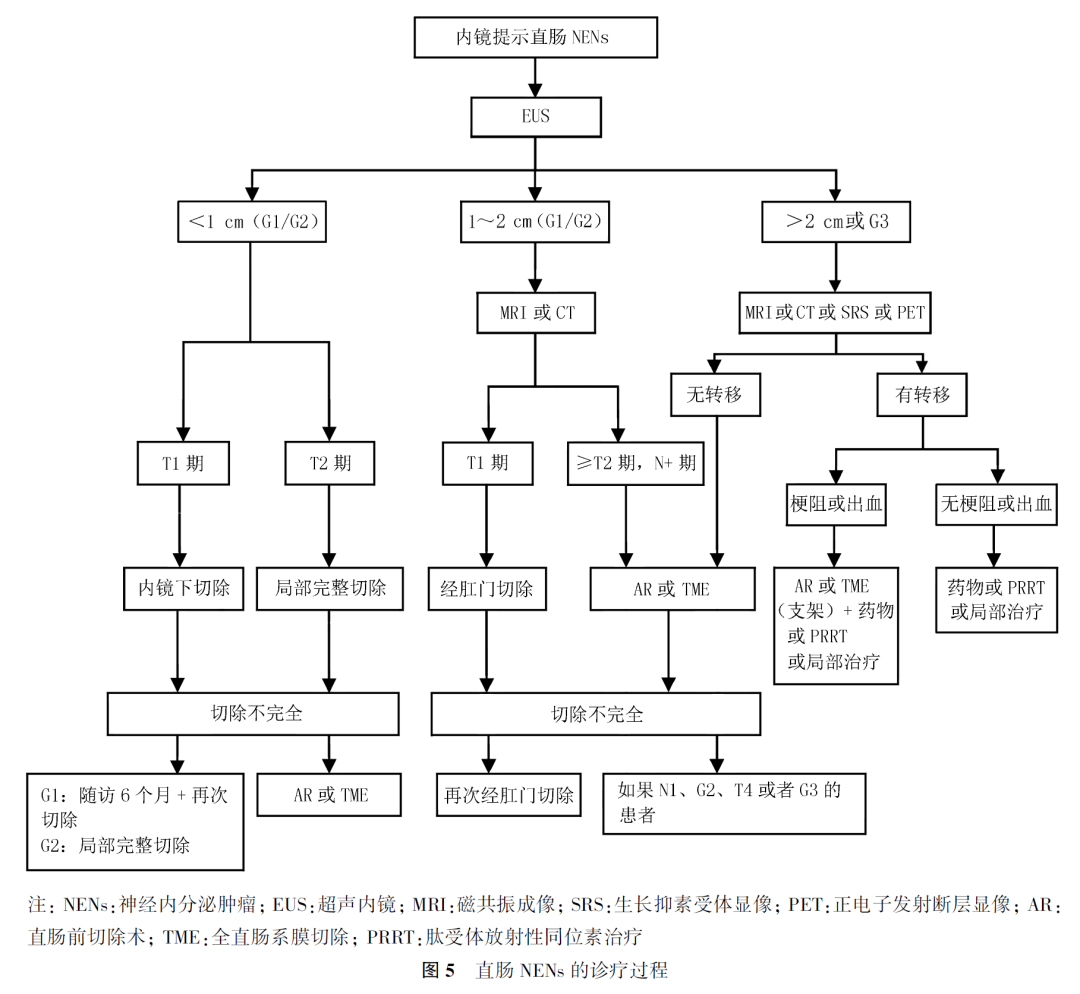
直肠NENs的具体诊疗流程参见图5。
与pNENs一样,肝脏是GI-NENs最容易出现远处转移的部位(具体内容参见pNENs肝脏局部治疗部分)。GI-NETs G1、G2术后不推荐辅助治疗,NETsG3和NECs可考虑辅助化疗。
2.晚期GI-NENs的抗肿瘤增殖治疗
(1)药物治疗:目前可用于晚期GI-NETs G1、G2的抗肿瘤增殖药物包括SSA、依维莫司、索凡替尼等。NET G3或NECs患者治疗参见pNENs药物治疗部分。对于无症状的、肿瘤负荷较低同时疾病稳定的GI-NETs患者,可采取观察等待策略。
安慰剂对照Ⅲ期临床研究PROMID结果证实,一线治疗使用长效奥曲肽可以显著延长晚期中肠NETs患者(G1占95.3%)中位疾病进展时间(分别为14.3和6.0个月,P=0.000072)。CLARINET研究纳入3~6个月内疾病无进展的Ki-67指数≤10%的晚期肠胰NETs患者,兰瑞肽水凝胶皮下注射对比安慰剂治疗,兰瑞肽组中位PFS尚未达到,安慰剂组中位PFS为18.0个月(P<0.001)。因此推荐SSA用于生长抑素受体阳性、生长缓慢、Ki-67指数≤10%的晚期GI-NETs的一线治疗。SSA一线治疗Ki-67>10%的G2 GI-NETs是否优于其他治疗方法,缺少随机对照研究数据支持。
RADIANT-4是一项对比依维莫司与安慰剂治疗非功能性6个月内疾病进展的晚期GI-NETs和肺NETs的Ⅲ期临床研究,结果显示,依维莫司组的中位PFS长于安慰剂组(分别为11和3.9个月,P<0.00001),并降低52%的疾病复发率和死亡率。
随机对照Ⅲ期SANET-ep研究中,纳入198例1年内疾病进展的晚期非胰腺NETs患者(GI-NETs占47%,初治患者33%),与安慰剂比较,索凡替尼使PFS延长5.4个月(研究者评估PFS为9.2和3.8个月,P<0.0001),索凡替尼组ORR也显著高于安慰剂组(分别为10%和0)。
另外,IFN-α可用于缺少其他有效治疗方法的晚期GI-NETs的抗肿瘤增殖治疗。化疗药物治疗晚期GI-NETs的疗效较pNETs差。在一项系统评价中,化疗治疗晚期GI-NETs的ORR为11.5%。对于其他治疗方法无效、Ki-67指数较高或肿瘤显著进展的患者可考虑化疗,方案包括CAPTEM及FOLFOX方案等。
(2)PRRT:NETTER-1研究是PRRT首个Ⅲ期国际多中心随机对照研究,入组的是不可手术的既往长效奥曲肽30mg治疗进展的中肠NETs患者,治疗组为177Lu-DOTATAE+长效奥曲肽30mg,对照组为长效奥曲肽加量至60mg,PFS为主要研究终点,PRRT组较对照组PFS显著延长(28.4和8.5个月,P<0.001),ORR分别为18%及3%,2021年公布的OS结果为48和36.3个月,虽然差异无统计学意义,但PRRT组症状缓解和生活质量评分均优于对照组,后续抗肿瘤治疗少于对照组。目前,PRRT推荐用于生长抑素受体表达阳性的转移性G1、G2级GI-NETs的二线及以上治疗。对于NET G3及NECs,回顾性研究结果表明,PRRT的ORR为31%~41%,DCR为69%~78%,NET G3组PFS为19个月,NECs(Ki-67≤55%)组为11个月,而NECs(Ki-67>55%)组仅为4个月,但上述研究的入组病例60%以上均为胰腺来源,目前尚无前瞻性随机对照研究结果公布。
(3)类癌综合征及相关并发症的治疗:25%~50%的类癌综合征患者合并CHD,导致患者预后差,5年生存率仅55%。由于CHD是导致患者死亡的主要原因,故所有患者应常规(尤其是术前)进行超声心动图排查,并可通过动态监测B型利钠肽及其前体早期发现CHD。CHD的主要表现为右心内膜增厚,呈斑点状、纤维化样改变,导致三尖瓣以及肺动脉瓣回缩、固定,导致右室扩大,三尖瓣反流及右心功能衰竭。右心室压增高和右房增大可导致卵圆孔重开,从而导致左心受损,这种情况下应行卵圆孔修补术。如果诊断CHD,应当在类癌综合征及肿瘤控制稳定时行瓣膜置换术,以延长患者的生存时间。若患者存在肝转移,应当在处理肝转移灶前行瓣膜置换术。
类癌综合征应采用SSAs控制症状,可改善70%~80%患者的皮肤潮红和腹泻;对于难治或耐药等情况,除肝转移灶的局部治疗外,可增加SSA剂量或缩短注射间隔,以缓解症状。在症状间歇性加重的情况下也可皮下注射短效奥曲肽。帕瑞肽是与生长抑素受体亚型1~3和5具有高结合力的SSA,对于所有方案失败的患者可以尝试使用。此外,IFN-α用于症状控制时(3~5 MU皮下注射,每周3次)疗效与SSA相似,由于不良反应较多,可用于生长抑素受体阴性患者或在SSA疗效不佳时与SSA联合使用。特罗司他乙酯是色氨酸羟化酶(5-HT合成的限速酶)的口服抑制剂,两项随机对照Ⅲ期研究(TELESTAR,TELECAST)证实,特罗司他乙酯与安慰剂比较,可显著减少难治类癌综合征患者的排便次数。因此,特罗司他乙酯(250mg 3次/d)联合SSA可用于治疗SSA控制不佳的类癌综合征相关的腹泻。PRRT也可改善SSA疗效不佳的类癌综合征症状。类癌综合征症状在PRRT治疗期间或之后可能发生一过性加重,需要加以重视。
(六)随访
随访总则及复查项目参见pNENs部分。姑息切除、未切除或转移的NENs患者,应每2~3个月随访1次。行根治性切除的NEC患者应按照相应部位的腺癌进行随访。
1.g-NENs:1型g-NETs患者建议每6~12个月随访1次共5年,包括胃镜和相关化验(维生素B12和甲状腺功能),5年后每年随访1次。对于R0或R1术后g-NENs患者,建议每3~6个月随访1次共5年,以后每年随访1次。
2.d-NENs:对于内镜下完整切除后、无症状的患者,应在半年、2年和3年时复查;根治手术后的患者,建议第1年每半年复查1次,以后每年复查1次;不可切除、存在远处转移、没有症状或疾病进展缓慢无需治疗的患者应当每3~6个月复查1次。
3.空回肠NENs:G1、G2肿瘤术后的患者,每6~12个月随访1次。
4.阑尾NENs:对于<1cm或1~2cm间R0切除之后的患者不需随访。而对于具有高危因素(阑尾周围深度浸润或血管侵犯)、R1切除、肿瘤>2cm的患者,建议每3~12个月随访1次。
5.结直肠NENs:结肠NET G1、G2术后的患者,每6~12个月随访1次。直肠NETs肿瘤<1cm者没有固定随访要求,如怀疑复发,建议行内镜检查;肿瘤1~2cm者,每年随访1次;肿瘤>2cm者,每3~12个月随访1次。
结语
在我国,临床医师对于GEP-NENs的认识已经从起步走向重视的阶段,但是对于许多问题的认知缺乏充分的循征医学证据加以证实支持。我们在参考国际指南的基础上形成了本共识的新版,主要是希望临床医师在工作中,特别注意GEP-NENs以及与其他疾病的鉴别,规范诊疗行为和提高研究水平;针对具体的患者,应当综合多方面的情况,全面衡量,实施个体化的诊疗。本共识亦将根据有关研究的不断进展,定期加以更新和完善。
本文为提前在线版本,如有不一致之处,以正式发表版本为准。出版日为每月23日,网站和数据库更新有时间差。欢迎正式出版后下载全文:
1. 机构用户IP:中华医学期刊全文数据库(http://www.yiigle.com/)右上角IP登录,正常检索/查看/下载即可
2. 个人帐号:绑定中华医学期刊机构用户后,直接登录本刊官网(http://www.chinjoncol.com/)检索/查看/下载全文(通过万方、知网检索也将跳转至本刊官网)
3. 年卡或单期购买用户:详询中华医学期刊网会员服务
4. 纸质版期刊订阅:中国邮政网上营业厅(https://11185.cn/)检索“中华肿瘤杂志”在线订购,或到全国各地邮局订阅,邮发代号2-47。需提前预定。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


