来源:肿瘤资讯
结直肠癌是一种高度异质性肿瘤,同一级别的结直肠癌在生存期和治疗疗效上存在显著差异,不同结直肠癌患者的分子特征可以解释部分差异。目前有多项研究基于临床信息、基因特征、染色体变异等信息对结直肠癌进行分子分型以解释结直肠癌的肿瘤异质性。但目前这类研究众多,没有一个固定的分型标准和预后评估,在2015年Nature Medicine上发表一篇关于结直肠癌的分子分型[1],共收集18个数据集(6个分型研究)通过筛选共选取3,962 个样本,通过对数据清洗分析将结直肠癌分为4个亚型:CMS1(MSI免疫型),CMS2(经典型),CMS3(代谢型),CMS4(间充质型)。这四种亚型具有不同的分子特征同时可以评估患者预后,根据临床数据表明CMS4 型的总生存期和无复发生存期最差;CMS1型复发后生存期较低,CMS2型复发后生存期最高。

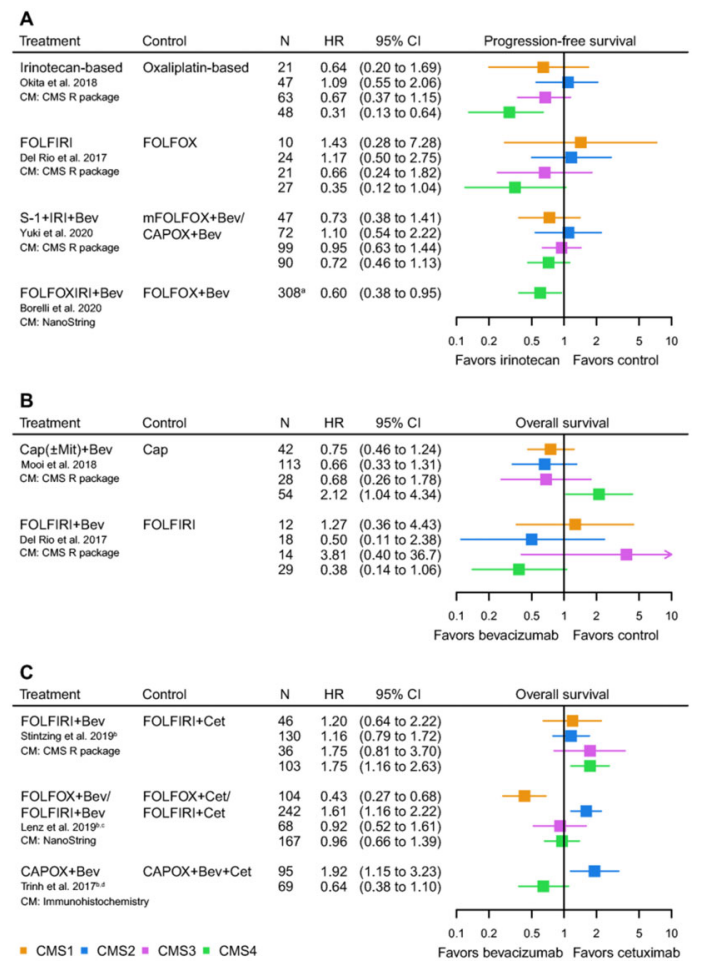
在随后的研究中发现结直肠癌的CMS分型可以进行药物疗效预测。在III期临床试验(CALGB/SWOG 80405)[2]中发现CMS1 亚型更能从贝伐珠单抗中获益,而CMS2亚型则更能从西妥昔单抗中获益。但在针对转移性结直肠癌的II期临床试验(AGITG MAX )[3]中则发现在贝伐珠单抗治疗中CMS2亚型与最佳结果相关,CMS1亚型与最差结果相关。
目前针对结直肠癌CMS分型与预后和用药评估的研究众多,需要对其进行一个系统分析。本文[4]通过对结直肠癌CMS分型文献检索发现共4380项研究,通过筛选最后共收集35项研究,其中21项研究展示预后,22项研究提示预测信息。通过对肿瘤分期和CMS分型统计发现在转移性结直肠癌中CMS4亚型占据比例较多,而CMS1亚型则更多出现在局灶性结直肠癌中[5]。
在分析CMS分型和预后相关性中主要从两个方面来评估,在局灶性(I-III期)结直肠癌中发现CMS4亚型的预后最差,这可能与CMS4亚型的侵袭性和间充质性导致早期转移原因相关。在转移性结直肠癌中则发现CMS1亚型的mOS最低,CMS2亚型最高。在转移性和局灶性结直肠癌中CMS2亚型是预后最好的亚型。
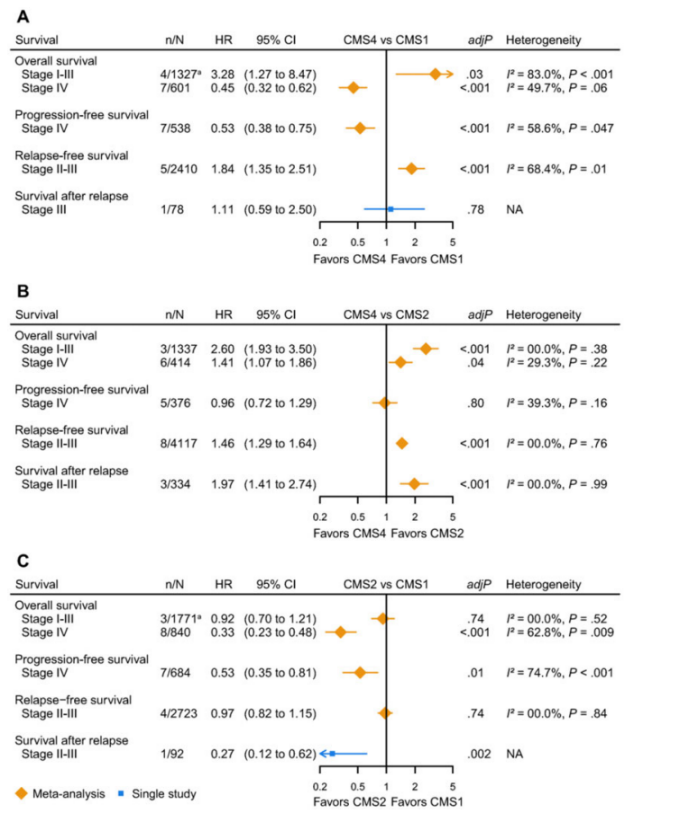
从化疗药物疗效预测层面上看,在局灶性结直肠癌中,与单纯手术相比,辅助化疗改善了 CMS2 和 CMS3 的 II 期和 III 期的 OS。但与 CMS1 和 CMS4 肿瘤的生存率没有明显相关性。不同亚型之间的治疗疗效差异可能是由于上皮与间充质肿瘤和免疫原性肿瘤之间的内在分子差异所致。
从转移性结直肠癌中发现伊立替康可增加 CMS4 亚型肿瘤患者的 PFS 和 OS。对于 CMS1亚型也观察到基于伊立替康的方案的生存率略有增加。考虑到结直肠癌的目前一线治疗的化疗方案通常以奥沙利铂为基础,因此这些发现很重要。
在靶向药物治疗中发现CMS2和CMS3更能从贝伐珠单抗联合卡培他滨化疗中获益;在CMS4亚型中与单纯化疗相比贝伐珠单抗联合化疗方案更能获益,但要低于西妥昔单抗联合化疗疗效;但在CMS1亚型中贝伐珠单抗联合化疗更能获益[6]。
结直肠癌患者的预后评估最初主要基于肿瘤的TNM分期,但是由于结直肠癌存在较高的肿瘤异质性,导致TNM分期在预后评估方面存在一定的局限性。现有研究表明通过基因变异等信息可以对结直肠癌进行分型,从而更好的预测预后和临床治疗。
在结直肠癌中通过检测指南推荐检测基因、靶向药物敏感性和耐药性相关基因、免疫相关信息,提示靶向治疗和免疫治疗相关信息,为患者的后续用药方案提供依据。
1.Lenz HJ, Ou FS, Venook AP, Hochster HS, Niedzwiecki D, Goldberg RM, Mayer RJ, Bertagnolli MM, Blanke CD, Zemla T, Qu X, Wirapati P, Tejpar S, Innocenti F, Kabbarah O. Impact of Consensus Molecular Subtype on Survival in Patients With Metastatic Colorectal Cancer: Results From CALGB/SWOG 80405 (Alliance). J Clin Oncol. 2019 Aug 1;37(22):1876-1885. doi: 10.1200/JCO.18.02258. Epub 2019 May 1. Erratum in: J Clin Oncol. 2020 Feb 20;38(6):656. PMID: 31042420; PMCID: PMC6675593.
2.Mooi JK, Wirapati P, Asher R, Lee CK, Savas P, Price TJ, Townsend A, Hardingham J, Buchanan D, Williams D, Tejpar S, Mariadason JM, Tebbutt NC. The prognostic impact of consensus molecular subtypes (CMS) and its predictive effects for bevacizumab benefit in metastatic colorectal cancer: molecular analysis of the AGITG MAX clinical trial. Ann Oncol. 2018 Nov 1;29(11):2240-2246. doi: 10.1093/annonc/mdy410. PMID: 30247524.
3.Ten Hoorn S, de Back TR, Sommeijer DW, Vermeulen L. Clinical Value of Consensus Molecular Subtypes in Colorectal Cancer: A Systematic Review and Meta-Analysis. J Natl Cancer Inst. 2022 Apr 11;114(4):503-516. doi: 10.1093/jnci/djab106. PMID: 34077519; PMCID: PMC9002278.
4.Coebergh van den Braak RRJ, Ten Hoorn S, Sieuwerts AM, Tuynman JB, Smid M, Wilting SM, Martens JWM, Punt CJA, Foekens JA, Medema JP, IJzermans JNM, Vermeulen L. Interconnectivity between molecular subtypes and tumor stage in colorectal cancer. BMC Cancer. 2020 Sep 4;20(1):850. doi: 10.1186/s12885-020-07316-z. PMID: 32887573; PMCID: PMC7473811.
5.Song N, Pogue-Geile KL, Gavin PG, Yothers G, Kim SR, Johnson NL, Lipchik C, Allegra CJ, Petrelli NJ, O'Connell MJ, Wolmark N, Paik S. Clinical Outcome From Oxaliplatin Treatment in Stage II/III Colon Cancer According to Intrinsic Subtypes: Secondary Analysis of NSABP C-07/NRG Oncology Randomized Clinical Trial. JAMA Oncol. 2016 Sep 1;2(9):1162-9. doi: 10.1001/jamaoncol.2016.2314. PMID: 27270348; PMCID: PMC5065181.
6.Stintzing S, Wirapati P, Lenz HJ, Neureiter D, Fischer von Weikersthal L, Decker T, Kiani A, Kaiser F, Al-Batran S, Heintges T, Lerchenmüller C, Kahl C, Seipelt G, Kullmann F, Moehler M, Scheithauer W, Held S, Modest DP, Jung A, Kirchner T, Aderka D, Tejpar S, Heinemann V. Consensus molecular subgroups (CMS) of colorectal cancer (CRC) and first-line efficacy of FOLFIRI plus cetuximab or bevacizumab in the FIRE3 (AIO KRK-0306) trial. Ann Oncol. 2019 Nov 1;30(11):1796-1803. doi: 10.1093/annonc/mdz387. PMID: 31868905; PMCID: PMC6927316.

















 苏公网安备32059002004080号
苏公网安备32059002004080号


