来源:肿瘤资讯
在结直肠癌中预测免疫治疗疗效主要通过TMB和MSI两个指标1-3,但临床发现在MSS患者中存在一部分患者对免疫治疗有应答。此外,研究发现肿瘤浸润淋巴细胞(TIL)、以及部分基因变异等指标会影响免疫应答4,5。本文报道了一篇临床研究,通过各类检测平台分析MSI或POLE/D1变异,与TIL、TMB之间的关系。
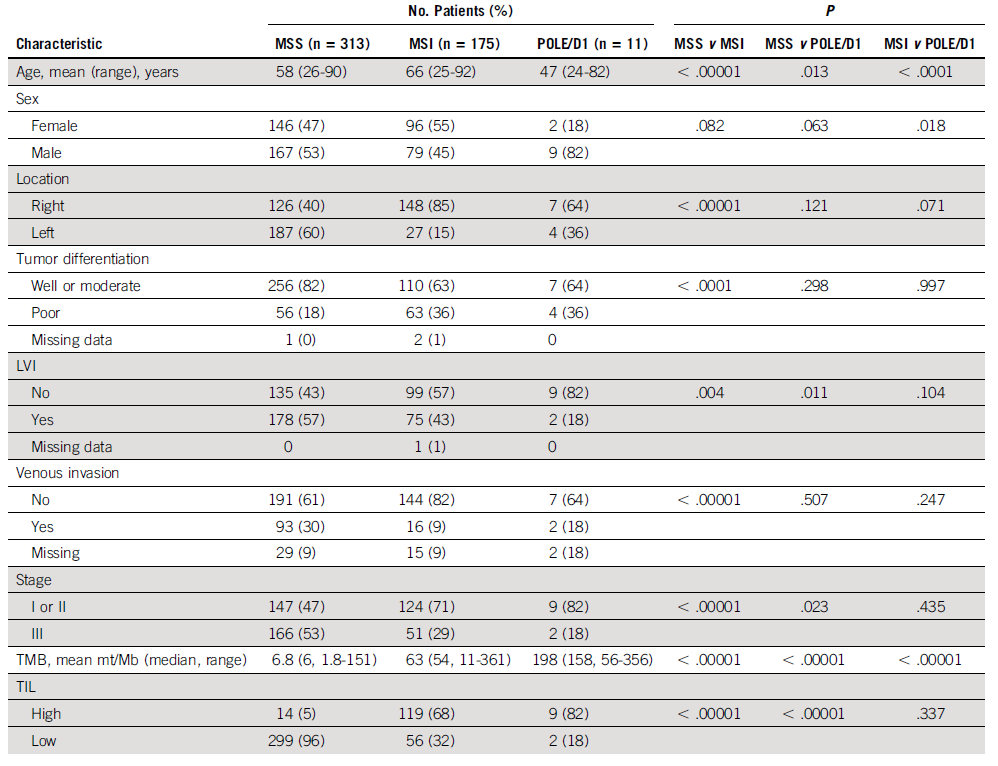
此次研究共收集499例结肠癌患者(MSS n=313;MSI n=175;POLE/D1 n=11),其中357例(72%)患者是免疫低浸润,142例(38%)患者出现免疫高浸润,进一步分析发现,在MSI-H、POLD/E1、MSS亚组中的免疫高浸润比例分别为68%、82%、4.5%。在MSI-H、POLD/E1、MSS亚组中的TMB分别为54 mut/Mb、158 mut/Mb、6 mut/Mb。但TMB和TIL之间无明显相关性。
利用MSK-IMPACT panel对患者进行NGS测序,与MSI-H和MSS亚组相比,POLE/D1亚组中的错义突变、剪切区域突变和无义突变比例相对较高,这是与POLE/D1基因的功能相关。而在MSI亚组中的插入缺失突变比例较高。
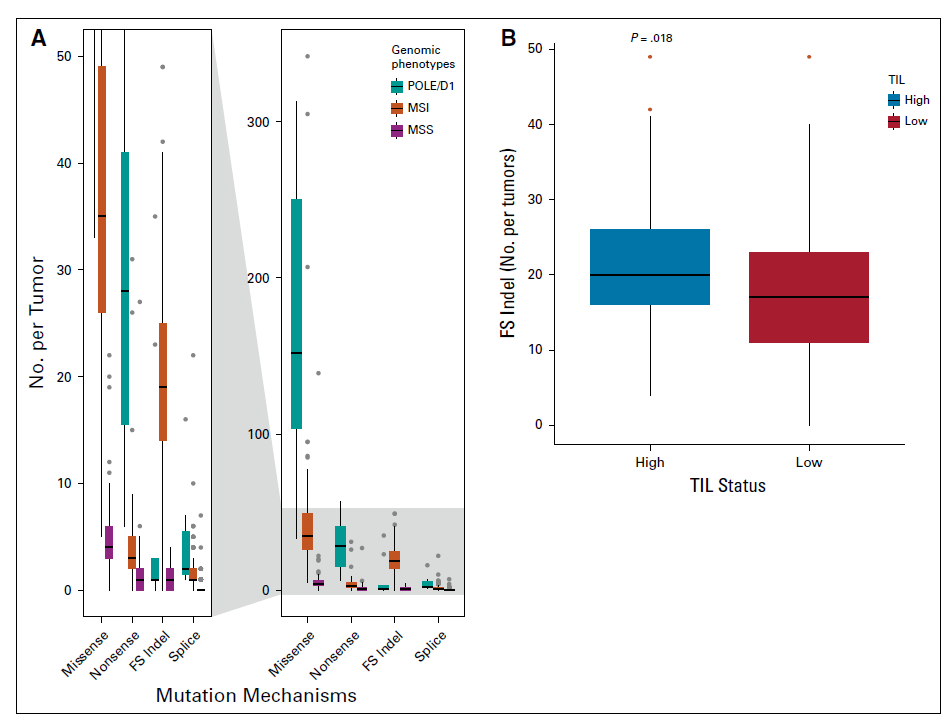
检测结果发现在MSI-H亚组中, TIL 高浸润的肿瘤中移码插入缺失的中位数显著增高,其他无明显差异,在MSS亚组中基因变异类型无明显差异;在MSS亚组中与TIL低浸润相比,TIL高浸润中TGF-β 信号通路、RAS、Hippo 信号通路发生变异的频率增加。但在MSI-H患者中没有发现明显差异。
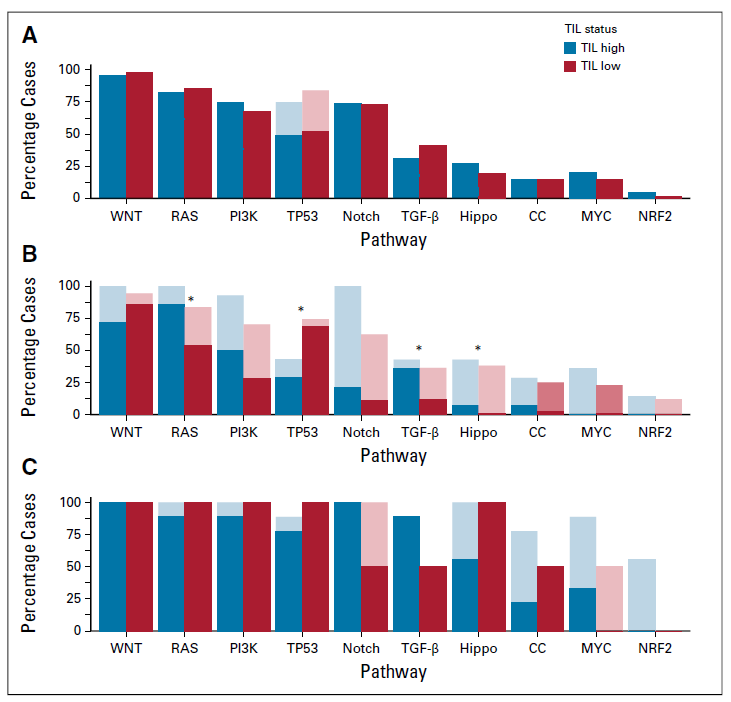
之前已有研究报道,上述信号通路变异与免疫之间存在一定相关性。一些研究表明,TGF-β信号通路的改变可能消除TGF-β介导的免疫逃逸,以及通过CD8活性促进免疫浸润6,我们的研究数据也验证了这一结论。在小鼠模型中,抑制TGF-β信号通路促进结肠癌对免疫治疗有反应7,8,目前一些临床试验正在研究免疫结合TGF-β抑制剂治疗实体瘤。尽管有研究表明RAS突变与免疫排斥有关,但KRAS的致病性变异可能与SNV变异衍生的新抗原有关,由这些RAS突变产生的抗原决定簇具有T细胞免疫原性,可以介导CD8+和CD4+ T细胞应答9。Hippo 信号通路下游效应蛋白与免疫调节相关,且Hippo 信号通路中的一些基因与WNT信号通路有着复杂的关联,而WNT信号通路的下调与MSS中T细胞浸润减少相关7,但本研究中未发现TIL与WNT信号通路具有相关性。
综上结果表明,在结肠癌中TIL和基因变异之间具有相关性,不同TIL浸润之间存在基因差异,这些差异可能有助于揭示肿瘤免疫以及免疫治疗反应的预测因子,这对临床治疗疗效,尤其是免疫应答具有重要提示作用。
目前研究表明在实体瘤中需要多指标综合预测肿瘤的免疫治疗疗效。需要多技术多维度分析才更可能发现肿瘤内在的分子机理和生物标志物,阔然基因目前在实体瘤中推出了NGS联合NGP检测概念,更准确、全面评估肿瘤突变谱和免疫微环境,从而预测患者预后和用药疗效。
参考文献
1.Andre, T. et al. Health-related quality of life in patients with microsatellite instability-high or mismatch repair deficient metastatic colorectal cancer treated with first-line pembrolizumab versus chemotherapy (KEYNOTE-177): an open-label, randomised, phase 3 trial. The Lancet Oncology 22, 665-677, doi:10.1016/s1470-2045(21)00064-4 (2021).
2.Andre, T. et al. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383, 2207-2218, doi:10.1056/NEJMoa2017699 (2020).
3.Marabelle, A. et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. The Lancet Oncology 21, 1353-1365, doi:10.1016/s1470-2045(20)30445-9 (2020).
4.Jimenez-Rodriguez, R. M. et al. Quantitative assessment of tumor-infiltrating lymphocytes in mismatch repair proficient colon cancer. Oncoimmunology 9, 1841948, doi:10.1080/2162402X.2020.1841948 (2020).
5.Tougeron, D. et al. Tumor-infiltrating lymphocytes in colorectal cancers with microsatellite instability are correlated with the number and spectrum of frameshift mutations. Mod Pathol 22, 1186-1195, doi:10.1038/modpathol.2009.80 (2009).
6.Gunderson, A. J. et al. TGFbeta suppresses CD8(+) T cell expression of CXCR3 and tumor trafficking. Nat Commun 11, 1749, doi:10.1038/s41467-020-15404-8 (2020).
7.Harvey, K. F., Zhang, X. & Thomas, D. M. The Hippo pathway and human cancer. Nat Rev Cancer 13, 246-257, doi:10.1038/nrc3458 (2013).
8.Mariathasan, S. et al. TGFbeta attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature 554, 544-548, doi:10.1038/nature25501 (2018).
9.Tran, E. et al. T-Cell Transfer Therapy Targeting Mutant KRAS in Cancer. N Engl J Med 375, 2255-2262, doi:10.1056/NEJMoa1609279 (2016).















 苏公网安备32059002004080号
苏公网安备32059002004080号


