随着乳腺癌患者生存时间的明显延长以及新型药物对原发病灶部位的有效控制,乳腺癌脑转移的发病率逐年升高。一项回顾性研究发现,HER2阳性乳腺癌患者中枢神经系统转移的比例可达到30%-55%,高于其他乳腺癌亚型[1]。HER2阳性乳腺癌一旦发生脑转移,其预后较差,这类患者的有效管理成为临床面临的一大挑战。尽管小分子酪氨酸激酶抑制剂(TKI)的出现,为这部分患者带来了部分治疗选择,但患者的选择依旧十分有限,而随着新一代ADC药物的诞生,其能否进一步为这部分患者带来新的治疗机会呢?本期【肿瘤资讯】特别邀请到广东省人民医院廖宁教授,结合2022 ESMO大会最新公布TUXEDO-1研究和DAISY研究数据,深入解读HER2阳性乳腺癌脑转移的前沿进展,共探未来。
本期特邀专家——廖宁教授

HER2阳性脑转移患者治疗选择有限,ADC药物能否突破屏障再下一城?
目前,局部治疗和神经外科手术一直是脑转移瘤治疗的主要手段,但患者的预后通常较差[2]。在HER2阳性转移性乳腺癌脑转移中,总生存期大约也只有24个月[3]。对于不适用局部治疗的患者,全身治疗已成为全脑放疗(WBRT)的一种潜在的替代方法,旨在预防 WBRT 相关的神经认知功能下降。全身治疗领域的研究最初集中在小分子酪氨酸激酶抑制剂 (TKI),这是由于其分子量小可透过血脑屏障 (BBB),但大分子如抗体和抗体药物偶联物 (ADC)则渗透率低,通常认为无效。然而,目前越来越多的疗效证据表明并非如此。血脑屏障的通透性主要取决于两个因素,其中一个是物质本身的性质和状态,例如分子量越小、脂溶性越高的药物通过BBB的速度越快,而另一个因素是血脑屏障的结构和功能,例如高渗、高温可增加BBB通透性,肿瘤、电离辐射、激光、超声波等可引起BBB功能改变[4、5]。目前,也有研究认为由于 BBB 在转移部位被破坏,并被具有较高内皮开窗的血-肿瘤屏障(BTB)取代,大分子也可能穿透脑实质[6、7](图1)。此外,也有不少报道提示放疗会导致脑转移屏障的破坏 [8],从而有利于大分子的通过。但总体而言,对于脑转移患者大分子通过血脑屏障的机制,还需要进一步的探索和验证。

图1. 血脑屏障和血-肿瘤屏障
T-DXd药物迅速崛起,破解HER2阳性乳腺癌稳定脑转移
T-DXd是目前备受关注的ADC药物,其通过连接子将曲妥珠单抗和拓扑异构酶I抑制剂(DXd)连接起来,和曲妥珠单抗具有相同的结合HER2受体的能力,并通过HER2介导的内吞作用将载药送至肿瘤细胞[9]。
对于HER2阳性乳腺癌稳定性脑转移患者的治疗,目前T-DXd已经进行了诸多积极的临床探索。DESTINY-Breast01研究是T-DXd的首个全球多中心临床试验,其入组了24例稳定性脑转移的患者,客观缓解率(ORR)达到了58.3%,持续应答时间(DOR)为16.9个月,中位无进展生存期(PFS)长达18.1个月,显示出稳定性脑转移的巨大潜力[10]。与此同时,DESTINY-Breast03研究是首个头对头比较T-DXd与T-DM1二线治疗HER2阳性晚期乳腺癌的随机对照、III期临床试验。研究结果证实,在既往接受曲妥珠单抗和紫杉醇治疗的HER2阳性晚期腺癌患者中,T-DXd能够显著延长PFS至25.1个月(研究者评估),降低疾病进展或死亡风险,从而成为HER2阳性晚期乳腺癌的标准二线治疗。其中,对于基线伴有脑转移的患者,T-DXd组的中位PFS达到了15个月,是目前已知在前瞻性研究中稳定性脑转移患者获得的最长PFS,而T-DM1组仅为3个月(图2)。总体疾病控制上T-DXd也更优,ORR分别为67.4%和20.5%。在颅内疗效上,T-DXd组颅内ORR率为63.9%,也明显高于T-DM1的33.4%,颅内完全缓解率(CR)分别为27.8%和2.8%(图3),而颅内进展率方面,T-DXd仅有2.8%,T-DM1为22.2%[11]。该亚组数据进一步巩固了T-DXd在稳定性脑转移患者的显著疗效,证实了T-DXd在对疾病总体控制更优的同时,也能够提高颅内病灶缓解率。

图2. DESTINY-Breast03研究伴或不伴有脑转移患者的PFS

图3. DESTINY-Breast03研究中经BICR评估的颅内缓解
层层推进,活动性脑转移中T-DXd也展现不俗潜力
除了在稳定性脑转移患者有所建树外,在活动性脑转移患者中T-DXd同样有两项研究证实了显著临床获益。同时,在2022 ESMO大会上公布的TUXEDO-1研究的生活质量评估数据中,进一步为T-DXd改善脑转移患者的QoL,提供了循证证据。
DEBBRAH 是T-DXd的一项开放标签、多中心、单臂、5队列的II期研究,其中的队列3入组了HER2阳性乳腺癌活动性脑转移(局部治疗后进展)的患者,结果显示 [12],已入组的9例患者中的4例达到缓解,颅内ORR 为44.4%。队列3整体的临床获益率(CBR)为77.8%,疾病控制率(DCR)为89.9%。该研究结果提示T-DXd针对脑转移治疗后进展的患者依然有效。
另外,2022年《自然医学》杂志发表的一项前瞻性、单臂、II期TUXEDO-1研究,探讨了T-DXd用于活动性脑转移患者的疗效和安全性。研究入组了15例新诊断脑转移或接受过针对脑转移病灶的局部治疗而发生进展,但暂无立即进行局部治疗指征的患者。研究结果显示[13],在意向治疗人群(ITT)中,颅内缓解率为73.3%(11/15),临床获益率(CBR,CR+PR+SD≥6个月)为86.7%(13/15)。在符合方案(PP)人群的缓解率为78.6%(11/14),CBR为92.9%(13/14)。中位随访11个月时,中位PFS为14个月(95%CI 8.48-19.52)(图4),中位OS尚未达到。

图4. TUXEDO-1研究中的患者缓解瀑布图和无进展生存时间
同时,TUXEDO-1研究还针对符合健康相关生活质量(QoL)评估条件的14名脑转移患者进行了分析,其中13名患者完成了一项或多项评估,9名患者完整填写了所有表格。2022年 ESMO大会公布的最新结果显示[14],通过EORTC QLQ-C30评估,整体健康状况在治疗期间保持不变(P=0.953)。情绪和身体功能,仅在第一周期第一天和第三周期第一天观察到QoL数值下降,随后改善至基线水平,P值分别为0.363和0.835,而认知功能方面,在整个治疗期间观察到维持基线水平(P=0.429)(图5)。在HER2阳性乳腺癌活动性脑转移患者接受T-DXd治疗期间,TUXEDO-1研究数据显示了生活质量和神经认知功能的维持。
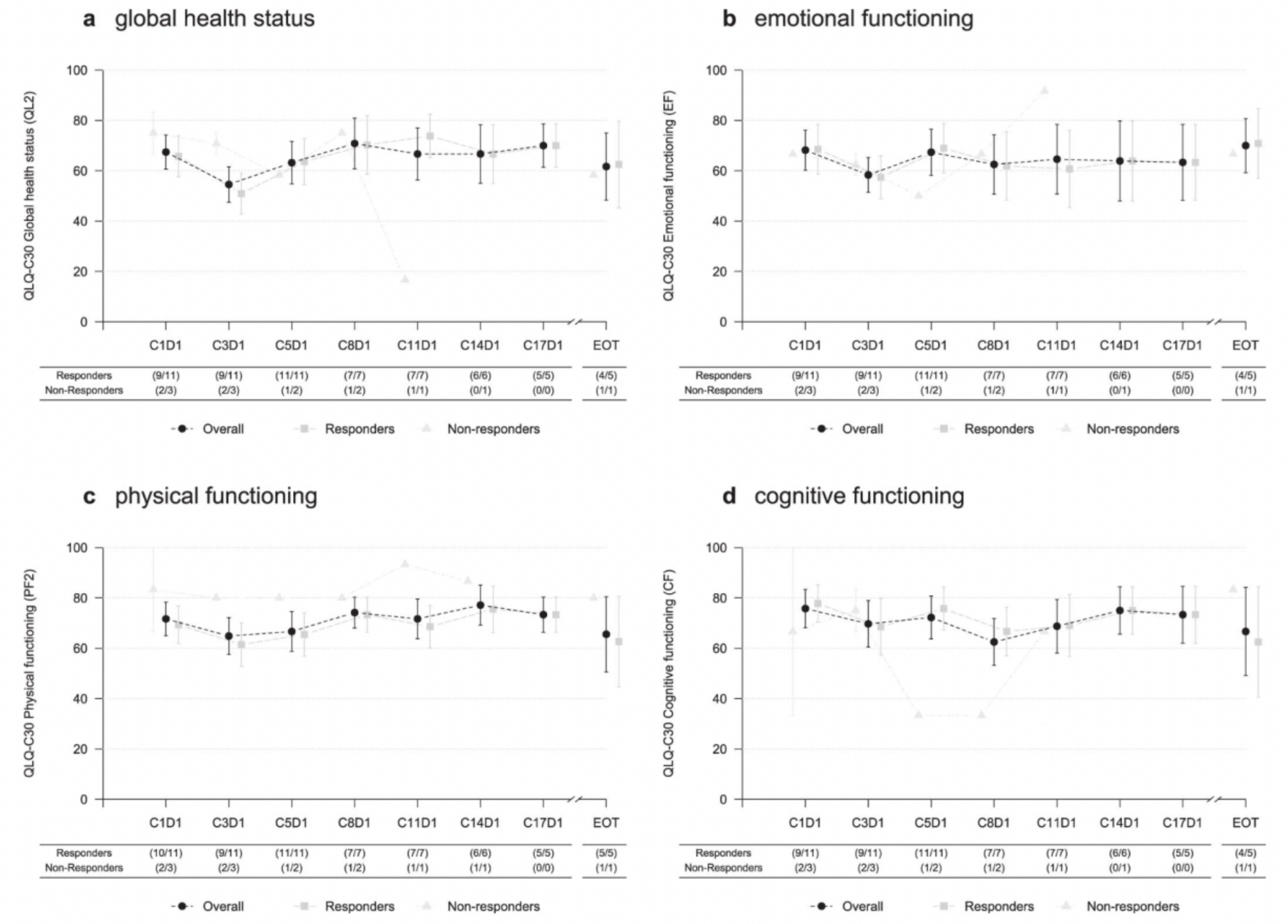
图5. 健康生活质评估
综合上述数据,DEBBRAH 和TUXEDO-1研究证实,T-DXd在HER2阳性活动性脑转移患者中具有较高的颅内缓解率和临床获益率,也获得了最新的ESMO转移性乳腺癌指南的推荐(图6)。除此之外,局部放疗可能引起机体学习、记忆、定向等功能下降,是目前影响脑转移放疗患者生活质量的主要因素。在TUEXDO-1研究中,T-DXd治疗患者的健康相关生活质量评估显示,患者认知功能并未受到损害,这或许为避免放疗导致的认知功能障碍提供了新的治疗可能性。

图6. ESMO临床实践指南,HER2阳性晚期乳腺癌诊疗流程图
另外,在2022年AACR大会上公布了一项T-DXd在HER2阳性软脑膜转移患者的病例研究结果。研究共纳入了6例HER2阳性软脑膜转移的晚期乳腺癌患者,结果显示[15],6例患者(100%)都获得了临床获益, 5例(83.3%)患者获得了客观MRI反应。患者的从开始接受T-DXd治疗到死亡或最后一次随访的中位生存期为264天(8.8个月左右)。该研究也为T-DXd在软脑膜转移乳腺癌患者以及其他HER2阳性肿瘤类型中进行前瞻性评估提供了理论依据。
深入挖掘,T-DXd在HER2低表达脑转移中的表现同样值得关注
在相对明确了T-DXd在HER2阳性脑转移患者中的疗效后,T-DXd对于HER2低表达脑转移患者是否同样有效,是临床所关心的问题。2022年ESMO大会上公布的DAISY研究,对于T-DXd用于HER2低表达,甚至HER2 IHC-0的脑转移患者治疗提供了参考数据。2021年公布的开放性、多中心、II期DAISY研究结果证实,T-DXd对HER2高表达、HER2低表达和HER2 IHC-0的晚期乳腺癌均有效。本次ESMO大会上,进一步分析了DAISY研究中未接受任何治疗控制脑转移症状和无症状脑转移患者使用T-DXd的疗效。结果显示[16],共有24例伴有脑转移病史的患者被纳入完整分析集,其中HER2高表达的队列1为12例,HER2低表达队列2为10例,HER2 IHC-0的队列3为2例。总体的最佳客观反应率(BOR)为62.5%(15/24),临床获益率(CBR)为70.8%(17/24),中位PFS位8.5个月。在队列1、队列2和队列3中,BOR分别为91.7% vs 30% vs 50%(图7),CBR分别为91.7% vs 50% vs 50%,中位PFS分别为13 个月 vs 4.1个月 vs NA。上述数据表明,T-DXd在基线有脑转移病史的乳腺癌患者中具有抗肿瘤活性,其中HER2低表达脑转移患者,值得进一步开展研究。

图7. DAISY研究中各队列脑转移患者BOR瀑布图
总结
乳腺癌是脑转移是临床中的一大治疗难题,尤其是HER2阳性乳腺癌,相比其他临床亚型脑转移发生率更高。既往临床研究主要集中在小分子TKI上,但ADC药物T-DXd的出现颠覆了小分子治疗药物更有效的传统认知。在稳定性脑转移中,DESTINY-Breast03研究给出了目前已知前瞻性研究中15个月最长PFS的优异结果,而在活动性脑转移中,多项单臂探索性研究同样提供了良好的临床获益率和PFS获益的数据,同时在HER2低表达脑转移患者的探索中,T-DXd也展示出抗肿瘤活性。
此外,TUXEDO-1研究表明,T-DXd除控制颅内病灶外,还可使得患者认知、情绪和社会功能也得到保障,保证了生活质量。以T-DXd为代表的系统治疗的进步,已经在逐渐改变脑转移的治疗理念,如ESMO转移性乳腺癌指南,稳定的脑转移二线治疗可优先选择包括T-DXd在内的系统治疗,而如果是活动性脑转移但无局部治疗的指征,也推荐图卡替尼或T-DXd治疗。系统治疗的进步,可以优化活动性脑转移患者现有的治疗手段,延长PFS、改善生存的同时,提高患者生活质量。
攻克脑转移治疗难题,ADC联合治疗模式也是值得期待的,包括以ADC为基础的系统治疗与颅内放疗的有机整合,以及ADC药物与TKI药物的联合等等。相信随着更多循证证据的出现,将为乳腺癌脑转移患者带来新的治疗希望。
未来可期!
[1] Lin NU, Amiri-Kordestani L, Palmieri D, et al. CNS metastases in breast cancer:old challenge, new frontiers[J]. Clin Cancer Res, 2013, 19(23): 6404-6418.
[2] Weil, R. J., Palmieri, D. C., Bronder, J. L., Stark, A. M. & Steeg, P. S. Breast cancer metastasis to the central nervous system. Am. J. Pathol. 167, 913–920 (2005).
[3] Bartsch, R. et al. Impact of anti-HER2 therapy on overall survival in HER2-overexpressing breast cancer patients with brain metastases. Br. J. Cancer 106, 25–31 (2012).
[4] Ballabh P, Braun A, Nedergaard M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol Dis. 2004 Jun;16(1):1-13.
[5] Sweeney MD, Zhao Z, Montagne A, Nelson AR, Zlokovic BV. Blood-Brain Barrier: From Physiology to Disease and Back. Physiol Rev. 2019 Jan 1;99(1):21-78.
[6] Brastianos, H. C., Cahill, D. P. & Brastianos, P. K. Systemic therapy of brain metastases. Curr. Neurol. Neurosci. Rep. 15, 518 (2015).
[7] Percy, D. B. et al. In vivo characterization of changing blood-tumor barrier permeability in a mouse model of breast cancer metastasis: a complementary magnetic resonance imaging approach. Invest. Radiol. 46, 718–725 (2011).
[8] Hart E, Odé Z, Derieppe MPP, et al. Blood-brain barrier permeability following conventional photon radiotherapy - A systematic review and meta-analysis of clinical and preclinical studies. Clin Transl Radiat Oncol. 2022 May 4;35:44-55.
[9] Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer. Lancet. 2019 Aug 31;394(10200):793-804.
[10] Jerusalem G, Park YH, Yamashita T, et al. CNS metastases in HER2-positive metastatic breast cancer treated with trastuzumab deruxtecan: DESTINY-Breast01 subgroup analyses. Annals of Oncology (2020) 31 (suppl_2): S62-S82. (Abstract 1380).
[11] Trastuzumab Deruxtecan (T-DXd) vs Trastuzumab Emtansine (T-DM1) in Patients (Pts) With HER2+ Metastatic Breast Cancer : Subgroup analyses from the Randomized Phase 3 DESTINY-Breast03 Study. 2021SABCS.GS3-01.
[12] Pérez-García JM, Batista MV, Cortez P, et al. Trastuzumab Deruxtecan in Patients with Central Nervous System Involvement from HER2-Positive Breast Cancer: The DEBBRAH Trial. Neuro Oncol. 2022 May 26:noac144.
[13] Bartsch R, Berghoff AS, Furtner J, et al. Trastuzumab deruxtecan in HER2-positive breast cancer with brain metastases: a single-arm, phase 2 trial. Nat Med. 2022 Aug 8.
[14] A.M. Starzer, A.S.S. Berghoff, J. Furtne, et al. Quality of life and neurocognitive function in patients withactive brain metastases of HER2-positive breast cancertreated with trastuzumab-deruxtecan: Secondary endpointanalysis of the prospective single-arm phase II TUXEDO-1trial. 2022 ESMO abstract 281MO.
[15] Laura Alder, Dario Trapani,Amanda Van Swearingen, et al. Durable clinical and radiographic responses in a series of patients with HER2+ Breast Cancer (BC) Leptomeningeal Disease (LMD) treated with trastuzumab deruxtecan (T-DXd). 2022 AACR Abstract 5257.
[16] N. Epaillard, A. Lusque, B. Pistilli, et al. Antitumor activity of trastuzumab deruxtecan (T-DXd) inpatients with metastatic breast cancer (mBC) and brainmetastases (BMs) from DAISY trial. 2022 ESMO abstract 260P.
排版编辑:肿瘤资讯-Pinky











 苏公网安备32059002004080号
苏公网安备32059002004080号


