表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)是肺癌领域的重要发现,其在晚期EGFR突变阳性NSCLC患者中的疗效优于标准化疗。NSCLC患者通常同时服用EGFR-TKIs与其他药物,药物的联合应用增加了EGFR-TKIs发生药物相互作用(DDIs)的风险。且临床中现有多种EGFR-TKIs类药物,对于不同的NSCLC患者,在了解药物相互作用特点的基础上选择合适的EGFR-TKIs至关重要,但药品说明书往往存在空白与差异,且仅通过各个药品的说明书很难全局把握EGFR-TKIs的DDIs特点。
近期,中国医学科学院肿瘤医院仲佳教授在《中华肿瘤杂志》发表“表皮生长因子受体酪氨酸激酶抑制剂药物相互作用概述”一文,为EGFR-TKIs的临床选择提供了更全面的依据。为此,本文特邀仲佳教授接受专访,介绍EGFR-TKIs药物相互作用的相关研究成果,给临床医生用药选择提供指导。
仲佳 教授
中国医学科学院肿瘤医院内科副主任医师
毕业于北京大学医学部肿瘤学博士
北京市医学奖励基金会肺癌青年专家委员会秘书
中国老年学会老年肿瘤专业委员会委员
北京抗癌协会肺癌专业委员会委员
入选北京市青年人才骨干项目、北京市青苗计划、培育计划等;致力于肺癌靶向治疗个体化研究;在JTO, CJCR等发表SCI论文数篇
EGFR-TKIs的出现为EGFR突变阳性的NSCLC患者带来了新的治疗选择和疗效的提升。首先请您谈谈,研究EGFR-TKIs药物相互作用对临床有何指导意义?目前还有哪些未满足的临床需求?
仲佳教授:肺癌患者中老龄患者较多,常伴有其他合并症,因此在服用EGFR-TKIs时常需同时服用其他药物[1]。药物相互作用(DDIs)是患者在同时使用多种药物出现不良反应或者影响治疗效果的最常见原因[2,3],所以,开展EGFR-TKIs药物相互作用风险的研究,充分理解EGFR-TKIs的DDIs机制及可能产生的结局,对于临床制定安全、有效的给药方案,尤其是对患者的个体化治疗有着非常重要的作用。
目前,关于EGFR-TKIs的药物相互作用风险的管理没有统一的指南或规范,导致临床上应用EGFR-TKIs时会面临如何选择药物、怎样合理用药的问题。为此,我们总结了全球和中国药品说明书及研究中推荐的EGFR-TKIs与其他药物相互作用的管理办法,为服用EGFR-TKIs的中国患者提供合并用药的指导。
目前,以中国患者为对象的EGFR-TKIs DDIs的研究尚缺乏,靶向药物最重要的代谢酶是CYP酶,CYP表型上的种族差异和CYP的基因多态性可能导致EGFR-TKIs的DDIs存在人群差异,所以,需要更多的研究来揭示中国患者的EGFR-TKIs的DDIs机制,可以为医师在临床实践中提供更多的参考与推荐。
充分理解DDIs的机制及可能产生的结局对在临床上制定安全、有效的给药方案有着非常重要的作用,请您介绍下,EGFR-TKIs常见的药物相互作用机制有哪些?他们会对EGFR-TKIs在人体内的吸收、分布、代谢和消除的生物过程产生哪些影响?
仲佳教授:EGFR-TKIs常见的药物相互作用机制主要包括三个方面:对细胞色素P450依赖性代谢的影响、对胃肠道 pH的影响以及对转运蛋白的影响。
首先,细胞色素P450家族(CYP)[4,5]是人体代谢药物的主要酶类。CYP抑制剂会降低CYP活性,减缓其底物药物代谢,增加药物暴露量,不良反应随之增多;相反,CYP诱导剂能加快其底物药物代谢,降低药物暴露量,药效随之降低[6,7]。所以,如果合并用药对P450酶有抑制或诱导作用,将影响EGFR-TKIs的药物暴露量。
其次,由于癌症患者经常服用抑酸药物来缓解胃肠道反流或药物胃肠道反应的症状,因此抑酸药物与EGFR-TKIs相互作用的可能性在临床上很重要[8]。常见的两类抑酸药物为质子泵抑制剂与H2受体拮抗剂,但是,这些药物会影响EGFR-TKI类药物的吸收,导致胃内PH值升高,降低碱性药物EGFR-TKIs在胃部的溶解度,从而降低药物在体内的吸收、生物利用度和有效性。
最后,药物转运体介导药物在体内的吸收、分布与消除[9]。比如我们熟知的P糖蛋白,相当于药物从细胞外排的泵,转运体可减少细胞对药物的摄入量,限制药物从血液循环系统通过血脑屏障到脑部,从肠腔到肠上皮细胞,协助药物从肝细胞和肾小管消除,从而影响药物的生物利用度和有效性,因此转运体抑制剂或诱导剂可能产生有临床意义的EGFR-TKIs药物相互作用[10-12]。
DDIs在代谢阶段发生率最高,细胞色素P450代谢酶(CYP)在DDIs的机制中起重要作用,不同EGFR-TKIs的代谢受CYP的影响是否有差异?临床实践中应如何进行推荐?
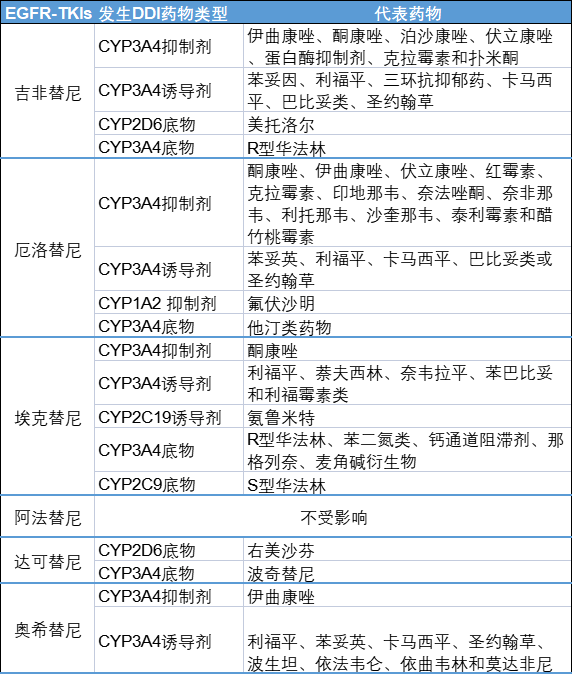
仲佳教授:CYP是一类结合在细胞膜上的血红蛋白,CYP3A4和CYP2D6是常见的代谢酶。不同EGFR-TKIs的代谢受CYP的影响不尽相同(表1)。
一代和三代TKIs主要通过P450酶代谢,比如吉非替尼,厄洛替尼,埃克替尼,奥希替尼。其中,CYP3A4酶是一代或三代TKIs的主要代谢酶,其他还包括CYP2D6,CYP2C19,CYP3A5等。CYP3A4酶的强抑制剂如抗真菌药物酮康唑、蛋白酶抑制剂、抗生素克拉霉素等,可增加EGFR TKIs暴露量,可能使患者出现临床不良反应,合用需谨慎,且应紧密监测患者出现的不良事件。CYP3A4诱导剂如苯妥因、抗结核药物利福平、三环抗抑郁药、卡马西平等,可降低EGFR TKIs暴露量,可能降低其疗效,应尽量避免合用[14,15]。
而对于二代EGFR TKIs,阿法替尼的代谢不受CYP影响,并且也不是CYP的抑制剂或诱导剂,它不是主要通过P450酶代谢[20,21]。达可替尼主要通过CYP2D6酶进行代谢[22,23]。达可替尼作为CYP2D6抑制剂,可以增加其底物右美沙芬的平均暴露量,需避免合用或考虑调整用药剂量。
表1 EGFR-TKIs与CYP代谢相关药物的DDIs
NSCLC患者广泛使用抑酸药物来预防或治疗同时使用EGFR-TKIs 带来的胃肠道不适。不同EGFR-TKIs的吸收受抑酸药物的影响是否有差异?临床实践中应如何进行推荐?
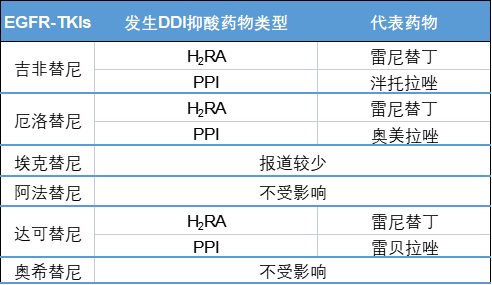
仲佳教授:不同EGFR-TKIs的吸收受抑酸药物的影响不同(表2)。
吉非替尼[13]、厄洛替尼[16,17]、达可替尼[22]的溶解度会随pH升高而降低,从而可能降低药物的吸收和生物利用度。因此,原则上应避免与质子泵抑制剂(PPI)和H2受体拮抗剂(H2RA)合用。如临床确需合用抑酸药如奥美拉唑、雷尼替丁等,可采取间隔给药的方式将药物相互作用产生的影响降到最低。吉非替尼应在奥美拉唑之前或之后12h服用[13],在雷尼替丁之前或之后6h服用;雷尼替丁给药前2h或给药后10h可给予厄洛替尼[17];达可替尼应在雷尼替丁给药前至少6h或给药后至少10h使用[23]。
阿法替尼在生理PH范围内(1~7.5)均是可溶的,与吸收相关的药物相互作用少见。奥希替尼与抑酸药物合用时无需限制。
表2 EGFR-TKIs与抑酸药物的DDIs
临床实践中,如有必要使用抑酸药,可以选用不受抑酸药影响或受影响较小的TKI药物, 如需同时服用受抑酸药影响较大的TKI药物,可以采用间隔给药的方式以降低影响。
药物转运体介导的主动转运影响药物在体内的吸收、分布与消除,转运体减少细胞对药物的摄入量,影响药物的生物利用度和有效性。如何才能避免药物转运体对EGFR-TKIs疗效的影响?
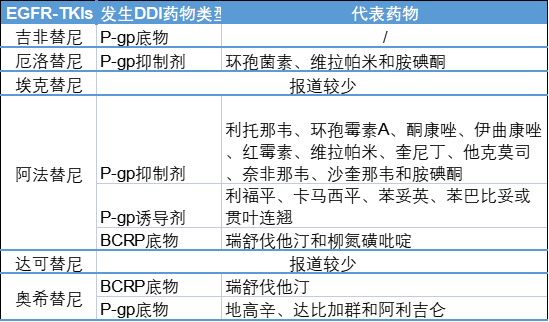
仲佳教授:我们常说的药物转运体:由ABCB1基因编码的P-gp和由ABCG2基因编码的乳腺癌耐药蛋白(BCRP)是两种主要的外排型转运体[7,28]。
阿法替尼是P-gp和BCRP的底物,与转运体的抑制剂或诱导剂合用时,可分别升高或降低阿法替尼暴露量。
如果需要使用P-gp抑制剂(如抗真菌药物酮康唑、伊曲康唑、抗心律失常药物奎尼丁、维拉帕米、胺碘酮等),应采用间隔时间给药。P-gp强诱导剂(包括利福平、卡马西平、苯妥因等)可能会减少阿法替尼的暴露量,对于需长期使用P-gp强诱导剂的患者,应根据患者耐受情况调整剂量。阿法替尼可抑制P-gp和BCRP转运体,然而临床数据显示,阿法替尼不影响P-gp底物的血浆浓度[19,20]。
奥希替尼可竞争性地抑制BCRP转运体,也可抑制P-gp转运体。奥希替尼与治疗指数低的BCRP底物药物或P-gp底物药物(如地高辛、达比加群和阿利吉仑)合用时,需密切监测患者对药物的耐受程度[25](表3)。
表3 EGFR-TKIs与转运体相关药物的DDIs
总体而言,EGFR-TKIs在与转运体抑制剂合用时,可以考虑减量以减少药物暴露量;在与转运体诱导剂合用时,可以在安全范围内适当增加剂量以保证药效。
需要注意的是,停用转运体抑制剂或诱导剂后,应恢复原剂量使用。当EGFR-TKIs作为P-gp或BCRP转运体抑制剂与P-gp或BCRP底物药物合用时,需密切监测评估患者对药物的耐受性。
参考文献:
[1] Xu ZY, Li JL. Comparative review of drug-drug interactions with epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small-cell lung cancer [J]. Onco Targets Ther, 2019, 12:5467-5484. DOI:10.2147/OTT.S194870.
[2] Palleria C, Di Paolo A, Giofrè C, et al. Pharmacokinetic drug-drug interaction and their implication in clinical management[J]. J Res Med Sci, 2013, 18(7):601-610.
[3] Rekić D, Reynolds KS, Zhao P, et al. Clinical drug-drug interaction evaluations to inform drug use and enable drug access[J]. J Pharm Sci, 2017, 106(9):2214-2218. DOI: 10.1016/j.xphs.2017.04.016.
[4] Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation[J]. Pharmacol Ther, 2013, 138(1): 103-141. DOI: 10.1016/j. pharmthera.2012.12.007.
[5] Lynch T, Price A. The effect of cytochrome P450 metabolism on drug response, interactions, and adverse effects[J]. Am Fam Physician, 2007, 76(3):391-396.
[6] Ogu CC, Maxa JL. Drug interactions due to cytochrome P450[J]. Proc (Bayl Univ Med Cent), 2000, 13(4):421-423. DOI:10.1080/08998280.2000.11927719.
[7] Liu X. Transporter-Mediated Drug-Drug Interactions and Their Significance[J]. Adv Exp Med Biol, 2019, 1141: 241-291. DOI:10.1007/978-981-13-7647-4_5.
[8] Oral epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small cell lung cancer: Comparative pharmacokinetics and drug–drug interactions.
[9] Hussaarts KGAM, Veerman GDM, Jansman FGA, et al. Clinically relevant drug interactions with multikinase inhibitors: a review[J]. Ther Adv Med Oncol, 2019, 11: 1758835918818347. DOI:10.1177/1758835918818347.
[10] Lin JH, Yamazaki M. Role of P-glycoprotein in pharmacokinetics: clinical implications[J]. Clin Pharmacokinet, 2003, 42(1): 59-98. DOI: 10.2165/00003088-200342010-00003.
[11] Elmeliegy M, Vourvahis M, Guo C, et al. Effect of p-glycoprotein (P-gp) inducers on exposure of P-gp substrates: review of clinical drug-drug interaction studies[J]. Clin Pharmacokinet, 2020, 59(6):699-714. DOI:10.1007/s40262-020-00867-1.
[12] Mao Q, Unadkat JD. Role of the breast cancer resistance protein (BCRP/ABCG2) in drug transport--an update[J].AAPS J, 2015, 17(1): 65-82. DOI: 10.1208/s12248-014-9668-6.
[13] FDA. Gefitinib (IRESSA) PRESCRIBING INFORMATION[EB/OL]. (2018-08-01) [2021-08-26]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/206995s003lbl.pdf.
[14] EMA.iressa-gefitinib-epar-product-information[EB/OL].(2021-03-05)[2021-08-26]. https://www.ema.europa.eu/en/documents/product-information/iressa-epar-product-information_en.pdf.
[15] Chhun S, Verstuyft C, Rizzo-Padoin N, et al. Gefitinib-phenytoin interaction is not correlated with the C-erythromycin breath test in healthy male volunteers[J]. Br J Clin Pharmacol, 2009, 68(2):226-237. DOI:10.1111/j.1365-2125.2009.03438.x.
[16] EMA. tarceva-erlotinib-epar-product-information[EB/OL]. (2021-08-18) [2021-08-26]. https://www.ema.europa.eu/en/documents/product-information/tarceva-epar-product-information_en.pdf.
[17] Roche Registration GmbH. 盐酸厄洛替尼片说明书[EB/OL]. (2021-04-20)[2021-08-26]. https://www.roche.com.cn/content/dam/rochexx/roche-com-cn/roche_china/zh_CN/pdf-instructions/2021/YansuanEluotiniPian_20210420.pdf.
[18] FDA. Erlotinib (TARCEVA) PRESCRIBING INFORMATION [EB/OL]. (2016-10) [2021-08-25]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/021743s025lbl.pdf.
[19] 周虹, 付国斌, 张文, 等. 酪氨酸激酶抑制剂的药物相互作用研究进展[J]. 中国新药与临床杂志, 2016, 35(12): 854-860. DOI:10.14109/j.cnki.xyylc.2016.12.005.
[20] FDA. GILOTRIF® (afatinib) PRESCRIBING INFORMATION[EB/OL]. (2019-10) [2021-08-26]. https://www.accessdata. fda.gov/drugsatfda_docs/label/2019/201292s015lbl.pdf.
[21] EMA. giotrif-epar-product-information_en[EB/OL].(2021-04-21)[2021-08-26]. https://www.ema.europa.eu/en/documents/product-information/giotrif-epar-product-information_en.pdf.
[22] EMA. vizimpro-epar-product-information_en[EB/OL]. (2021-07-21)[2021-08-26].https://www.ema.europa.eu/en/documents/product-information/vizimpro-epar-product-information_en.pdf.
[23] FDA. VIZIMPRO® (dacomitinib) tablets prescribinginformation[EB/OL]. (2020-12) [2021-08-26]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/211288s003lbl.pdf.
[24] Ji W, Shen J, Wang B, et al. Effects of dacomitinib on thepharmacokinetics of poziotinib in vivo and in vitro[J].Pharm Biol, 2021, 59(1): 457-464. DOI: 10.1080/13880209.2021.1914114.
[25] EMA. tagrisso-epar-product-information_en[EB/OL].(2021-07-01)[2021-08-26]. https://www.ema.europa.eu/en/documents/product-information/tagrisso-epar-product-information_en.pdf.
[26] FDA. TAGRISSO® (osimertinib) tablets prescribinginformation[EB/OL]. (2020-12) [2021-08-26]. https://www. accessdata. fda. gov/drugsatfda_docs/label/2021/208065s022lbl.pdf.
[27] AstraZeneca AB. 甲磺酸奥希替尼片说明书[EB/OL].(2017-03-22) [2021-08-26]. https://www. astrazeneca.com. cn/content/dam/az-cn/pdfs/Tagrisso-Leaflet-IDL-new%20launch.pdf.
[28] Huang L, Fu L. Mechanisms of resistance to EGFR tyrosine kinase inhibitors[J]. Acta Pharm Sin B, 2015, 5(5): 390-401. DOI:10.1016/j.apsb.2015.07.001.
排版编辑:Chris











 苏公网安备32059002004080号
苏公网安备32059002004080号


