受新冠疫情影响,肿瘤界年度盛会美国临床肿瘤学会(ASCO)年会2020年将首次以线上形式主办,分为科学大会(Scientific Program)和教育大会(Education Program)两个板块,将分别于5月29-31日、8月8-10日进行。主题为:团结与征服,共同加速进步。在泌尿生殖系统肿瘤领域,四项有关于晚期肾细胞癌免疫联合治疗的最新研究结果公布。

在晚期肾细胞癌中优化纳武利尤单抗联合伊匹木单抗治疗方案(Ⅱ期OMNIVORE研究)
CheckMate-214研究已经证实纳武利尤单抗(nivolumab)联合伊匹木单抗(ipilimumab)可以作为晚期肾细胞癌的一线治疗方案。目前对纳武利尤单抗治疗产生应答的患者,应用纳武利尤单抗作为维持治疗的最佳持续时间还尚未确定。研究者假设并非所有患者都需要联合CTLA-4抑制剂,开展了Ⅱ期响应-自适应(response-adaptive)试验(OMNIVORE),一方面探讨了对纳武利尤单抗治疗无应答者序贯2周期伊匹木单抗治疗的临床疗效,另一方面对纳武利尤单抗治疗应答者接受纳武利尤单抗维持治疗的最佳持续时间进行了相关研究。
研究纳入先前未接受过免疫检查点抑制剂治疗的晚期肾细胞癌患者,全部接受纳武利尤单抗治疗,并在治疗后的6个月之内根据治疗应答情况(RECISTv1.1标准)给予后续治疗。对于纳武利尤单抗治疗6个月内疗效评估为部分缓解(PR)或完全缓解(CR)的患者,中断纳武利尤单抗治疗,并进行定期观察(A组)。如果出现疾病进展(PD),则A组患者会重新接受纳武利尤单抗治疗;如果PD持续存在或再次出现复发,后续将在纳武利尤单抗的基础上加用伊匹木单抗。对于纳武利尤单抗单药治疗6个月内疗效评估为疾病稳定(SD)或PD的患者,将接受2周期的伊匹木单抗治疗(B组)。研究主要终点是A组中纳武利尤单抗停药后1年PR/CR患者所占的比例,以及B组中对纳武利尤单抗治疗无应答者在添加伊匹木单抗治疗后转化为PR/CR患者的比例。
研究共入组83例患者,患者基线特征:ECOG 评分为0-1占99%;肾透明细胞癌占96%;先前未接受任何治疗占51%;IMDC评价为中/低风险占69%。中位随访时间为17.0个月,15例未参与到分组(7例因PD;7例因毒性问题;1例仍在治疗过程中,疗效未确认PR)。在6个月时,纳武利尤单抗单药治疗疗效评估为PR的患者占11%(9/83)。11例患者(13%:9例PR,1例未经确认的PR,1例SD)分配到A组,其中5(45%,90%CI:20%~73%)例患者纳武利尤单抗停药时间已经超过1年。B组共入组57(69%)例患者,有2例患者疗效转换为PR(4%,90%CI:1%~11%),而这2例患者在纳武利尤单抗治疗时最佳疗效评估为PD。安全性方面,纳武利尤单抗单药治疗引起的3~4级治疗相关不良事件发生率为7%(6/83),而B组则为23%(13/57)。
OMNIVORE研究疗效数据
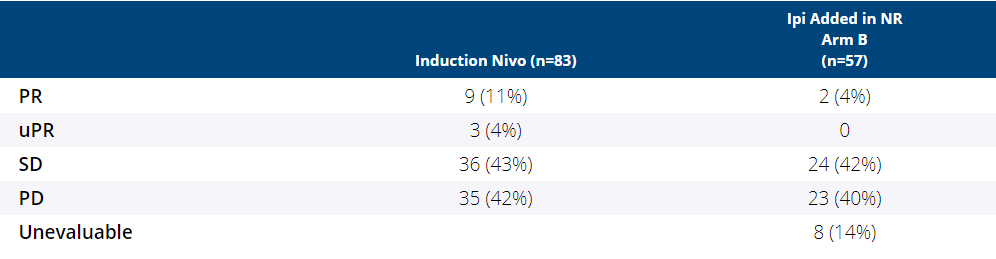 Ⅱ期OMNIVORE研究结果表明,由于CR患者的缺乏以及PR/CR转换率相对较低(4%),目前不推荐在纳武利尤单抗单药治疗后,根据应答情况添加伊匹木单抗的治疗策略。尽管采用纳武利尤单抗单独治疗的部分患者可以在1年时显示持久获益,但目前不推荐在未发生不可耐受毒性的情况下尽早停用纳武利尤单抗。
Ⅱ期OMNIVORE研究结果表明,由于CR患者的缺乏以及PR/CR转换率相对较低(4%),目前不推荐在纳武利尤单抗单药治疗后,根据应答情况添加伊匹木单抗的治疗策略。尽管采用纳武利尤单抗单独治疗的部分患者可以在1年时显示持久获益,但目前不推荐在未发生不可耐受毒性的情况下尽早停用纳武利尤单抗。
初治晚期肾细胞癌患者接受纳武利尤单抗单药治疗和纳武利尤单抗联合伊匹木单抗挽救治疗(Ⅱ期HCRN GU16-260研究)
目前美国FDA已经批准纳武利尤单抗用于VEGFR TKI治疗耐药晚期肾细胞癌患者治疗,并且纳武利尤单抗联合伊匹木单抗方案也已经获批用于初治的IMDC中/低风险晚期肾细胞患者。然而,纳武利尤单抗单药对于初治晚期肾细胞癌的疗效和安全性,以及纳武利尤单抗单药初治耐药后接受纳武利尤单抗联合伊匹木单抗挽救治疗的有效性还缺乏循证医学证据支持。
HCRN GU16-260是一项Ⅱ期临床研究,纳入符合入组条件的初治晚期肾细胞癌患者,接受纳武利尤单抗(240mg,Q2W)治疗共6周期,然后接受纳武利尤单抗(360mg,Q3W)共4个周期,随后接受纳武利尤单抗(480mg,Q4W),直到疾病进展(PD)、不可耐受的毒性或完成96周的治疗(A部分)。在第48周之前处于疾病稳定(SD)或PD的患者将接受4周期纳武利尤单抗(3mg/kg,Q3W)+伊匹木单抗(1 mg/kg,Q3W)作为挽救治疗,然后进行纳武利尤单抗(Q4W)维持治疗直至48周(B部分)。
从2017年5月至2019年12月,共有123例肾细胞癌患者入组,117例患者疗效可评估。通过RECIST评价标准评估的ORR为29.1%(34/117),CR为4.3%(4/116),PR为24.8%(29/117),SD为40.2%(47/117)PD为30.7%(36/117)。根据irRECIST评价标准评估的ORR为35%。根据患者IMDC风险分层评估的ORR:高风险患者为41.4%(12/29);中/低风险患者为25.3%(22/87)。组织病理学含肉瘤成分患者的ORR为27.3%(6/22)。
所有患者的中位缓解持续时间为13.8个月,中位无进展生存期(PFS)为7.4个月。数据截止时,110例患者仍然存活。有60例患者符合纳武利尤单抗+伊匹木单抗挽救性治疗标准(B部分),但是其中有28例患者未参与到分组,其中17例是由于有症状的PD,8例是由于纳武利尤单抗治疗所引起的3~4级毒性,剩余3例是由于其他原因。
在纳入B部分的32例患者中,27例可进行疗效评估,30例可进行毒副反应评估。接受纳武利尤单抗联合伊匹木单抗的最佳疗效情况如下:PR(11%),SD(30%),PD(59%)。通过irRECIST评价标准评估的ORR为19%。
安全性方面,纳武利尤单抗单药治疗所引起的3~5级与治疗相关不良事件的发生率为28%(35/123),其中1例死于呼吸衰竭。纳武利尤单抗联合伊匹木单抗治疗组有10例(33%)患者出现3~4级治疗相关不良事件,未发生死亡事件。
纳武利尤单抗单药治疗适用于所有IMDC风险的晚期肾细胞癌患者,毒性反应与之前进行的纳武利尤单抗相关研究一致。纳武利尤单抗单药治疗后采用纳武利尤单抗+伊匹木单抗挽救治疗是行之有效的,11%患者疗效评估为PR。
纳武利尤单抗联合伊匹木单抗用于难治性晚期肾细胞癌(Ⅱ期FRACTION-RCC研究)
Ⅱ期FRACTION-RCC研究报告了纳武利尤单抗联合伊匹木单抗在先前接受免疫检查点抑制剂治疗进展的晚期肾细胞癌患者中的疗效和安全性初步结果。入组患者接受纳武利尤单抗(3mg/kg,Q3W)+伊匹木单抗(1mg/kg,Q3W)治疗4周期,然后在6周后接受纳武利尤单抗(480mg,Q4W)治疗直至治疗时间达2年、疾病进展、不可耐受毒性或方案规定的停药。研究主要终点为ORR(RECIST v1.1评价标准),次要终点包括DOR、24周时的PFS率和安全性。
研究共入组46例(有1例先前未接受免疫检查点抑制剂治疗)患者,其中45例先前接受过抗PD-1/PD-L1治疗并出现疾病进展,37例患者既往接受过TKI药物治疗,所有患者既往都没有接受过抗CTLA-4药物治疗。大多数患者病理类型为肾透明细胞癌(n=44)。在中位随访8.9个月后,评估的ORR为15.2%:CR患者为0例,PR患者为7例。7例应答患者的DOR范围为2~19+个月,5例患者仍显示出持久的临床获益。另外,7例PR的患者中有6例既往接受过2线及以上治疗。
安全性方面,36例(78.3%)患者出现任何级别的治疗相关不良事件,最常见的不良事件为疲劳(19.6%)、皮疹(19.6%)和腹泻(17.4%)。13例(28.3%)患者出现3~4级治疗效果不良事件,最常见的为腹泻(8.7%)、淀粉酶升高(6.5%)和脂肪酶升高(6.5%)。22例(47.8%)患者出现任何级别的免疫治疗相关不良事件,包括皮疹(19.6%)、腹泻(17.4%)和谷丙转氨酶升高(8.7%)。研究中没有治疗相关死亡事件发生。
Ⅱ期FRACTION-RCC研究结果表明,对于先前接受过某些免疫检查点抑制剂治疗进展,以及既往接受过多线治疗的晚期肾细胞癌患者,纳武利尤单抗联合伊匹木单抗方案显示出持久的临床获益,且安全性数据与既往研究结果相似。
仑伐替尼联合帕博利珠单抗用于经PD-1/PD-L1抑制剂治疗进展的转移性肾透明细胞癌患者(Ⅱ期KEYNOTE-146研究)
Ⅱ期KEYNOTE-146研究旨在评估仑伐替尼联合帕博利珠单抗用于经PD-1/PD-L1抑制剂治疗进展的转移性肾透明细胞癌患者的疗效和安全性。主要入组标准:确诊为转移性肾透明细胞癌;接受免疫检查点抑制剂治疗后进展;具备可测量病灶;既往至少接受过1线及以上治疗。入组患者接受仑伐替尼(20mg,QD)+帕博利珠单抗(200mg,Q3W)治疗,直至疾病进展或不可耐受毒性。研究主要终点为第24周时通过irRECIST评价标准评估的ORR。
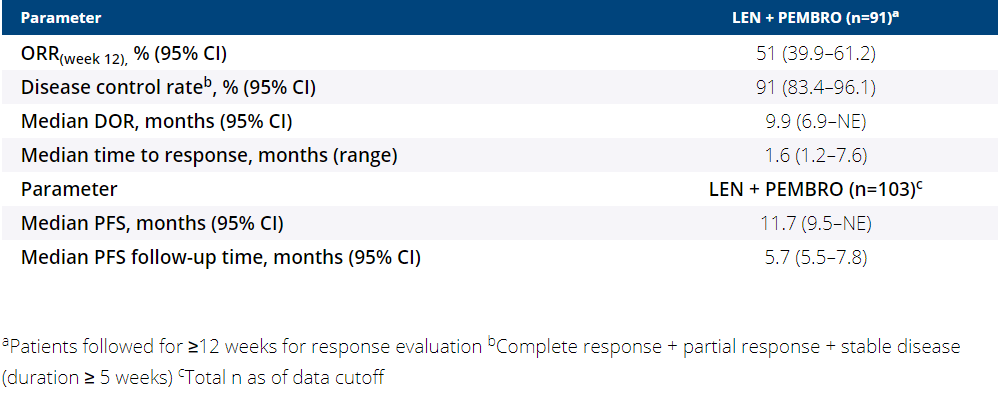
研究共入组104例患者,数据截止2020年1月12日,仍有71例(69%)患者在继续接受治疗。大多数患者(58%)既往接受过2线及以上抗肿瘤治疗。在第12周时,有91例患者疗效可评估,其中46例患者疗效评估为PR,ORR为51%,疾病控制率为91%。中位DOR为9.9个月,中位至应答时间为1.6个月。103例患者的中位随访时间为5.7个月,评估的中位PFS为11.7个月。
KEYNOTE-146研究疗效数据
 安全性方面,最常见的治疗相关不良事件为疲劳(49%)、腹泻(44%)、蛋白尿(37%)、高血压(31%)、恶心(31%)、发声困难(29%)、口腔炎( 29%)和关节疼痛(27%)。1例患者出现5级治疗相关不良事件(上消化道出血)。43%患者需要减量治疗,12%患者因治疗相关不良事件导致停药。
安全性方面,最常见的治疗相关不良事件为疲劳(49%)、腹泻(44%)、蛋白尿(37%)、高血压(31%)、恶心(31%)、发声困难(29%)、口腔炎( 29%)和关节疼痛(27%)。1例患者出现5级治疗相关不良事件(上消化道出血)。43%患者需要减量治疗,12%患者因治疗相关不良事件导致停药。
Ⅱ期KEYNOTE-146研究结果表明,对于经免疫检查点抑制剂抑制剂治疗进展的晚期肾透明细胞癌患者,仑伐替尼联合帕博利珠单抗显示出非常好的抗肿瘤活性,并且具有较好安全性,未观察到新的安全性事件。
1.McKay RR,Xie WL,McGregor BA,et al.Optimized management of nivolumab(Nivo) and ipilimumab(Ipi) in advanced renal cell carcinoma(RCC):A response-based phase Ⅱ study (OMNIVORE)[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5005).
2.Atkins MB,Jegede O,Haas NB,et al.Phase Ⅱ study of nivolumab and salvage nivolumab + ipilimumab in treatment-naïve patients (pts) with advanced renal cell carcinoma(RCC)(HCRN GU16-260)[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5006).
3.Choueiri TK,Kluger HM,George S,et al.FRACTION-RCC:Innovative,high-throughput assessment of nivolumab + ipilimumab for treatment-refractory advanced renal cell carcinoma (aRCC)[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5007).
4.Lee CH,Shah AY,Hsieh JJ,et al.Phase Ⅱ trial of lenvatinib (LEN) plus pembrolizumab (PEMBRO) for disease progression after PD-1/PD-L1 immune checkpoint inhibitor (ICI) in metastatic clear cell renal cell carcinoma (mccRCC)[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5008).
排版编辑:Zack














 苏公网安备32059002004080号
苏公网安备32059002004080号


