受新冠疫情影响,肿瘤界年度盛会美国临床肿瘤学会(ASCO)年会2020年将首次以线上形式主办,分为科学大会(Scientific Program)和教育大会(Education Program)两个板块,将分别于5月29-31日、8月8-10日进行。主题为:团结与征服,共同加速进步。在泌尿生殖系统肿瘤领域,三项有关于肾细胞癌罕见病理类型的研究公布。
沃利替尼对比舒尼替尼治疗MET驱动的乳头状肾细胞癌的Ⅲ期研究
乳头状肾细胞癌(PRCC)是最常见的非透明肾细胞癌类型,占肾恶性肿瘤的10%~15%。由于一部分乳头状肾细胞癌是由MET驱动的,因此MET抑制剂可能是一种合适的靶向治疗方法。在单臂Ⅱ期研究中,具有高选择性的MET酪氨酸激酶抑制剂(TKI)沃利替尼在MET驱动的乳头状肾细胞癌中表现出抗肿瘤活性。
SAVOIR研究(NCT03091192)是一项开放标签(赞助不知情)、随机的Ⅲ期临床研究,旨在进一步比较沃利替尼和标准疗法舒尼替尼在MET驱动乳头状肾细胞癌患者中的有效性和安全性。研究纳入经研究中心确认的MET驱动(MET和/或HGF扩增,7号染色体增益和/或MET激酶结构域突变)的转移性乳头状肾细胞癌患者,随机接受沃利替尼(600mg,QD)或舒尼替尼(50mg,QD,连续服药4周,停药2周)治疗。研究的主要目标是独立盲法评审中心(BIRC)评估的无进展生存期(PFS),次要目标包括总生存期(OS),客观缓解率(ORR),安全性和耐受性。
在获得使用舒尼替尼治疗MET驱动乳头状肾细胞癌的外部PFS数据后,研究并关闭了入组登记。数据截止2019年8月,只有60例患者(原计划180例)进行了随机,沃利替尼组33例,舒尼替尼组27例。入组患者大部分有7号染色体增益(沃利替尼组为91%,舒尼替尼组为96%)、先前未接受治疗(沃利替尼组为85%,舒尼替尼组为93%)。
疗效分析显示,沃利替尼相比舒尼替尼在PFS(中位PFS:7.0 vs 5.6个月,HR=0.71,95%CI:0.37~1.36,P=0.313)、OS(中位OS:未达到 vs 12.2个月,HR=0.51,95%CI:0.21~1.17,P=0.110)、ORR(27% vs 7%)数值上均有所改善。
SAVOIR研究疗效分析
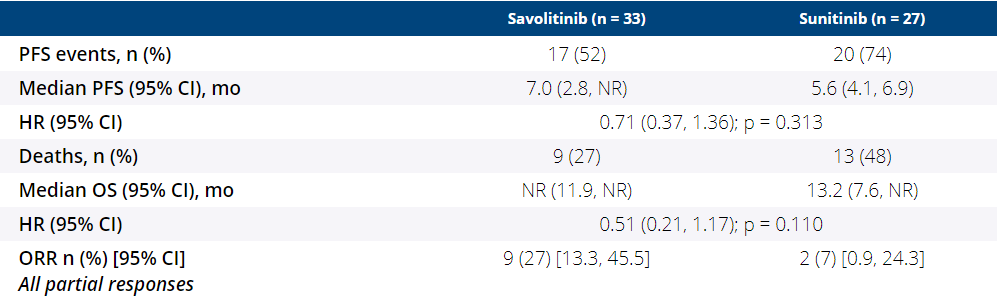 安全性分析显示,沃利替尼组和舒尼替尼组分别有42%和81%的患者报告了≥3级不良事件。两组因为不良事件导致剂量调整的患者比例分别为30%和74%。在治疗中止后,沃利替尼组36%的患者和舒尼替尼组19%的患者分别接受了后续的抗癌治疗。
安全性分析显示,沃利替尼组和舒尼替尼组分别有42%和81%的患者报告了≥3级不良事件。两组因为不良事件导致剂量调整的患者比例分别为30%和74%。在治疗中止后,沃利替尼组36%的患者和舒尼替尼组19%的患者分别接受了后续的抗癌治疗。
SAVOIR研究的结果表明,尽管患者数量和随访情况有限,但与舒尼替尼相比,沃利替尼显示了令人鼓舞的疗效,改善了治疗的安全性,具有更低的≥3级不良事件,更少患者需要调整剂量。根据外部回顾性数据,舒尼替尼的疗效与预期更差,未来有必要进一步研究沃利替尼作为MET驱动乳头状肾细胞癌的治疗选择。
口服HIF-2α抑制剂MK-6482用于Von Hippel-Lindau病相关性肾细胞癌的Ⅱ期研究
Von Hippel-Lindau(VHL)病患者有患其他几种癌症的风险,包括肾透明细胞癌。VHL的失活导致HIF-2α转录因子组成性激活,从而驱动肿瘤的生长。MK-6482是一种有效的、选择性的小分子HIF-2α抑制剂,在Ⅰ/Ⅱ期研究中显示出良好的安全性和抗肿瘤活性。
在MK-6482治疗VHL相关肾透明细胞癌的开放标签Ⅱ期临床研究(NCT03401788)中,纳入具有致病性种系VHL变异、有可测量病灶、先前未接受系统抗癌治疗、ECOG PS 0或1的局部性/非转移性肾透明细胞癌成人患者,口服MK-6482(120mg,QD)治疗直至疾病进展、不可耐受的毒性、研究者/患者决定退出。研究的主要终点为ORR,次要终点包括缓解持续时间(DOR),至应答时间(TTR),PFS,安全性和耐受性。
截至2019年12月6日,研究共登记了61例患者,中位年龄41岁,大多数患者为男性(52.5%),ECOG PS为0分(82.0%)。肾脏外最常见的病变(非肾细胞肿瘤)为中枢神经系统血管母细胞瘤(80.3%)和胰腺病变(50.8%)。治疗的中位持续时间为9.9个月,并且95.1%的患者仍在接受治疗。
疗效分析显示,MK-6482治疗VHL相关肾透明细胞癌确认的ORR为27.9%(17/61),另有8例(13.1%)患者为未经确认的应答,全部应答均为部分缓解(PR)。在61例患者中,53例(86.9%)靶病灶有缩小。在确认的17例患者中,中位DOR未达到,中位TTR为5.5个月,中位PFS为达到,12个月的PFS率为98.3%。在伴有中枢神经系统、视网膜和胰腺病变的患者中均观察到应答。
安全性方面,与治疗相关不良事件的发生率为96.7%,主要为1级(44.3%)和2级(42.6%),9.8%的患者发生3级治疗相关不良事件,主要是疲劳(4.9%)和贫血(3.3%),没有4级或5级治疗相关不良事件出现,1例患者因为治疗相关不良事件(头晕)而停药。
贝伐珠单抗联合厄洛替尼治疗晚期遗传性平滑肌瘤病及肾细胞癌或散发性乳头状肾细胞癌的Ⅱ期研究
遗传性平滑肌瘤病及肾细胞癌(HLRCC)是与2型乳头状肾细胞癌变异体相关的家族性癌症综合征,由延胡索酸酶(fumarate hydratase,FH)基因种系突变引起,FH失活导致不依赖VHL的缺氧诱导因子上调,对有氧糖酵解的依赖以及NRF2途径的激活,一些散发性pRCC肿瘤也具有这些特征。
本项Ⅱ期研究允许晚期乳头状肾细胞癌患者入组,为了丰富FH缺乏症的患者,研究将1)HLRCC;2)散发性乳头状肾细胞癌患者纳入平行、独立的队列中。所有患者接受贝伐珠单抗(10mg/kg,Q2W)和厄洛替尼(150mg,QD)治疗,直至出现不可耐受的毒性或疾病进展。研究入组的患者包括先前接受不超过两种靶向VEGFR通路药物治疗的患者。研究主要终点为ORR,次要终点包括PFS和DOR。
研究共纳入83例乳头状肾细胞癌患者,HLRCC队列42例,散发性乳头状肾细胞癌队列41例。大多数患者为IMDC中度风险(53/83,64%),其中27例(33%)患者至少接受过1次治疗。
疗效性分析显示,所有患者的ORR为51%(42/83),HLRCC队列的ORR为64%(27/42),散发性乳头状肾细胞癌队列的ORR为37%(15/41)。所有患者的中位PFS为14.2个月,HLRCC队列中位PFS为21.1个月,散发性乳头状肾细胞癌队列中位PFS为8.7个月。
安全性方面,大多数治疗相关不良事件为1级或2级,最常见的不良反应为痤疮样皮疹(92%)、腹泻(77%)、蛋白尿(71%)和皮肤干燥(61%)。47%的患者发生了≥3级治疗相关不良事件,包括高血压(34%)和蛋白尿(13%)。
该项Ⅱ期研究的结果表明,贝伐珠单抗联合厄洛替尼具有良好的耐受性,并且在晚期乳头状肾细胞癌患者中表现出令人鼓舞的抗肿瘤活性,特别是在FH缺陷的患者中。本研究是HLRCC中首个也是目前最大样本量的前瞻性研究,为没有广泛接受标准治疗的这部分患者提供考虑将贝伐珠单抗联合厄洛替尼作为首选治疗方案提供依据。
1.Choueiri TK,Heng DYC,Lee JL,et al.SAVOIR:A phase Ⅲ study of savolitinib versus sunitinib in pts with MET-driven papillary renal cell carcinoma (PRCC)[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5002).
2.Jonasch E,Donskov F,Iliopoulos O,et al.Phase Ⅱ study of the oral HIF-2α inhibitor MK-6482 for Von Hippel-Lindau disease–associated renal cell carcinoma[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5003).
3.Srinivasan R,Gurram S,Harthy MA,et al.Results from a phase Ⅱ study of bevacizumab and erlotinib in subjects with advanced hereditary leiomyomatosis and renal cell cancer (HLRCC) or sporadic papillary renal cell cancer[EB/OL].J Clin Oncol 38:2020(suppl;abstr 5004).
排版编辑:Zack














 苏公网安备32059002004080号
苏公网安备32059002004080号


