重磅
时隔三月
医肿GCP中心再次在Lancet Oncology发表文章
研究全球抗肿瘤生物类似药可获得性及影响因素

2020年2月,柳叶刀·肿瘤(Lancet Oncology)刊发了医肿GCP中心文章——“Availability of anticancer biosimilars in 40 countries”。向全球肿瘤科研学术界及医药研发界汇总报告全球40个国家,抗肿瘤生物类似药的可获得性情况。
生物类似药是指在质量、安全性和有效性方面与已获批的参照原研药具有相似性的生物制品,通常价格较原研药更低。
研究背景
随着肿瘤生物制品等新药不断涌现,全球肿瘤费用持续增加,不论是对于各国医保部门还是全球中低收入患者人群,抗肿瘤生物类似药都将以更具有影响力的方式改变全球医疗服务质量及公平性,为解决昂贵肿瘤生物药打开另一扇门。
实现全民健康覆盖(SDG3.8)是联合国可持续发展目标2030核心目标之一,也是“健康中国”重要目标之一。其内容包括所有人的财务风险保障、获得优质基本卫生保健服务以及获得安全、有效、优质负担得起的基本药物和疫苗。推广使用肿瘤生物类似药已成为实现全球癌症防控公平性、可及性的重要战略。药物可获得性(供方范畴,指药物获批上市)是实现药物可及性(需方范畴,指患者用上药)的基本前提。汇总全球肿瘤生物类似药可获得性数据对于发现全球健康公平问题及提供相关解决方案具有重要意义。
为此,在国家药品监督管理局药品审评中心的大力支持下,经赫捷院士、孙燕院士、徐兵河教授指导,由国家癌症中心/中国医学科学院肿瘤医院GCP中心李宁教授牵头,联合北京天坛医院陈霞教授、河南省肿瘤医院贺宝霞教授、淮安市第一人民医院范瑞华教授、葫芦岛市中心医院周彩云教授,由黄慧瑶博士、吴大维博士和马飞教授作为第一作者完成本项研究报告—全球抗肿瘤生物类似药可获得性。
研究结果
1. 全球共有针对10个原研品种的63个抗肿瘤生物类似药上市,利妥昔单抗、曲妥珠单抗和贝伐珠单抗是最常见的原研品种。
截止2019年12月31日,全球共有262种生物类似药获批上市,其中肿瘤生物类似药共有129种,包括抗肿瘤生物类似药63(24%)种,肿瘤辅助类似药66(25%)种。
全球63个抗肿瘤生物类似药共涉及10个原研品种,利妥昔单抗、曲妥珠单抗和贝伐珠单抗为涉及类似药品种数最多的原研品种,分别有20、14和14个获批类似药。这三个品种也是全球销售额最大的三个肿瘤生物制品。
2. 国家经济发展水平越高,抗肿瘤生物类似药可获得性越好。
按照世界银行标准将40个国家按经济发展水平重新归类,发现高收入国家抗肿瘤生物类似药上市最多(针对7个原研药30个类似药),中高收入国家(针对5个原研药17个类似药)和中低收入国家(针对7个原研药19个类似药)数量相当。剔除印度数据进行敏感性分析发现,抗肿瘤生物类似药上市数量与国家经济发展程度显著相关(相关系数=0.534,P=0.005)。
3. 中国大陆已有2个抗肿瘤生物类似药上市,多个产品进入注册申报及临床疗效验证阶段,中国即将迎来抗肿瘤生物类似药快速发展期。
中国已有2个抗肿瘤类似药获批上市,另有3个类似药已进入上市申请阶段,并有27个类似药已进入临床疗效比较阶段。从临床试验发起数量来看,2016-2019年发起数量为2012-2015年的11倍。由此可见,在国家药监局出台系列加快审评审批以及生物类似药监管政策下,一方面强化了全球企业对生物类似药进入中国市场的信心,同时也激发了国内企业看齐国际高标准和创新转型的动力,预示着中国即将迎来生物类似药的快速发展期。
研究意义
本研究首创性进行了全球抗肿瘤生物类似药可获得性的汇总和不同地区可获得性差异比较,并以中国作为生物类似药新兴市场代表,从临床研发角度分析提高生物类似药可获得性的关键,为促进实现全球健康覆盖,提升医疗公平和可及性提供重要参考和依据。
生物类似药的研发和应用受到以下三个方面的影响和制约:
1. 全球地域经济发展情况差异:不同经济发展地区呈现的抗肿瘤生物类似药可获得性差异可能受市场需求和支付能力驱动的商业利益影响。在经济发达地区,面对高需求和预算限制,医疗系统有采取生物类似药的动力,政府愿意加快批准并通过纳入医保来提高生物类似药使用率;在经济欠发达地区,当昂贵肿瘤药物未进入医疗福利或是报销范围中的情况下,药企不会首选在这些地区研发药物。但恰恰正是在这些经济和资源欠发达地区,价格更低廉的生物类似药更应该尽早地被大范围使用,以实现全民健康覆盖。
2. 对于生物类似药学术认知和政策法规差异:对生物类似药的了解、认知和监管审查体系不成熟也影响了此类药物的普及应用。生物类似药研发时需要满足的条件,临床试验的研究终点设定,以及是否能够无缝替代原研药物都对其发展产生了一定的影响。妥善解决生物类似药生产、存储、供应和审批监管等问题,以避免生产不合标准的生物类似药十分重要。
3. 生物类似药的商业定价策略:针对药物可及性,中国利用大市场,集中竞争性带量采购的策略,在很短的时间内,很好地解决了患者用药经济负担。但在全球范围内,割裂的小市场下,应该警惕价格竞争可能带来的风险。药品定价需合理,太低定价可能迫使其他药企退出市场,从而形成垄断,导致药物短缺。对于采用垄断、政策限制推迟生物类似药进入等反竞争的商业行为也不应鼓励,这可能会损害生物类似药市场和为患者持续提供最佳医疗保健服务的可持续性。同时,对于过程、质量也要加强监控,不能为了实现药物可负担性而降低药物生产质量。
小结
研究提示在全球范围内,抗肿瘤生物类似药的可获得性不断提高。为了充分发挥其潜能,通过培训、教育提升抗肿瘤生物类似药的使用率至关重要。抗肿瘤生物类似药的地区差异也表明,需要更多的努力来促进其在资源受限地区的可获得性。此外,对于生物类似药的全球新兴市场,应更加注意确保制药公司确定合理的研发重点,并为生物类似药培育可持续发展的生态系统。
国内已上市和上市申请阶段的肿瘤生物类似药

研究重点图表
表1. 全球抗肿瘤生物类似药可获得性汇总
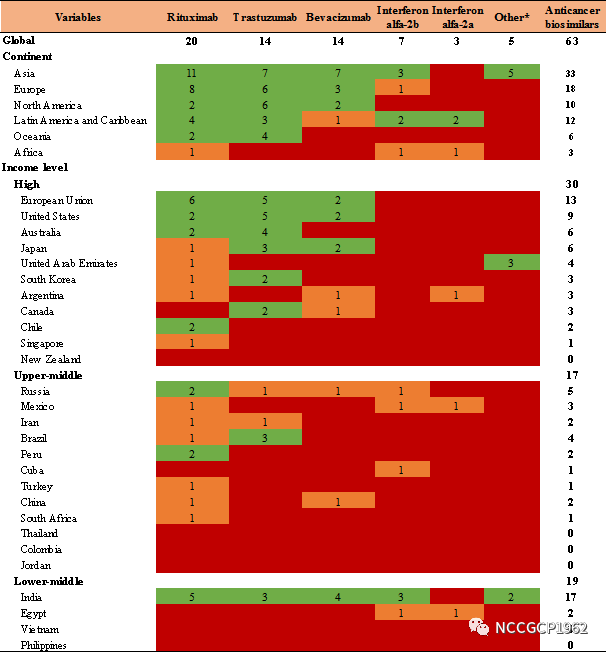
Note: *For the other five anticancer biosimilars approved, three (pertuzumab, cetuximab and ado-trastuzumab emtansine) were launched in United Arab Emirates, and the other two (peginterferon alfa-2b, aldesleukin) were launched in India.
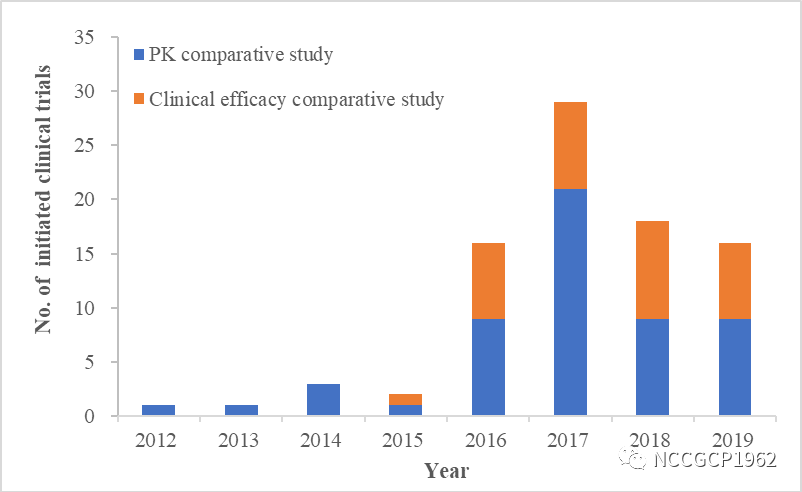
图1.中国大陆抗肿瘤生物类似药临床试验时间趋势
表2.中国大陆抗肿瘤生物类似药研发进展
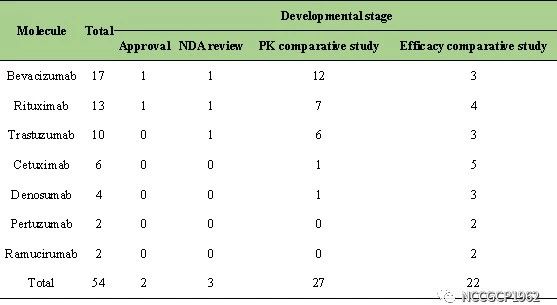
Note: NDA was the abbreviation of new drug application
推荐阅读:
重磅!医肿GCP中心在《Lancet Oncology》发文:报告我国肿瘤临床试验十年进展

扫描上方二维码,关注“NCCGCP1962”微信公众号
















 苏公网安备32059002004080号
苏公网安备32059002004080号


