2019年9月27日—10月1日,2019年欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那盛大召开。为了更好地照护癌症患者,诸多临床专家潜心钻研。2019年9月30日,媒体发布会公布三大研究的重磅结果,【肿瘤资讯】小编从前线带来最新报道。

重磅一:LBA10——ClarIDHy:ivosidenib 对比安慰剂用于IDH1突变晚期胆管细胞癌的全球III期随机双盲研究


报告者:Ghassan K.Abou-Alfa教授
ClarIDHy研究入组组织学确诊的胆管细胞癌患者,以二代测序(NGS)法明确mIDH1状态,ECOG PS评分0~1,先前接受过1~2线治疗(至少1个含吉西他滨或5-FU的方案),有符合RECIST v1.1标准的可测量病灶,骨髓、肝、肾功能良好。预先筛查出IDH1突变患者185例,按2∶1随机接受ivosidenib[500 mg qd,连续服用28天(±2天);n=124]或安慰剂(n=61)治疗。允许患者在疾病进展后交叉至另一组。分层因素为既往治疗线数。
ClarIDHy研究设计
研究结果显示:ivosidenib组较安慰剂组显著改善无进展生存(PFS),中位PFS分别为2.7个月和1.4个月,ivosidenib组的6个月PFS率达32%,12个月PFS率22%,疾病进展或死亡风险降低63%(HR=0.37,P<0.001)。疾病控制率(DCR)亦以ivosidenib组显著更优(53% vs 28%)。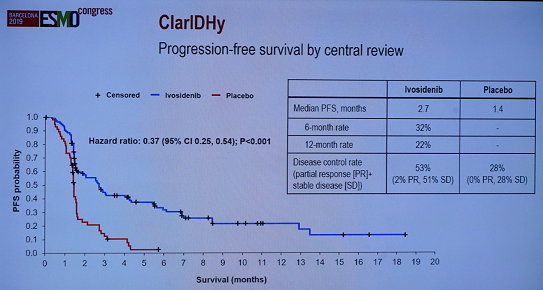
ClarIDHy研究PFS结果
总生存(OS)也有获益的趋势,ivosidenib组和安慰剂组的中位OS分别为10.8个月和9.7个月。6个月OS率分别为67%和59%,12个月OS率分别为48%和38%。死亡风险降低31%(HR=0.69,P=0.06)。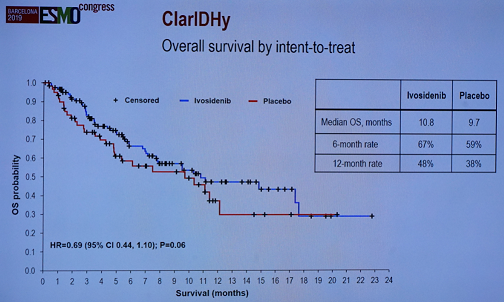
ClarIDHy研究OS结果
ClarIDHy中ivosidenib较安慰剂显著改善了PFS,OS也有改善趋势,且安全性可耐受,研究结果支持ivosidenib对于IDH1突变胆管细胞癌患者的临床获益。这项关键性的临床研究展示出了改变临床实践的结果,基因检测将成为这类患者的标准处理方法,该研究为这一多年来治疗无进展的罕见疾病的靶向治疗研究打开了希望之门。
重磅二:LBA12——PROfound研究:奥拉帕利对比恩杂鲁胺或阿比特龙治疗伴有同源重组修复(HRR)基因改变的转移性去势抵抗性前列腺癌(mCRPC)


报告者:Maha Hussain教授
转移性去势抵抗性前列腺癌(mCRPC)可能伴有同源重组修复(HRR)基因的改变,包括BRCA1、BRCA2、ATM等基因的改变,而这些基因改变对PARP抑制剂敏感。PROfound研究是一项前瞻性、国际多中心、随机、开放标签的Ⅲ期试验,入组患者为肿瘤组织检测证实携带同源重组修复基因突变且经新型内分泌治疗发生进展的mCRPC患者。
研究共分为2个队列,队列A纳入BRCA1、BRCA2、ATM基因改变的患者,队列B则纳入携带其他12种基因改变的患者。两个队列均按2∶1随机分配至奥拉帕利治疗组或新型内分泌治疗组(恩杂鲁胺或阿比特龙)。分层因素包括既往是否接受过紫杉类化疗、基线是否存在可衡量病灶。主要终点为独立评审委员会(BICR)评估的影像学无进展生存期(rPFS;队列A),次要终点包括:BICR评估的客观缓解率(ORR;队列A)、BICR评估的rPFS(队列A+B)、至疼痛进展时间(队列A)以及OS(队列A)。研究以组织检测结果为标准判定HRR突变状态,同时获得患者血液标本,进行胚系突变检测和ctDNA检测,以进行回顾性分析。
PROfound研究设计
中位治疗时间,奥拉帕利组为7.4个月,对照组为3.9个月,≥3级不良事件发生率2组分别为50.8%和37.7%。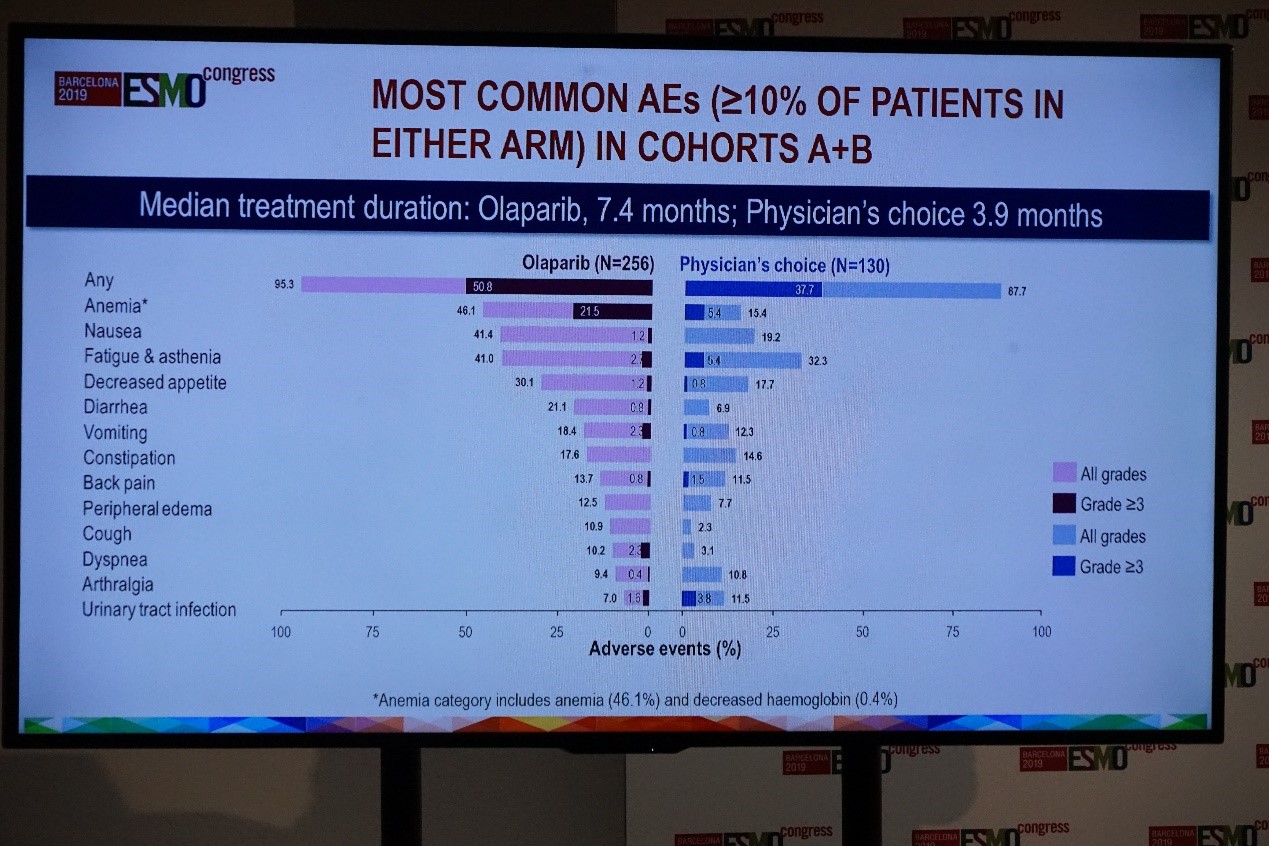
PROfound研究安全性分析
对主要终点队列A的rPFS进行分析,结果显示,奥拉帕尼组(n=162)显著延长患者的rPFS,中位rPFS达到7.39个月,而对照组(n=83)为3.55个月(HR=0.34,95%CI:0.24~0.47;P<0.0001)。
次要终点分析,队列A中,奥拉帕利组显著提高ORR(33.3% vs 2.3%;P<0.0001);奥拉帕利组显著延长至疼痛进展时间(NR vs 9.92个月;HR=0.44,P=0.0192);在对照组中有80.6%的患者进展后交叉接受奥拉帕利治疗的情况下,两组的中位OS分别为18.5个月和15.11个月,尽管奥拉帕利组降低36%死亡风险,但两组间并无统计学差异[HR=0.64,P=0.0173(预设P值为0.01)]。
对另一次要终点队列A+B的rPFS进行分析,奥拉帕利组同样显著改善rPFS,两组中位rPFS分别为5.82个月和3.52个月(HR=0.49,95%CI:0.38~0.63;P<0.0001)。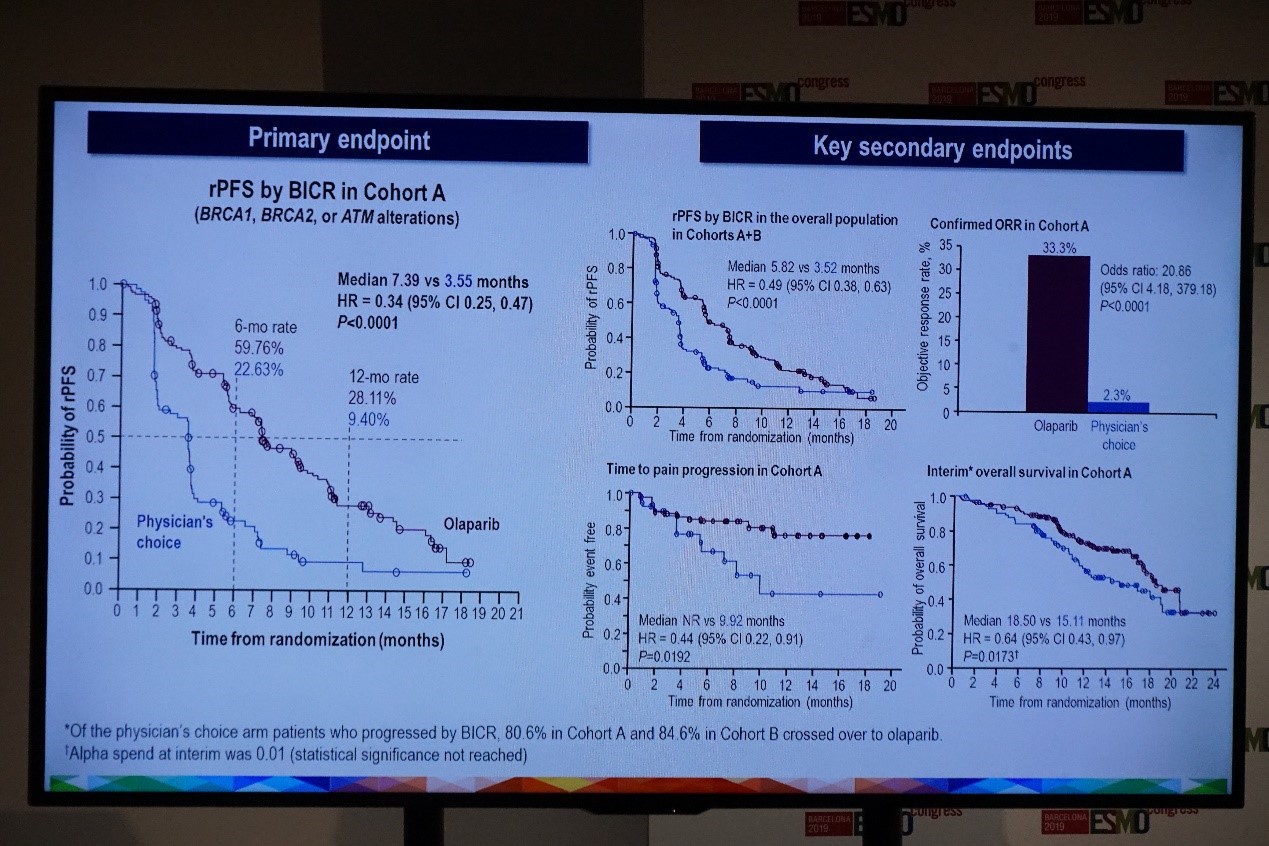
PROfound研究疗效分析
研究者表示,PROfound研究证实了PARP抑制剂奥拉帕利在接受新型内分泌治疗进展后、存在HRR改变的mCRPC患者中具有良好的治疗效果,相比恩杂鲁胺或阿比特龙+强的松显著改善rPFS。PROfound研究是第一项在mCRPC患者中通过生物标志物选择取得阳性结果的评估分子靶向治疗的Ⅲ期研究,研究结果表明在这部分人群中进行基因检测的重要性。
重磅三:LBA14——Ⅲ期IMvigor130研究:atezolizumab±含铂化疗对比安慰剂+含铂化疗用于初治局部晚期或转移性尿路上皮癌的疗效和安全性


报告者:Enrique Grande教授
IMvigor130研究是一项多中心、部分盲法、随机的3期研究,评估PD-L1抑制剂atezolizumab联合吉西他滨铂类(A组)、atezolizumab单药(B组),对比安慰剂+吉西他滨铂类(C组)用于初治局部晚期或转移性尿路上皮癌的疗效和安全性。共同主要终点包括:研究者(INV)评估的PFS和OS(A组 vs C组);OS(B组 vs C组,分层)。主要的次要终点包括INV评估的ORR和缓解持续时间(DoR);PFS和OS(B组 vs C组,PD-L1 IC2/3亚组);安全性。
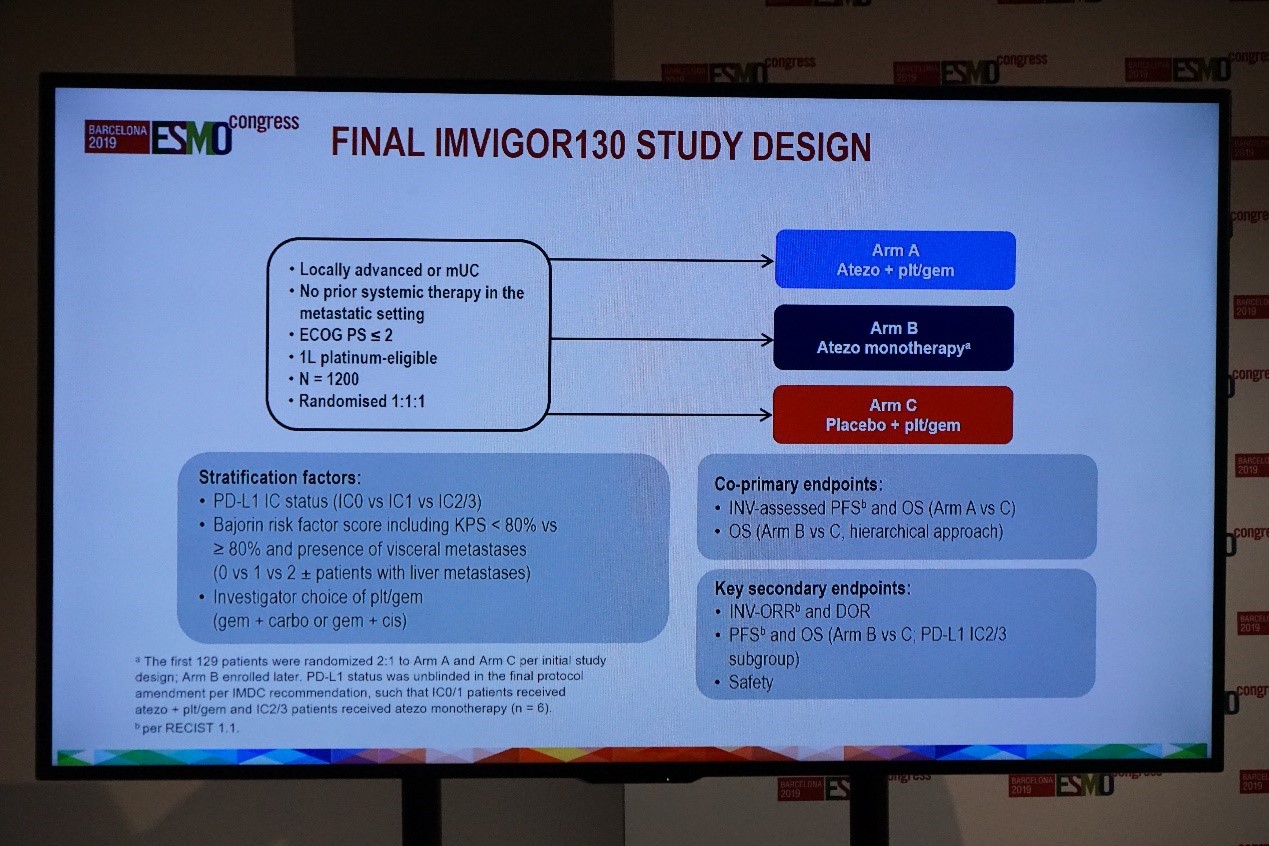
IMvigor130研究设计
在意向治疗人群中,最终的PFS结果显示,atezolizumab联合化疗组和单纯化疗组的中位PFS分别为8.2个月和6.3个月(HR=0.82,95%CI:0.70~0.96;P=0.007)。
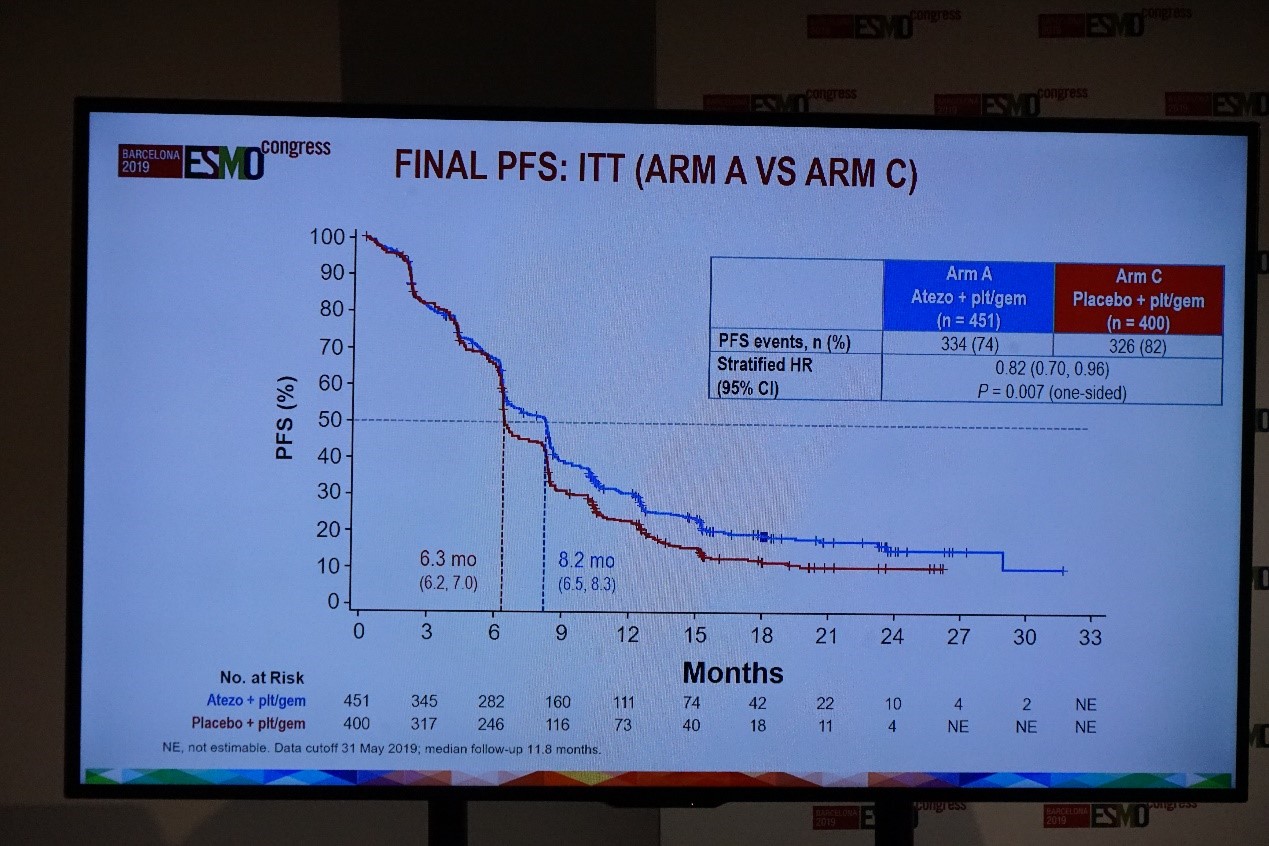
IMvigor130研究最终PFS分析(A组 vs C组)
atezolizumab联合化疗组和单纯化疗组的中位OS分别为16.0个月和13.4个月(HR=0.83,95%CI:0.69~1.00;P=0.027)。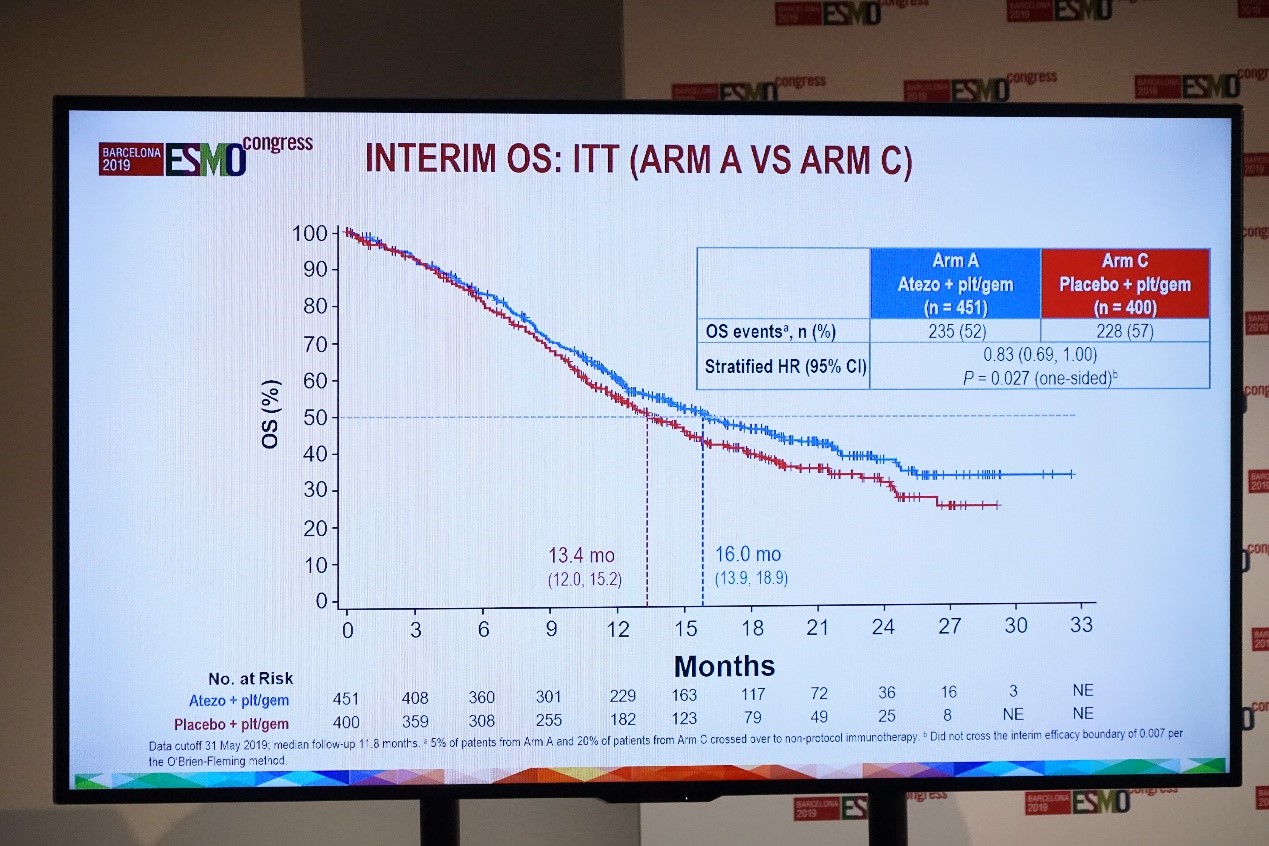
IMvigor130研究中期OS分析(A组 vs C组)
根据PD-L1表达水平,B组和C组的中期分析OS结果显示:在PD-L1 IC0/1亚组中,atezolizumab单药组和单纯化疗组的中位OS分别为13.5个月和12.9个月(HR=1.07,95%CI:0.86~1.33);在PD-L1 IC2/3亚组中,atezolizumab单药组和单纯化疗组的中位OS分别为不可评估(NE)和17.8个月(HR=0.68,95%CI:0.43~1.08)。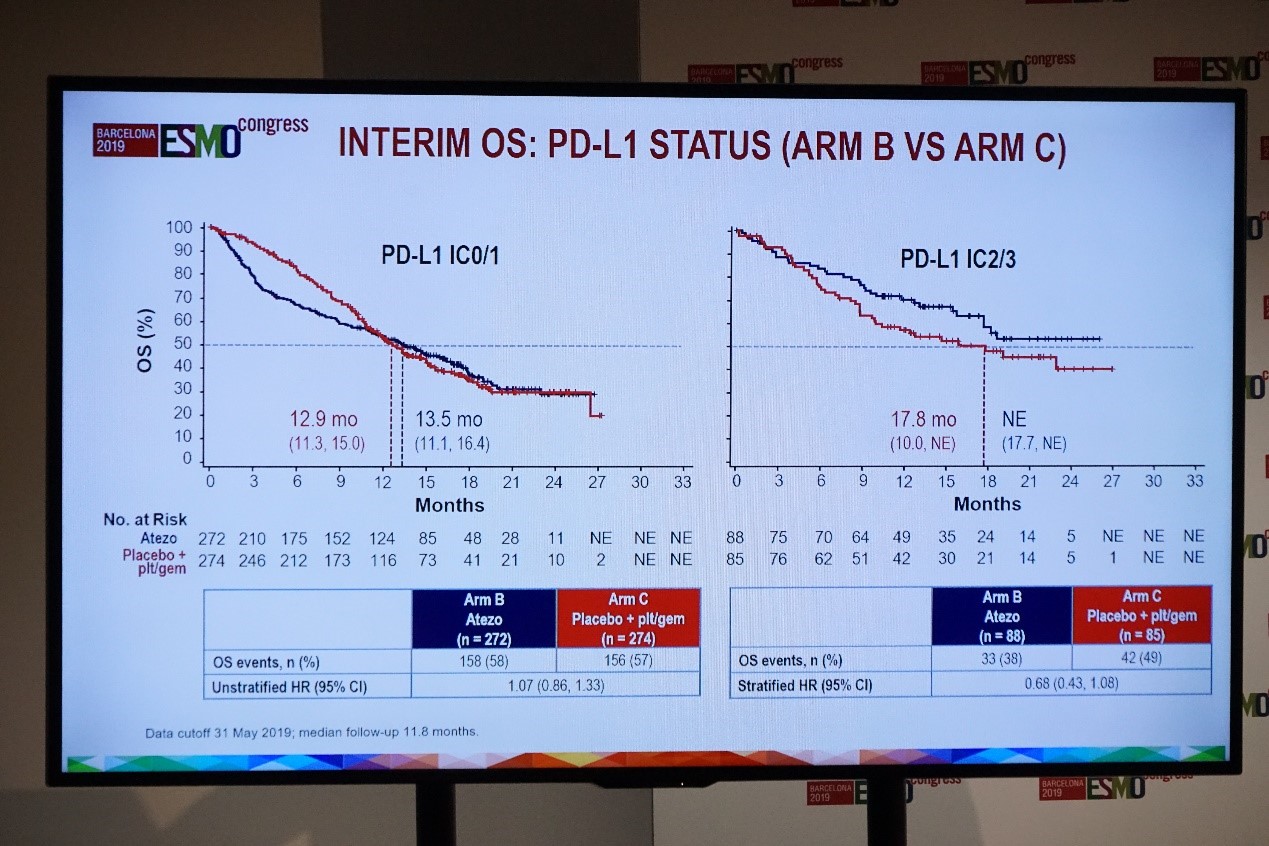
IMvigor130研究中期OS分析(B组 vs C组)
研究者表示,IMvigor130研究达到共同主要终点PFS,atezolizumab联合吉西他滨铂类安全性可控,研究结果支持该方案作为未经治疗的转移性尿路上皮癌患者的重要治疗选择。











 苏公网安备32059002004080号
苏公网安备32059002004080号


