2019年9月27日—10月1日,2019年欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那盛大召开,今年的会议主题是“Translating science into better cancer patient care(让科学更好地呵护癌症患者)”,再一次成为全球关注的焦点。
继2019年第20届世界肺癌大会(WCLC)上,Marina Chiara Garassino教授以及Corey Jay Langer教授分别汇报了KEYNOTE-189研究以及KEYNOTE-021研究中肿瘤组织中肿瘤突变负荷(tTMB)与帕博利珠单抗联合化疗疗效关系的探索性分析结果之后,火热的TMB被浇了一盆冷水。本次ESMO大会上,来自耶鲁大学医学院的Roy S.Herbst教授公布了KEYNOTE-010研究以及KEYNOTE-042研究中关于tTMB在帕博利珠单抗单药治疗下,是否能够预测疗效、临床预后等的探索性分析结果。

Roy S.Herbst教授
既往研究提示:TMB不能预测帕博利珠单抗联合化疗疗效,TMB与PD-L1表达水平无相关性
肿瘤突变负荷(TMB)作为免疫治疗疗效预测标志物的研究,已经在非小细胞肺癌患者中进行了大量的研究探索,采用TMB作为标志物有可能筛选处从免疫治疗中获益的患者。然而,TMB能否作为化疗或化疗联合免疫治疗的标志物,相关研究数据甚少。2019年第20届世界肺癌大会上、Marina Chiara Garassino教授以及Corey Jay Langer教授分别汇报了KEYNOTE-189研究以及KEYNOTE-021研究中,tTMB在预测帕博利珠单抗联合化疗的疗效和临床预后等方面的探索性分析结果。然而,这两项研究的结果一致认为,TMB不能预测帕博利珠单抗联合化疗用于晚期NSCLC一线治疗的疗效,并且TMB与PD-L1表达水平也无相关性。
那么,PD-L1和TMB是否确实是两个独立的生物标记物呢?或者是受到了联合化疗药物的影响?在本次ESMO大会上,Roy S.Herbst教授公布了KEYNOTE-010研究以及KEYNOTE-042研究招募的患者接受帕博利珠单抗单药治疗或者含铂双药化疗时,TMB在预测帕博利珠单抗的疗效、临床预后等方面的分析结果。

研究方法
KEYNOTE-010研究是一项Ⅱ/Ⅲ期临床试验,招募PD-L1表达阳性(PD-L1 TPS≥1%)且既往接受过至少一种化疗方案的局部晚期或转移性NSCLC患者,旨在探索帕博利珠单抗对比化疗药物多西他赛的临床疗效。Ⅲ期KEYNOTE-042研究纳入EGFR/ALK阴性、PD-L1表达阳性(PD-L1 TPS≥1%)的未经治疗的转移性NSCLC患者,比较帕博利珠单抗单药和含铂双药化疗方案作为一线治疗方案的疗效和安全性。
在本次汇报的探索性分析结果中,纳入KEYNOTE-010研究和KEYNOTE-042研究中的入组患者。对TMB的评估是基于肿瘤组织以及对应的正常组织的DNA标本的全外显子测序(WES)数据。其次,进行tTMB与肿瘤PD-L1 TPS的相关性分析。在tTMB与临床预后的相关性方面,主要的评价指标包括总体生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)等。

研究结果
KEYNOTE-010研究数据
在KEYNOTE-010研究中,共计有254例患者具有足够的DNA和合格的WES数据进行TMB评估,其中253例患者被纳入后续分析。tTMB可评估的253例患者与KEYNOTE-010研究纳入的总体人群(1033例)的基线资料相当,同时在OS、PFS、ORR方面无显著差异。
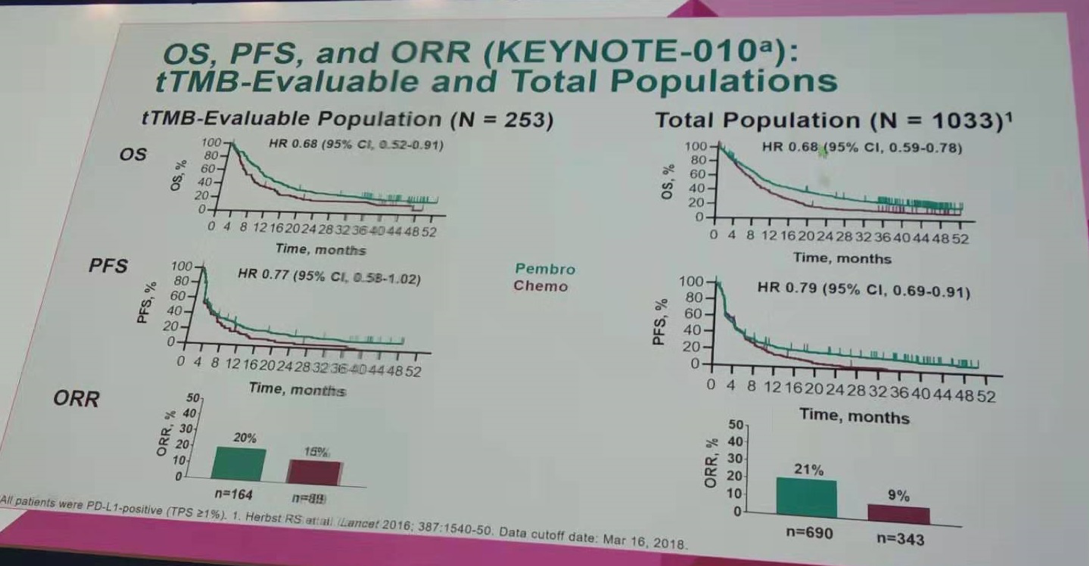
tTMB可评估人群与总体人群之间OS、PFS、ORR无显著差异
tTMB预测帕博利珠单抗治疗组OS、PFS、ORR的ROC曲线P值均小于0.05;而化疗组OS、PFS、ORR的ROC曲线P值均大于0.05。其中tTMB预测ORR的ROC曲线,帕博利珠单抗组为0.61(0.50~0.71),化疗组仅为0.40(0.21~0.58)。提示tTMB作为一个连续变量与帕博利珠单抗的疗效相关,但与化疗无关。
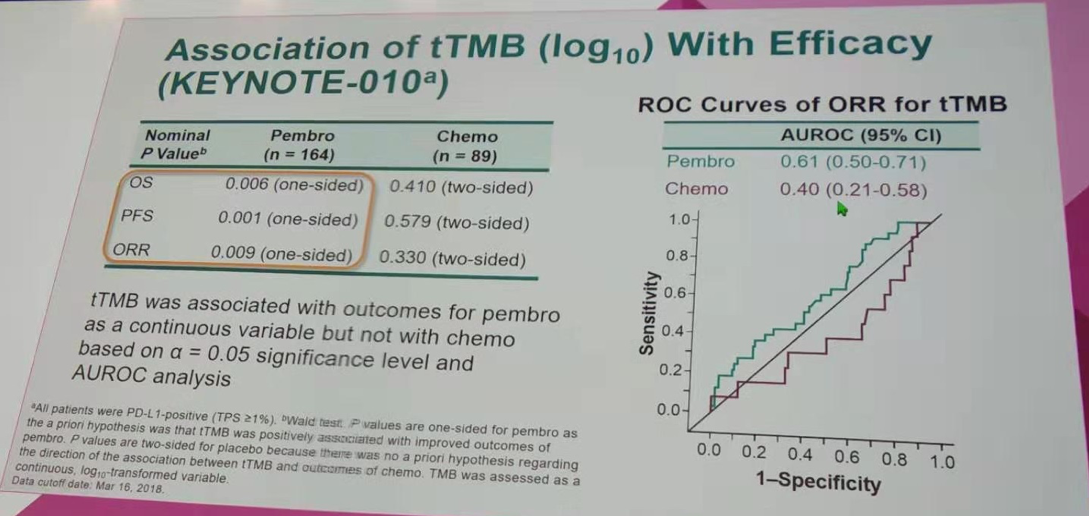
tTMB与疗效(KEYNOTE-010研究)的关联性
tTMB与PD-L1表达水平的相关性分析显示,不论是帕博利珠单抗组,还是化疗组,tTMB均与PD-L1的表达水平无显著相关。
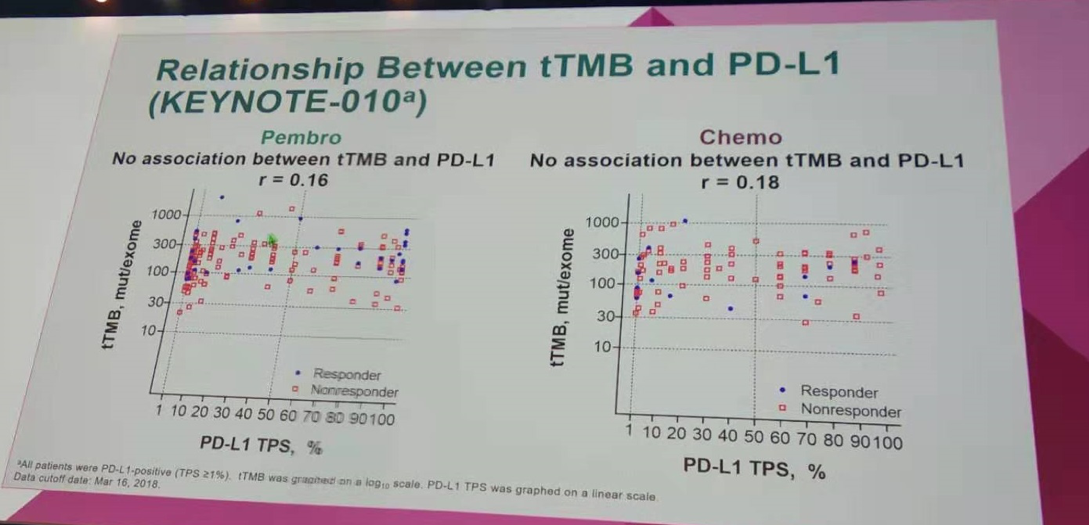
tTMB与PD-L1表达水平无显著相关(KEYNOTE-010研究)
研究者将KEYNOTE-010研究中的253例患者,以tTMB=175 mut/exome(10 mut/Mb)作为分界值,tTMB≥175 mut/exome的患者占52.2%。
在tTMB≥175 mut/exome的患者中,帕博利珠单抗组的中位OS为14.1个月,化疗组的中位OS为7.6个月(HR=0.56;95%CI 0.38~0.83);两组中位PFS分别为4.2个月和2.4个月(HR=0.59;95%CI 0.40~0.87);两组ORR分别为23.5%和9.8%。
而在tTMB<175 mut/exome的患者中,两组的中位OS分别为9.3个月和7.2个月(HR=0.85;95%CI 0.56~1.30);中位PFS分别为3.7个月和3.4个月(HR=1.09;95%CI 0.72~1.63);ORR分别为16.9%和21.1%。提示对于tTMB高的患者,帕博利珠单抗组在OS和PFS上有一定程度的获益。
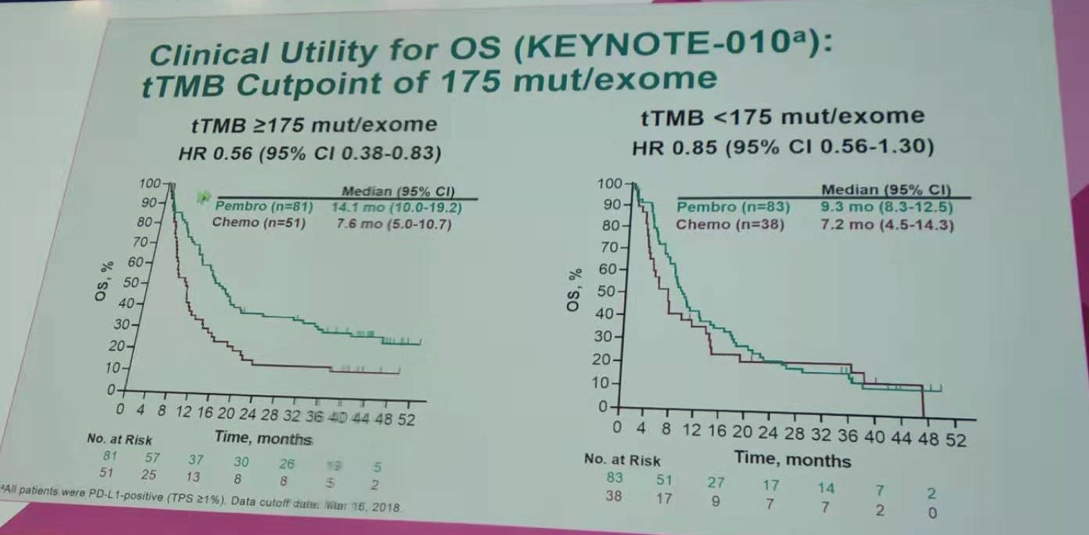
按tTMB=175 mut/exome作为分界值进行OS分析(KEYNOTE-010研究)
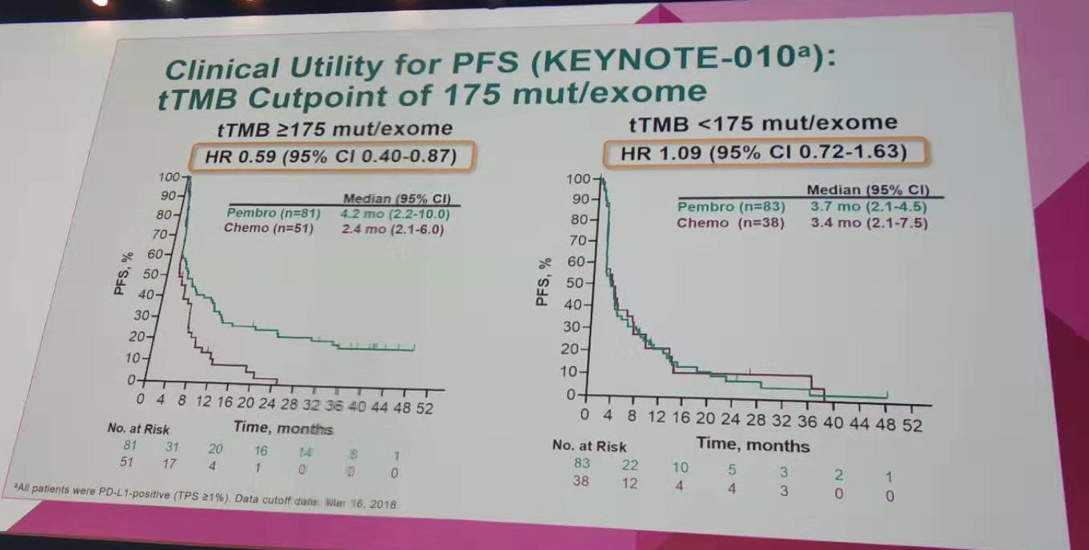
按tTMB=175 mut/exome作为分界值进行PFS分析(KEYNOTE-010研究)
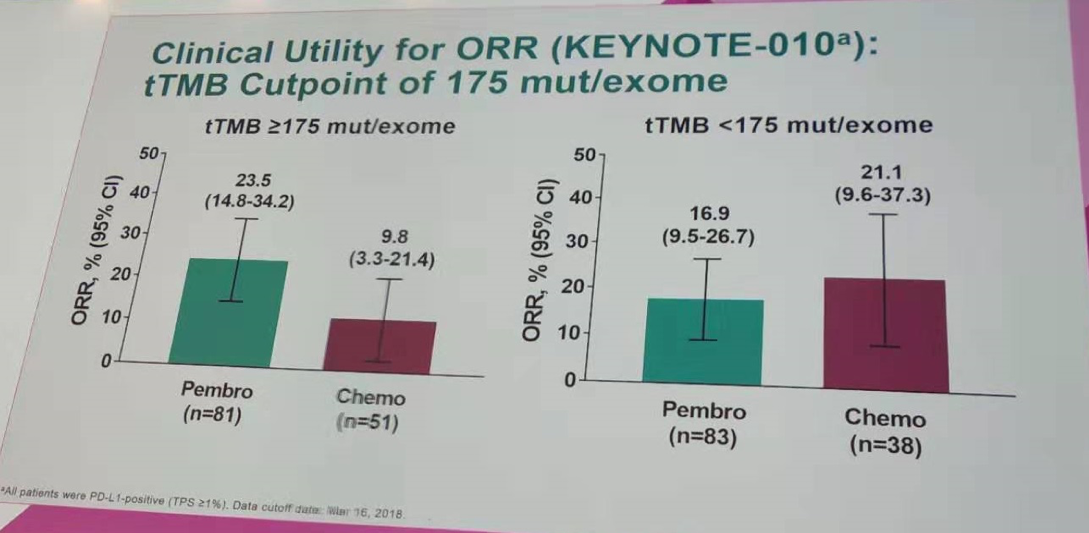
按tTMB=175 mut/exome作为分界值进行ORR分析(KEYNOTE-010研究)
KEYNOTE-042研究数据
在KEYNOTE-042研究中,共计有793例患者具有足够的DNA和合格的WES数据进行肿瘤组织的肿瘤突变负荷评估,均被纳入后续分析。793例患者与KEYNOTE-042研究的总体人群1274例患者的基线水平一致,同样tTMB可评估人群的疗效与KEYNOTE-042研究总体人群相一致。
tTMB预测帕博利珠单抗治疗组OS、PFS、ORR的ROC曲线P值均小于0.001,具有统计学意义;而化疗组除ORR以外,OS、PFS的ROC曲线P值均大于0.05。tTMB预测ORR的ROC曲线,帕博利珠单抗组为0.67(0.61~0.73),化疗组仅为0.57(0.50~0.63)。这与KEYNOTE-010研究的结果相一致,再次提示tTMB作为一个连续变量与帕博利珠单抗的疗效相关,但与化疗无关。
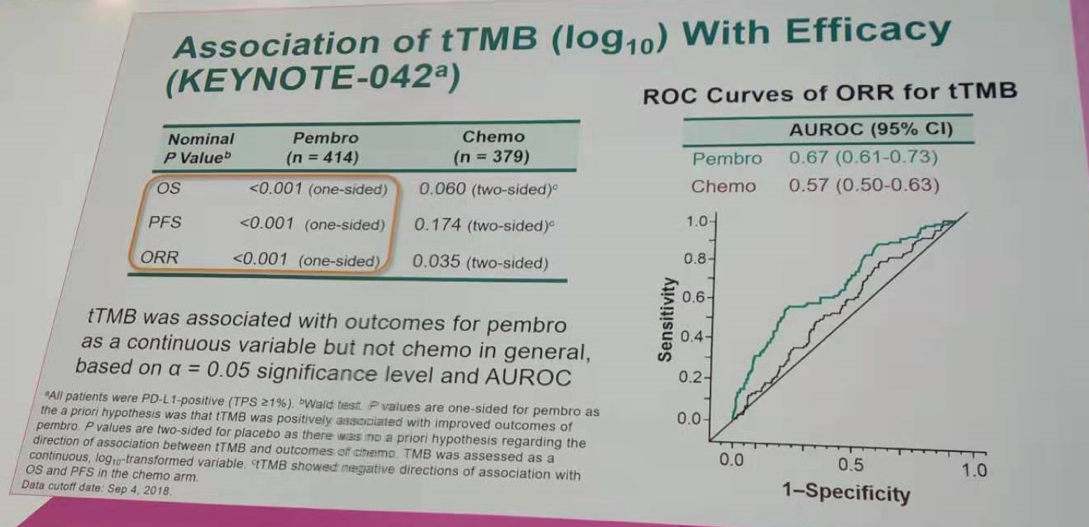
tTMB与疗效(KEYNOTE-042研究)的关联性
tTMB与PD-L1表达水平的相关性分析显示,不论是帕博利珠单抗组,还是化疗组,tTMB同样均与PD-L1的表达水平无显著相关,与KEYNOTE-010研究结果一致。
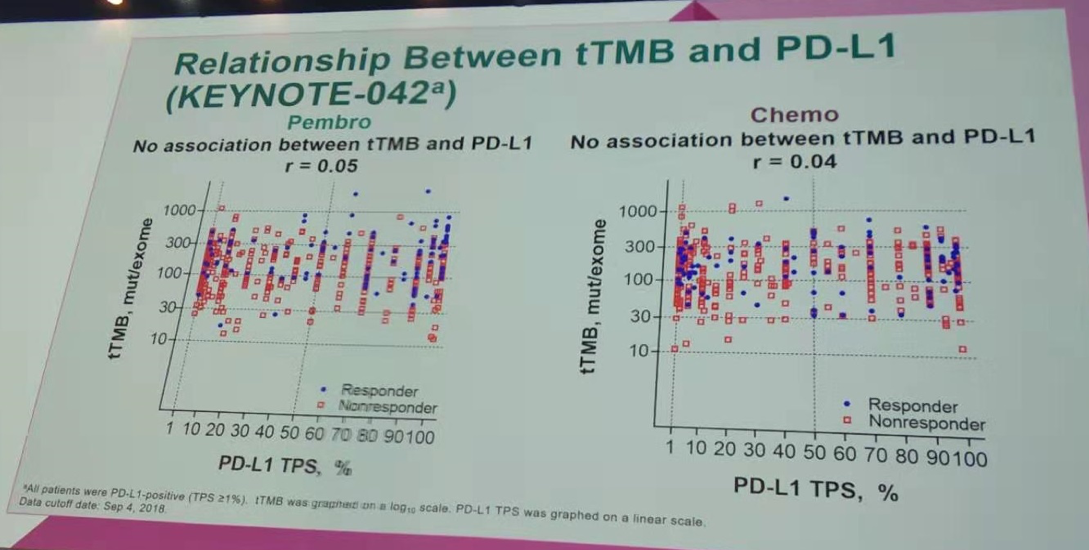
tTMB与PD-L1表达水平无显著相关(KEYNOTE-042研究)
同样以tTMB=175 mut/exome(10 mut/Mb)作为分界值,tTMB≥175 mut/exome的患者占43.5%,略微低于KEYNOTE-010研究。
在tTMB≥175 mut/exome的患者中,帕博利珠单抗组和化疗组的中位OS分别为21.9个月和11.6个月(HR=0.62;95%CI 0.48~0.80);中位PFS分别为6.3个月和6.5个月(HR=0.75;95%CI 0.59~0.95);两组的ORR分别为34.4%和30.9%。
而在tTMB<175 mut/exome的患者中,帕博利珠单抗组和化疗组的中位OS分别为12.0个月和12.3个月(HR=1.09;95%CI 0.88~1.36);中位PFS分别为4.1个月和6.3个月(HR=1.27;95%CI 1.04~1.55);两组的ORR分别为18.8%和22.4%。提示对于tTMB高的患者,帕博利珠单抗组有一定程度的疗效获益。
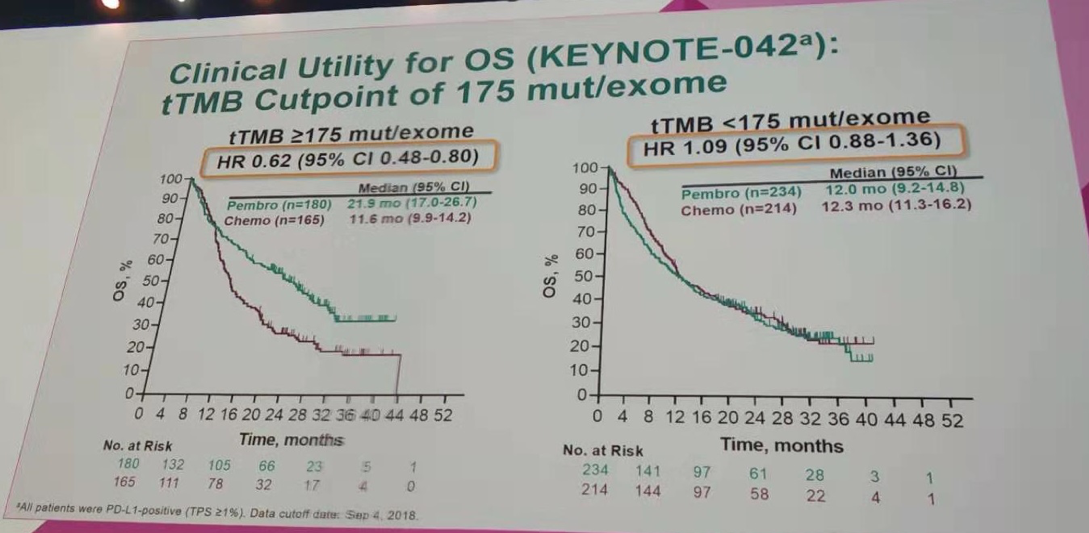
按tTMB=175 mut/exome作为分界值进行OS分析(KEYNOTE-042研究)
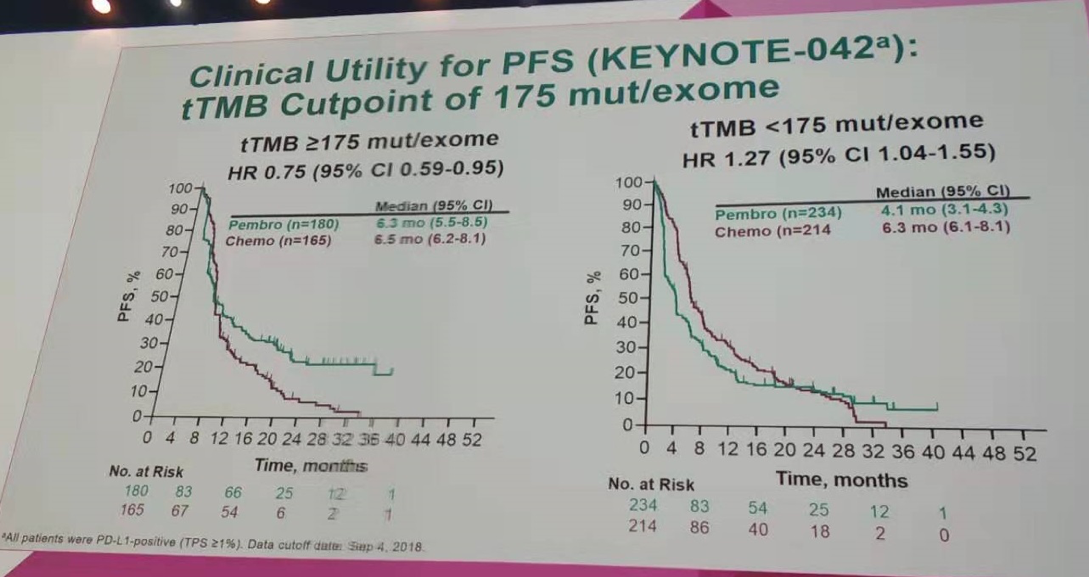
按tTMB=175 mut/exome作为分界值进行PFS分析(KEYNOTE-042研究)
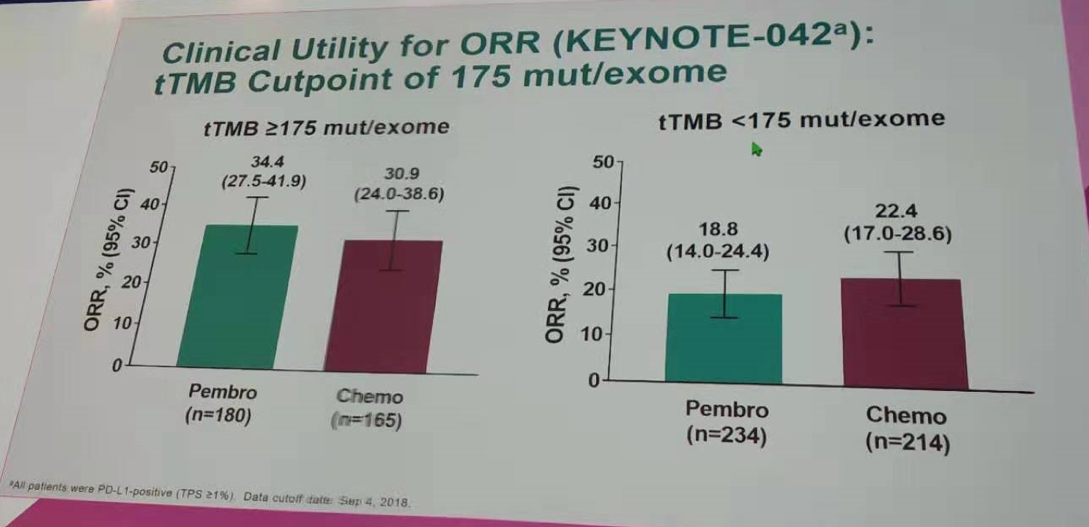
按tTMB=175 mut/exome作为分界值进行ORR分析(KEYNOTE-042研究)
研究结论及讨论
研究者表示,此项探索性分析结果显示,对于PD-L1表达阳性的非小细胞肺癌患者,高tTMB能够在一定程度上预测帕博利珠单抗单药作为一线治疗或者二线及以上治疗方案的临床结局,同时高tTMB水平与化疗的疗效应答无关联性。当然,不能忽视的是,本项研究仅是一项探索性的分析,也仅纳入了KEYNOTE-010研究以及KEYNOTE-042研究的部分亚组人群进行分析,目前还需要更大样本量的队列进行前瞻性研究。研究结果表明,tTMB可能为帕博利珠单抗单药疗法在PD-L1表达阳性晚期NSCLC的一线治疗、二线或以上治疗中提供有关临床获益的额外信息。
单药可预测疗效,但帕博利珠单抗联合化疗疗效却与tTMB无关
尽管KEYNOTE-010研究以及KEYNOTE-042研究的探索性分析结果提示tTMB与帕博利珠单抗单药的疗效相关,但对于帕博利珠单抗联合化疗,tTMB无法预测疗效也是不争事实。除了先前提及的在WCLC上汇报的KEYNOTE-189研究以及KEYNOTE-021研究的探索性分析,本次ESMO大会上,由来自西班牙的Luis Paz-Ares教授汇报的对KEYNOTE-021/189/407三项研究进行汇总的探索性分析结果同样表明,tTMB与帕博利珠单抗联合化疗的疗效无显著相关。

Luis Paz-Ares教授

疗效与tTMB的相关性分析(KEYNOTE-021/189/407研究)
探索性分析中同样对tTMB和PD-L1的相关性进行分析,同前文所述的研究结果一致,在任一研究的任一队列中,tTMB与PD-L1并没有非常强烈的关联性。
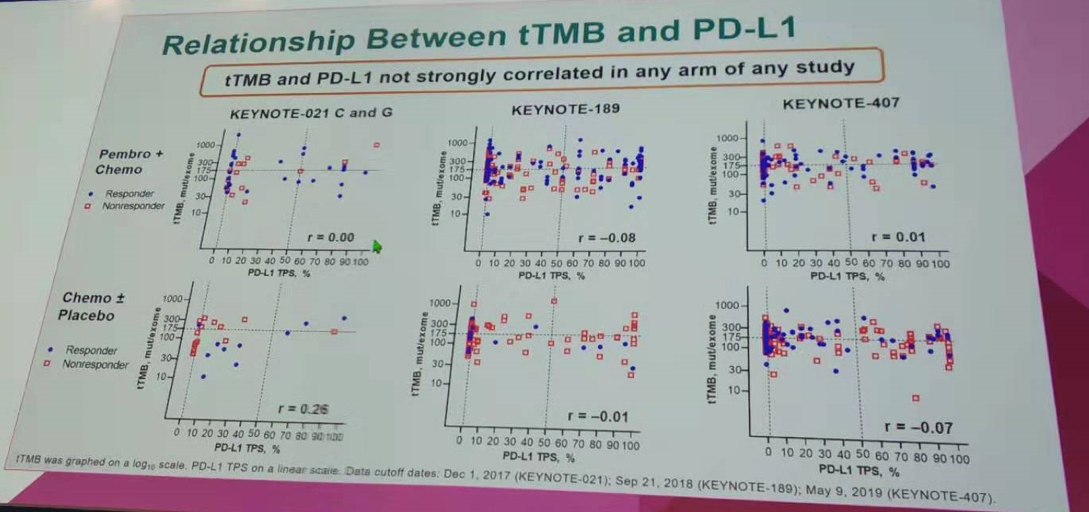
tTMB与PD-L1并没有非常强烈的关联性(KEYNOTE-021/189/407研究)
同样以tTMB=175 mut/exome(10 mut/Mb)作为分界值,对三项研究的队列进行OS、PFS和ORR分析。结果显示,不管是肺鳞癌还是非鳞癌患者,相比单纯化疗,帕博利珠单抗+化疗在tTMB高和tTMB低组有OS的获益。同时在tTMB高和tTMB低组,均观察到帕博利珠单抗+化疗在PFS和ORR上的获益。
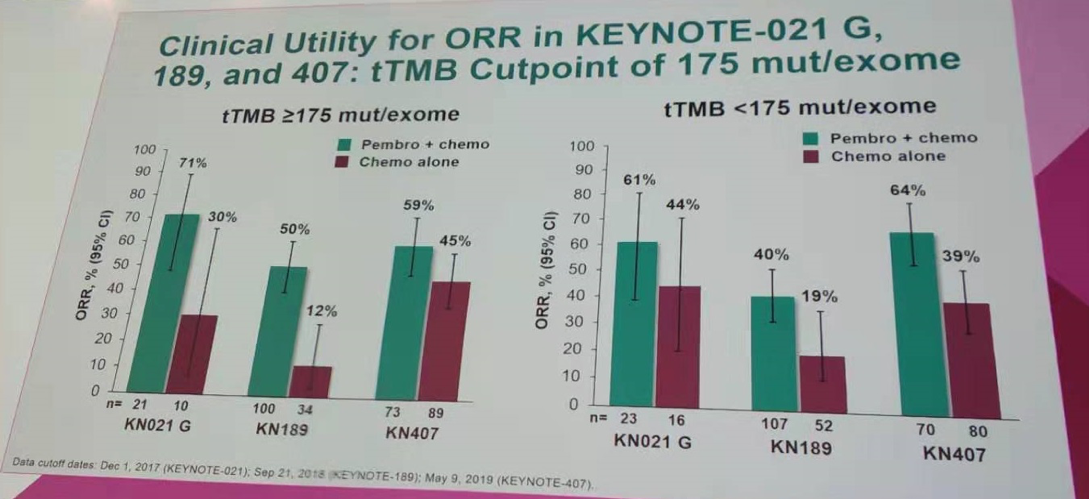
按tTMB=175 mut/exome作为分界值进行ORR分析(KEYNOTE-021/189/407研究)
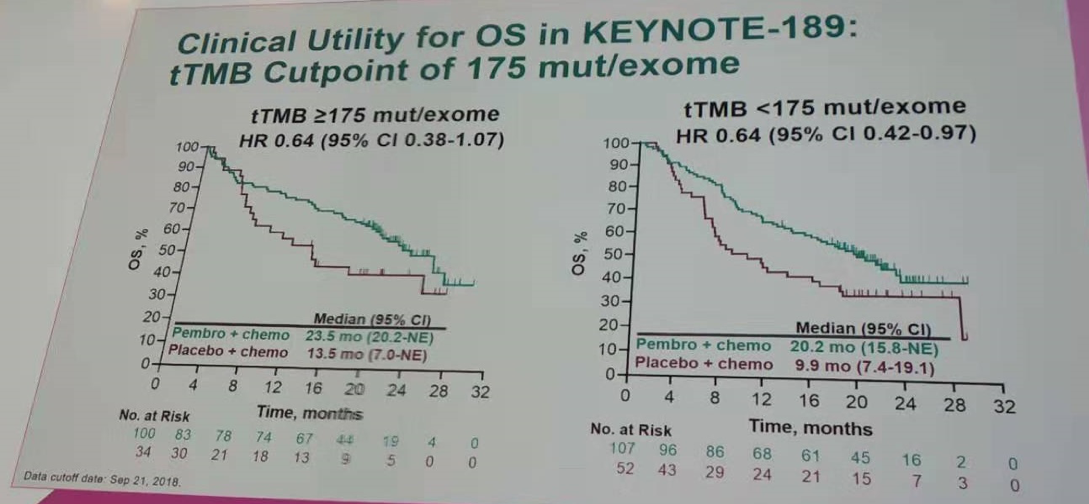
按tTMB=175 mut/exome作为分界值进行OS分析(KEYNOTE-189研究)
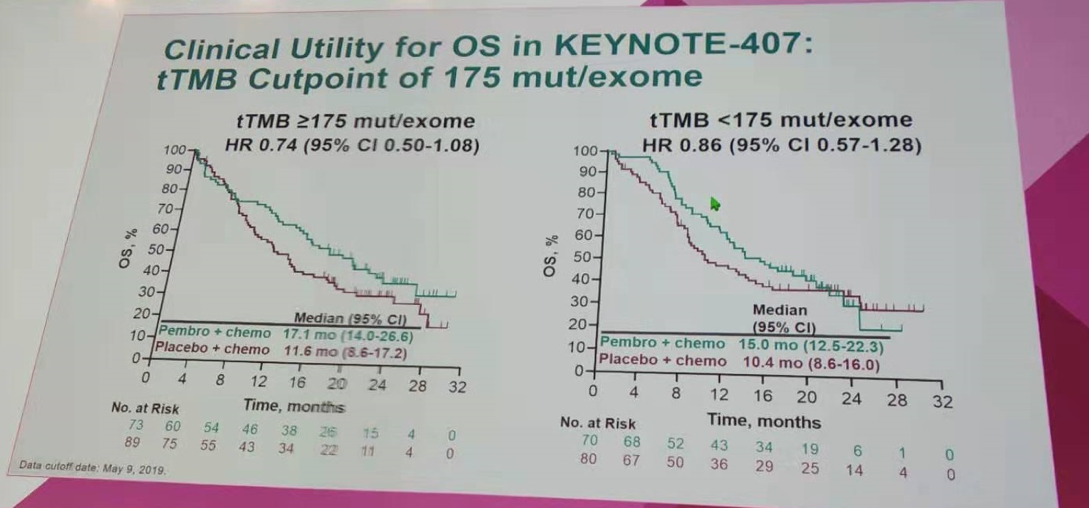
按tTMB=175 mut/exome作为分界值进行OS分析(KEYNOTE-407研究)

研究结论
近期WCLC、ESMO年会上报告的有关于tTMB预测帕博利珠单抗疗效的4项探索性分析结果表明,tTMB能够一定程度预测帕博利珠单抗单药的疗效,但与帕博利珠单抗联合化疗的疗效无显著相关,不论是肺鳞癌还是非鳞癌。同时4项研究均表明,tTMB与PD-L1表达无相关性,对“TMB能否作为免疫疗法生物标志物“的问题,目前作出结论可能为时尚早,需要更多前瞻性研究对TMB与免疫疗法疗效的关系进行深入探索。TMB探索之路争议与挑战并存,道阻且长!
1.Herbst RS,Lopes G,Kowalski DM,et al.Association between tissue TMB(tTMB) and clinical outcomes with pembrolizumab monotherapy(pembro) in PD-L1-positive advanced NSCLC in the KEYNOTE-010 and -042 trials[EB/OL].ESMO 2019,abstract LBA79.
2.Paz-Ares L,Langer CJ,Novello S,et al.Pembrolizumab(pembro) plus platinum-based chemotherapy(chemo) for metastatic NSCLC:Tissue TMB(tTMB) and outcomes in KEYNOTE-021,189,and 407[EB/OL].ESMO 2019,abstract.












 苏公网安备32059002004080号
苏公网安备32059002004080号


