靶向治疗已经成为驱动基因阳性晚期非小细胞肺癌(NSCLC)患者的标准治疗,但几乎所有的患者,不可避免都会出现耐药。对于TKI耐药后的患者,化疗是主要的治疗手段。随着免疫治疗的广泛应用,在驱动基因阳性NSCLC患者中,是否同样适用呢?在2019年美国临床肿瘤学会(ASCO)年会继续教育专场上,来自宾夕法尼亚大学的Corey J.Langer教授带了相关主题演讲——TKI治疗进展后的驱动基因阳性NSCLC患者,免疫治疗单药或联合化疗是否有一席之地?

免疫治疗单药用于晚期NSCLC一线治疗
KEYNOTE-024研究取得了阳性结果,在PD-L1≥50%的患者中,帕博利珠单抗显示出显著的总生存时间(OS)获益,对比化疗,中位OS从14个月延长到30个月。KEYNOTE-042研究再次证实了帕博利珠单抗单药一线治疗的地位,但获益人群主要集中在PD-L1表达≥50%的患者。然而,在KEYNOTE-024和042研究中,均排除了EGFR突变和ALK重排的患者。
一项Ⅱ期研究入组了EGFR突变、PD-L1阳性、既往未接受过TKI治疗的晚期NSCLC患者,评估了帕博利珠单抗的疗效,患者接受帕博利珠单抗治疗(200mg,q3w),主要终点为客观缓解率(ORR)。计划入组25例患者,但在入组11例患者后,因为未观察到疗效而提前终止研究。这11例患者中,9例为初治患者,7例携带EGFR敏感突变,8例为PD-L1高表达。仅1例患者取得PR,回顾性分析显示这例患者未携带EGFR突变。2例患者在治疗6个月后死亡。该研究提示,帕博利珠单抗用于既往未接受过TKI治疗、PD-L1阳性的EGFR突变患者,并未观察到较好的疗效,即使是PD-L1高表达人群。
免疫治疗单药用于二线治疗或局部晚期NSCLC
免疫检查点抑制剂用于EGFR突变患者二线治疗的疗效如何?CheckMate-057研究在非鳞NSCLC患者中对比了多西他赛和纳武利尤单抗,结果显示,EGFR突变亚组的HR值为1.18,而未检测到EGFR突变的患者,HR值为0.66。KEYNOTE-010研究在PD-L1阳性患者中对比了多西他赛和帕博利珠单抗,结果显示在EGFR突变患者中,HR值为0.88,两组无显著差异;而在EGFR野生型患者中,HR值为0.66,且观察到帕博利单抗组OS的显著获益。在OAK研究中,对照组也是多西他赛,研究组为PD-L1抑制剂Atezolizumab,结果显示,在EGFR突变患者中,两组对比提示化疗组更优,HR值为1.24,两组的中位OS相差近6个月。但在EGFR野生型患者中,HR值为0.69,Atezolizumab组观察到6个月的OS获益。
值得注意的是,这3项研究中,入组的EGFR突变患者人数较少,每个研究约80例患者。研究结果均显示,对于EGFR突变患者,免疫检查点抑制剂单药并不能带来生存优势,HR值几乎都大于1。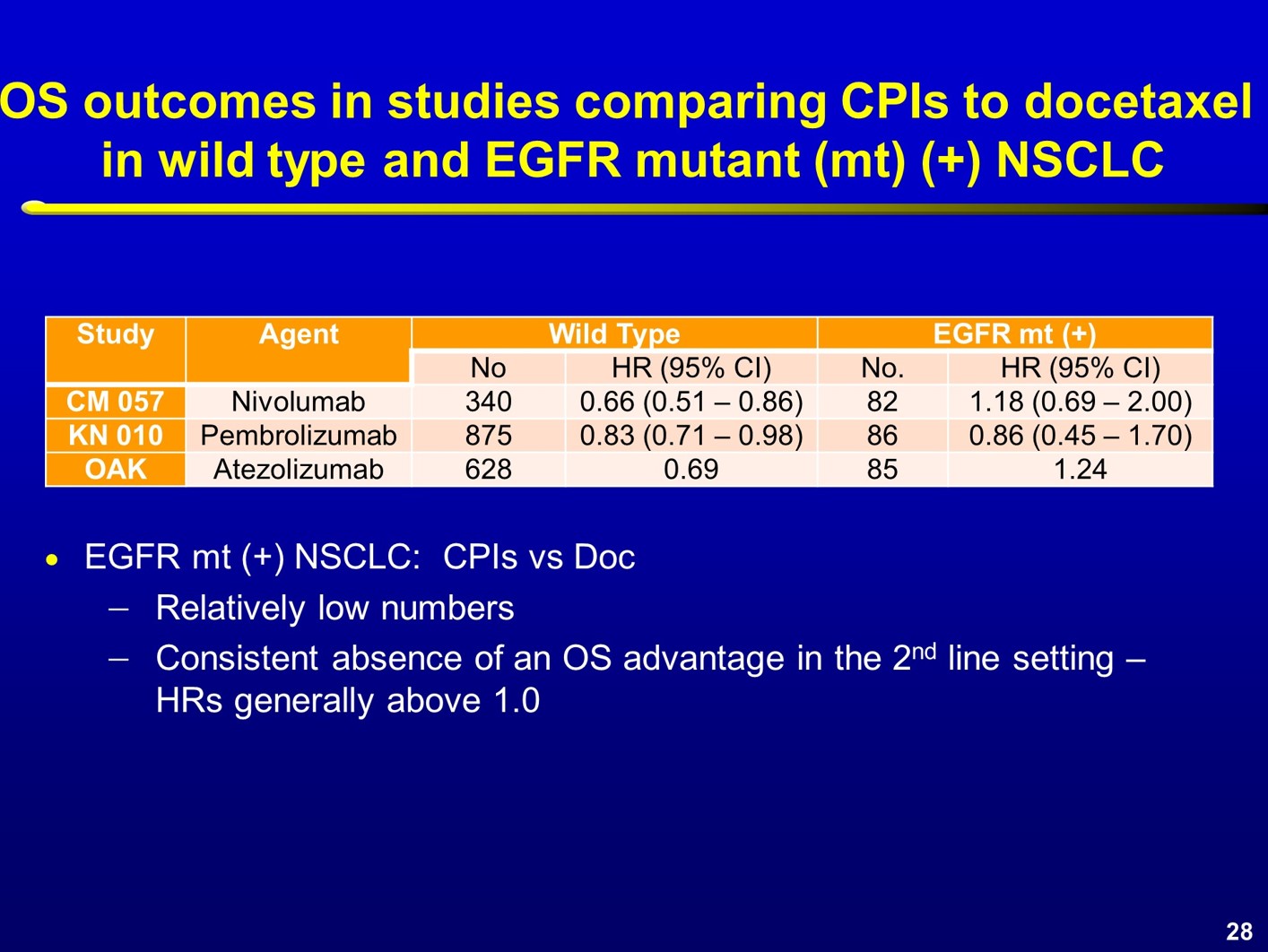 在局部晚期NSCLC中进行的PACIFIC研究中,700多例患者中,仅43例患者为EGFR突变人群,两组对比显示,EGFR突变组HR值的95%CI非常宽,且未观察到显著获益;而EGFR野生型人群,从免疫维持治疗中的获益显著,两组HR值分别为0.76 和0.47。
在局部晚期NSCLC中进行的PACIFIC研究中,700多例患者中,仅43例患者为EGFR突变人群,两组对比显示,EGFR突变组HR值的95%CI非常宽,且未观察到显著获益;而EGFR野生型人群,从免疫维持治疗中的获益显著,两组HR值分别为0.76 和0.47。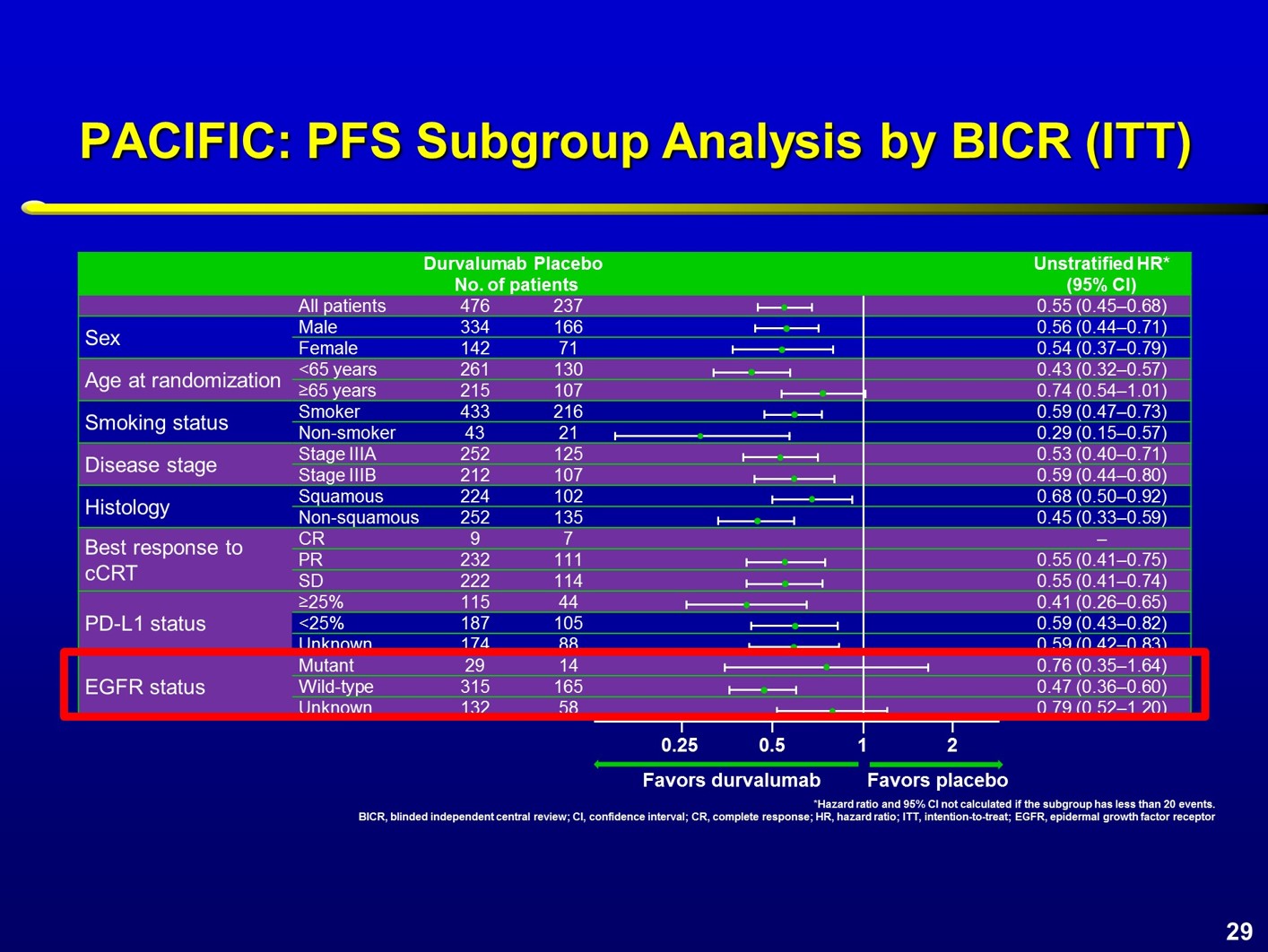 在2018年的ASCO大会上,Mazieres教授总结了免疫检查点抑制剂用于不同类型驱动基因阳性患者的疗效。结果显示,那些与吸烟和高肿瘤突变负荷(TMB)相关的驱动突变,接受免疫治疗后的ORR更高,可以达到24~26%,而那些以TKI治疗为主的驱动基因突变患者,则ORR率较低。
在2018年的ASCO大会上,Mazieres教授总结了免疫检查点抑制剂用于不同类型驱动基因阳性患者的疗效。结果显示,那些与吸烟和高肿瘤突变负荷(TMB)相关的驱动突变,接受免疫治疗后的ORR更高,可以达到24~26%,而那些以TKI治疗为主的驱动基因突变患者,则ORR率较低。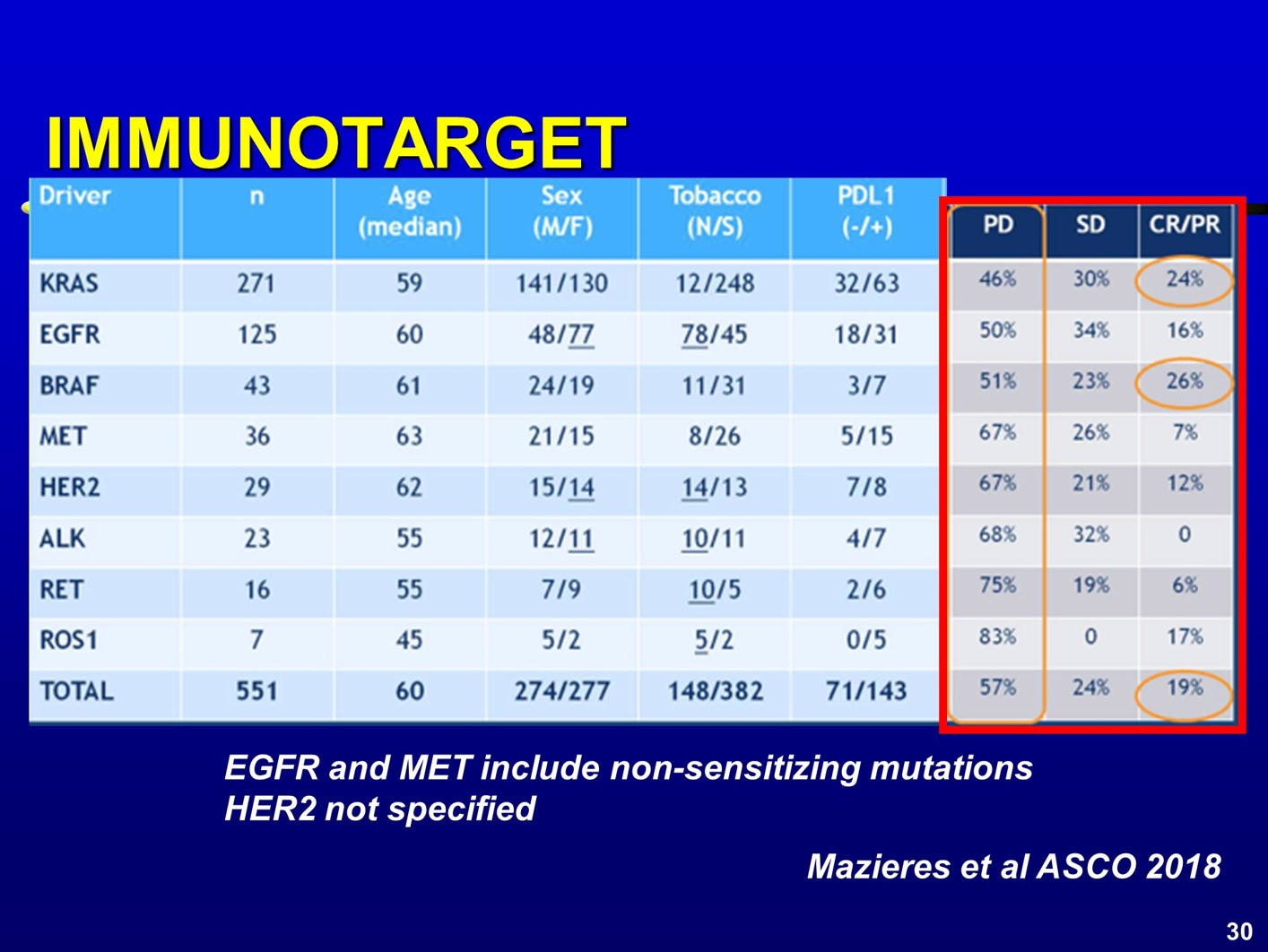
免疫治疗联合化疗和抗血管生成治疗用于TKI耐药患者
免疫治疗联合化疗在TKI耐药的患者中是否有一席之地呢?IMpower 150研究入组了EGFR突变和ALK重排的患者,这是一项3臂研究,对照组C为ECOG 4599的研究方案,紫杉醇和卡铂联合贝伐珠单抗,研究组B在这一方案基础上联合Atezolizumab(ABCP),研究组A则采用Atezolizumab联合紫杉醇和卡铂。
从基线特征来看,约9~11%的患者合并EGFR突变,2~5%的患者合并EML4- ALK重排。在EGFR野生型人群中,ABCP四药联合方案的生存曲线和对照组明显分开,观察到明显的PFS获益。进一步分析EGFR突变患者,两组对比的HR值为0.61;对于合并EGFR敏感突变的患者,HR值为0.41;对于既往接受过TKI治疗的患者,HR值为0.42。在PFS生存曲线对比上,EGFR和ALK阳性患者,PFS观察到3.6个月的获益,HR值为0.6。对于合并EGFR常见突变的患者,观察到4个月的PFS优势,HR为0.41。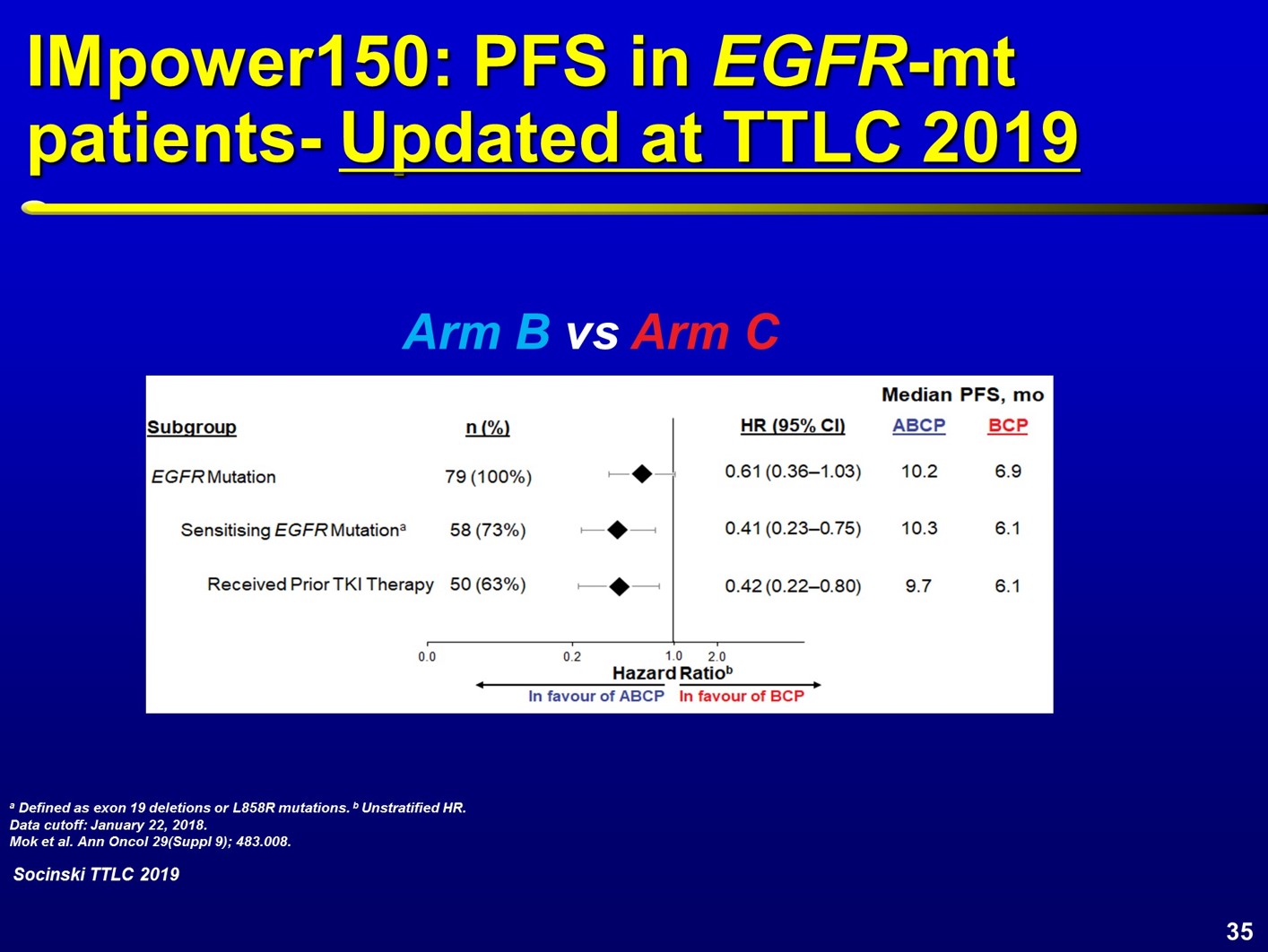
IMpower150研究中PFS的获益转化为生存获益,在EGFR/ALK野生型人群中,ABCP组和对照组的中位OS分别为14.9和19.8个月,HR值为0.76;进一步分析EGFR/ALK阳性患者,HR分析显示获益更为显著,为0.54。
从IMpower150研究来看,免疫检查点抑制剂联合化疗,同时联合贝伐珠单抗治疗,可以看到PFS和OS的获益。但值得注意的是,这一研究中EGFR/ALK阳性患者人数较少,仅为100例左右。我们需要思考EGFR突变阳性患者的PFS和OS获益是否是因为免疫检查点抑制剂和贝伐珠单抗或化疗或两种联合的交互作用。
在2018年欧洲肿瘤内科学会(ESMO)年会上公布的IMpower 130研究,也取得了阳性结果,研究允许EGFR/ALK阳性患者入组,评估了白蛋白紫杉醇和卡铂联合或不联合Atezolizumab治疗,但未包括贝伐珠单抗,研究取得阳性结果的原因主要是因为EGFR/ALK野生型人群的获益,而不是突变人群。我们是否可以根据IMpower150研究的结果,推荐其作为EGFR阳性,TKI耐药患者的标准治疗?目前仍有待商榷,在ALK阳性患者中,联合培美曲塞化疗可能是更好的选择。
免疫治疗联合靶向治疗
目前,还有很多临床研究评估了TKI联合PD-1/PD-L1单抗。大多数研究评估了EGFR TKI联合不同的免疫检查点抑制剂,仅小部分研究评估了ALK TKI联合免疫治疗。TATTON研究评估了奥希替尼联合多种不同的阿斯利康产品线药物,其中一个队列评估了奥希替尼联合Durvalumab。在这一研究中,奥希替尼采用标准剂量80 mg/d,Durvalumab则从3mg/kg增加至10mg/kg,如果观察到明显的疗效则进入剂量扩展队列。
从疗效瀑布图中可以观察到,联合方案取得了非常显著的疗效。这两个药物单独使用时,间质性肺炎的发生率约为2~3%,但联合使用时,研究发现在A部分,联合方案中间质性肺炎的发生率达到26%,初始队列和更高剂量组分别为20%和31%;在B部分,间质性肺炎发生率达到64%,直接导致这一研究终止。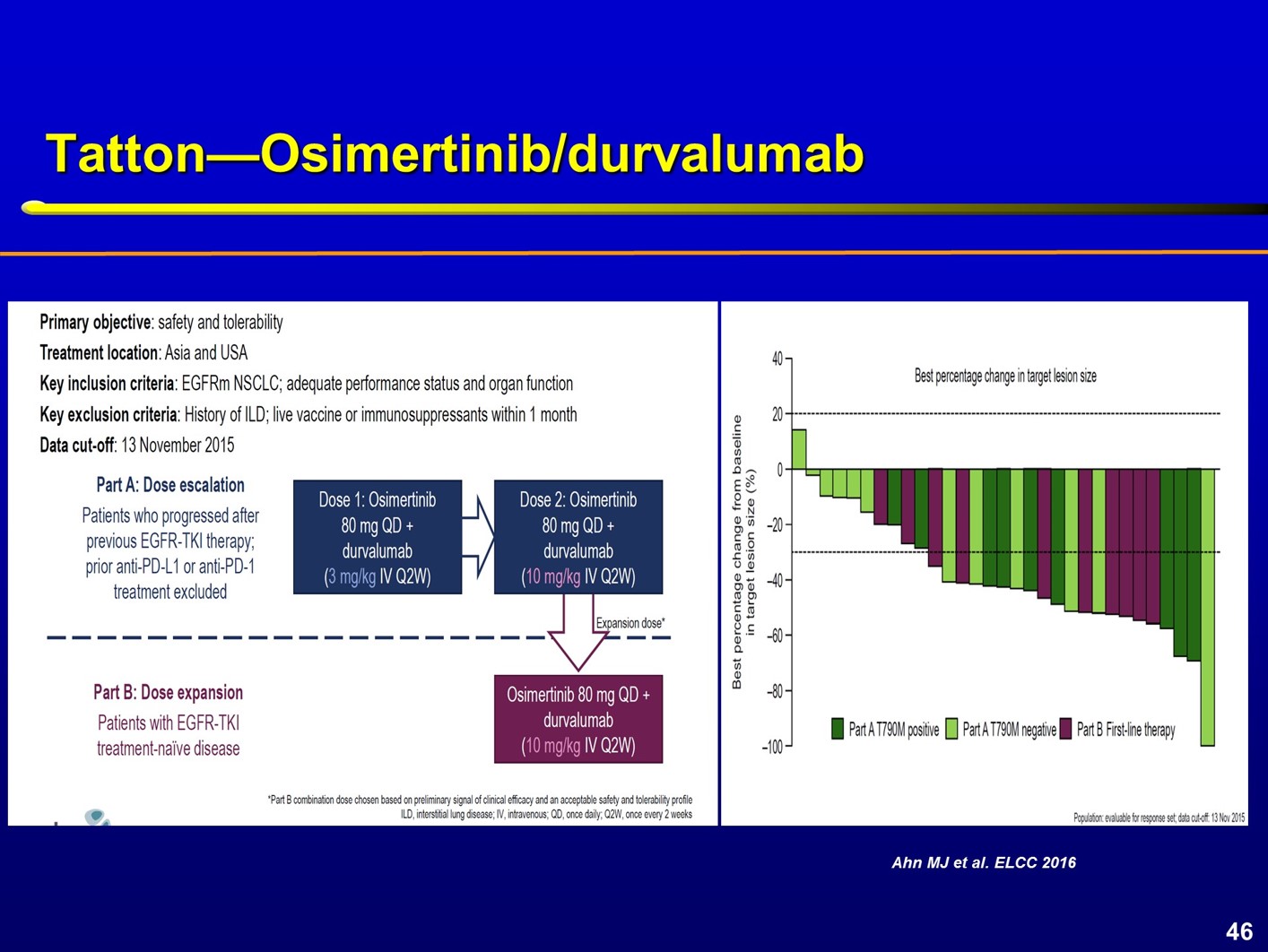 Atezolizumab联合厄洛替尼用于晚期NSCLC显示出不同的结果。在2018年的世界肺癌大会(WCLC)上,Charlie Rudin团队报道了这一联合方案的研究结果。研究首先进行了剂量探索,之后进入剂量扩展队列,2个药物均采用标准剂量,Atezolizumab(1200mg,q3w)联合厄洛替尼(150mg/d)。
Atezolizumab联合厄洛替尼用于晚期NSCLC显示出不同的结果。在2018年的世界肺癌大会(WCLC)上,Charlie Rudin团队报道了这一联合方案的研究结果。研究首先进行了剂量探索,之后进入剂量扩展队列,2个药物均采用标准剂量,Atezolizumab(1200mg,q3w)联合厄洛替尼(150mg/d)。
研究并未观察到明显的间质性肺炎,部分患者出现转氨酶升高、发热等,因为不良事件导致Atezolizumab停药和厄洛替尼停药的患者比例分别为18%和11%。这一联合方案显示出非常好的疗效,ORR达到75%,中位PFS为15个月,中位OS尚未达到。然而,目前奥希替尼已经获批用于一线治疗,可以达到18.9个月的中位PFS,这一联合方案是否值得继续探索,有待考量。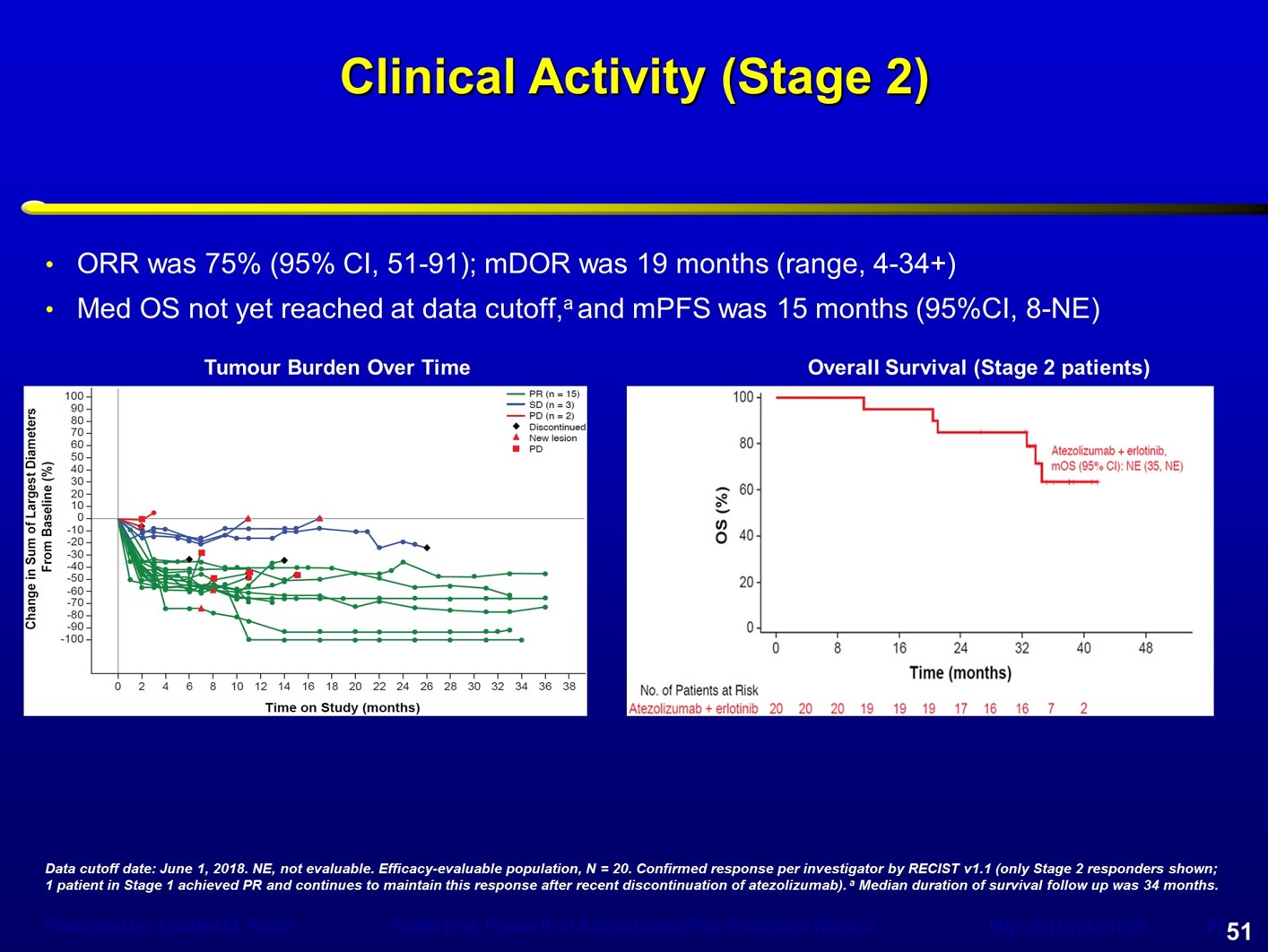
与EGFR突变患者相似,在ALK阳性患者中也进行了相关研究探索,如CheckMate-370研究评估了克唑替尼联合纳武利尤单抗治疗。入组的13例患者中,5例(38%)出现严重的肝毒性导致治疗终止,2例患者死亡,最终研究关闭入组。克唑替尼联合Avelumab方案的毒性似乎更小一些,但研究入组人群有限。另一些研究评估了免疫检查点抑制剂联合更高效的ALK抑制剂,但未观察到联合方案更好的疗效。虽然是横向对比,但结果显示,阿来替尼单药对比阿来替尼联合Atezolizumab,显示出相似的ORR,约为25%,但PFS更短,中位PFS分别为22个月和26个月。Lorlatinib单药或lorlatinib联合Avelumab也显示出相似的ORR,为46%,联合方案的PFS可能有一定改善。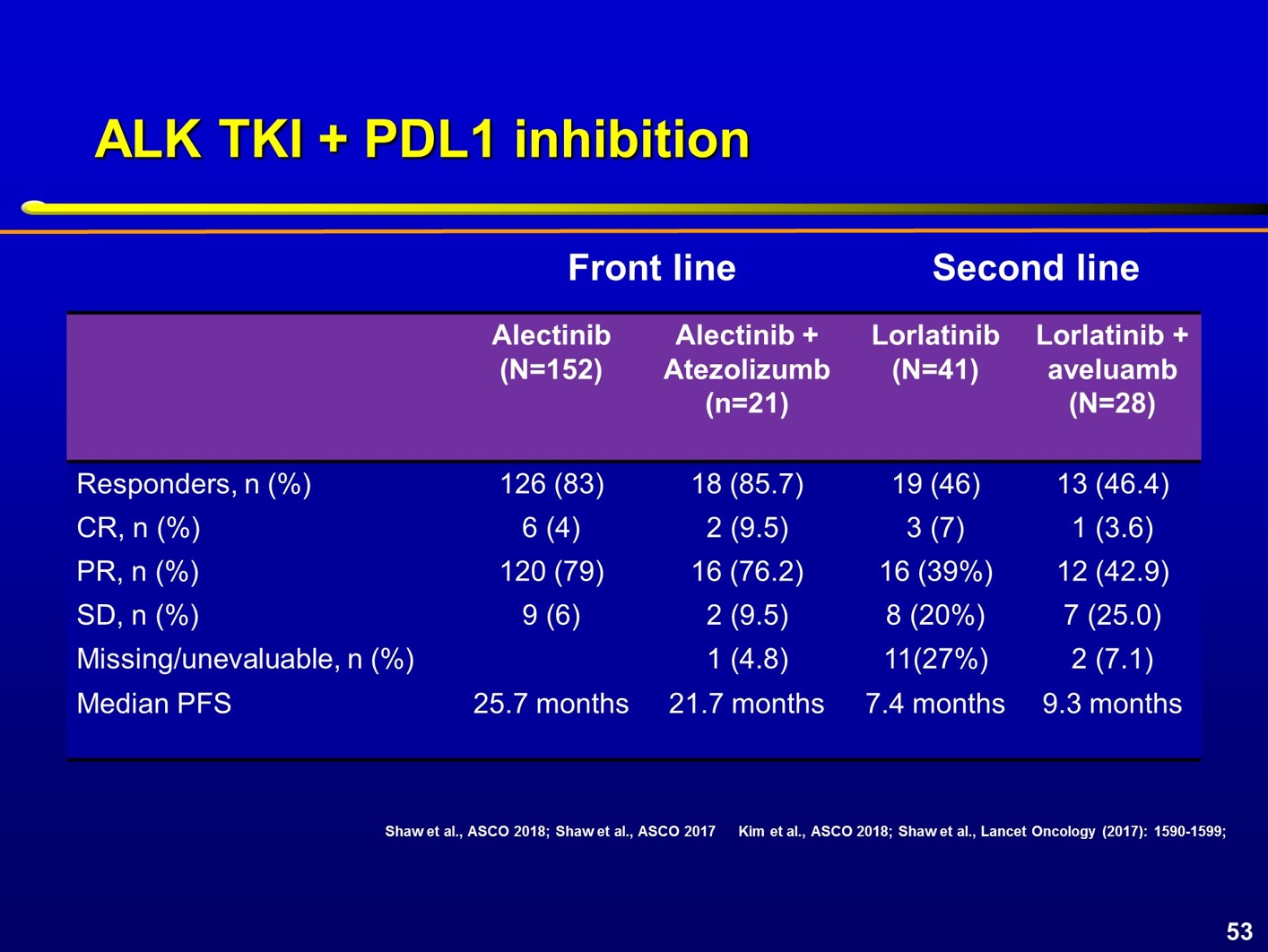
TKI和免疫检查点抑制剂序贯使用
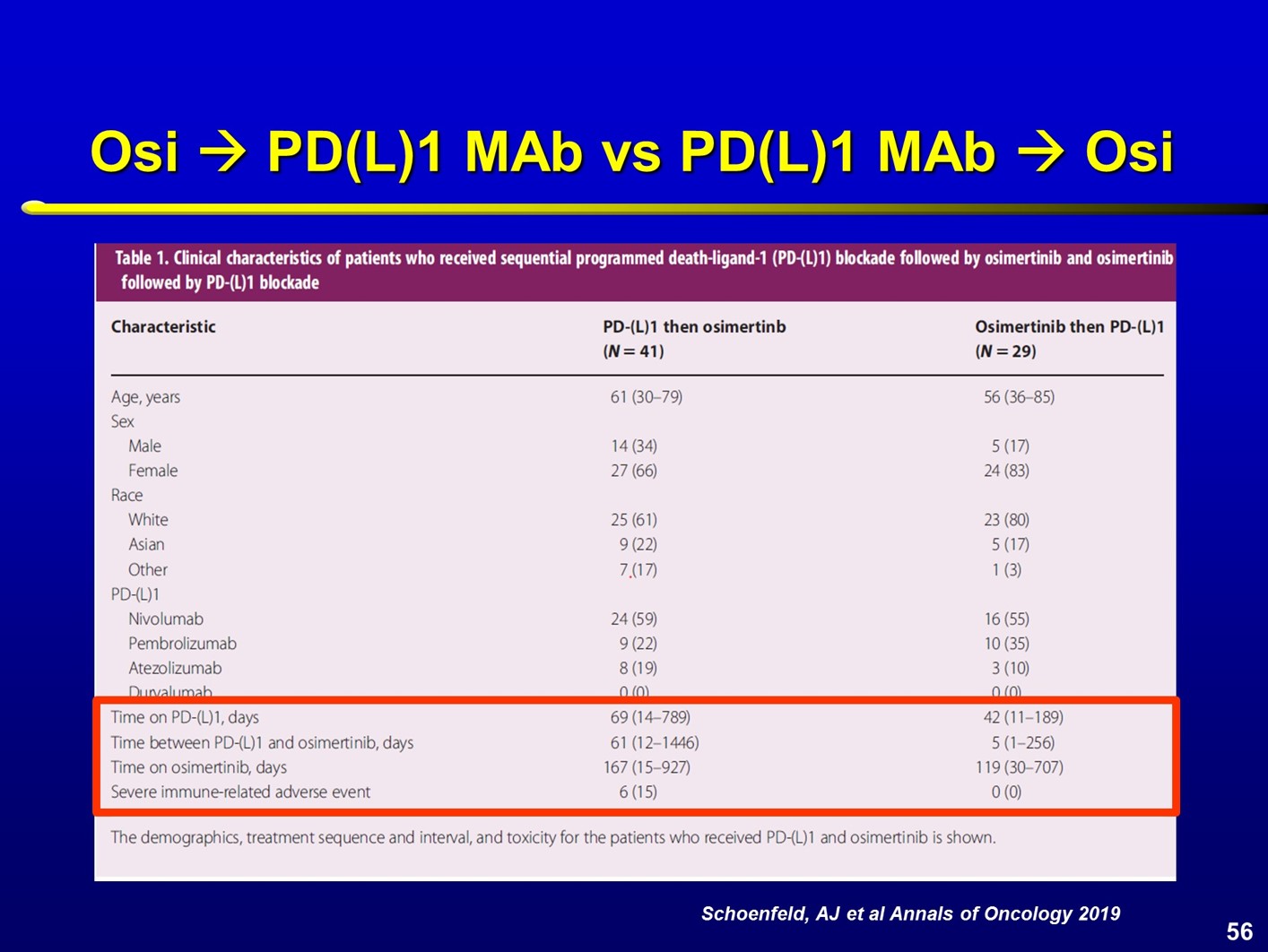
在TKI和免疫检查点抑制剂序贯使用中,观察到较严重的毒性反应。在一项Ⅱ期研究中,7例患者在接受帕博利珠单抗治疗后接受厄洛替尼治疗,结果在几例患者中观察到3度转氨酶升高,1例exon20突变患者死亡,1例患者在接受厄洛替尼治疗3个月后出现5度肺炎,距离最后1次帕博利珠单抗治疗时间为4个月。Lynn等进行了一项回顾性分析,在免疫检查点抑制剂治疗后使用克唑替尼。结果显示,11例患者中,转氨酶升高的发生率达到35~45%。近期刚刚发布在Annals of Oncology杂志的一项研究,由密歇根大学的Schoenfeld教授撰稿,也强调了TKI和免疫治疗序贯使用会增加免疫相关不良反应的发生率。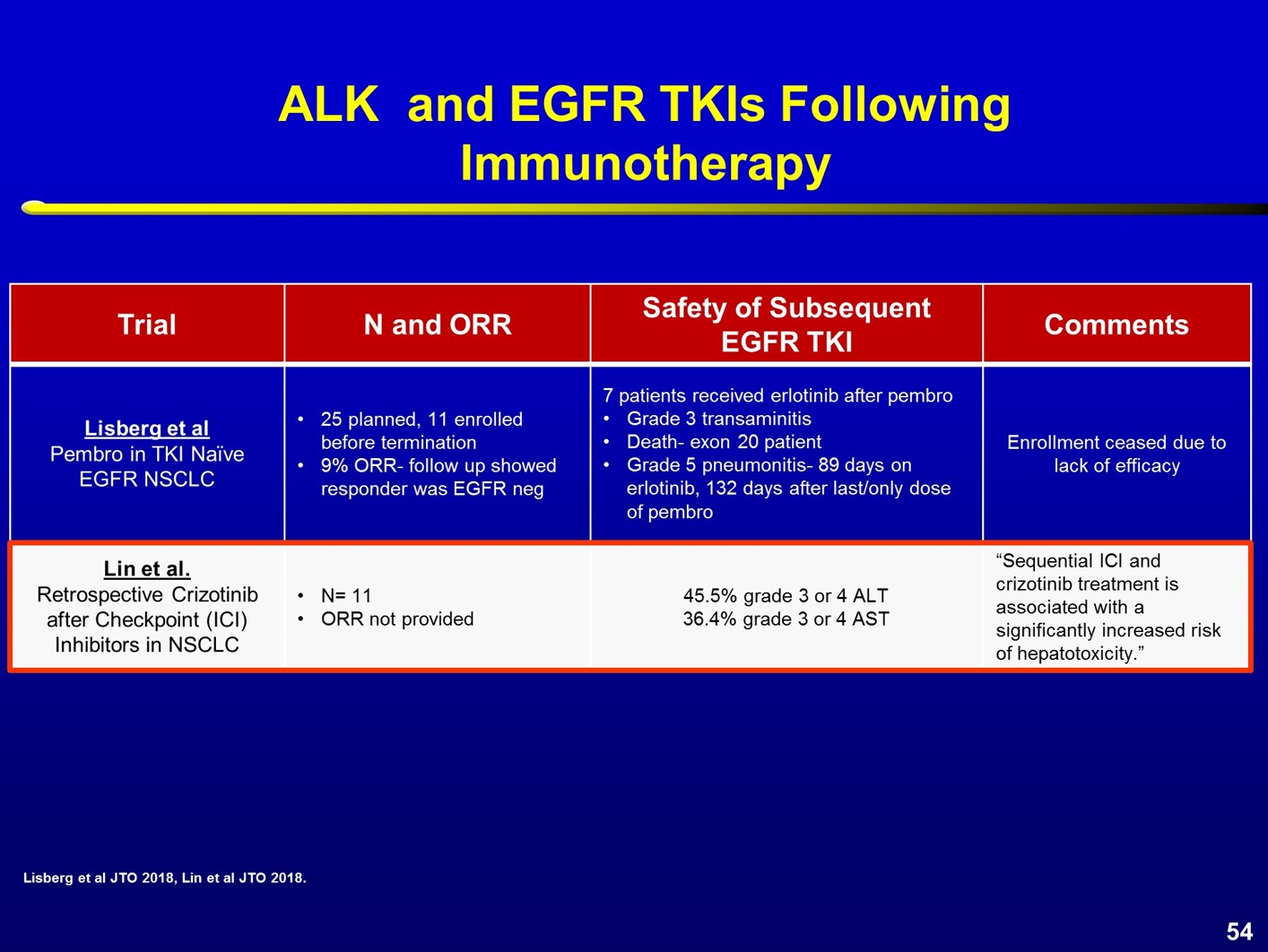 奥希替尼治疗后序贯免疫检查点抑制剂治疗对比免疫检查点抑制剂序贯奥希替尼治疗是否存在差异呢?29例患者先使用了奥希替尼治疗,之后再接受免疫治疗,未观察到严重免疫相关不良事件;而如果先使用免疫治疗再接受奥希替尼治疗,41例患者中,6例(15%)出现严重免疫相关不良事件。其中大多数(4/6)为肺炎,还有1例结肠炎和1例肝炎。免疫相关不良事件通常出现在奥希替尼治疗3周之后。所有出现免疫相关毒性的患者均需要激素治疗,并且要住院处理。
奥希替尼治疗后序贯免疫检查点抑制剂治疗对比免疫检查点抑制剂序贯奥希替尼治疗是否存在差异呢?29例患者先使用了奥希替尼治疗,之后再接受免疫治疗,未观察到严重免疫相关不良事件;而如果先使用免疫治疗再接受奥希替尼治疗,41例患者中,6例(15%)出现严重免疫相关不良事件。其中大多数(4/6)为肺炎,还有1例结肠炎和1例肝炎。免疫相关不良事件通常出现在奥希替尼治疗3周之后。所有出现免疫相关毒性的患者均需要激素治疗,并且要住院处理。
总结
免疫检查点抑制剂单药治疗在EGFR突变、ALK重排的患者中疗效有限,可能因为这类患者的TMB较低,因为这些患者大多数为从未吸烟或轻度吸烟者。对EGFR突变患者进行TMB分析显示,383例患者中,中位TMB为3.8mut/Mb,而同期非选择人群的TMB为7.4mut/Mb。此外这类患者接受EGFR TKI联合免疫治疗或两者序贯治疗,免疫相关不良事件发生率较高。目前,对于这类患者的治疗还存在很多尚未回答的问题。为什么不良事件发生率如此高?为什么患者接受联合治疗的疗效并不十分显著?在EGFR和ALK阳性患者中的研究经验十分适用与其他相对罕见突变基因,如ROS1、BRAF等?
总体而言,铂类为基础的化疗仍然是TKI耐药后的标准治疗,推荐方案包括紫杉醇联合卡铂、培美曲塞加卡铂联合或不联合贝伐珠单抗。免疫检查点抑制剂单药治疗的疗效有限。单药用于二线治疗,疗效与多西他赛相当或较多西他赛更差。用于一线治疗的疗效较差,即使是对于PD-L1高表达的患者。在免疫检查点抑制剂治疗使用TKI治疗会增加相关毒性。

Corey J.Langer.What’s the Role for Immunotherapy With and Without Chemotherapy in Oncogene Mutated NSCLC?2019 ASCO.











 苏公网安备32059002004080号
苏公网安备32059002004080号


