2019年ASCO年会即将于5月31日至6月4日在美国芝加哥举办。今年的主题为“Caring for Every Patient, Learning from Every Patient”。本次ASCO年会将公布多项肉瘤领域的重磅研究结果。【肿瘤资讯】小编筛选其中具有代表性的5项进行了编译,并邀请北京积水潭医院的牛晓辉教授对其作了精彩点评,详情如下。


北京积水潭医院骨肿瘤科主任
中国临床肿瘤学会(CSCO)肉瘤专家委员会主任委员
中国抗癌协会(CACA)肉瘤专业委员会主任委员
国际保肢协会(ISOLS)常务理事
亚太骨与软组织肿瘤学会(APMSTS)常务理事
东亚骨与软组织肿瘤协作组(EAMOG)前主席、常务理事
中华医学会骨科分会骨肿瘤专业组副组长
中国医师协会骨科分会骨肿瘤专业组副组长
担任10余家期刊编委、SCI期刊审稿专家
以第一作者或通讯作者发表论文180余篇,参与编写的专著10余部
ABS:11002——培唑帕尼联合放化疗新辅助治疗可提高儿童和成人中/高风险化疗敏感的非横纹肌肉瘤的软组织肉瘤疗效
背景
培唑帕尼是一个多靶点的酪氨酸激酶抑制剂,在晚期软组织肉瘤中显示出一定的疗效。ARST1321是一项II期研究,旨在儿童和成人中等/高风险化疗敏感的非横纹肌肉瘤的软组织肉瘤(NRSTS)中对比术前放化疗+/-培唑帕尼治疗的近完全病理缓解率(>=90%的细胞坏死)。
方法
ARST1321是由COG 和NRG肿瘤协作组联合发起的研究,自2014年7月开始入组。符合入组标准的患者包括成人(>=18岁)和儿童(<18岁)不可切除的、新诊断的躯干/肢端NRSTS患者,纳入化疗队列(>5cm,2/3级,方案指定的化疗敏感的组织学类型)。在剂量探寻期后,患者随机分配接受(方案A)或不接受(方案B)培唑帕尼治疗(<18岁:350mg/m2/天;>=18岁: 600mg/天)联合异环磷酰胺(7.5 g/m2/周期)和多柔比星(75 mg/m2/周期) + 45 Gy 术前放疗,在13周时序贯原发灶切除,之后接受辅助化疗。
结果
截至2018年6月30日,80例符合标准的患者入组和随机。第13周时,42例患者的疗效可评估(60%的预期人数)。病理评估坏死肿瘤细胞>=90% 的患者比例,方案A和B组分别为58.3%和22.2%。以0.081作为显著性水准,两组差异83.8%的置信区间为16.5%-55.8%。在这次既定的中期分析自,疗效界值交叉,提示方案A相比于方案B,疗效更优。基于这一研究结果,目前已经停止入组。方案A和方案B 3/4度毒性发生率分别为73.8%和29%,最常见的毒性包括中性粒细胞减低、血小板减低和粒缺性发热。
结论
在儿童和成人中等/高风险NRSTS患者中,在术前放化疗基础上联合培唑帕尼,可以显著提高近完全病理缓解率。后续延长随访将进一步报道患者的生存结果。临床试验信息: NCT02180867。
ABS:11003——EZH2抑制剂Tazemetostat在上皮样肉瘤患者中初显疗效
背景
上皮样肉瘤是一类罕见的软组织肉瘤,约30-50%的患者合并转移。90%以上的上皮样肉瘤不表达INI1,INI1是甲基化调节的重要成分。INI1功能失活将会诱导另一个甲基化调节蛋白EZH2成为肿瘤细胞中的重要驱动因子。Tazemetostat是一个首创的、选择性、口服EZH2抑制剂,在I-II期研究中显示出一定的疗效,且安全性较好。
方法
本研究报道II期开放、多中心研究结果,在局部晚期或转移性上皮样肉瘤中评估了Tazemetostat的疗效。主要和次要研究终点包括客观缓解率(ORR),采用RECIST 1.1标准评价、疾病控制率(DCR;取得客观缓解或SD >=32周的患者)、疗效持续时间(DOR)、无进展生存期(PFS)和总生存期(OS);同时还评估了安全性和耐受性。
结果
截至2018年9月17日,共入组62例INI1表达阴性的上皮样肉瘤患者,接受tazemetostat 800 mg,bid治疗。患者既往接受过中位1线治疗(范围:0-9)。62例患者中,9例(15%)取得确认的PR,ORR为15%,DCR为26%。总体人群中,DOR范围为7.1+周至103.0+周(中位DOR尚未达到),患者的中位OS为82.4周(95% CI: 47.4,尚未达到)。Tazemetostat 的耐受性良好,治疗期间出现的不良事件(TEAEs)均为轻度-中等,最常见报道的AE(>=10%),无论其发生原因,包括疲劳(24/62; 39%)、恶心(22/62; 35%)和疼痛(20/62; 32%)。任意治疗相关的>=3度的TEAEs发生率为10/62 (16%)。>=3度TEAEs,且在>=2例患者中发生的AE包括贫血(6%)和体重减轻(3%)。未观察到药物相关的死亡,治疗中断率较低(1.7%)。
结论
这是目前在上皮样肉瘤患者中进行的最大样本量的前瞻性研究,tazemetostat在晚期上皮样肉瘤患者中取得了26%的疾病控制率,且观察到持久的疗效获益。Tazemetostat显示出较好的安全性,较少有患者出现治疗相关的3度或以上AE。临床试验信息: NCT02601950。
ABS:11004——CDK4/6抑制剂Abemaciclib治疗低分化脂肪肉瘤初显疗效
背景
在>90%的低分化脂肪肉瘤中观察到CDK4扩增。既往的研究显示,CDK4抑制剂哌柏西利治疗低分化脂肪肉瘤显示出较好的PFS。Abemaciclib是一个新型、更有潜力的CDK4抑制剂。这一单臂II期研究旨在低分化脂肪肉瘤中评估abemaciclib的疗效。
方法
该研究入组了成人低分化晚期脂肪肉瘤,有符合RECIST 1.1标准的可测量病灶,既往接受或未接受过治疗,接受过治疗的患者在入组前6个月出现RECIST标准评价的进展。主要终点为12周的PFS率。基于历史数据,有潜力的药物12周的PFS率>=40%,没有潜力的药物12周PFS率<=20%。如果这一研究中,患者12周的PFS率>=60%,则认为取得阳性结果。
结果
患者接受abemaciclib 200 mg,口服,bid,连续用药。30例患者接受治疗,29例可以进行主要终点评估。患者的基线特征为:中位年龄62岁(范围: 39~88),60%为男性。既往的治疗线数分别: 0 (50%); 1线(33%); >= 2线(17%)。12周的PFS率为76% (95% CI 57%~90%)。中位PFS 为30.4周(95% CI:28.9-NE)。1例患者取得PR,另外3例患者,采用RECIST评估,肿瘤大小缩小>10%。3~4度毒性包括贫血(37%)、中性粒细胞减低(20%)、血小板减低(17%)和腹泻(7%)。
结论
研究达到主要终点,在晚期进展性低分化脂肪肉瘤患者中,abemaciclib治疗取得了较好的PFS和客观缓解率,毒性可管理。临床试验信息: NCT02846987。
ABS:11005——mTOR抑制剂ABI-009在晚期恶性血管周围上皮细胞瘤中初显疗效
背景
晚期恶性血管周围上皮细胞瘤(PEComa)是一类罕见、侵袭性较强的肉瘤,目前尚未获批相应治疗药物,也未进行相关临床试验探索。个案报道提示,这类肿瘤可以提高TSC1或TSC2突变或缺失活化mTOR,因此mTOR抑制剂用于这类患者具有一定的疗效。ABI-009是一个结合了白蛋白的mTOR抑制剂,可以增加肿瘤对药物的摄取率。AMPECT研究是第一项在恶性PEComa患者中进行的前瞻性研究。
方法
研究入组了中心确认的PEComa患者,接受ABI-009(nab-sirolimus,100mg/m2 IV,每周给药,2/3周)直至进展或不可耐受的毒性。主要终点为独立评估委员会评估的ORR,采用RECIST v1.1标准每6周评价一次;次要终点包括:疗效持续时间(DOR)、6个月的PFS率(PFS6)、PFS和安全性。探索性终点包括:研究者评估的治疗结局和突变状态。样本量计算:目标ORR为30%时,需要30个疗效可评估人群(当所有患者治疗>=6个月后进行主要分析)。
结果
目前先报道探索性分析和安全性结果,独立评估委员会仍在评估中。截至2019年2月12日,研究完成入组,共34例患者接受治疗,31例患者可评估疗效,42% (13/31) 的患者疗效仍在继续。研究者评估的ORR为42%,均为PR (13/31,95%CI: 24.5,60.9);SD的患者占35%(11/31);PD的患者占23%(7/31)。PR的患者中,69%达到第一次再分期(第6周);69%的PRs患者疗效仍在继续,其中5例患者治疗>2年,2例患者治疗>2年(疗效仍在继续)。其他研究者评估的疗效终点:中位DOR尚未达到;6个月的PFS率为 66%;中位PFS为8.9个月(95%CI: 5.5, NR)。最常见的(>30%)的、任意级别的非血液学治疗相关AE (TRAEs)包括:粘膜炎(65%)、疲劳(53%)、恶心(35%)、体重减轻 (35%)、腹泻(32%);最常见的(>15%)的血液学TRAEs包括:贫血(44%)和血小板减低(18%)。肺炎发生率为15%,均为1~2度。最常见的(>10%) 3度TRAEs包括: 粘膜炎(18%)、贫血(12%);未观察到4度或以上的TRAEs。25例突变状态已知的患者中,TSC1或TSC2 突变患者分别为5例和9例(两类患者无覆盖)。在TSC2突变的患者中,PR率为100% (9/9),TSC1突变患者中,PR率为20% (1/5);在未合并TSC1或TSC2突变的患者中,PR率为9% (1/11);采用FISH精确检验,3组疗效具有显著差异,P<0.0001;两两比较显示,TSC2突变的患者,PR率远高于未合并TSC1或TSC2突变的患者,P=0.0001;在TSC1或TSC2突变的患者和未合并上述突变的患者中,DCR率分别为93% (13/14) vs 55% (6/11),差异无显著统计学意义。
结论
研究者评估的初步结果显示,ABI-009治疗PEComa可以取得较高的缓解率和较持久疗效,且毒性可管理。TSC2突变与研究者评估的疗效相关。临床试验信息:NCT02494570.
ABS:11008——培唑帕尼+吉西他滨和吉西他滨+多西他赛治疗软组织肉瘤的疗效相当
背景
培唑帕尼是一个多靶点酪氨酸激酶抑制剂,在很多肉瘤亚型中均显示出较好的疗效。本研究旨在软组织肉瘤患者中评估培唑帕尼+吉西他滨(G+P)能否作为吉西他滨+多西他赛(G+T)方案的替代。
方法
这是一项开放、随机II期研究,入组了晚期非脂肪肉瘤的软组织肉瘤,要求患者既往接受过蒽环类为基础的治疗。患者随机1:1分配G 1000 mg/m2,d1和8天用药+ P 800mg,qd或G 900mg/m2,d1和8天用药+ T 100mg/m2,d8用药,q3w。分层因素包括平滑肌肉瘤和盆腔放疗。主要终点为评估中位PFS和>=3度不良事件(AEs)。次要终点包括预估风险比和缓解率。患者在RECIST标准评价进展后可以接受交叉治疗。统计计算样本量为90例,可以评估每组的毒性和PFS数据。
结果
共入组90例患者,每组45例,患者的基线特征总结见下表。每组患者的mPFS均为4.1个月(基于分层log-rank检验,p=0.3)。每组的临床获益率均为29% (p>0.99)。治疗相关的3度或以上AEs发生率,G+T组和G+P组分别为20.6%和19.9%。治疗相关的、发生率>=10%的>=3度AEs及其发生率,G+T和G+P组分别为:贫血(36% vs 20%)、疲劳(29% vs 13%)、血小板减低(56% vs 51%)、中性粒细胞减低(20% vs 49%)、AST升高(2% vs 13%)和高血压(2% vs 20%)。
表. 患者的基线特征和疗效数据
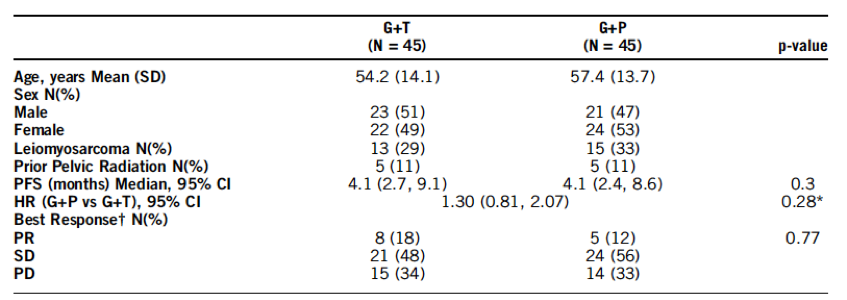
结论
这一研究在非脂肪肉瘤的软组织肉瘤患者中显示G+P和G+T方案的疗效相当,提示G+P可以考虑用于这类患者的二线治疗。临床试验信息: NCT01593748。
牛晓辉教授点评
为了提高软组织肉瘤的局部控制率,减少局部手术后的局部复发率,新辅助放疗(+/-化疗)被认为是有效的治疗方法。对于新辅助放疗的疗效评估金标准是局部复发率的降低,早期的评效方法则是肿瘤标本的病理缓解率(>=90%的细胞坏死)。靶向治疗往往用于晚期的软组织肉瘤的治疗,其实我们更期待了解其在早期治疗中的作用。在新辅助治疗中的应用不但可以了解靶向药物对肿瘤的作用,也可避免肿瘤切除后靶向药物的终身应用。在ARST1321的II期研究中,作者将在晚期软组织肉瘤中显示出一定疗效的多靶点酪氨酸激酶抑制剂培唑帕尼在联合术前放化疗治疗儿童和成人中等/高风险化疗敏感的非横纹肌肉瘤的软组织肉瘤(NRSTS)的作用进行了研究。结果得出在术前放化疗基础上联合培唑帕尼,可以显著提高近完全病理缓解率。此研究为靶向药物在软组织肉瘤中的应用开辟了新思路、新方法,我们期待在局部复发率下降及长期生存获益方面的结果。
软组织肉瘤亚型繁多、发病率低,单一亚型的研究并不多。上皮样肉瘤是一类罕见的软组织肉瘤,约30-50%的患者合并转移。EZH2可能是上皮样肉瘤细胞中的重要驱动因子,应用EZH2抑制剂Tazemetostat在治疗上皮样肉瘤中的作用值得期待。NCT02601950试验结果令人满意,tazemetostat在晚期上皮样肉瘤患者中取得了26%的疾病控制率,且观察到持久的疗效获益。Tazemetostat显示出较好的安全性,较少有患者出现治疗相关的3度或以上AE。
低分化脂肪肉瘤的靶向治疗效果并不令人满意。在>90%的低分化脂肪肉瘤中观察到CDK4扩增,应用CDK4抑制剂Abemaciclib治疗低分化脂肪肉瘤的结果值得期待。NCT02846987研究应用Abemaciclib治疗晚期进展性低分化脂肪肉瘤取得了较好的PFS和客观缓解率,这可能成为脂肪肉瘤治疗的研究方向。
晚期恶性血管周围上皮细胞瘤(PEComa)侵袭性较强,而且少见,目前尚未获批相应治疗药物。AMPECT研究是第一项在恶性PEComa患者中进行的前瞻性研究,应用结合了白蛋白的mTOR抑制剂ABI-009治疗PEComa。研究者评估的初步结果显示,ABI-009治疗PEComa可以取得较高的缓解率和较持久疗效,且毒性可管理。此项研究尚未完全完成,但是结果值得期待。
吉西他滨+多西他赛作为进展期软组织肉瘤的二线治疗已被应用数年,培唑帕尼在很多肉瘤亚型的治疗中均显示出了较好的疗效。培唑帕尼+吉西他滨(G+P)能否作为吉西他滨+多西他赛(G+T)方案的替代是NCT01593748研究的主要目的。研究结果表明非脂肪肉瘤的软组织肉瘤患者中G+P和G+T方案的疗效相当,提示G+P可以考虑用于这类患者的二线治疗。
进展期软组织肉瘤的治疗仍然是大多数临床研究的主要对象,令人兴奋的是出现了靶向药物在软组织肉瘤早期治疗中作用的研究。基于早期软组织肉瘤的联合治疗,降低远处转移的发生率应该是提高生存获益的有效途径。















 苏公网安备32059002004080号
苏公网安备32059002004080号


