10月22日上午,2018 ESMO大会结直肠癌免疫治疗最重要的三个LBA摘要以口头报告的形式进行公布,三个研究分别涉及早期肿瘤术前新辅助治疗、转移性疾病一线治疗和二线维持治疗三个领域,结果喜忧参半,先来看看这三个研究的具体信息及结果:

副主任医师,中山大学附属肿瘤医院结直肠科副主任
中国临床肿瘤学会(CSCO)副秘书长、常务理事;
2015-2017年ASCO学术委员会委员;
CSCO青年专家委员会第一届主任委员;
中国抗癌协会大肠癌专业委员会委员;
CSCO结直肠癌专委会常委;
CSCO结直肠癌指南专家组秘书、执笔人;
CSCO全国胃肠道间质瘤专家委员会委员、胃肠胰神经内分泌肿瘤专家委员会委员;
中国医师协会结直肠外科医师分会常务委员;
广东省大肠癌专业委员会常委;
早期肿瘤术前新辅助免疫治疗:LBA37
LBA37_PR – NICHE研究:ipilimumab+nivolumab用于早期结肠癌的新辅助治疗
来自荷兰的NICHE研究,旨在探索免疫治疗用于早期结肠癌术前新辅助治疗的安全性及有效性。通过术前肠镜活检,病理明确为腺癌,行IHC检测明确MMR状态(dMMR或pMMR),所有患者基线CT检查排除远处转移,临床分期为I~III期,然后患者接受CTL-A4单抗ipilimumab(Ipi)1mg/kg(第1天)和PD-1单抗nivolumab(Nivo)3mg/kg(第1、15天),然后患者在不迟于6周内接受手术。主要研究终点是安全性和可行性,次要终点包括有效性评估(病理缓解),以及病理应答与TMB、IFNᵧ 基因签名、T细胞浸润和T细胞受体克隆性之间的关系。研究计划招募dMMR和pMMR各30例,本次会议汇报了14例可评价患者的基本资料(dMMR和pMMR各7例)。入组人群特征见下表,值得注意的是基线50%的肿瘤分期为III期:
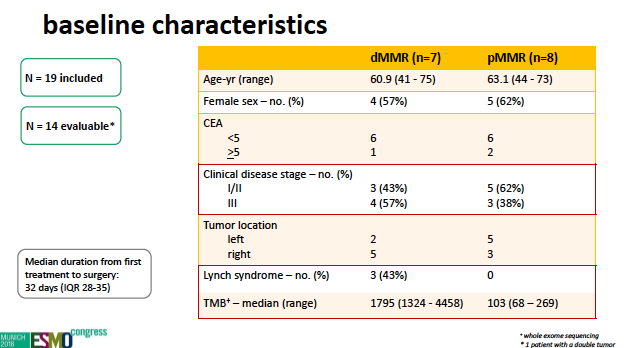
安全性结果
所有患者对术前免疫治疗的耐受性均很好,全部患者均顺利接受手术,手术时间没有延迟,从第一个剂量的免疫治疗距离手术的平均时间为32天。一共有5例患者(36%)出现3度以上毒性,但仅有1例腹痛被判断与肿瘤假进展,术后3例3度以上严重并发症(腹腔感染、吻合口漏和肺炎各1例)均判断与免疫治疗无关。安全性详见下表:
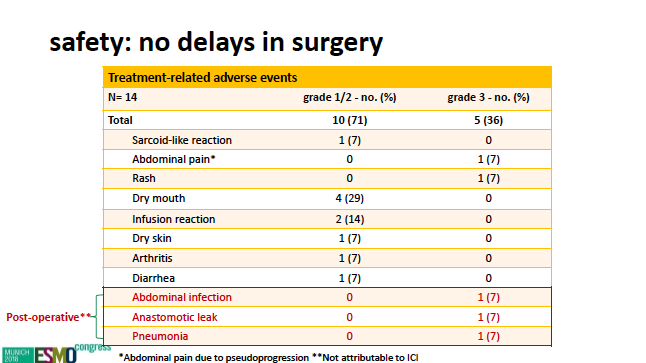
主要有效性结果
以术后病理检查残留的活性癌细胞<10%为“病理重大缓解”的标准,全部7例dMMR患者均达次标准,其中4例为“病理完全缓解”(pCR),而未完全缓解的3例病例,残留癌细胞比例均2%及以下。反之,在pMMR则几乎没有出现病理应答,所有患者,残留癌细胞比例均在85%以上。详见下表:

TMB在dMMR和pMMR两组间有显著差异(p=0.008),治疗前肿瘤中的CD3+淋巴细胞浸润(p=0.662)、IFNᵧ 基因签名(p=0.56)不能预测疗效。治疗后两组的CD8+T细胞浸润均显著增加,dMMR组增加2.4倍,pMMR组更甚,4.8倍。而治疗后CD3+淋巴细胞浸润增加则见于dMMR(p=0.031)而非pMMR肿瘤(p=0.461)。
术前的短期免疫治疗是安全的,能让7例所有的dMMR肿瘤出现重大病理缓解,值得开展更大型的临床试验来进一步验证。
点评
NICHE研究是免疫治疗首次用于人类早期结肠癌的新辅助治疗,并证实PD-1单抗联合小剂量CTL-A4单抗的疗法是安全可行的,没有给后续的手术带来干扰。
自从2015年霍普金斯研究发现dMMR可以筛选免疫治疗优势人群,肠癌免疫治疗开启MSI时代。
我们都知道免疫治疗总有一天会向早期肿瘤的辅助治疗、新辅助治疗发展,但没想到来得这么快,更让人意外的是肿瘤应答这么快、这么好。在晚期肿瘤免疫治疗的发展过程中,我们得到的基本信息是同化疗、靶向这些传统治疗相比,免疫治疗的应答可能来得比较迟,也就是基于这个原因,目前很多晚期实体瘤的免疫治疗试验,入组标准都会限制肿瘤负荷太大的患者入组,比如大块型、全肝侵犯型的肝转移,一个重要原因就是免疫治疗带来的肿瘤退缩比较慢,担心这些患者很快就会出现肿瘤导致的严重症状。
而NICHE研究中,患者仅仅接受1次剂量的Ipi,和2次剂量的Nivo,从免疫治疗开始到手术的时间平均才32天,也就是在最后一个剂量的Nivo治疗后大约2周即手术。这么小的治疗剂量在这么短的时间内带来如此显著的肿瘤消退,确认让人倍感意外。如果说和晚期疾病相比,早期肿瘤的负荷要小得多,缺乏可比性的话,那么,同为早期疾病的局部进展期直肠癌(LARC)术前放化疗后,6-8周手术,病理完全缓解大约15%~20%,而如果单纯化疗,中国FOWARC研究显示术前mFOLFOX6化疗3个月,4周后手术,pCR7%。因此,不管从哪个角度看,免疫治疗在MSI-H行早期结肠癌术前带来的肿瘤消退,不管速度还是深度,均是史无前例的。
从既往报道的数据,以及本次ESMO报道的LBA18研究的数据来看,MSI-H型转移性肠癌转移灶出现的缓解(当然主要是iRECIST评价的缓解,而非病理缓解)要明显慢于NICHE研究中表现出来的原发瘤退缩,这是整体肿瘤负荷不同而导致的退缩速度不同,还是MSI-H型肠癌在原发灶和转移瘤方面的差异?甚至于,同为MSI-H型肠癌,是否早期患者的自身T淋巴细胞数量、功能本来就有别于晚期患者,才会出现肿瘤缓解的如此差异?
当然本次NICHE并没有报道影像学评估的肿瘤缓解情况,从LARC的情况来看,pCR的肿瘤绝大多数均是大体肿瘤完全消失,仅残留浅表溃疡或小疤痕,即临床上也为完全缓解(cCR);但也有极罕见的病例是大体仍然存在明显的肿瘤性肿块,但术后病理检查没有活性癌细胞,全为纤维化,即非cCR的pCR,不知NICHE研究中的4例pCR,大体肿瘤是如何变化的?因为临床上的一个担心就是在治疗结束如此短时间(2周)内大体肿瘤完全消失,会否伴随肠道的穿孔,这在肠道淋巴瘤化疗后是比较常见的。
而NICHE研究中在pMMR组看到的病理缓解情况很差,这倒没有出乎意料,毕竟pMMR肿瘤本来就属于免疫治疗抗拒性的“冷肿瘤”,比较有意思的是,在pMMR组免疫治疗后CD8+T细胞浸润均显著增加,达4.8倍,比dMMR组还高,这会给临床研究及治疗带来什么启示呢,比如,延长一段时间会否能看到应答?这样增加的T细胞浸润会否有助于改善患者的最终生存,虽然没有带来短期的退缩。
那么,NICHE研究会给现行的临床实践带来那些启示呢?我首先想到的是免疫治疗带来的肿瘤快速明显退缩,这种治疗特点,对于那些局部侵犯严重的巨快型不可切除肿瘤,需要治疗来缩瘤时,或者患者因为其他原因无法接受手术时,免疫治疗将会发挥其他手段无法比拟的价值。而对于可切除的早期MSI-H型结肠癌,新辅助免疫治疗带来的良好病理退缩能否转化为生存获益,那就得看后续的而进一步研究了
总之,NICHE研究,吹响了结直肠癌领域免疫治疗向术前新辅助治疗进军的号角,完全可以预见,在接下来的几年时间里,该领域的类似研究将会大大增加。
MSI-H mCRC一线免疫治疗:LBA19
LBA18_PR – MSI-H/dMMR表型mCRC一线接受Nivolumab 联合小剂量Ipilimumab 可获得持久的临床获益
该研究是PD-1单抗nivolumab在肠癌领域的II期单臂试验CheckMate 142的一部分,该研究一个有三个队列,晚期末线治疗两个队列(Nivo单药组和Nivo+Ipi联合组),晚期一线治疗1个队列,无化疗,单纯接受免疫治疗,Nivo 3mg/kg Q2W + Ipi 1mg/kg Q6W。研究主要终点为ORR。CheckMate 142研究目前正在进行中,本次报道1线队列共45例可评估病例的资料。
中位随访13.8个月后,观察到60%的ORR,84%的DCR,与基线肿瘤负荷相比,80%的患者均出现肿瘤负荷降低。详见以下表和图:
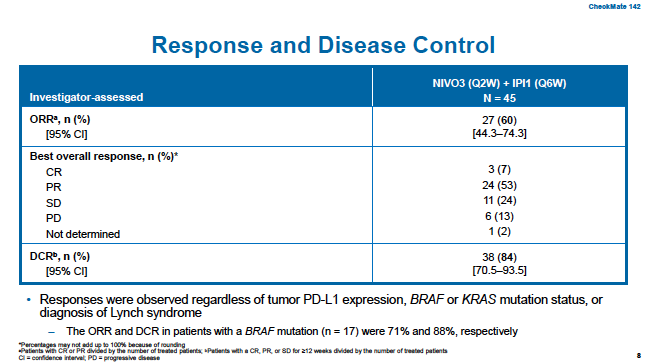
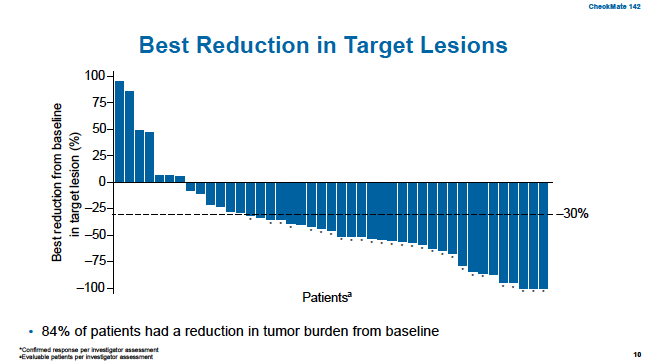
一线免疫治疗后肿瘤出现治疗应答的中位时间是2.6个月,而且这种应答的持续时间比较长,在研究数据截止时82%的肿瘤应答还在持续,74%的治疗应答已经超过6个月比较有意思的是。
研究者专门介绍了两列特别病例,都是在免疫治疗开始1年以后才出现肿瘤应答,其中1例更是被研究者判断为无效已经出组后才出现肿瘤退缩。
所有45例患者的中位PFS尚未达到,12个月PFS率为77%,12个月OS率为83%。
1例治疗相关死亡,3/4度治疗相关严重不良事件(sTRAE)7%(3例),尹毒性而导致的治疗终止7%(3例)。总体不良事件与既往报道的一致,主要集中在皮肤、内分泌系统、肝脏和胃肠道,详见下表:
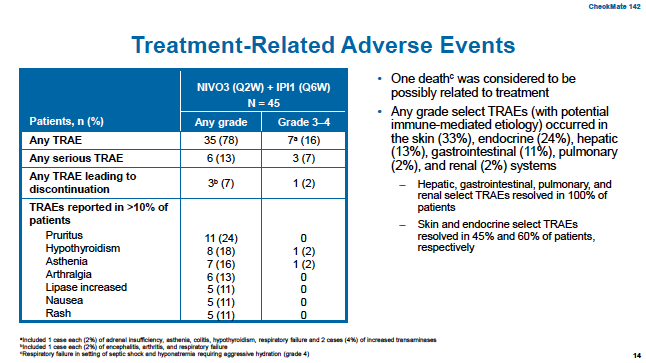
CTL-A4单抗联合PD-1单抗的双药一线免疫治疗给MSI-H型晚期转移性结直肠癌带来了显著、持久的治疗应答和临床获益,治疗耐受性良好,可能成为该类患者未来的新型一线治疗选择。
点评
免疫治疗走到MSI-H型mCRC一线治疗中,作为此领域第一个报道的临床研究,CheckMate142的这个结果倒是并不令人意外。之前大家思考的仅仅是免疫治疗将于一种什么样的形式走入一线治疗:单纯免疫治疗还是联合化疗?免疫治疗是单药还是联合使用?
单纯从ORR的结果来看,免疫治疗应用在一线治疗的优势到是没有体现出来,60%的ORR,既不比末线治疗中的高(Pembrolizumab在2015报道的ORR为56%),也不比目前标准治疗(化疗+靶向)高,例如,今年ESMO报告的TRIBE2研究,三药FOLFOXIRI+Bev的ORR也可达60%。但从PFS来看,优势还是体现了,目前一线两药+靶向治疗的PFS一般在10个月,TRIBE2研究中FOLFOXIRI+BEV的一线PFS为12月,这是目前标准治疗中最长的PFS,而CheckMate142研究中,12个月PFS率高达77%,可以推测,随访13.8个月后中位PFS尚未达到,显然,该队列的中位PFS肯定要超过14个月以上了。如果再考虑上治疗的耐受性和毒性,那么免疫治疗的优势就很明显了,该研究中,27里有效者,25例治疗超过6个月,17例持续治疗已经超过1年,在目前的标准一线治疗中,对于细胞毒药物联合方案来说,几乎是不可能的。当然,经济毒性不在考虑之列。
CheckMate 142研究的一线队列结果虽然样本量很小、生存数据还很不成熟,但我们完全有理由相信,在不远的未来,免疫治疗必将给MSI-H型晚期结直肠癌的一线治疗带来革新,成为新型的治疗标准,现在的问题是,MSI-H型mCRC,一线治疗还需要化疗或靶向药物吗?未来MSI-H群体免疫治疗的一个主要方向,应该是进一步富集/筛选优势人群,毕竟,还有40%左右的群体无效,如果在MSI-H这一表型基础上,结合TMB(肿瘤突变负荷)和TNB(肿瘤新抗原),或者,进一步去细分MSI-H的类型(突变位点的多少),能否进一步富集优势人群呢?比如,MSI-H但TMB不高的那些患者,是不是也对免疫治疗没效?
MSS mCRC一线诱导治疗后免疫维持治疗:MODUL
LBA19 –氟化嘧啶+贝伐单抗+ atezolizumab对比氟化嘧啶+贝伐单抗治疗BRAF野生型mCRC:MODUL研究(一线诱导治疗后基于分子标志物驱动的维持治疗的随机多中心研究)中队列2的发现
MODUL研究是美国NCI开展的大型伞形研究-mCRC一线诱导治疗后基于分子标志物驱动的个体化维持治疗。详细设计见下图。所有mCRC一线接受FOLFOX+贝伐单抗(Bev)的治疗3-4月,取得疾病控制以上疗效(CR、PR、SD)的患者,进行分子标志物检测,然后基于检测结果进入不同的维持治疗模式,其中队列2既是BRAF野生型患者,按1:2接受氟化嘧啶(FP)+Bev对比FP/BEV+PD-L1单抗atezolizumab(Atezo)维持治疗。研究主要终点是PFS,假设是从FP/BEV组的7.5月延长到FP/BEV/Atezo组的11.5个月,HR 0.65。本次ESMO大会报道的即是该队列的结果。
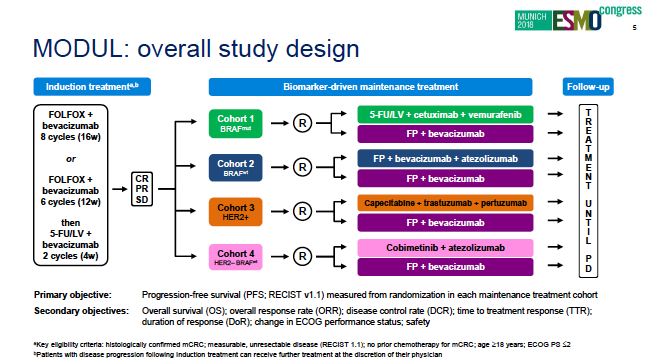
结果
研究一共入组445例,其中378例检测了MSI状态,98%(371例)为MSS。中位随访18.7月后,结果显示两组间PFS和OS均无差异,PD-L1单抗加入维持治疗并未带来生存获益,安全性资料与既往的报道一致。生存结果详见下图:
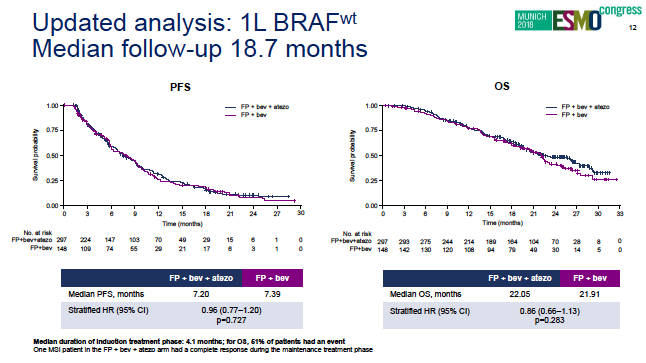
结论
MODUL研究显示PD-L1单抗不能给BRAF野生型转移性肠癌带来生存获益,由于本组患者几乎全部都是MSS型,因此,未来有必要开展更多的研究来寻找MSS型结直肠癌潜藏的免疫逃逸机制。
点评
PD-L1单抗Atezo在MSS型人群中治疗失败,这倒在我的意料之中,毕竟,既往的试验显示,MSS对现行已知的免疫治疗均无法获益。其实,更失望的反而是,这次Atezo的失败是在Bev的助力之下也没能挽回的败局。尽管已经有很多的基础研究显示,贝伐单抗可以通过逆转VEGF接到的免疫抑制,来增强肿瘤的T细胞浸润,从而可能给PD-L1单抗Atezo带来增效功能(详见下图),不幸的是,事实再次证明,MSS型肿瘤背后的免疫耐受机制并不是我们理解的那么简单。
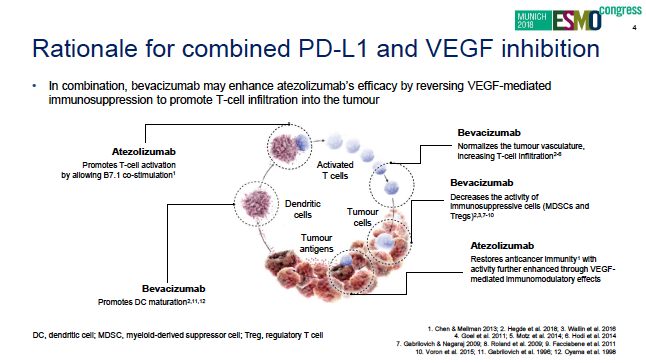
2015年以来,业界尝试了很多方法,来将MSS型肠癌这种对免疫治疗抗拒的肿瘤,又称之为“冷肿瘤”(cold tumor),变为对免疫治疗有效的“热肿瘤”(Hot tumor),核心内容就是通过与其他治疗手段联合,来增加肿瘤的免疫原性,包括抗血管生成治疗、各种靶向药物(如MEK抑制剂)、化疗、放疗、局部毁损治疗(如RFA)。现在看来,结果并不理想,在肠癌领域,曾经被寄予厚望的是MEK抑制剂Cobimetinib,早前的II期研究显示它能部分程度逆转MSS肠癌对Atezo的耐药,带来了20%的ORR,罗氏也很快启动了III期研究,遗憾的是,2018年6月,罗氏已经宣布该研究已经失败,未达研究终点。
今天,随着Bev联合Atezo的失败,,这似乎给MSS型mCRC免疫治疗的突破,又堵死了一条路,正如本次ESMO大会讨论嘉宾、来自法国的Julien Taieb教授在最后结论中说的那样:我们真的能将冷肿瘤变为热肿瘤吗?目前还在研究中的那些方法,又能有几成把握?此时,让我想起癌症免疫治疗先驱、华人科学家陈列平教授说过的一句话,“癌症免疫治疗能走多远,取决于人类免疫基础研究能走多远”,看来要解决MSS免疫耐受这个问题,只得依靠像陈教授一样潜心于基础研究的科学家做出突破,希望那一天不要太远。

总结
2018 ESMO结直肠癌领域免疫治疗应该说有希望,也有失望,一句话总结就是:无突破中有进展。无突破,意指免疫治疗的有效人群,还是仅仅局限在MSI-H/dMMR这一比例很少的特殊群体,而对于绝大多数的MSS/pMMR群体,尚无法享受到免疫治疗带来的红利。迄今为止所有旨在将这类“cold tumor”变为 “hot tumor”的所有尝试均以失败而告终,此为无突破。有进展则是在免疫治疗的优势人群MSI-H/dMMR中,免疫治疗的适应症进一步扩大,开疆拓土,从原来的转移性疾病末线治疗,拓展到一线治疗,让我们看到了免疫治疗在一线治疗中的曙光。而NICHE研究则将这种希望推进到了无远处转移的局部进展期MSI-H结肠癌术前新辅助治疗领域,奇高的病理完全缓解率,让你无法怀疑,直肠癌术前放化疗后cCR患者“观察等待”的非手术治疗策略,不久的将来也许会因免疫治疗而再次上演。今天出现的这些肠癌免疫治疗进展,算该领域2015年开启MSI时代以来,一路阴霾中终于露出的最大亮光!











 苏公网安备32059002004080号
苏公网安备32059002004080号


