当地时间2018 年10 月19-22日,2018 年欧洲肿瘤内科学会(ESMO)年会在德国慕尼黑(Munich)举行,ESMO年会是欧洲最负盛名和最有影响力的肿瘤学会议,在世界上享有盛誉。本届ESMO年会的主题是“Securing access to optimal cancer care”。免疫治疗作为当下抗肿瘤治疗最热门的话题,毫无疑问是本次大会的亮点。其中,已在全球获批9个瘤种17项适应症的肿瘤免疫治疗代表药物纳武利尤单抗,同时也是中国首个获批、目前国内唯一批准用于非小细胞肺癌(NSCLC)的PD-1抑制剂, 其在肺癌领域进行了多项研究,奠定了肿瘤免疫治疗在NSCLC二线治疗地位。在此基础上,纳武利尤单抗作为抗肿瘤免疫治疗领域的引领者,向更早期NSCLC进军,不断探索新方案以及生物标志物如何预测疗效,在本次ESMO大会上其多项研究结果亮相,引领肿瘤免疫治疗进入2.0时代。我们选取了几篇代表性的研究摘要,先睹为快。
纳武利尤单抗在NSCLC新辅助治疗的研究进展
以下两篇摘要均来自纳武利尤单抗随机II期NEOSTAR研究,研究目的是评估纳武利尤单抗单药或联合新辅助治疗是否可用于可通过外科手术治疗的非小细胞肺癌(NSCLC)患者。
摘要一: LBA49 纳武利尤单抗或纳武利尤单抗联合伊匹木单抗新辅助治疗可切除NSCLC患者
LBA49 报告了NEOSTAR研究纳武利尤单抗单药治疗组和纳武利尤单抗和伊匹木单抗联合治疗组初步结果。NEOSTAR研究是一项单中心、开放II期研究,纳入可手术切除的I-IIIA期NSCLC,1:1随机分为A、B两组,A组接受新辅助纳武利尤单抗单药治疗,3mg/kg,第1,15,29天用药;B组接受新辅助伊匹木单抗1mg/kg,第1天用药联合纳武利尤单抗治疗,3mg/kg,第1,15,29天用药;新辅助治疗后患者接受手术,术后8周给予辅助治疗。分别在基线、新辅助治疗过程中、治疗后、手术后留取外周血标本;在基线和新辅助治疗后进行CT或PET/CT检查。主要终点为接受新辅助治疗患者的主要病理学应答(MPR,<=10%的活性肿瘤细胞)。
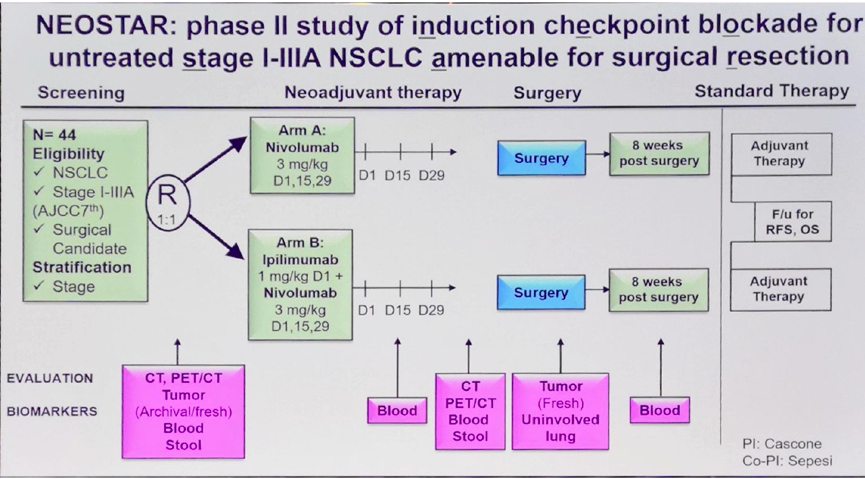
2017年9月6日至2018年3月10日,共45例符合要求的患者入组,9例筛查失败,36例患者参与随机并接受治疗。总体人群和两个新辅助治疗组患者在性别、吸烟状态、IIIA期患者比例、腺癌患者比例等特征上相似。共32例(89%)患者完成新辅助治疗,其中纳武利尤单抗单药治疗组和纳武利尤单抗加伊匹木单抗联合治疗组均为16例(89%)。26例(84%)患者完成手术,其中两组分别为14例(88%)和12例(80%)。
在接受手术治疗可评估的26例患者中,术后标本达到完全病理缓解(pCR)的患者比例为19%,两组分别为14%和25%;达到MPR的患者比例为11%,两组分别为14%和8%。两个治疗组患者手术标本存活细胞比例的中位数分别为65%和27.5%。
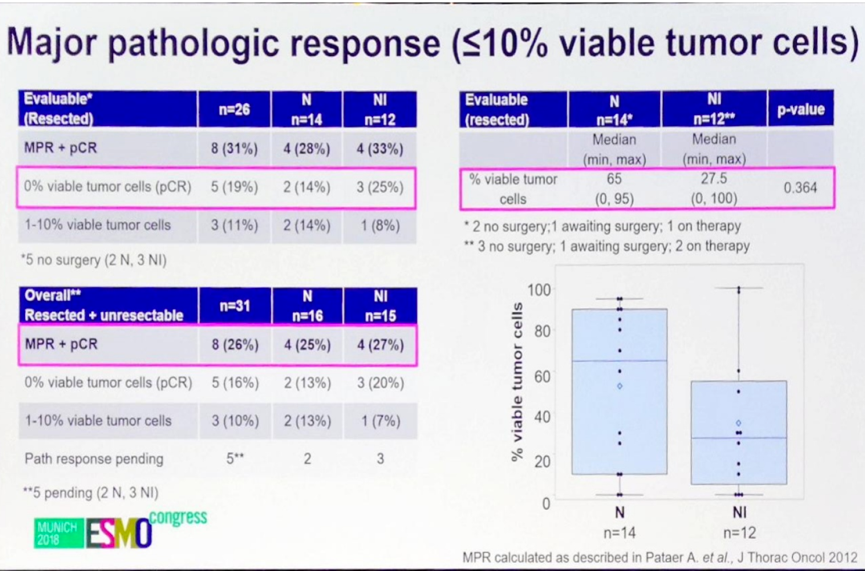
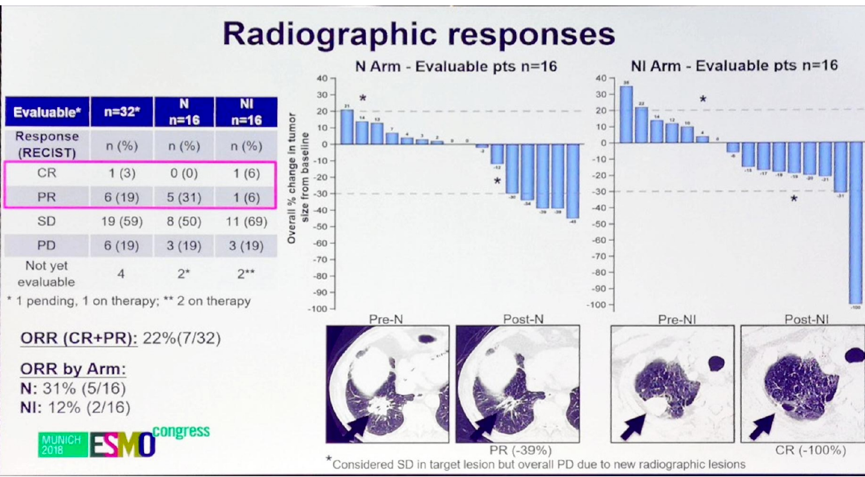
共32例患者可以进行影像学缓解率评估,两组均为16例,总体人群和两个治疗组的ORR分别为22%(7/32)、31%(5/16)和12%(2/16)。进一步分析影像学缓解和MPR的关系,发现两者显著相关(P<0.002)。

安全性评估显示新辅助治疗的耐受性良好,大多数治疗相关不良事件(TRAE)为1-2级,总体人群和两个治疗组中1-2级TRAEs的发生率分别为59%、271.%和72.9%。
探索性分析显示,相比于未接受治疗的肺癌患者,新辅助纳武利尤单抗单药治疗或纳武利尤单抗联合伊匹木单抗治疗可以增加肿瘤浸润淋巴细胞(TILs)的增殖和活化;相比于新辅助纳武利尤单抗单药,新辅助纳武利尤单抗联合伊匹木单抗治疗可以诱导出更显著的增殖效应,且观察到不同的T细胞亚群。此外,相比于未接受治疗的肺癌患者,新辅助免疫治疗可以诱导出更强的T细胞受体(TCR)多样性,并在接受新辅助纳武利尤单抗联合伊匹木单抗治疗的患者中观察到TCR同源性增加。
这一研究结果显示新辅助纳武利尤单抗单药治疗或纳武利尤单抗联合伊匹木单抗治疗用于可切除患者可以取得31%的MPR率,且总体耐受性良好。相比于未接受新辅助治疗的肿瘤,新辅助免疫治疗可以诱导大量的TIL增殖和活化;此外,联合免疫治疗组还能产生更显著TIL增殖和不同的T细胞亚群增殖。新辅助纳武利尤单抗单药治疗或纳武利尤单抗联合伊匹木单抗治疗可以诱导广泛的TCR多样性;相比于临近正常肺组织,在联合免疫组患者中还观察到肿瘤组织中增加的TCR同源性。这一研究结果在现有新辅助免疫单药治疗的基础上,扩展了NSCLC新辅助治疗的经验,引入了联合治疗策略。然而,目前研究仍存在一定的局限性,每个治疗组的患者人数较少,没有足够统计效能比较两组患者的MPR。探索性的生物标志物分析仍在进行中。
摘要二:1928P 对接受新辅助免疫治疗或化疗的NSCLC患者进行病理评估,观察到相似的病理表现
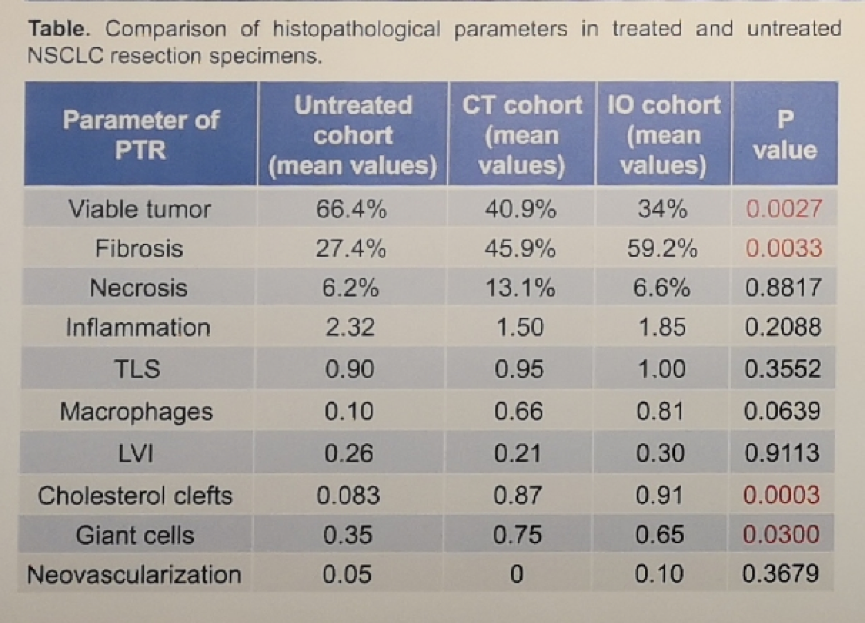
1928P 该研究对比了接受新辅助化疗和免疫治疗(纳武利尤单抗单药或纳武利尤单抗联合伊匹木单抗)的患者对比直接手术患者外科切除标本的组织病理学差异。分三组(n=30,10例/组)对未经治疗、接受新辅助化疗或免疫治疗的NSCLC患者手术切除标本进行以下病理特征评估:存活肿瘤细胞和坏死肿瘤比例、炎症、三级淋巴管结构(TLS)、巨噬细胞、淋巴血管侵犯(LVI)、空隙样胆固醇结晶(CC)、巨细胞和新生血管(NV,评分0-3分)。
结果显示,新辅助化疗和免疫治疗与显著更低的活性肿瘤细胞比例相关(分别为p<0.04和p<0.02)。相比于未接受过治疗的肿瘤,新辅助免疫治疗后可见更多的纤维化 (p<0.04),新辅助化疗后可见更多的CC (p<0.03)。此外,相比于未接受过治疗的肿瘤,新辅助免疫治疗后的肿瘤中观察到炎症细胞、巨噬细胞和CC的比例更高;新辅助化疗后的肿瘤中观察到更多纤维化和GC,结果汇总见下表。
结合既往新辅助化疗的研究数据可知,新辅助化疗或免疫治疗均可以使NSCLC患者取得病理缓解。然而既往尚无研究对比新辅助化疗、免疫治疗和直接手术患者的外科手术切除标本特征。这一研究通过对比3种方案下的NSCLC患者肿瘤组织中的变化,使得我们对新辅助化疗和免疫治疗的作用机理有了更深的理解。后续将在更大样本量的患者中(n=80),对比接受纳武利尤单抗或纳武利尤单抗联合伊匹木单抗新辅助治疗患者的病理组学特征,这些研究结果将进一步为新的治疗策略提高重要的理论依据。
治疗探索:纳武利尤单抗联合放疗治疗研究
摘要三:1502TiP FORCE研究:增强抗PD-1单抗治疗效,纳武利尤单抗联合放疗治疗晚期NSCLC
FORCE研究是目前正在进行的一项前瞻性、双臂、非随机、开放II期研究, 评估纳武利尤单抗与放疗联合治疗在转移性非鳞状NSCLC患者中的疗效,并前瞻性探索性分析预测Nivo疗效的生物标志物。纳入130例计划接受二线或三线治疗的IV期非鳞NSCLC患者。其中,65例患者有接受非头颅和胸部姑息放疗的适应症,患者在接受5 x 4Gy的姑息放疗后序贯接受nivo 240 mg 治疗。A组患者中,在接受第一次nivo治疗后72h内开始接受20 Gy光子放疗;B组的65例患者没有放疗适应症,将直接接受nivo治疗。两组患者中,nivo使用均为每2周1次,直至疾病进展或毒性限制。主要终点为根据RECIST 1.1标准评估的ORR,次要终点为根据RECIST 1.1标准评估的PFS、OS、根据PD-L1表达进行亚组分析、毒性和生活质量评估。此外,基于这一研究还开展了一个深入的、探索性转化研究项目,旨在深度探索放疗引发免疫刺激效应的机理,且探寻nivo疗效的潜在预测标志物。
免疫治疗目前已经获批用于非鳞NSCLC,可以改善患者的治疗结局。临床前研究和早期临床研究结果提示光子放疗联合抗PD-1单抗治疗有协同机理,可以提高免疫治疗的疗效,延长疗效持续时间。既往临床研究结果多为回顾性分析或小样本量研究,FORCE研究将会提供前瞻性的数据,评估Nivo联合放疗的疗效,尝试探索大分割光子放疗与免疫联合这一安全高效联合治疗策略背后的作用机制。
生物标志物在免疫治疗的应用探索
摘要四:1503 Tip CheckMate 592研究: 纳武利尤单抗联合伊匹木单抗一线治疗IV期或复发性NSCLC的基于生物标志物评估疗效的II期探索性研究
CheckMate 592研究 (NCT03001882)是一项正在进行的探索性的开放II期研究,研究开始时间为2017年3月,预计完成主要研究的时间为2019年3月。目的是探寻潜在的疗效预测标志物,包括PD-L1,TMB等,评估其预测纳武利尤单抗联合伊匹木单抗一线治疗IV期或复发性NSCLC的疗效相关性。
研究分为两部分,第一部分研究计划入组100例患者,将根据患者的PD-L1表达水平(≥1% vs <1%)进行分析。主要终点为ORR与基线TMB、外周血潜在标志物和基线及治疗过程中的肿瘤标志物的关系。次要终点为ORR、DCR、疗效持续时间、至疾病缓解时间、PFS、OS以及肠道生物标志物与疗效的关系。第二部分计划入组150例患者,无论患者的PD-L1表达状态。主要终点为基线和外周血TMB与ORR的关系;次要终点包括ORR、PFS、OS、安全性和肠道菌群与疗效的关系。
在既往发表的研究中,CheckMate 012 研究结果,纳武利尤单抗联合伊匹木单抗对比纳武利尤单抗单药一线治疗IIIB/IV期NSCLC,显示出更高的ORR和2年OS率。CheckMate 568研究(纳武利尤单抗联合伊匹木单抗)、III期CheckMate 026研究(纳武利尤单抗单药)均提示高TMB是一个潜在的预测标志物,无论患者PD-L1表达水平; CheckMate 227研究(纳武利尤单抗联合伊匹木单抗)进一步验证了TMB的预测价值:高TMB可以导致肿瘤新抗原的高表达,使得抗肿瘤免疫能够更好的发挥作用。目前针对免疫治疗疗效预测标志物除目前比较公认的PD-L1和TMB,还有一些其他的重要潜在预测标志物,如外周血淋巴细胞比例、肠道标志物等,其分析多为回顾性的,证据级别有限,CheckMate 592研究是一项前瞻性探寻疗效预测标志物的研究,将能够提供高级别证据,助力精准免疫治疗实践落地。
总结
纳武利尤单抗作为肿瘤免疫治疗领域的引领者,不断探索创新,勇往直前。在本次ESMO大会上报道的NEOSTAR 研究初期数据,以及FORCE研究研究和CheckMate 592研究进展将为我们继续探寻临床新的治疗手段以及提高现有治疗策略疗效迈出了重要的一步。











 苏公网安备32059002004080号
苏公网安备32059002004080号


