2018年8月9日,美国国立综合癌症网络(NCCN)公布了《2019 NCCN宫颈癌临床实践指南(第1版)》。为使大家更好地了解新版指南,现对其进行简要解读。
新版指南主要更新
(1)ⅠB2期及以上宫颈癌术前检查可考虑行麻醉下膀胱镜检查。(2)ⅠA1期伴淋巴脉管间隙浸润和ⅠA2期初始治疗:保留生育功能者可选择锥切+盆腔淋巴结切除术。不保留生育功能者可选择次广泛性子宫切除术+盆腔淋巴结切除术。均不再推荐行腹主动脉旁淋巴结取样。(3)手术分期提示腹主动脉旁淋巴结阳性,后经影像学或病理活检证实不存在远处转移的患者,术后辅助治疗表述更改为:延伸野外照射+顺铂为基础的同步化疗±阴道后装放疗。(4)意外发现的ⅠA1期伴淋巴脉管间隙浸润或ⅠA2、ⅠB1期宫颈癌,如切缘阴性且影像学无阳性发现者,无符合Sedlis标准放疗危险因素者,可选择放疗或行宫旁广泛性切除加阴道上段切除+盆腔淋巴结切除术±腹主动脉旁淋巴结取样。(5)广泛性子宫切除术可选择经腹、腹腔镜或机器人技术。鉴于近期有随机对照研究显示,早期宫颈癌患者经腹腔镜手术生存结局较开腹手术差,因此术前需将不同手术方法的风险和益处明确告知患者。(6)腹主动脉旁淋巴结切除一般在肠系膜下动脉(IMA)下水平进行。更高范围的切除可以根据临床和影像学结果进行调整。(7)顺铂/吉西他滨联合方案不再纳入复发或转移性宫颈癌的一线化疗方案。(8)放疗原则新增:对于宫旁或盆壁大的病灶,可考虑在全盆放疗结束后给予宫旁加量。
分期
仍采用国际妇产科联盟(FIGO)临床分期,在该分期中,辅助检查仅限于阴道镜检查、活检、宫颈锥切术、膀胱镜和直肠乙状结肠镜检查。影像学和手术分期不纳入评估。CT、MRI、联合PET-CT和手术分期常常用于指导治疗方案设计。区域淋巴结转移定义N分期(表1)。 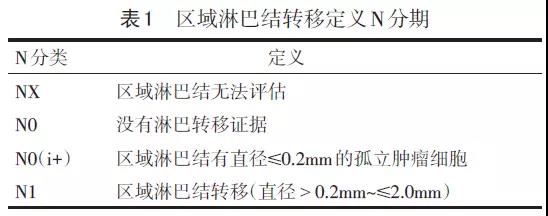
手术原则
宫颈癌手术治疗根据临床分期进行分级手术
3.1 锥切和单纯子宫切除术(即筋膜外子宫切除术)
3.1.1 需保留生育功能者 ⅠA1期淋巴脉管间隙无浸润者可行锥切,切除部分宫颈及宫颈管组织。切缘至少有3mm的阴性距离。推荐冷刀锥切,也可以采用环形电切术(LEEP),应尽量整块切除,保持标本的完整性。小心操作以减小电器械对组织边缘的影响。切除组织的形状和深度需与病灶大小、形状和病变部位相适应。例如,对于位于宫颈管的可疑浸润性腺癌与原位腺癌,锥切应设计成一个窄长锥形,延伸至宫颈内口以避免遗漏宫颈管病变。锥切术可分诊断性锥切和治疗性锥切。
3.1.2 不保留生育功能者 经锥切确诊的ⅠA1期淋巴脉管间隙无浸润者可行单纯子宫切除术。ⅠA1期伴有淋巴脉管间隙浸润者,按ⅠA2期处理,行次广泛(改良根治)性子宫切除术加双侧盆腔淋巴结切除术(或前哨淋巴结显影)。
3.2 广泛性子宫切除术加双侧盆腔淋巴结切除术(或前哨淋巴结显影) 广泛性子宫切除术较筋膜外子宫切除术切除了更多宫旁组织,包括部分主韧带、宫骶韧带和阴道上段。阴道的切除长度在ⅠA2期为1~2 cm,ⅠB1或ⅡA1期为阴道的上1/4或1/3。需切除盆腔淋巴结,必要时切除腹主动脉旁淋巴结。广泛性子宫切除可以选择经腹、腹腔镜或机器人辅助腹腔镜技术。鉴于近期有随机对照研究显示,早期宫颈癌患者经腹腔镜手术生存结局较开腹手术差,因此术前需将不同手术方法的风险和益处明确告知患者。
QM分型是子宫切除术现代分型,见表2。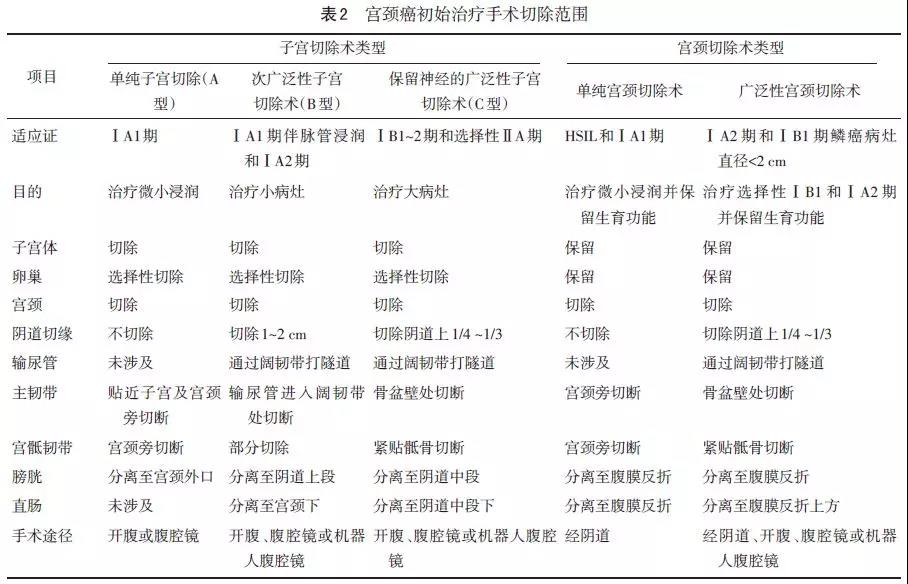
3.3 经阴道广泛性宫颈切除术加腹腔镜下淋巴结切除(或前哨淋巴结显影) 用于经仔细筛选的ⅠA2期或ⅠB1期、病灶直径≤2cm、需要保留生育功能的患者。宫旁和阴道上段的切除范围同B型广泛性子宫切除术,但保留子宫体。经腹广泛性宫颈切除术能切除更多的宫旁组织,适用于病灶直径2~4cm的ⅠB1期患者。手术范围类似C型广泛性子宫切除术。
3.4 ⅡB期及以上的晚期病例通常不采用手术治疗 在美国,大多数晚期患者采用放化疗。在有些国家,部分ⅡB期病例可能首选广泛性子宫切除术或新辅助化疗后进行广泛性子宫切除术。
3.5 放疗后盆腔中心性复发或病灶持续存在者采用盆腔器官廓清术仍有治愈的可能 术前需明确是否存在远处转移。如复发局限于盆腔,可进行手术探查。未侵犯盆壁及淋巴结者可切除盆腔器官。根据肿瘤的位置采用前、后或全盆腔器官廓清术。若有足够的手术切缘,可保留盆底肌肉和肛门括约肌。
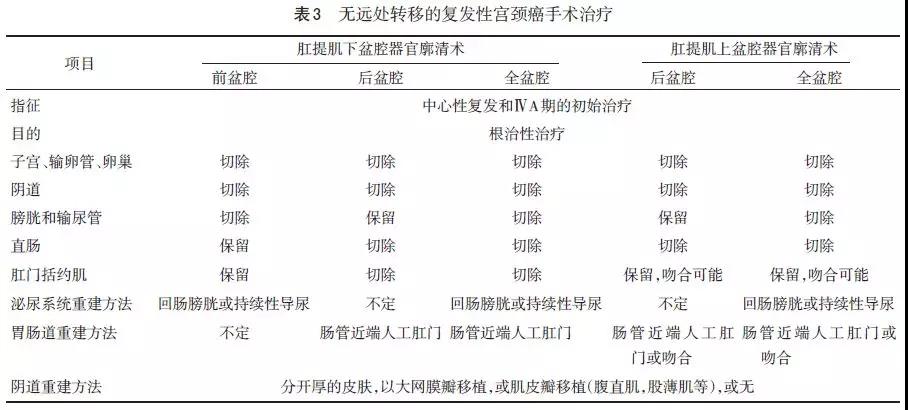
表3总结了盆腔器官廓清术的不同类型及切除范围。盆腔器官廓清术很少用于初始治疗,仅用于不宜盆腔放疗或因既往患有其他疾病,已接受过盆腔放疗或局部晚期宫颈癌不适合盆腔放疗的患者。
3.6 前哨淋巴结显影 该技术已经被应用于经选择的Ⅰ期宫颈癌患者手术程序中。尽管可用于病灶直径达4cm的患者,但肿瘤直径<2cm时检测率和显影效果最好。操作时可直接在宫颈的3和9点或3、6、9、12点位置注射染料或放射性胶体99mTc。通过注射吲哚菁绿(ICG)者用荧光摄像头显影;注射99mTc者使用γ探测器探测;注射染料者直接肉眼观察,从而在术中识别前哨淋巴结。前哨淋巴结通常位于髂外血管内侧、侧脐韧带外侧或闭孔窝上部。前哨淋巴结显影的关键技术是严格按照以下检测流程:切除所有显影的淋巴结(这些淋巴结如HE染色无转移,病理专家需采用更高级的检测技术)→切除任何可疑淋巴结(不论有无显影)→一侧没有显影淋巴结时,切除该侧髂内和髂外等高危淋巴结→肿瘤和宫旁组织整块切除。这些结果可为术后的辅助治疗提供依据。
放射治疗原则
4.1 外照射放疗(EBRT) 以CT为基础的计划设计和适形铅挡块技术是目前EBRT的标准方法。MRI是判断肿瘤浸润周围软组织和宫旁的最佳辅助检查。对不能手术的宫颈癌患者,PET有助于确定转移淋巴结的范围,而且有助于对术后残留阳性淋巴结的诊断。
外照射的靶区需要包括大体肿瘤区(如果存在)、宫旁、宫骶韧带、骶前淋巴结及其他可能受累淋巴结和足够的阴道组织(距离肿瘤至少3cm)。如手术或影像学检查未发现阳性淋巴结,照射范围需包括髂外淋巴结、髂内淋巴结、闭孔淋巴结和骶前淋巴结群;如淋巴结转移的风险较大(如肿瘤体积大,可疑或确定低位真骨盆内淋巴结转移),照射范围还需要增加髂总淋巴结区;而对于髂总或腹主动脉旁淋巴结转移患者,则需要进行盆腔延伸野及腹主动脉旁淋巴结照射,照射野上界应达肾血管水平或根据淋巴结范围继续向头侧延伸,如病变已侵犯阴道下1/3,双侧腹股沟淋巴结也应包括在照射范围内。
常规分割下(1.8~2.0Gy/d)外照射控制镜下微转移灶所需剂量约为45Gy,如有未切除的肿大淋巴结,局部需推量10~20Gy或增加近距离放疗。多数患者在外照射期间,都辅助以铂类为基础的同期化疗,化疗方案为顺铂单药或顺铂+氟尿嘧啶(5-FU)。对于宫旁或盆壁大的病灶,可考虑在全盆放疗结束后给予宫旁加量。
调强放疗等高适形度放疗技术不仅能给区域淋巴结以大剂量照射,对于术后需行腹主动脉旁淋巴放疗的患者,还可以减少肠道等危及器官的剂量。但是对于初治中心性病变的宫颈癌患者来说,精确放疗如调强放疗和体部立体定向放疗(SBRT)不能常规取代近距离放疗。开展调强等适形放疗技术时,应注重治疗的重复性,包括靶区和正常组织的界定,患者内脏器官的运动及软组织形变,并进行严格的剂量和物理质控。建议每日行锥形束CT(CBCT)等图像引导技术以明确是否有组织移位。
在适形放疗尤其调强放疗中,大体肿瘤区(GTV)、临床靶区(CTV)、计划靶区(PTV)、危及器官(OARs)、剂量体积直方图(DVH)等概念已经被明确定义。立体定向放疗(SBRT)是通过1~5次分割照射,将外照射聚焦达到一个很高剂量的放疗方法,可能对局限性病灶或孤立转移病灶有较好的效果。
4.2 近距离放疗 近距离放疗是宫颈癌根治性放疗的重要治疗手段。通常通过宫腔管和阴道施源器实施。阴道施源器通常有卵圆形、环状形和柱状体,可根据患者生理及肿瘤的解剖特点进行选择。治疗时,阴道施源器与宫腔管相连同时进行治疗。放疗前MRI有助于确定残余肿瘤几何形状。在患者接受EBRT时,近距离放疗通常在放疗后期进行,这时肿瘤体积已明显缩小,使得施源器放置的部位能够达到近距离治疗的理想几何形状。对部分极早期患者(如ⅠA2期),也可选择单纯近距离放疗。少数情况下,由于患者解剖因素或肿瘤形状无法进行近距离放疗时,可以选择组织间插植放疗,但是这种方法只能在有经验的单位由专家开展,如没有条件,尽早转诊给有经验的单位也是确保疗效的重要途径。
已行子宫切除术的患者,尤其是阴道切缘阳性或靠近切缘的患者,EBRT后,可使用阴道柱状施源器对阴道残端推量放疗,剂量参考点通常设在阴道黏膜下5mm处,治疗方案一般为5.5Gy×2 次(黏膜下5mm为参考点)或6Gy×3 次(阴道表面为参考点),SBRT不能常规替代近距离放疗。
迄今为止,A点一直是最广泛使用的剂量参考点,代表宫颈旁剂量,但A点局限性在于没有考虑到肿瘤的三维形状及肿瘤与正常组织结构的相互关系。通常,A点的处方剂量为早期病变5.5Gy×5次,肿瘤较大或放疗不敏感者6Gy×5次。已有证据表明,图像引导的近距离放疗可以提高患者的生存率并减少治疗副反应。MRI提供了残留肿瘤最佳的软组织图像,在近距离治疗前行MRI检查,可以帮助确定肿瘤范围。没有MRI设备时也可以使用CT,但CT对病灶范围的确定及靶区的勾画都远不如MRI准确。通过外照射和近距离放疗,高危CTV(HR-CTV)靶区剂量需达到80Gy(2Gy单次分割等效生物剂量,EQD2),而对于肿瘤体积大或部分不敏感患者靶区剂量应该达到87Gy。根据已出版的指南,正常组织的限定剂量为:直肠≤65~75Gy;乙状结肠≤70~75Gy;膀胱≤80~90Gy。如果达不到这些参数要求,应该考虑使用组织间插值技术。
4.3 放疗剂量 图像引导的近距离放疗技术鼓励处方剂量采用HR-CTV。一直以来,近距离放疗最常用剂量系统是在解剖基础上,对A点进行明确定义,并结合对子宫和阴道放射源的驻留和活性的分配进行规范化而建立的,同时,也对标准化的B点、膀胱点和直肠点进行剂量分析。目前3D图像引导的近距离放疗技术都致力于优化肿瘤靶区的覆盖,同时减少邻近膀胱、直肠和肠管的照射。然而,既往的经验和对照研究以及即将开展的临床研究,都是以A点剂量系统为基础,建议在使用图像引导的近距离放疗增加放疗剂量时,治疗剂量不应低于传统A点剂量系统的推荐。
NCCN指南对A点的剂量推荐都是以传统的、经广泛验证的低剂量率近距离(LDRs)治疗剂量分割为基础。在这个剂量系统里,外照射采用每天1.8~2Gy,近距离放疗采用A点LDRs的剂量为40~70cGy/h。如果使用高剂量率(HDR)进行近距离放疗,则需通过线性二次模型将A点HDR的剂量转换为具有相同生物学效应的LDR剂量。联合使用EBRT时,近距离放疗计划有很多种,但最常用的HDR方法是采用5次宫腔和阴道施源器插入,每次A点剂量为6Gy,A点总剂量达到30Gy/5次,转化为LDR等效生物学剂量为A点40Gy。欧洲的临床研究也建议,对于高危CTV,28Gy/4次也是一个合理的使用方法。小肿瘤和消退迅速的肿瘤可以适当减小近距离放疗的剂量。
4.4 初治病例的根治性放疗 未接受手术的初治宫颈癌患者外照射靶区应根据手术及影像检查确定的淋巴结状态而定,原发肿瘤及区域淋巴引流区的外照射剂量约为45Gy(40~50Gy),并使用近距离放疗对原发肿瘤进行推量,使A点剂量增加30~40Gy(LDR等效剂量)。根据指南建议,这时A点总剂量在体积小的肿瘤要达到80Gy,体积大的肿瘤要≥85Gy。存在明显增大且未切除的淋巴结,需要使用高适形度的EBRT追加放疗,额外给予10~15Gy。高剂量照射尤其使用EBRT时,需要特别注意正常组织的放疗耐受剂量,严格控制位于高剂量区内的正常器官照射剂量,避免过量照射。
4.5 子宫切除术后的辅助放疗 子宫切除术后病理学检查发现高危或中危因素时需补充术后辅助放疗。放疗野至少需要包括以下部位:阴道断端下3~4cm、宫旁组织和邻近的淋巴结引流区(如髂外淋巴结和髂内淋巴结)。确定有淋巴结转移时,放射野的上界还需要相应延伸,通常推荐按标准分割放疗,剂量为45~50Gy。对于不能切除的肿大淋巴结,需要通过高适形度EBRT追加剂量10~15Gy,高剂量照射尤其使用EBRT时,需要特别注意正常组织的放疗耐受剂量。
4.6 术中放疗(IORT) IORT是指在开腹手术时,对存在有残留风险的瘤床或无法切除的孤立性残留病灶进行单次、高聚焦的大剂量放疗。尤其适合放疗后复发病例。进行IORT时,可手动直接将正常组织(如肠管和其他器官)从辐射区中推开。IORT通常使用电子线,可根据风险区域的大小选择不同的施源器,这样就可以限制照射的面积和深度,避免周围正常组织接受不必要的照射。
全身治疗(化疗)原则
5.1 同期放化疗药物 顺铂或顺铂+5-FU,顺铂不耐受者可采用卡铂。
5.2 一线联合化疗 顺铂一直被认为是转移性宫颈癌最有效的药物。以顺铂为基础的联合方案如顺铂+紫杉醇+贝伐单抗(证据等级1)、顺铂+紫杉醇(证据等级1)、顺铂+拓扑替康(证据等级2A)已广泛用于临床研究。联合方案反应率、无进展生存期均优于顺铂单药。美国食品和药品监督管理局(FDA)已经批准顺铂/拓扑替康用于晚期宫颈癌。顺铂+紫杉醇联合或卡铂+紫杉醇联合方案因毒性较低更易于管理。GOG204对4种顺铂双药方案(顺铂+紫杉醇,顺铂+拓扑替康,顺铂+吉西他滨,顺铂+长春瑞滨)进行了比较,发现顺铂+紫杉醇优于其他方案,且血小板减少症和贫血症发生率更低。GOG240研究了含贝伐单抗的联合化疗方案(顺铂+紫杉醇+贝伐单抗或拓扑替康+紫杉醇+贝伐单抗),发现接受贝伐单抗的患者总生存期改善(17.0 个月vs. 13.3个月,P=0.004)。拓扑替康+紫杉醇(证据等级2A)未显示出优于顺铂+紫杉醇方案。虽然贝伐单抗导致了更高的毒性(例如高血压、血栓栓塞事件和胃肠瘘),但不具有统计学意义。FDA最近批准贝伐单抗与紫杉醇和顺铂或拓扑替康联合用于治疗持续性、复发性或转移性子宫颈癌。
日本临床肿瘤研究组(JCOG)0505Ⅲ期临床研究结果显示,卡铂+紫杉醇(证据等级2A)较顺铂+紫杉醇用于转移或复发性宫颈癌总生存期相当且具有更好的耐受性,便于毒性反应的管理。但在之前未接受过铂类药物的患者中,TP方案(紫杉醇+顺铂)的总生存期高于TC方案(紫杉醇+卡铂)。因此,NCCN专家组推荐卡铂+紫杉醇可作为先前接受过顺铂治疗患者的1类选项。研究认为,顺铂+紫杉醇和卡铂+紫杉醇是转移性或复发宫颈癌应用最广泛的方案,对于不能使用紫杉醇的患者,可采用顺铂+拓扑替康替代。
5.3 单药化疗 顺铂是最有效的化疗单药,被推荐作为一线单药治疗复发或转移性宫颈癌患者。对于无法接受手术或者放射治疗的复发患者,单药顺铂、卡铂或紫杉醇姑息化疗都是合理的方案。
5.4 二线化疗的药物 包括帕姆单抗(用于PD-L1阳性或MSI-H/dMMR肿瘤)、贝伐单抗、多西他赛、5-FU、吉西他滨、异环磷酰胺、伊立替康、丝裂霉素、拓扑替康、培美曲塞(证据等级3)和长春瑞滨(证据等级3)。
影像学检查原则
除了胸部CT不要求增强,指南中提及的MRI及CT均为增强检查,除非有禁忌证。
初始检查影像学检查推荐
6.1.1 Ⅰ期 (1)不保留生育功能者:考虑胸部平片,若有异常,则可行CT平扫检查;可选择性行MRI增强检查以评估局部病灶范围,特别是ⅠB2期患者首选MRI检查;ⅠB1期可考虑全身PET-CT或胸部、腹部、盆腔CT检查;ⅠB2期常规行全身PET-CT或胸部、腹部、盆腔CT检查;全子宫切除术后意外发现宫颈癌的患者考虑全身PET-CT或胸部、腹部、盆腔CT检查以评估转移情况,行盆腔MRI评估盆腔残留病灶。(2)保留生育功能者:考虑胸部平片,若有异常,则可行CT平扫检查;首选盆腔MRI以评估测量病灶范围以及病灶和宫颈内口的距离。不适宜MRI检查者用经阴道超声检查;ⅠB1期可考虑全身PET-CT或胸部、腹部、盆腔CT检查;根据临床症状及可疑转移病灶诊断,选择其他影像学检查。
6.1.2 Ⅱ~Ⅳ期 行全身PET-CT或胸部、腹部、盆腔CT检查以评估转移情况;盆腔MRI增强检查评估局部病灶范围;根据临床症状及可疑转移病灶诊断,选择其他影像学检查;全子宫切除术后意外发现宫颈癌的患者考虑全身PET-CT或胸部、腹部、盆腔CT检查以评估转移情况,行盆腔MRI评估盆腔残留病灶。
随访时影像学检查推荐
6.2.1 Ⅰ期 (1)不保留生育功能患者的影像学检查选择应根据临床症状及复发、转移而决定;ⅠB2期患者或术后有高、中危因素需接受辅助放疗及放化疗的患者,治疗结束3~6个月后可行全身PET-CT检查。(2)保留生育功能者:术后6个月考虑行盆腔MRI平扫+增强检查,之后的2~3年间每年1次;若怀疑复发,考虑行全身PET-CT检查;根据临床症状及复发、转移选择其他影像学检查。
6.2.2 Ⅱ~Ⅳ期 治疗结束后3~6个月内行全身PET-CT检查(首选)或胸部、腹部、盆腔CT平扫+增强检查;治疗结束3~6个月后选择性行盆腔MRI平扫+增强检查;根据临床症状及复发、转移选择其他影像学检查。可疑复发转移者均考虑全身PET-CT。
各期宫颈癌的初始治疗方法
ⅠA1期无淋巴脉管间隙浸润
该期淋巴结转移率<1%,不需要切除淋巴结。建议先锥切。有适应证者加宫颈管搔刮术(ECC)。锥切切缘至少3mm阴性[无浸润性病变或高度鳞状上皮内病变(HSIL)]。
7.1.1 保留生育功能者 如切缘阴性,术后可随访观察;如切缘阳性,再次锥切或行宫颈切除术。目前尚未见数据支持小细胞神经内分泌肿瘤、肠型腺癌或微偏腺癌等病理类型患者可保留生育功能。强烈建议术后持续性异常宫颈细胞学涂片或HPV感染患者在完成生育后切除子宫。
7.1.2 不保留生育功能者 如锥切切缘阴性并有手术禁忌证者,可观察随访。无手术禁忌证者行筋膜外子宫切除术。切缘阳性者(包括HSIL或癌)最好再次锥切以评估浸润深度排除ⅠA2/ⅠB1期。不再次锥切直接手术者,切缘为HSIL时行筋膜外全子宫切除术,切缘为癌时行次广泛性子宫切除术+盆腔淋巴结切除术(证据等级2B),可考虑行前哨淋巴结显影(证据等级2A)。
ⅠA1期伴淋巴脉管间隙浸润和ⅠA2期
7.2.1 保留生育功能者 可选择:(1)锥切+盆腔淋巴结切除术。可考虑行前哨淋巴结显影(证据等级2A)。锥切切缘阴性者术后随访观察。锥切切缘阳性者,再次锥切或行宫颈切除术。(2)直接行广泛性宫颈切除术+盆腔淋巴结切除术。可考虑行前哨淋巴结显影(证据等级2A)。完成生育后对于持续性HPV阳性或细胞学异常或有手术意愿的患者可行子宫切除术,<45岁的鳞癌患者可保留卵巢。
7.2.2 不保留生育功能者 可选择:(1)次广泛或广泛性子宫切除术+盆腔淋巴结切除术。可考虑行前哨淋巴结显影(证据等级2B)。<45岁的鳞癌患者可保留卵巢。(2)盆腔外照射+近距离放疗。
ⅠB1和ⅡA1期
7.3.1 保留生育功能限于ⅠB1期鳞癌患者 推荐行广泛性宫颈切除术+盆腔淋巴结切除术±腹主动脉旁淋巴结取样。可考虑行前哨淋巴结显影(证据等级2A)。原则上推荐选择肿瘤直径≤2cm者,可选择经阴道行广泛性宫颈切除术。肿瘤直径2~4cm者,应行经腹或经腹腔镜、机器人辅助腹腔镜的广泛性宫颈切除术。
7.3.2 不保留生育功能者 可选择:(1)广泛性子宫切除术+盆腔淋巴结切除术(证据等级1 )±腹主动脉旁淋巴结取样(证据等级2B)。可考虑行前哨淋巴结显影(证据等级2A)。<45岁的鳞癌患者可保留卵巢。(2)盆腔外照射+阴道近距离放疗(A 点总剂量80~85Gy)±含顺铂的同期化疗。
7.4 ⅠB2 和ⅡA2 期 可选择:(1)根治性盆腔外照射+顺铂同期化疗+阴道近距离放疗,A点剂量≥85Gy(证据等级1)。(2)广泛性子宫切除术+盆腔淋巴结切除术±腹主动脉旁淋巴结取样(证据等级2B)。(3)盆腔外照射+顺铂同期化疗+近距离放疗,A 点剂量75~80Gy,放疗后行辅助性子宫切除术(证据等级3)。以上3种推荐中,首选同期放化疗。第3种选择同期放化疗之后进行辅助性子宫切除术还存在争议。该做法可减少盆腔复发、但不改善总生存率,却增加并发症,故只适用于放疗结束后仍有肿瘤残留、或病灶或子宫已超出近距离放疗所能达到的放疗区域的患者。腹腔镜手术可减少术后并发症。
ⅡB~ⅣA及部分ⅠB2和ⅡA2期 可选择手术分期,也可先进行CT、MRI、PET等影像学评估。
选择先行影像学检查者,未发现淋巴结转移,可行盆腔外照射+含顺铂同期化疗+阴道近距离放疗(证据等级1);若盆腔淋巴结阳性且腹主动脉旁淋巴结阴性时,可选择:(1)盆腔外照射+阴道近距离放疗+含顺铂同期化疗(证据等级1)±腹主动脉旁淋巴结放疗。(2)腹膜外或腹腔镜淋巴结切除术,术后病理腹主动脉旁淋巴结阴性者,行盆腔放疗+阴道近距离放疗+顺铂同期化疗(证据等级1);腹主动脉旁淋巴结阳性者,行延伸野放疗+阴道近距离放疗+顺铂同期化疗。影像学检查发现盆腔淋巴结和腹主动脉旁淋巴结均阳性时,行延伸野放疗+顺铂同期化疗+阴道近距离放疗。影像学检查发现有远处转移并经有临床指征活检证实转移者,行全身化疗±个体化放疗。局限于锁骨上淋巴结转移者可能可以采用根治性治疗。
手术分期是指先行腹膜外或腹腔镜下淋巴结切除术(证据等级2B),根据淋巴结情况选择相应的处理:(1)盆腔和腹主动脉旁淋巴结均阴性,可采用盆腔外照射+含顺铂同期化疗+阴道近距离放疗(证据等级1)。(2)盆腔淋巴结阳性、腹主动脉旁淋巴结阴性,可行盆腔外照射+含顺铂同期化疗+阴道近距离放疗(证据等级1)。(3)腹主动脉旁淋巴结阳性者,需根据临床指征补充进一步的影像学检查以排除更广泛的转移。确定无其他远处转移时,行延伸野外照射+含顺铂同期化疗+阴道近距离放疗。影像学检查发现有更远处的转移,有临床指征者在可疑处活检,活检阴性者行延伸野外照射+顺铂同期化疗+阴道近距离放疗;活检阳性者行全身治疗±个体化放疗。
术后辅助治疗
取决于手术发现及分期。淋巴结、宫旁浸润及切缘阴性者,可以观察或根据是否存在中危因素(肿瘤大小、间质浸润、淋巴脉管间隙阳性)按照“Sedlis标准”(见表4)补充盆腔外照射(证据等级1)±含顺铂同期化疗(化疗证据等级2B)。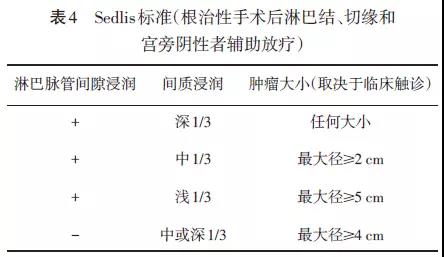 “高危因素”包括淋巴结阳性、切缘阳性和宫旁浸润。具备任何一个“高危因素”均推荐术后补充盆腔外照射+顺铂同期化疗(证据等级1级)±阴道近距离放疗。阴道切缘阳性及阳性切缘小于5mm者,阴道近距离放疗可以增加疗效。
“高危因素”包括淋巴结阳性、切缘阳性和宫旁浸润。具备任何一个“高危因素”均推荐术后补充盆腔外照射+顺铂同期化疗(证据等级1级)±阴道近距离放疗。阴道切缘阳性及阳性切缘小于5mm者,阴道近距离放疗可以增加疗效。
腹主动脉旁淋巴结阳性者处理如上“手术分期”。
意外发现的宫颈癌
意外发现的宫颈癌是指单纯筋膜外子宫切除术后意外发现的浸润性宫颈癌。ⅠA1期无淋巴脉管间隙浸润者,可随访观察;ⅠA1期伴淋巴脉管间隙浸润或ⅠA2、ⅠB1期或切缘阳性或有病灶残留者建议完善病史、体格检查、血常规(含血小板)和肝肾功能检测及影像学检查。(1)切缘及影像学检查均阴性者,可选择放疗或手术。行盆腔外照射+含顺铂同期化疗±个体化近距离放疗。对于全子宫切除病理如无Sedlis标准所述危险因素者可行宫旁广泛性切除加阴道上段切除+盆腔淋巴结切除术±腹主动脉旁淋巴结取样。术后淋巴结阴性且无残余病灶者可以观察;术后淋巴结或切缘或宫旁阳性者建议盆腔外照射±含顺铂的同期化疗。(2)存在残留病灶、影像学检查阳性、或宫旁阳性和(或)切缘阳性或肿瘤特征符合Sedlis标准中危因素者,淋巴结阴性建议行同期放化疗±阴道近距离放疗;淋巴结阳性可考虑切除淋巴结后再行同期放化疗。阴道切缘阳性者,建议行个体化近距离放疗。
妊娠合并宫颈癌
宫颈癌是合并妊娠女性中最常见的妇科恶性肿瘤,大多数为Ⅰ期患者。选择延迟治疗直至胎儿成熟还是立即接受治疗是患者和医生必须做出的困难选择。推迟治疗直至胎儿成熟的患者应该接受剖宫产,并可在剖宫产的同时行广泛性子宫切除术和盆腔淋巴结切除术。经阴道广泛性宫颈切除术已在部分早期宫颈癌患者中成功实施。对选择放疗的患者,传统的放疗±化疗也许需要做适当调整。
随访
建议治疗后2年内每3~6个月随访1次,第3~5年每6~12个月1次,5年后每年1次。高危患者应缩短随访间隔(如第1~2年每3个月1次),低危患者可以延长(如6个月1次)。至少每年进行1次宫颈(保留生育功能)或阴道细胞学检查。随访时需进行仔细的临床评估,教育患者了解复发的早期症状,如阴道排液、体重减轻、厌食,盆腔、髂关节、背部或腿部疼痛等。鼓励患者戒烟或减少吸烟。随访过程中不需常规进行影像学检查,有症状或怀疑复发时可应用。复发病例在治疗前需经病理证实。对于肿瘤未控或复发者,治疗前需行进一步的影像学检查或手术探查来评估病情。
复发性宫颈癌的治疗
局部复发的病例,如果既往没有接受放疗或者复发部位在原来放射野之外,能切除者可以考虑手术切除后继续个体化外照射加或不加同期化疗及阴道近距离放疗。再次复发的患者建议参与临床试验或选择化疗或支持治疗。放疗后中心性复发者可考虑盆腔器官廓清术,加或不加术中放疗(IORT)(证据等级3)。复发病灶直径≤2cm的中心性复发病例,也可以考虑行广泛性子宫切除术或阴道近距离放疗。对于非中心性复发者,可选择个体化外照射±化疗或切除加术中放疗或参加临床试验或全身治疗。远处转移或ⅣB期适合局部治疗者,可选择手术切除±外照射或局部消融±外照射或个体化外照射±全身治疗,或者单纯化疗。不适合局部治疗者建议参与临床试验或化疗或最好的支持治疗。
结语
新版指南更新内容不多,除了对于ⅠA2期宫颈癌不再推荐腹主动脉旁淋巴结取样,腹主动脉旁淋巴结切除一般到肠系膜下动脉水平,如有指征可切除更高部位的淋巴结等几个小的改动外,我们需要重点注意以下3个问题。(1)近年来,随着腹腔镜手术的开展和医生有意无意的片面夸大腹腔镜技术的优势,腹腔镜手术“微创”的概念已深入人心,越来越多的宫颈癌患者接受了腹腔镜广泛性子宫切除术。2018年3月在美国召开的SGO会议上一项局部晚期宫颈癌(LACC)研究报告给如火如荼的腹腔镜手术“泼了一盆冷水”。该项长达8年的前瞻性多中心随机对照研究显示,早期宫颈癌患者经腹腔镜手术的复发率和病死率均高于开腹手术,生存结局较开腹手术差。新版NCCN指南因此提出“有必要将不同手术方法的风险和益处明确告知患者”。我们既不能无视该项研究,也不能因为一项研究而全盘否定腹腔镜。至少需引起我们的警醒,始终把患者生命放在第一位,寻找可能的原因,积极改进操作方法,克服腹腔镜技术短板,确实降低复发率和病死率。(2)宫颈癌的新辅助化疗在国内备受推崇甚至被滥用。一项发表于今年的RCT研究比较了局部晚期宫颈癌新辅助化疗后手术和直接同期放化疗的效果,发现新辅助化疗加手术的5年无病生存率(DFS)比直接同期放化疗差。更早的GOG141研究比较了ⅠB期宫颈癌术前加与不加化疗的效果,发现加化疗没有益处。迄今为止,NCCN指南仍然不推荐新辅助化疗用于局部晚期宫颈癌的治疗。(3)肿瘤靶向治疗是当前肿瘤治疗的热点。肿瘤免疫治疗PD-1和PD-L1抑制剂帕姆单抗已在2017年5月被美国FDA批准可用于任何成人和儿童不可切除或转移的MSI-H/dMMR实体肿瘤的一线治疗。NCCN指南也推荐帕姆单抗可用于PD-L1阳性或MSI-H/dMMR复发转移宫颈癌患者的二线治疗,为这些患者的治疗带来了新希望。(参考文献略)













 苏公网安备32059002004080号
苏公网安备32059002004080号


