如今NGS在肿瘤患者的研究与临床应用愈发广泛,包括血液检测的NGS分析,对于血液检测无创,便捷,可重复检测及实时检测大大提升其便利性。我们甚至可以看到ctDNA在肿瘤疾病管理的各个阶段都开始介入疾病管理的探索,比如疾病诊断,检测原发灶,监测治疗反应,监测克隆变化,进行测序分析并指导临床用药等。
文章共分为三部分:
不同检测平台检测出不同结果数据细读;
ASCO联合CAP发布对ctDNA平台的建议;
从公司到监管机构,NGS规范化之路。
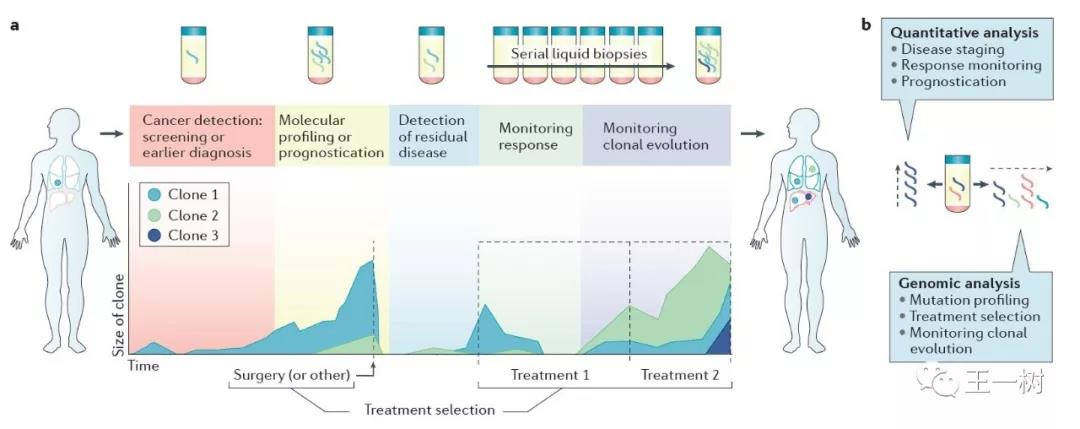
 但是也有一些有经验的医生反映,同样一个患者的标本,送往不同公司出来结果却截然相反,动摇了临床指导的信心。血液检测是否能够指导临床实践?不同的血液检测平台之间的结果一致性如何?血液检测与组织检测之间的一致性又如何?俩家国际知名检测公司的结果不一致,这已经不是第一次,就几家知名公司来比对我们就看到:
但是也有一些有经验的医生反映,同样一个患者的标本,送往不同公司出来结果却截然相反,动摇了临床指导的信心。血液检测是否能够指导临床实践?不同的血液检测平台之间的结果一致性如何?血液检测与组织检测之间的一致性又如何?俩家国际知名检测公司的结果不一致,这已经不是第一次,就几家知名公司来比对我们就看到:
血检Vs血检
Guardant 360 Vs PlasmsSELECT
2017年12月发表在JAMA Oncology上的,Guardant 360(GuardantHealth,Inc)和PlasmsSELECT(PersonalGenome Diagnostics,Inc)比对,共40例胰腺癌患者的cfDNA检测。
结果显示:25名患者(62.5%)检测出了基因变化,3名(7.5%)结果完全一致,6名(15%)结果部分一直,16名(40%)结果完全不一致。另有15名患者未检测出任何改变。这可以说是相当低的一致性了。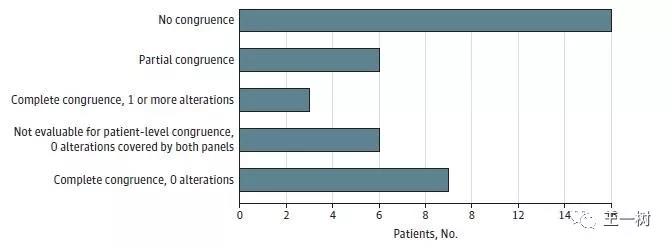
血检Vs组织
Guardant 360 Vs FoundationOne
2017年7月发表在JAMA Oncology上的,FoundationOne(Foundation Medicine)进行组织标本检测和Guardant 360进行血液标本检测(GuardantHealth,Inc)比对,共9名患者,包括了乳腺癌,肺癌,胰腺癌等不同瘤种。
结果显示:1名患者未检测出突变,其余8名患者共检出45中基因变化,仅10个基因(22%)的检测结果完全一致,其中2名患者的检测结果完全不一致。在报告上根据基因变化共推荐了36种药物,仅9种药物(25%)被两种平台同事推荐,其中5名患者的药物推荐完全不同。这对临床的影响可不小。
血检Vs组织
Guardant 360 Vs FoundationOne
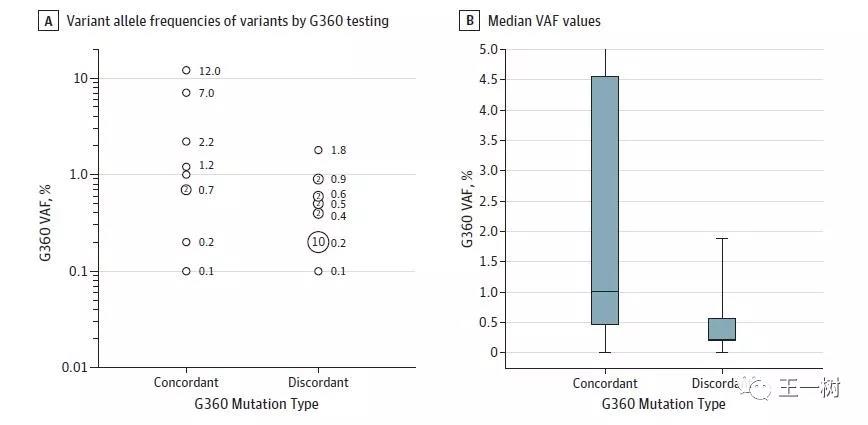
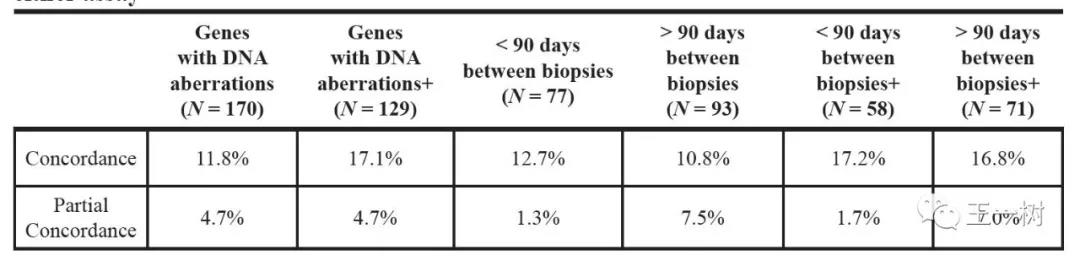
2016年8月发表在Oncotarget上的,FoundationOne(Foundation Medicine)和Guardant 360(GuardantHealth,Inc)比对,针对28名实体瘤患者分别进行组织和cfDNA的检测。
结果显示:突变数目的总体一致率高达91.9-93.9%,但两个平台检测的一致性结果仅11.8–17.1%。
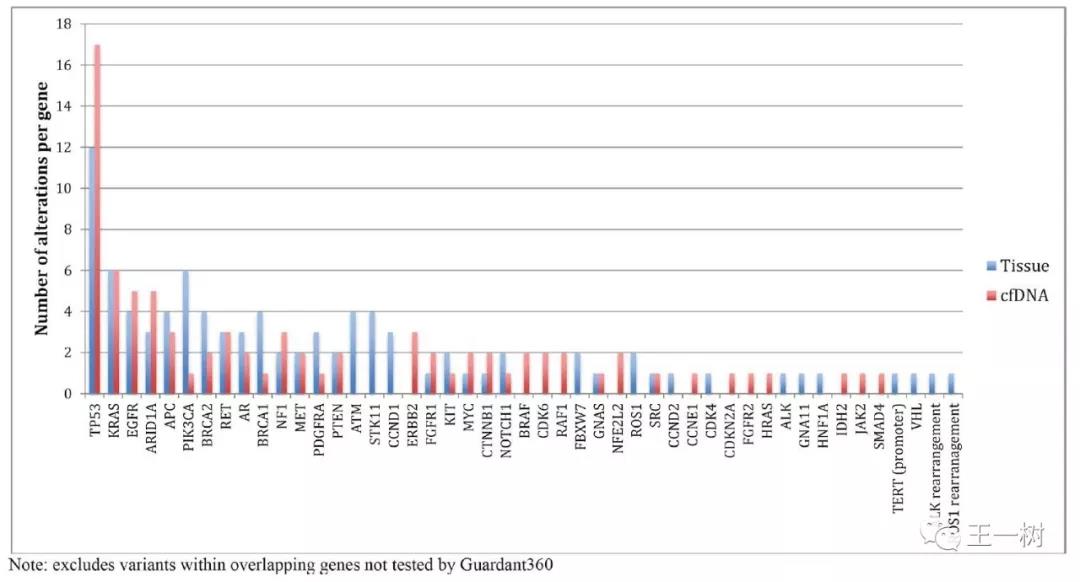
平台比较
三个平台的实验室均有CLIA和CAP认证,均声称具有高的敏感度和特异度。其中:
FoundationOne(组织检测):共检测315个基因的全外显子和28个基因的内含子,特异度大于99%,敏感度略低于特异度。
Guardant 360(血液检测):共检测73个基因,包括19个基因全外显子,54个基因的关键外显子及扩增(18个基因),融合(6个基因),插入缺失(23个基因)。敏感度85%,特异度超过99%;
PlasmsSELECT(血液检测):共检测64个基因,报告突变和缺失的敏感度达99.4%,特异度超过99.9%。
突变丰度报告Guardant 360最低0.1%等位基因突变而PlasmsSELECT最低0.5%等位基因突变。
结果分析
1. 尽管样本量很小,还是看得出通过了CLIA和CAP认证的两家实验室的血液检测结果一致性很低,尽量量价都宣称具有较高的敏感度和特异度。数据无法显示哪个平台的检测结果更准确,但可以看得出患者选择了不同平台进行检测,最后可能会导致接受截然不同的治疗选择,这将导致影响了患者的临床获益。
2. 研究结果也看到了组织检测与血液检测结果的差异性也很大。导致结果不同的原因可能包括:肿瘤标本异质性,不同平台操作流程的差异,对于基因突变检测种类不同(例如FoundationOne可以检测出更多突变类型),对于最低丰度检测值不同(例如相比FoundationOne,Guardant 360可以检测更低频的突变。),空间和时间因素,治疗间隔差异,亚克隆,和潜在的生殖细胞DNA污染。
3. 这些结果需要大样本前瞻性的研究来对不同的平台进行基因检测结果一致性评估的重要性,最终可能作出治疗决定之间的决策依据。

现在ctDNA基因检测平台在临床的应用越来越多,ASCO和美国病理协会联合做了Review,名为<ASCO-CAP Joint Review on ctDNA Analysis in Patients With Cancer>,借以观察ctDNA临床应用现状并探索未来可能的方向。
该Review一共选择了截至2017年3月20日的针对实体瘤共77篇文献,来评估ctDNA目前在肿瘤领域的应用以为未来研究和指南实践提供依据。观察分析前准备,分析有效性,解读与报告,临床实用性几个方面。
1. 标本制备:ctDNA检测最好是进行血清,并且6小时内使用EDTA管收集;
2. 进展期肿瘤:一些ctDNA的平台显示出了在特定癌症进展期肿瘤中的临床有效性;
3. 血检对比组织检测:证据显示出血检和组织标本检测的不一致性,并证实应有组织标本检测来确定血检未知的结果;
4. 早期肿瘤:没有证据显示出ctDNA在早期肿瘤、治疗检测、原发部位探查的有效性;
5. 肿瘤筛查:没有证据显示ctDNA在肿瘤筛查有效;
6. 再次Review:随着研究速度的加快,可能需要再次的文献Review评估,用来指导工具的制作和临床指南的撰写。
汇总:
分析前标本
1. 血浆是理想的进行ctDNA检测的标本;
2. 使用细胞稳定管或EDTA抗凝管,但EDTA管需要在收集的6小时内尽可能地进行处理。白细胞稳定管允许长达48小时从收集到处理。
3. 需要进一步研究来分析影响DNA分析的可能标量,例如包括标本采集与处理,储存条件和时间,以及与病人相关的生物学因素。
分析验证
1. ctDNA平台需明确分析的有效性,尤其是变化丰度接近下线的报告。且有效性验证最好包含标本制备标准化以进行不同公司平台的比较。
2. 不同公司间平台不同可能导致检测结果不同,例如检测的突变丰度下限。
3. 需要更多研究来进行不同公司间平台比较,平台准确性,及检测机制的提升。
报告解读
1. 已被证实整合临床信息的重要性,以及通过ctDNA检测从肿瘤分析的有效信息,并选择合适的治疗;
2. 血浆中cfDNA中所含ctDNA的比例在不同患者中有很大差异,且ctDNA对预后和治疗影响需进一步研究;
3. 当发现造血细胞ctDNA突变的潜在可能是需要进行警示,且需要更多研究来解释和报告出现的变异;
4. 无论体细胞突变与否,报告都应体现ctDNA检测可能存在和肿瘤组织检测的潜在不一致。
临床应用
1. 除了已经得到监管部门批准的检测方法外,大多数检测没有足够的证据来证实临床有效性,且没有临床实用性的证据。需要设计良好的临床试验或等效研究来证明大多数检测的临床实用性。
2. 有证据显示了ctDNA检测与组织检测结果的不一致性,并支持进行组织检测来进行未知ctDNA结果的鉴定;
3. 在进展期肿瘤的证据更多证实了ctDNA平台对疾病进展的提示有帮助,但对治疗响应的提示有限;
4. 当相关基因变化在组织检测中已关联到相关治疗时,经验证的ctDNA平台检测结果可能支持到靶向治疗的选择;
5. 对于以下方面的临床应用上缺乏证据,包括:疗效检测, 早期肿瘤诊断,治疗评估,肿瘤筛查等。
ctDNA对比组织标本检测
进展期肿瘤ctDNA结果与组织标本检测结果比对
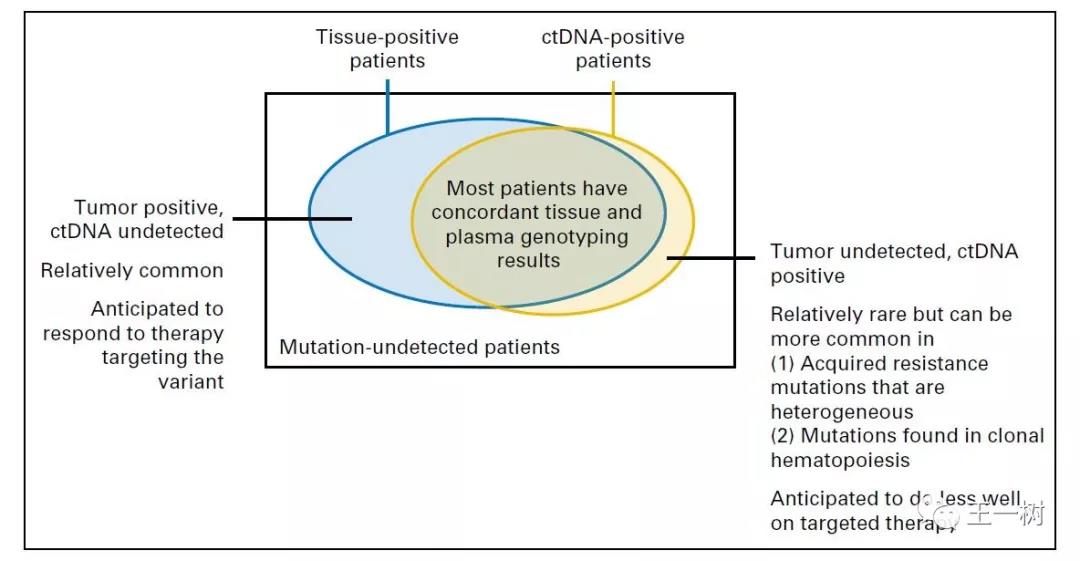
1. 重叠部分代表血液检测与组织检测结果一致;
2. 组织标本阳性而血液检测阴性的不一致的多为肿瘤细胞未脱落至血液的较少导致了血液检测敏感度较低,这类组织检测阳性而血液检测阴性的患者往往对相应的靶向治疗有相应;
3. 血液检测阳性而组织检测阴性的不一致多为时间异质性(组织标本异质性)或空间异质性(亚克隆突变),或分析出现了错误(组织标本假阴性或ctDNA检测假阳性),造血细胞克隆的不确定性可能导致了两者突变的不一致。

NGS及ctDNA的检测未来可能会在肿瘤治疗方面扮演着重要的作用,但现在还需要更多证据支持临床应用及治疗决策。另外NGS平台包括ctDNA的规范化、验证性也是需要解决的。
迄今为止,已经有不少厂家的平台进行了分析性验证研究,并发表于高分期刊,例如:
FoundationOne /FoundationACT
Foundation Medicine家实体瘤针对组织标本进行DNA的检测及针对血液标本检测ctDNA两大平台FoundationOne和FoundationACT均进行了验证性研究并发表在2013年的Nature Biotech杂志和2016年的ESMO大会,研究对其四种突变进行了多重有效性验证。
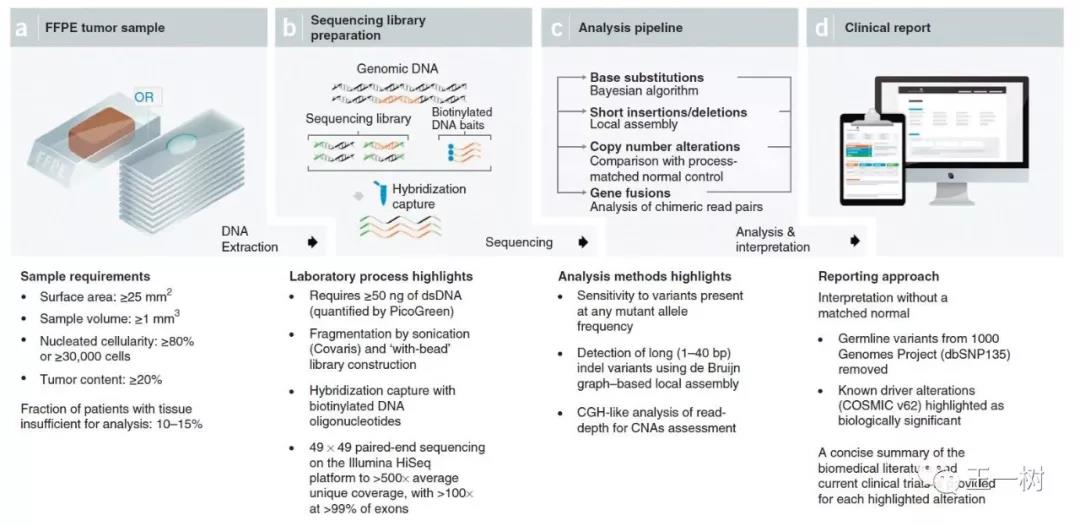
Guardant360
G360是Guardant Health公司一款全球知名的血液检测平台,在2015年其验证性结果就发表于PlosOne杂志,对1000例标本进行分析,认证其有效性及特异性。
Analytical
在上个月Analytical也刚刚发表了其ctDNA平台的验证性研究在PlosOne杂志,
 并且在去年12月一个里程碑的事件,FDA宣布批准了Foundation Medicine的FoundationOneCDx( F1CDx)做为实体瘤伴随诊断,这是一款二代测序(NGS)的体外诊断(IVD)平台,可以针对所有实体瘤进行检测,观察324个基因的突变及2个基因标签的特征。同时,美国CMS通过对其进行医保覆盖。
并且在去年12月一个里程碑的事件,FDA宣布批准了Foundation Medicine的FoundationOneCDx( F1CDx)做为实体瘤伴随诊断,这是一款二代测序(NGS)的体外诊断(IVD)平台,可以针对所有实体瘤进行检测,观察324个基因的突变及2个基因标签的特征。同时,美国CMS通过对其进行医保覆盖。
血液检测与组织检测:
1. 血液检测什么时候用?组织标本检测是金标准,对于无法组织取材的可以考虑使用血液检测;进行实时监测尤其是肿瘤进展监测;
2. 无论是组织还是血液,都需要进行验证性研究,甚至进行FDA/CFDA申报的准备,产品为王,且官方认证的的才是靠谱的。
医生在选择NGS平台的时候也可以参考以上原则。
行业举措
在去年5月,美国分子病理协会(AMP, Associationof Molecular Pathology)和美国病理学家协会(CAP, College ofAmerican Pathologists)联合发表了<Guidelines forValidation of Next-Generation Sequencing-Based Oncology Panels>,认为NGS现在在临床实验室的应用进行了快速发展,旨在对NGS测试开发,优化、验证和持续监测进行规范化,以免对患者造成伤害。
去年12月,FDA颁发了两个新草案《在分子低频突变的疾病中发展靶向治疗》(Developing Targeted Therapies in Low-Frequency Molecular Subsets ofa Disease)及《药物治疗研究中IVD的应用》(InvestigationIVD Used in Clinical Investigations of Therapeutic Products),针对分子检测指导个体化治疗和在临床研究中IVD检测分子变化。这无疑可以关联到前日F1CDx获批了伴随诊断,新技术的发展推动了新政策,FDA的快速反应,也无疑为肿瘤精准治疗的下一步推进指明新方向。
就在刚刚,今年4月13日,FDA颁布了一项新草案,名为《肿瘤试验中体外诊断的研究:为研究风险提供指导的简易流程》(InvestigationalIn Vitro Diagnostics in Oncology Trials: Streamlined Submission Process forStudy Risk Determination Guidance for Industry)。旨在完善一个自发的流程化的提交流程,确定IVD在临床研究药物开发中是否有风险,并可能需要提交器械临床研究豁免来确认无重大风险。
FDA这几年也前前后后和NGS公司进行了无数次Workshop,包括公司、专家、政府等多方对话,这才促进了Foundation Medicine产品的获批及FDA诸多法规的颁布,这是偶然的一天,这是必然的一步,相信后续还有更多相关的规范性办法会陆续出台。
而国内NGS企业如何呢?中国政府如今的执行力和效率让大家频频称赞,这一块早晚要进行的,目前遗传办的规定又不能标本外送,绝对是国内公司的极大机会,提升产品质量,联合政府进行规范化进程,最后才能达到企业政府及医患多方获益。
Jonathan C. M. Wan, Charles Massie, et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. NATURE REVIEWS | CANCER. doi:10.1038/nrc.2017.7
Gonzalo Torga, MD,Kenneth J. Pienta, MD. Patient-Paired Sample Congruence Between 2 Commercial Liquid Biopsy Tests. JAMA Oncology. doi:10.1001/jamaoncol.2017.4027
Nicole M. Kuderer,MD, Kimberly A. Burton, PhD. Comparison of 2 Commercially Available Next-Generation Sequencing Platforms in Oncology. doi:10.1001/jamaoncol.2016.4983
Young Kwang Chae, Andrew A. Davis. et al. Concordance between genomic alterations assessed by next-generation sequencing in tumor tissue or circulating cell-free DNA. Oncotarget, Vol. 7, No. 40
Jason D. Merker, Geoffrey R. Oxnard, et al: Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review. JCO. 2017.76.8671
Philip J. Stephens, et al. Analytic Validation of a Clinical Circulating Tumor DNA Assay for Patients with Solid Tumors. 2016 ESMO
Frampton GM, et al. development and validation of a clinical cancer genomic profiling tests on massively parallel DNA sequencing. Nat Biotechnol. 2013 Nov;31(11):1023-31. doi: 10.1038/nbt.2696. Epub 2013 Oct 20.
Richard B. Lanman1, Stefanie A. Mortimer. Et al. Analytical and Clinical Validation of a Digital Sequencing Panel for Quantitative, Highly Accurate Evaluation of Cell-Free Circulating Tumor DNA. PLoS ONE 10(10): e0140712.
Vincent Plagnol,, Samuel Woodhouse. et al. Analytical validation of a next generation sequencing liquid biopsy assay for high sensitivity broad molecular profiling. . PLoSONE 13(3): e0193802.
FDA announces approval, CMS proposes coverage of first breakthrough-designated test to detect extensive number of cancer biomarkers
J Mol Diagn ,Guidelines for Validation of Next-Generation Sequencing-Based Oncology Panels, 2017, 19: 341e365;http://dx.doi.org/10.1016/j.jmoldx.2017.01.011
https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM588884.pdf
https://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/UCM589083.pdf
https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM604441.pdf











 苏公网安备32059002004080号
苏公网安备32059002004080号


