2013年,癌症的免疫治疗获得了Science杂志的年度最重要科学突破的榜首,治疗的标靶是身体的免疫系统而不是直接针对肿瘤,利用T细胞和其他免疫细胞来对抗肿瘤,其中最重要的就是程序性死亡因子1抗体(anti-PD1)及其他免疫检查点抗体以及嵌合抗原受体T细胞疗法(CAR-T疗法)。
PD-1是表达在T细胞表面的另一种重要的免疫抑制跨膜蛋白,为CD28超家族成员,其最初是从凋亡的小鼠T细胞杂交瘤2B4.11克隆出来。PD-1有两个配体,PD-L1和PD-L2。PD-L1比PD-L2表达更为广谱,主要在造血和非造血细胞(包括上皮细胞、血管上皮细胞、基质细胞等)中,由促炎症细胞因子诱导表达。在肿瘤的微环境中,肿瘤细胞能够表达PD-L1或者PD-L2。这两个配体与PD-1的结合会导致PD-1的胞内结构域的酪氨酸磷酸化,并招募酪氨酸磷酸酶SHP-2,从而减少TCR信号通路的磷酸化,降低了TCR通路下游的激活信号以及T细胞的激活和细胞因子的生成。因此PD-1通路的抑制会加速和加强自身免疫[1]。
肿瘤的发生、发展过程十分复杂,其中 T 细胞在机体抗肿瘤的过程中承载着至关重要的作用,肿瘤细胞表达的PD-L1 与 T 细胞表面的免疫卡控点 PD-1 结合后能通过对其的抑制性作用,而促进肿瘤的免疫逃逸。由此可见 PD-1 及PD-L1 已经成为了主要的研究对象,目前通过阻断二者见的相互作用来提高免疫应答,从而更有效的治疗多种人类恶性肿瘤[1]。
现在,多种方面已经证实了 PD-1在淋巴组织恶性增生性疾病中的重要性, PD-1 在成人 T 淋巴细胞白血病中高表达。 PD-1在正常人、 HTLV1 携带者及 ATLL 患者中存在显著差异。正常对照组中细胞毒性 T 细胞表达 PD-1 要低得多。这些发现表明 PD-1/PDL-1 在 HTLV1 持续感染及 ATLL 在宿主免疫逃逸方面的重要性。Krishnan 等[2]的研究发现 PD-1 在血管免疫母细胞淋巴瘤、 外周 T 细胞淋巴瘤非特殊型和 ALK 阴性的间变大细胞淋巴瘤组织中均明显高表达。在 B 细胞非霍奇金淋巴瘤中, PD-1 主要表达在小淋巴细胞性淋巴瘤、慢性淋巴细胞性白血病细胞和 III 级滤泡性淋巴瘤。在某些情况下,在弥漫性大 B 细胞淋巴瘤表达。没有证据显示在套细胞淋巴瘤和边缘区淋巴瘤表达 PD-1。Yamamoto 等[3]研究发现, 在霍奇金淋巴瘤中 H /RS 细胞 PD-L1 表达阳性, 而肿瘤浸润 T 细胞和外周 T 细胞高表达PD-1。抑制 PD-1 信号途径可使 HL 浸润的 T 细胞恢复产生 IFN-γ。 HL 患者细胞免疫的降低可以用 PD-L1 信号途径引起的" T 细胞耗竭"来解释(图1)。
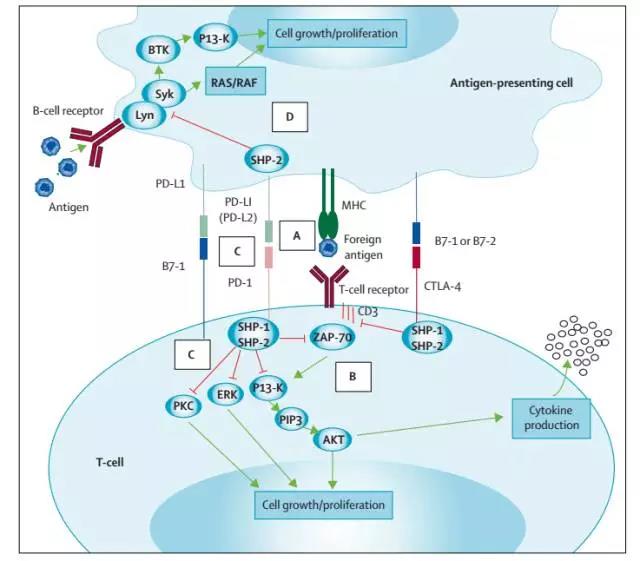
图1
截止目前,FDA已经批准了6个免疫检查点抑制剂,分别为:Ipilimumab(依匹木单抗,BMS公司,抗CTLA-4),Nivolumab(纳武单抗,BMS公司,抗PD-1),Pembrolizumab(派姆单抗,默沙东公司,抗PD-1),Atezolizumab(PD-L1单抗,罗氏公司),Duvalumab(PD-L1单抗,阿斯利康),Avelumab(PD-L1单抗,辉瑞+默克)。这些免疫检查点抑制剂目前已经在多个实体瘤中取得了非常理想的效果,而在恶性淋巴瘤中,也渐渐开始崭露头角。
霍奇金淋巴瘤
一项Ⅱ期临床研究用Nivolumab治疗BV(Brentuximab vedotin)和ASCT失败后复发或进展的患者,结果显示其ORR为66%,9%患者达到CR,58%患者达到PR,6个月的PFS率为77%[4]。因此在2016年,美国FDA批准了该药用于经BV和ASCT治疗后复发进展的患者。
Pembrolizumab在HL患者中的治疗主要有KEYNOTE-013和Keynote-087研究:KEYNOTE-013研究中Pembrolizumab治疗曾用过SGN35和造血干细胞移植失败的HL患者,截止2016年9月,ORR为65%,CR15%。Keynote-087研究中Pembrolizumab ,200 mg, Q3W ,治疗复发难治的HL患者,共3组,ORR 69%, CR 22.4%[5]。基于两项研究成果,Pembrolizumab分别于2017年3月被美国FDA及2017年5月被欧盟委员会批准用于复发难治HL的患者。
非霍奇金淋巴瘤
Nivolumab(BMS-936558)在复发或难治性淋巴恶性肿瘤患者中的I期研究的初步结果也已经公布[6],该实验入组了多种复发难治性淋巴系统恶性肿瘤,包括B细胞非霍奇金淋巴瘤,T细胞非霍奇金淋巴瘤,慢性粒细胞白血病,经典霍奇金淋巴瘤及多发性骨髓瘤。使用剂量递增设计(1 mg / kg和3 mg / kg)治疗患者,每两周一次。结果显示B-NHL患者的ORR和CR分别为28%和7%,其中弥漫性大B细胞淋巴瘤患者的ORR为36%,40例%滤泡淋巴瘤患者(FL)。在T-NHL患者中,ORR为17%(无CR),其中5例外周T细胞淋巴瘤患者的ORR为40%。 MM没有观察到客观反应(见图2)。关于PD-L1的表达分析与临床结果的相关性的研究还在进行中。
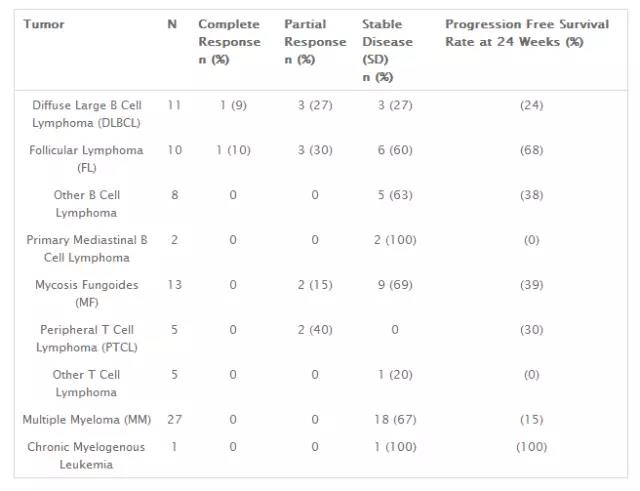
图2
另外,2017年发表在Blood的一项研究结果显示[7], 7例男性高度复发难治NK/TCL患者,既往接受过1-5周期化疗方案失败,其中2例Allo-SCT复发,给予pembrolizumab 2mg/kg,3周重复,5例CR,2例PR,取得了非常理想的效果。
目前的挑战及未来展望
1安全性管理
免疫治疗致命的毒性反应比较少见(心脏毒性,肺毒性,致盲等),但3-4级的不良反应发生率为12%-14%[8],尽管免疫治疗的不良反应总体比化疗药物小很多,但是需要注意的是免疫性疾病的发生。特别是对于既往有肝炎,自身免疫疾病,特别是炎症性肠道疾病的患者,选择免疫治疗时一定要慎重。
2一线使用还是二线
一种观点:应该一线治疗使用,免疫系统未被抑制,可以更好的激活,获得更好的疗效。
另外一种观点:应该在二线治疗使用,随着化疗药物可以导致肿瘤大大缩小,并且伴随着更多抗原的释放以及肿瘤耐药后获得更多突变产生新异抗原,能更多的激活免疫系统。
目前,免疫抑制剂更多的被批准用于恶性肿瘤的二线以上治疗及多线治疗,不过在NSCLC中,免疫抑制剂不仅是晚期NSCLC的标准二线治疗,同时也是PD-L1强阳性患者的标准一线治疗,目前多项III期免疫抑制剂一线治疗NSCLC的相关临床试验正在进行,如 MYSTIC 研究、NEPTUNE 研究和 CheckMate 227 研究。在今年的5月23日,美国FDA宣布:加速批准Pembrolizumab用于确定有高度微卫星不稳定性(MSI-H)或错配修复基因缺陷(dMMR)的成人和儿童晚期或转移性实体肿瘤患者,被认为是免疫治疗里程碑式的事件。虽然在淋巴瘤患者中,免疫抑制剂更多的应用在复发难治的患者的二线以上治疗及多线治疗中,不过从免疫治疗在实体肿瘤的发展来看,未来免疫抑制剂应用在淋巴瘤的一线治疗中是完全值得期待的,但还需进一步研究。
3疗效评估
因为肿瘤免疫治疗的延迟效应,目前免疫治疗的疗效评价均采用新的免疫治疗疗效评价标准(immune-related response criteria irRC)。但是对于淋巴瘤患者来说,PET-CT仍然是目前判断疗效的标准,但是因为PD-1/PD-L1免疫治疗的起始是有道免疫细胞的归巢,浸润肿瘤,然后发挥杀伤作用,这也就意味着免疫治疗的疗效开始时间会比较慢,存在迟发缓解的情况,因此使用PET-CT评价疗效容易出现假阳性。对此,加入了“Indeterminateresponse(IR)”即“不确定的反应”的概念(图3),IR患者需要进一步活检或影像学检查以确认是否PD,虽然Lugano目前已经对该标准进行细化,但仍然是暂时的,需要进一步验证。目前,多项临床试都将这个评估标准作为次要研究终点,随着数据的积累以验证这一评估标准是否有效[9]。

图3
4联合化疗及其他靶向药物等
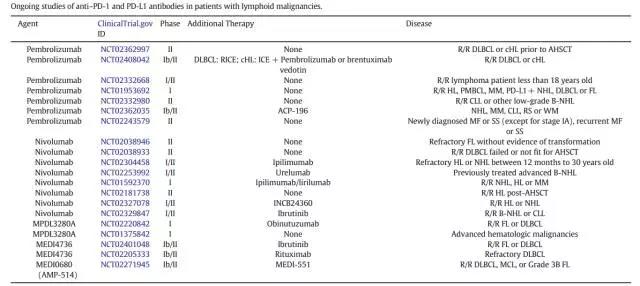
目前,已经开展了多项PD-1/PD-L1用于恶性淋巴瘤的临床研究[1](见图4),其中包括了双重免疫检查点抑制剂Nivolumab和Ipilimumab用于复发难治NHL、HL或多发性骨髓瘤的临床试验(NCT02304458,NCT01592370)。Sagiv-Barfi等人在对Ibrutinib单药治疗不敏感的淋巴瘤小鼠模型中使用抗PD-L1和Ibrutinib,获得了显着的治疗果后[10],免疫检查点抑制剂Nivolumab联合BTK抑制剂Ibrutinib治疗复发难治B-NHL及CLL的临床试验(NCT02401048,NCT02329847,NCT02362035)也在招募中。
5联合 CAR-T治疗
有学者报道,在一例CAR-T治疗失败的复发难治DLBCL患者应用PD-1抑制剂Pembrolizumab取得了较好的疗效,说明PD-1抑制剂对CAR-T治疗失败的DLBCL有效[11]。虽然是个例,但是仍然提示PD-1通路可能在CAR-T免疫治疗中起关键作用,仍需进一步探索。
小结
PD-1/PD-L1抑制剂目前在复发难治的恶性淋巴瘤中取得了卓越的成就,随着各项临床试验结果的不断更新,期待会取得更好的结果。
目前PD-1/PD-L1抑制剂仍是对抗恶性淋巴瘤的新兴力量,对其不良反应、临床疗效、使用时机、联合其他治疗等,仍然是我们在未来需要进行观察及探索的方向。
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!
1.Xia Y, Jeffrey M L, Young K H. Signaling pathwayand dysregulation of PD1 and its ligands in lymphoid malignancies.[J].Biochimica et biophysica acta, 2015, 1865(1):58-71.
2.Krishnan C, Warnke R A, Arber D A, et al. PD-1 expression inT-cell lymphomas and reactive lymphoid entities: potential overlap in stainingpatterns between lymphoma and viral lymphadenitis[J]. American Journal ofSurgical Pathology, 2010, 34(2):178.
3.Yamamoto R,Nishikori M, Kitawaki T, et al. PD-1-PD-1 ligand interaction contributes toimmunosuppressive microenvironment of Hodgkin lymphoma[J]. Blood, 2008,111(6):3220-4.
4. Younes A, Santoro A, Shipp M, et al. Nivolumab for classical Hodgkin's lymphoma after failure ofboth autologous stem-cell transplantation and brentuximab vedotin: a multicentre,multicohort, single-arm phase 2 trial[J]. Lancet Oncology, 2016, 17(9):1283.
5. Armand P, Shipp M A, Ribrag V, et al.Programmed Death-1 Blockade With Pembrolizumab in Patients With ClassicalHodgkin Lymphoma After Brentuximab Vedotin Failure.[J]. Journal of ClinicalOncology Official Journal of the American Society of Clinical Oncology, 2016,46(1):28-33.
6. Lesokhin A M, Ansell S M, Armand P, et al.Preliminary Results of a Phase I Study of Nivolumab (BMS-936558) in Patientswith Relapsed or Refractory Lymphoid Malignancies[J]. Blood, 2014, 124:291-291.
7. Kwong Y L, Chan T S, Tan D, et al. PD1blockade with pembrolizumab is highly effective in relapsed or refractoryNK/T-cell lymphoma failing L-asparaginase.[J]. Blood,2017:blood-2016-12-756841.
8. Hawkes E A, Grigg A, Chong G. Programmedcell death-1 inhibition in lymphoma[J]. Lancet Oncology, 2015, 16(5):e234.
9. Cheson B D, Ansell S, Schwartz L, et al.Refinement of the Lugano classification response criteria for lymphoma in theera of immunomodulatory therapy.[J]. Blood, 2016, 128(21):2489.
10. I. Sagiv-Barfi, H.E. Kohrt, D.K. Czerwinski, P.P. Ng,B.Y. Chang, R. Levy, Therapeuticantitumor immunity by checkpoint blockadeis enhanced by ibrutinib, an inhibitorof both BTK and ITK, Proc. Natl. Acad. Sci.U. S. A. 112 (2015) E966–E972.
11.Chong E A,Melenhorst J J, Lacey S F, et al. PD-1 Blockade Modulates Chimeric AntigenReceptor (CAR) Modified T Cells and Induces Tumor Regression: Refueling theCAR[J]. 2016:blood-2016-09-738245.















 苏公网安备32059002004080号
苏公网安备32059002004080号


