免疫检查点抑制剂(ICIs)是一类新型、广谱抗肿瘤药物,显著改善了肿瘤患者的生存,但同时也可能造成全身多个器官、组织损伤,部分严重免疫检查点抑制剂相关不良反应(irAEs)甚至危及生命,已成为全球肿瘤领域关注的焦点。东部战区总医院肿瘤科是国内最早一批应用ICIs的医学中心,并率先成立了irAEs多学科专家团队(MDT),在irAEs管理方面积累了非常丰富的经验。为系统性分享诊治经验,专家组特在肿瘤资讯平台开设专栏,其核心特色在于:1. 全程追踪疑难案例 专栏深度展示具有代表性的疑难病例从诊断、治疗到随访的完整过程,传递不同系统irAEs的精准诊治思路与前沿进展;2. 汇聚多学科智慧 真实记录MDT讨论精华,融合肿瘤、心脏、肝脏、呼吸、消化、内分泌、皮肤、影像、病理等多学科视角,分享跨学科的理论知识、指南共识与实战经验;3. 系统连载即时更新 病例采取定期连载形式发布,确保内容的时效性、系统性与持续的高品质输出。本专栏力求为同行提供实用参考,然学海无涯,文中疏漏之处在所难免,恳请各位同道不吝批评指正,共同推动irAEs管理水平的提升。
参加人员:东部战区总医院免疫相关不良反应多学科专家组
病例介绍
梅魁敏(主管医生):汇报患者的病情经过。
患者男性,56岁,有慢性乙型肝炎病史,无慢性肠道疾病病史。患者2023年9月12日在外院行肝脏Ⅴ段切除术,术后病理诊断为肝细胞癌,术后于2023年10月17日、2024年2月5日分别行TACE治疗,2023年10月至2024年3月接受仑伐替尼(12mg 1/日)术后辅助治疗。2024年3月19日因肝脏肿瘤复发行切除术,2024年3月24日至2024年4月4日口服多纳非尼(0.2g 2/日),后自行停服。2024年5月13日患者经肝脏MRI检查发现肝内多发转移灶,2024年5月28日接受TACE治疗1次,2024年5月30日开始接受PD-1抑制剂(200mg 静滴 d1,Q3W)治疗2周期,2024年6月5日开始口服阿帕替尼(250mg 1/日)。
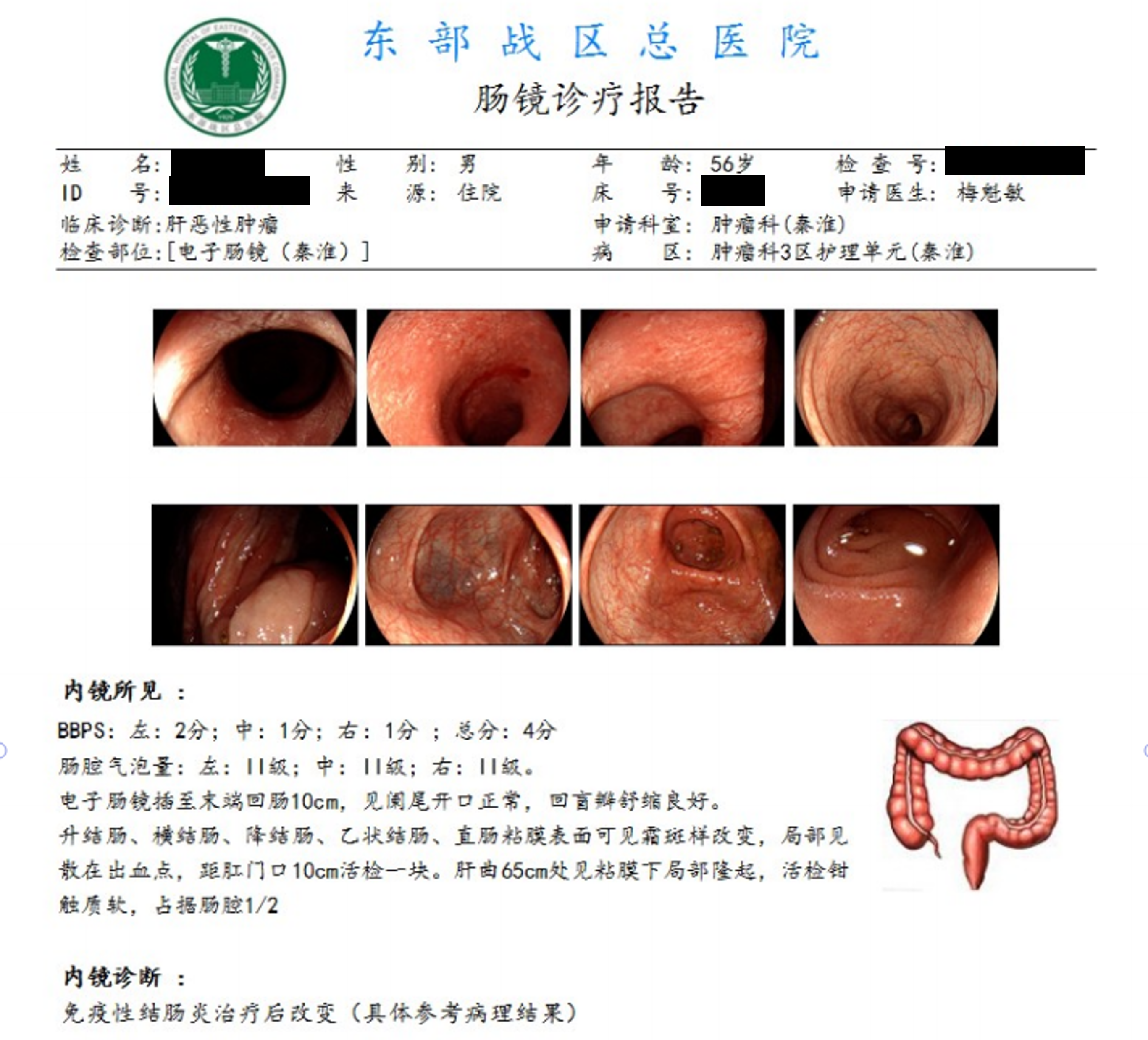
2024年7月5日出现1级腹泻,2024年7月8日停服阿帕替尼,并口服蒙脱石散剂、双歧杆菌三联活菌胶囊。治疗无效,腹泻加重,每天约8~10次,2024年7月10日收入当地医院,加强止泻治疗(洛派丁胺胶囊、盐酸小檗碱片),同时予禁食及补液治疗,腹泻仍无改善。2024年7月14日患者腹泻加重,每天10余次,伴间歇下腹部绞痛,伴暗红色血便。2024年7月16日行电子肠镜检查示:直肠及全结肠各段黏膜散在充血肿胀局部糜烂,活检组织病理示:重度粘膜急慢性炎伴隐窝脓肿形成(见图1),诊断为免疫性肠炎。2024年7月17日起接受甲泼尼龙治疗(1.3-1.7mg/kg/d 静滴),2024年7月18日联合生长抑素(1.2g 持续静脉泵入)治疗,腹泻无改善。
2024年7月19日患者转至我院肿瘤科,将甲泼尼龙剂量升至2.0mg/kg/d,并联合英夫利西单抗(5mg/kg)治疗,同时予生长抑制素抑制消化液分泌,蛇毒血凝酶止血,丙氨酰谷氨酰胺促进肠粘膜修复,艾司奥美拉唑预防应激性胃溃疡,活性炭片吸附肠内毒素。上述处理后第2日患者腹泻改善至1级,第3日腹痛与血便消失。
2024年7月22日至2024年7月26日逐步减少甲泼尼龙剂量(1.3mg/kg/d至0.67mg/kg/d)。2024年7月27日患者腹泻再次加重,每日4~6次,伴便血,且血压下降(86/56 mmHg),将甲泼尼龙剂量增至1.3mg/kg/d,加用灌肠液(含布地奈德,美沙拉嗪,云南白药粉)灌肠,加强补液扩容治疗。2024年8月2日患者接受第2次英夫利西单抗治疗,次日腹泻与便血明显减少。2024年8月7日腹泻每天1~3次,血便消失,下调甲泼尼龙剂量至0.67mg/kg/d。2024年8月13日患者腹泻缓解,恢复正常饮食,停用甲泼尼龙,予泼尼松片(15mg PO 3/日)治疗,后逐渐降量,维持8周,腹泻未再出现。
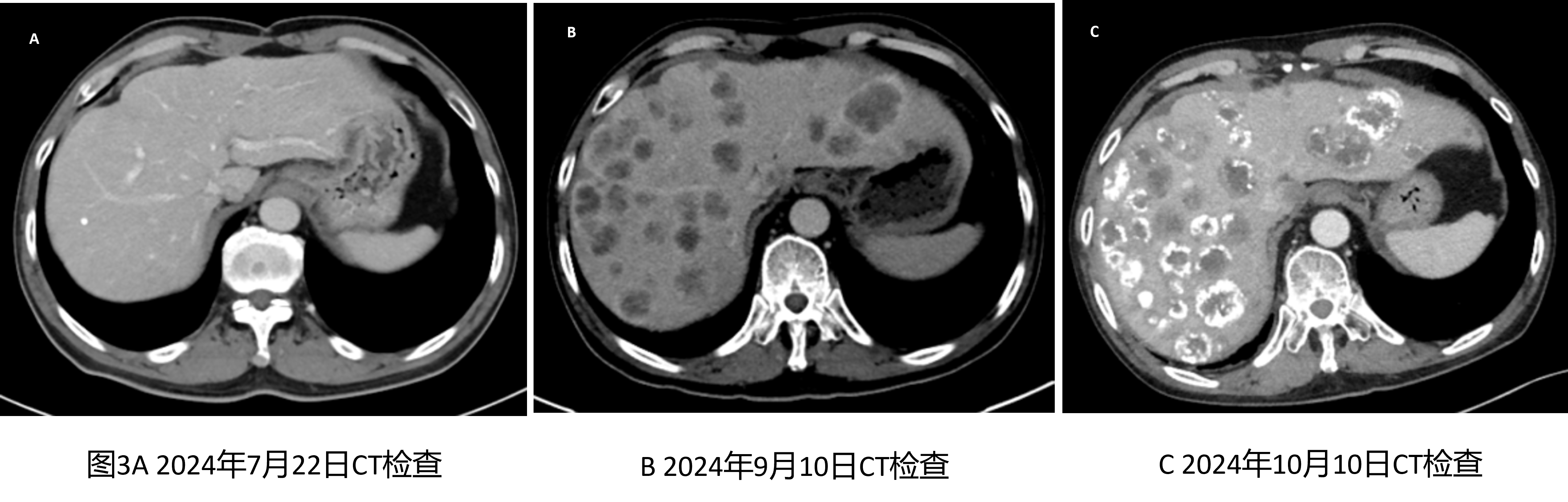
2024年9月10日患者行腹部增强CT检查示:结肠壁水肿较前明显改善;复查肠镜见肠黏膜炎症改善(见图2),但肝内转移灶较前(2024年7月22日图3A)显著进展(见图3B)。2024年9月13日、2024年10月11日患者先后接受TACE治疗2次(经肝动脉共灌注奥沙利铂200mg,5-FU2.0g,碘化油35ml)。治疗后患者复查CT提示肝内多数转移灶内碘油沉积良好(见图3C)。2024年9月24恢复阿帕替尼(250mg PO 1/日)治疗,治疗后未再出现腹泻。患者于2024年12月14日死亡,死亡原因:败血症、肿瘤进展、肝功能衰竭。
辅助检查
2024年7月22日查HBV-DNA载量:61.4IU/ml(正常范围<30IU/ml),AFP 5.58(正常范围0-10µg/L)。
2024年9月10日查HBV-DNA载量:62400IU/ml,AFP 108.7µg/L。
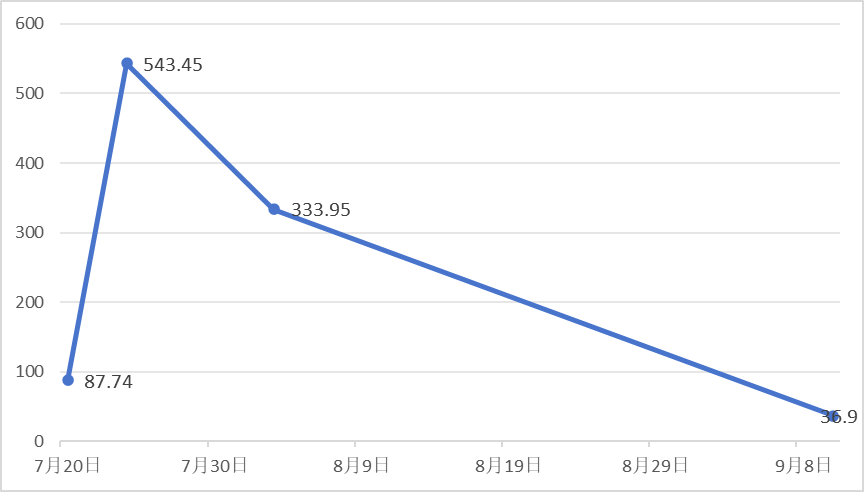
2024年7月至9月粪钙卫蛋白变化见表1。
MDT会诊内容
王锋(肿瘤科):今天我们讨论一位重症免疫检查点抑制剂(ICIs)相关肠炎(简称免疫性肠炎)病例,这位患者因“肝细胞癌”曾在外院行肝脏肿瘤切除术,术后半年出现肝内肿瘤复发,再次行肿瘤切除术,二次肝切除术后2个月出现肝内多发转移,行TACE联合PD-1抑制剂、靶向药物治疗,出现严重腹泻,经肠镜组织病理活检证实为免疫性肠炎,在当地医院予常规止泻、抗感染、激素、补液等治疗无效,后转至我院,经综合治疗,腹泻渐消失。关于这个病例,我们主要围绕以下3个问题进行讨论:1.患者诊断免疫性肠炎的证据是否充足?2.患者治疗免疫性肠炎过程中有什么不足之处?3.患者免疫性肠炎得到有效控制后,抗肿瘤治疗是否合理?
王锋(肿瘤科):魏主任好,近年来,ICIs在肿瘤患者中应用日益广泛,免疫相关不良反应也引起高度重视,但免疫性肠炎似乎在临床上并不多见,重症肠炎更为少见,其真实的发生率占多少?
魏娟(消化科):免疫性肠炎其实并不少见,文献报道,ICIs导致的结肠炎发生率为8%~27%,CTLA-4抑制剂导致的胃肠道毒性发生风险远高于PD-1/PD-L1抑制剂,最高达54%。
王锋(肿瘤科):发生率这么高有点超出想象啊!免疫性肠炎的危害相比免疫性肺炎、免疫性肝炎,是不是轻一点?
魏娟(消化科):国外文献报告,致死人数最多是免疫性肠炎,高于免疫性肺炎、免疫性肝炎。
王锋(肿瘤科):但是,中国医生感觉免疫性肠炎的发生率并没有那么高,死亡人数就更少了,因免疫不良反应致死人数排在首位的应该是免疫性肺炎吧?
魏娟(消化科):是的,因为中国医生应用最多的ICIs药物是PD-1/PD-L1抑制剂,而在国外,CTLA-4抑制剂是最早上市的ICIs药物,应用较为广泛。CTLA-4抑制剂的多数不良反应明显高于PD-1/PD-L1抑制剂,如肠炎、心肌炎、肝炎等。由于CTLA-4抑制剂联合PD-1/PD-L1抑制剂的疗效和生存期明显优于PD-1/PD-L1抑制剂单药,在国外已批准用于多种实体瘤如黑色素瘤、非小细胞肺癌、肝细胞癌等,所以双免联合治疗的应用比例较高。然而,这种联合方式引起的免疫相关不良反应较PD-1/PD-L1抑制剂单药发生得更早、更多、更严重。由于CTLA-4抑制剂于2021年才在中国获批上市,且价格较昂贵,临床应用较少。此外,PD-1/PD-L1抑制剂引起的免疫性肠炎多为1-2级,经过常规止泻、补液等非激素治疗后可以好转,所以中国医生感觉免疫性肠炎发生率不高,致死人数也少。
王锋(肿瘤科):为什么CTLA-4抑制剂的多数不良反应均高于PD-1/PD-L1抑制剂?
魏娟(消化科):2013年,有学者提出“肿瘤免疫循环”理论,分为7个步骤:1.肿瘤细胞死亡后释放肿瘤抗原;2.APCs提呈肿瘤抗原至细胞表面;3.APCs启动并激活T细胞;4.T细胞游走至肿瘤部位;5.T细胞浸润至肿瘤内部;6.T细胞识别肿瘤细胞;7.T细胞杀伤肿瘤细胞。CTLA-4抑制剂主要作用于肿瘤免疫循环的第3步骤,通过阻断T细胞活化抑制信号,增强免疫应答,但会广泛激活免疫系统,导致更多脱靶效应;而PD-1/PD-L1抑制剂作用于第7个步骤,主要增强肿瘤免疫识别能力,对正常组织的影响相对较小。因此,CTLA-4抑制剂绝大多数不良反应高于PD-1/PD-L1抑制剂,尤其在免疫性肠炎方面更为多见。我们在基础实验中,如果使用PD-1/PD-L1抑制剂作为诱导剂,需要加一些促炎因子,才能模拟出免疫性肠炎的模型。
李祥(药学科):中国近年来上市了PD-1/CTLA-4双抗、PD-1/CTLA-4组合双抗,这2类药物与PD-1/PD-L1抑制剂联合CTLA-4抑制使用,其临床疗效、不良反应如何?
王锋(肿瘤科):目前缺乏将PD-1/CTLA-4双抗、PD-1/CTLA-4组合双抗与PD-1/PD-L1抑制剂联合CTLA-4抑制剂进行对比的高质量临床研究,因此,没有确切的数据。但从临床经验来看,PD-1/CTLA-4双抗、PD-1/CTLA-4组合双抗的疗效似乎略低于常规剂量的PD-1抑制剂(1mg/kg)与CTLA-4抑制剂(3mg/kg)联合使用,但同时PD-1/CTLA-4双抗、PD-1/CTLA-4组合双抗的不良反应似乎也要低一些,这仍需要通过大样本、多中心、随机、对照临床研究证实。
王锋(肿瘤科):免疫性肠炎通常有哪些症状?
魏娟(消化科):主要表现为腹泻,也可能伴有腹痛、大便带血和黏液、恶心、发热等症状。值得注意的是,消化道免疫毒性不仅仅涉及结肠、直肠,也可能累及食管、胃、十二指肠、小肠,造成相关炎症或溃疡,从而引起相关症状。另外,少部分患者还可能同时合并其他免疫毒性,可能出现口腔溃疡、肛门病变(肛瘘、脓肿、肛裂)、关节疼痛、内分泌紊乱、皮肤病变等。
王锋(肿瘤科):需要行哪些特殊检查才能确诊免疫性肠炎?
魏娟(消化科):主要的检查包括肠镜病理组织活检、腹部增强CT,肠镜病理上往往提示急性结肠炎(中性粒细胞和嗜酸性粒细胞浸润),或者弥漫性或局灶性片状隐窝脓肿,也有的表现为慢性炎症性肠病特征,如肉芽肿、基底部浆细胞增多和片状病变(萎缩、扭曲、分枝和发芽)等。一些患者表现为上消化道症状(吞咽困难和上腹痛),内镜下病变(食管溃疡、胃炎和十二指肠炎)。大约有一半的CTLA-4抑制剂介导的小肠结肠炎患者伴有胃部和十二指肠的慢性、轻度片状炎症(隐窝扭曲、局灶性和异质性绒毛缩短、固有层嗜酸性和单核炎症细胞增多)。
王锋(肿瘤科):赵主任好,免疫性肠炎在腹部CT检查方面有什么特异性表现?
赵颖(影像科):腹部CT对肠炎的诊断有重要参考价值,尤其对炎症范围、肠壁增厚程度、周围淋巴结肿大等情况的评估较为直观。肠壁从内向外由黏膜(黏膜上层、黏膜固有层和黏膜肌层)、黏膜下层(疏松结缔组织)、肌层(环行肌和纵行肌)和外膜(浆膜下层和浆膜)构成。典型肠炎在CT增强检查表现为“靶环征(target sign)”或者“箭头征(arrowhead sign )”,显示出明显强化的黏膜固有层→无强化的水肿的黏膜下层→明显强化的浆膜下层(由内至外)。部分轻型肠炎或早期病变可能因CT分辨率限制而漏诊。另外,这种影像学表现不是免疫性肠炎特有的,其他原因引起的肠炎也会有类似表现,需要结合肠镜或粪便检查,排除其他疾病。
王锋(肿瘤科):免疫性肠炎与溃疡性结肠炎有什么鉴别要点?
魏娟(消化科):溃疡性结肠炎是一种自身免疫性肠病,临床表现为脓血便,内镜下表现为血管网消失,黏膜红肿呈颗粒状,黏膜脆性增加,触之易出血,可见浅表溃疡,病变呈连续性分布。病理活检可见中性粒细胞浸润,隐窝可见分支变形成慢性炎症改变,可见隐窝脓肿。溃疡性结肠炎从直肠向近端结肠连续性蔓延,不累及小肠。病变局限于黏膜层和黏膜下层,较少穿透肠壁。因此,其临床症状、内镜表现和组织学分布都和ICIs相关结肠炎非常相似。溃疡性结肠炎是免疫性肠病的典型病种,其发病是易感人群在致敏因素刺激后触发的自身免疫反应如T细胞活化导致肠黏膜损伤。这与肿瘤免疫循环第三步“APCs启动并激活T细胞”的发病机制有重合的部分,那么这两种疾病是否有“同气连枝”的既视感?有研究也表明了从基因易感性方面两种疾病有交叉点。其实在治疗药物方面,水杨酸类药物如美沙拉嗪、激素、生物制剂等对2种疾病均有效。两者鉴别目前主要还是要看发病前的ICIs用药史。
王锋(肿瘤科):免疫性肠炎与克罗恩病有什么鉴别要点?
魏娟(消化科):克罗恩病主要的表现是节段性分布,肠镜下的表现有黏膜呈铺路石样改变,或者是鹅卵石样的改变,多数是裂隙性溃疡,严重时形成肠腔狭窄。组织病理可提示非干酪性肉芽肿。另外,克罗恩病全消化道均可受累,最常见于回肠末端和结肠,病变呈“跳跃式”(正常黏膜与病变区域交替)。而且可以表现为透壁性炎症,累及肠壁全层,容易引发瘘管、脓肿或肠梗阻。有学者在数据库中将克罗恩病的易感基因筛选出来,结果在ICIs相关肠炎患者中无明显交叉。所以,从根本上来说,克罗恩病与ICIs相关肠炎的亲缘关系比溃疡性结肠炎远得多。
王锋(肿瘤科):免疫性肠炎还有哪些鉴别要点?
魏娟(消化科):免疫性肠炎往往与ICIs用药存在时间上的关联性,症状会突然出现。而克罗恩病、溃疡性结肠炎的病情往往有由轻到重逐渐发展的过程,部分患者有家族遗传史。除了克罗恩病、溃疡性结肠炎,还需要与感染性肠炎、不完全性肠梗阻等鉴别。其中,感染性肠炎理论上有病原体的感染,所以粪便镜检和病原体培养很重要,需要行镜检白细胞、虫卵、寄生虫等,粪培养检查目的是排除病毒、艰难梭菌、隐孢子虫和耐药病原体感染。晚期消化道肿瘤患者往往因腹膜转移,伴发不完全性肠梗阻,临床表现为间歇性腹痛、腹泻、便秘交替,腹膜刺激征等,部分重症免疫性肠炎与感染性肠炎、不完全性肠梗阻等并存,增加了鉴别诊断的难度,且预后较差。
王锋(肿瘤科):本例患者发病过程中,粪钙卫蛋白检测值与病情的严重程度有很好的同步性,如何评价粪钙卫蛋白检验对免疫性肠炎的诊断价值?
魏娟(消化科):这要从粪便钙卫蛋白的来源和临床意义说起,粪便中钙卫蛋白主要来源于肠腔中的中性粒细胞,是较为稳定的蛋白,不容易被降解。所以不论是感染、非感染的病因,只要肠道有炎症,都会出现升高。但每种肠炎的cut-off值是不同的。在溃疡性结肠炎的活动度评估中,粪便钙卫蛋白和肠道内镜下炎症表现有密切的相关性,是评估溃疡性结肠炎肠道炎症活动的无创的重要生物标志物。这项指标不仅可以评估肠道疾病活动度,还是监测药物治疗反应和疾病预后的最常用生物标志物。这位患者在诊治过程中,粪钙卫蛋白与病情的严重程度呈现很好的相关性,我们认为粪钙卫蛋白对诊断免疫性肠炎有一定参考价值,但目前尚不作为诊断标准。我们曾会诊一些外院病例,发现不同医疗单位的试剂不同,结果存在差异,检测本身存在一定比例的假阳性或假阴性。
邢继成(检验科):粪钙卫蛋白假阳性主要有饮食因素、药物因素、疾病因素等。例如患者检测前吃了含钙多的食物如牛奶、豆腐等,可能出现粪钙卫蛋白轻度升高,利尿剂、抗胆碱能药物也可能导致粪钙卫蛋白升高,溃疡性结肠炎、肠道肿瘤、肠道菌群失调等也会引起粪钙卫蛋白升高。
王锋(肿瘤科):有哪些高危人群,容易发生免疫性肠炎?
魏娟(消化科):有研究将溃疡性结肠炎的易感基因组(Polygenic risk score,PRSUC)从数据库中筛选出来,PRSUC 可在ICIs相关肠炎队列中进行验证,得出的结论是PRSUC可识别发生ICIs相关肠炎的接受免疫治疗的肿瘤患者,对监测患者和改善患者预后有重要价值。研究显示既往存在炎症性肠病,可能增加接受ICIs治疗的患者发生严重胃肠道不良事件的风险。
王锋(肿瘤科):免疫性肠炎最常发生在ICIs用药后多长时间?
李祥(药学科):免疫性肠炎可以发生在ICIs用药过程的任何时间,甚至治疗结束后数月,PD-1/PD-L1抑制剂的胃肠道毒性的中位发生时间为用药后6~8周,建议用药期间注意监测,停药后仍需要继续随访半年左右。
王锋(肿瘤科):免疫性肠炎如何分级?
魏娟(消化科):根据CSCO免疫检查点抑制剂相关的毒性管理指南划分原则,可分为:G1 无症状;只需临床或诊断性观察(腹泻频率<4次/d)。G2 腹痛;粪便黏液或带血(腹泻频率4~6次/d)。G3 剧烈腹痛;排便习惯改变;需要药物干预治疗;腹膜刺激征(3级腹泻频率≥7次/d)。G4 症状危及生命;需要紧急干预治疗。
梅魁敏(主管医生):不同分级免疫性肠炎如何处理?
魏娟(消化科):患者ICIs用药后出现腹泻症状,可以按常规方法治疗2-3天,如蒙脱水散冲服,适当口服补液,同时告知患者避免高纤维/乳糖饮食,防止加重腹泻。若症状无缓解,及时行肠镜、增强CT检查、粪钙卫蛋白检查。CSCO指南特别指出,G2肠炎可以不等结肠镜检查结果,即可开始激素治疗,一般口服泼尼松1mg/kg/d,如果48~72小时激素治疗无改善或加重,增加剂量至2mg/kg/d,并及时加予其他免疫抑制剂。
梅魁敏(主管医生):这位患者病程中除了免疫性肠炎之外,还出现了肝功能损害、血小板降低、肺炎,是否也考虑免疫不良反应?
王锋(肿瘤科):重症肠炎往往同时或相继出现其他免疫不良反应,常见的包括肝炎、甲状腺炎、皮疹等,血小板降低也有相关报道。肝功能损伤原因较多,临床上需要排除肝脏原发或转移性肿瘤进展、乙肝病毒激活或其他药物引起的肝损伤,在治疗上,免疫性肝炎以常规保肝、利胆为主,部分患者需要联合糖皮质激素。当然,重症肠炎一般也会用到糖皮质激素,对免疫性肝炎也有治疗作用。
谢芳(肝病科):这位患者肝功能损伤首先考虑免疫药物相关毒性,另外,我们也看到,2024年7月22日查HBV-DNA载量:61.4IU/ml(正常范围<30IU/ml)。而2024年9月10日查HBV-DNA载量:62400IU/ml,提示乙肝病毒被激活,通过加强抗乙肝病毒处理(恩替卡韦+替诺福韦)后病毒载量降至正常范围,因此,这位患者不排除合并乙肝病毒激活引起的肝功能损伤,此外,患者同时使用的靶向药物也存在肝毒性的风险,不排除免疫、靶向药物协同作用引起的肝损伤。
梅魁敏(主管医生):重症免疫性肠炎为什么有很高的死亡风险?
王锋(肿瘤科):我们中心曾有2例患者因为重症免疫性肠炎死亡,主要原因在于:1.早期诊断困难,在肠炎的早期阶段临床表现轻微或不典型,往往误认为感染性腹泻、肠痉挛、不完全性肠梗阻等,当明确诊断时,患者相关症状已经非常严重,难以逆转;2.重症肠炎对激素不敏感,容易出现并发症如腹膜炎、感染等,由于摄入不足、大量失液,严重者出现休克,最终造成不良结局;3.重症肠炎往往合并多系统免疫毒性,如肝炎、内分泌毒性等,与多种并发症交织促进,难以把握重点,治疗顾此失彼,最终因多器官功能衰竭死亡。
梅魁敏(主管医生):重症免疫性肠炎使用常规剂量激素效果不好,加大激素剂量能否提高疗效?如何进行二线挽救治疗?
王锋(肿瘤科):治疗重症免疫性肠炎的激素初始最大剂量为2mg/kg/d,如果足量的激素效果不佳,一般不主张将激素加量,而是加用其它免疫抑制剂。糖皮质激素是免疫性肠炎的一线治疗药物,但部分患者在其治疗后无反应或症状加重,一旦发展成重症肠炎,治疗非常棘手。对常规止泻治疗无效,激素治疗3~5天后仍无反应者,建议尽早加用英夫利昔单抗(infliximab)或维多利珠单抗(vedolizumab)。
谢芳(肝病科):TNF-α抑制剂英夫利昔单抗可能明显增加严重细菌感染与HBV再激活风险,而靶向肠道的α4β7整合素抗体维多利珠单抗(vedolizumab)在疗效上与其相似,但全身免疫抑制相关风险却明显减少。因此,对于乙肝相关HCC患者,可优先选择维多利珠单抗作为二线治疗,以减少严重感染或HBV再激活风险。
魏娟(消化科):鉴于前面我们谈到的ICI结肠炎从基因遗传背景机制、临床表现、内镜评估还有组织学方面,均酷似溃疡性结肠炎。ICI结肠炎出现重症活动,激素治疗无效时,我们可以参考急性重症溃疡性结肠炎(ASUC)的治疗方案。ASUC也是炎症风暴导致的内科急症,国内外相关指南将ASUC单独列为一章,如不积极或延迟处理,可能预后极差乃至死亡。ASUC治疗方面,给予相当于40~60mg甲泼尼龙的激素诱导,国内外指南认为如激素超过60mg,不但不能增加疗效,反而会增加感染风险。
激素诱导3~5天后观察,如疗效不佳及时转换生物制剂或钙调磷酸酶抑制剂环孢素诱导缓解,小分子药物如JAK1抑制剂如乌帕替尼也应用于ASUC的挽救性治疗中。总体而言,IL-12/23抑制剂乌司奴单抗是相对于处于安全金字塔尖的药物。小分子药物因其自身的特点,是多种生物制剂的下游信号阻断剂,可能会导致机体感染、其他副作用风险增加,尤其是特殊人群老年人、体质较差的人群如中晚期肿瘤患者。JAK抑制剂托法替布临床应用时会出现“黑框警告”如心血管事件,出现血栓等。JAK1抑制剂乌帕替尼也可能出现带状疱疹、机会感染及严重的贫血等,在合并感染的人群需要谨慎选择。
如内科治疗仍无效,必要时转换手术治疗,施行回肠储袋肛管吻合术(ileal pouch-anal anastomosis,IPAA)。
梅魁敏(主管医生):重症免疫性肠炎的处理,除了激素、生物制剂之外,还有哪些治疗措施?
王锋(肿瘤科):重度免疫性肠炎往往因严重腹泻导致大量液体丢失,可能出现血容量不足,另外,警惕严重感染,毒素释放甚至引起血压降低。所以,对于G3-4级肠炎,除了常规止泻、激素等免疫抑制剂之外,应予以禁食、全肠外营养,大量补液,保证血容量,给予抗生素治疗,防治肠道感染。另外,给予丙氨酰谷氨酰胺促进肠粘膜上皮修复,部分患者可尝试活性炭片减少肠道毒素的吸收。
梅魁敏(主管医生):陈主任好,这位患者在免疫性肠炎的高峰期,曾行肠道局部灌注治疗,这种治疗方法有什么特点?
陈军(普外科):免疫性肠炎主要累及直肠、乙状结肠,重症肠炎往往出现血便,局部灌注药物有利于药物的快速吸收,这位患者的灌肠液含有布地奈德、美沙拉嗪、云南白药粉,起到止泻、消炎、止血的作用,我们在临床上试用过不少严重肠炎的患者,疗效较佳。需要提醒的是,多次腹泻可能造成肛门粘膜的损伤,应注意局部清洁。我们建议一些患者在肛门擦拭干净后,用电吹风热风吹拂数分钟,保持肛门皮肤、粘膜干燥。
梅魁敏(主管医生):这位患者在治疗免疫性肠炎过程中,在短期内出现肝脏肿瘤迅速进展,是否判定为超进展(Hyperprogressive Disease,HPD)?
王锋(肿瘤科):HPD是指接受免疫治疗后肿瘤生长速度加快的现象,判断HPD需要满足以下条件:1.肿瘤进展时间小于2个月;2.肿瘤负荷较基线增长超过50%;3. 肿瘤生长速率增加≥2倍。研究显示,HPD的发生率在肝癌中为12.7%,中位总体生存期(mOS)仅59天。
这位患者在免疫性肠炎治疗早期CT扫描显示肝转移肿瘤负荷低,但在肠炎缓解后4周CT扫描发现肝内肿瘤呈弥漫性分布,两次CT检查时间间隔仅为7周,符合HPD的标准。相关研究显示,糖皮质激素可通过抑制CD8+T细胞、调控DC功能及直接改变肿瘤细胞免疫表型(如PD-L1/MHC-I)显著削弱抗肿瘤免疫。另有研究提示长期或高剂量糖皮质激素的使用可能通过免疫抑制效应削弱ICIs的抗肿瘤作用,从而直接促进肿瘤进展。当然,也不排除肿瘤本身已处于快速进展期,正好与免疫性肠炎治疗时间重合。
梅魁敏(主管医生):中国肝癌患者常常合并慢性乙型肝炎、肝硬化,这类慢性肝病患者的免疫性肠炎有什么特点?
谢芳(肝病科):慢性肝病患者可能因肝脏代谢功能受损影响药物清除,进一步加重免疫相关毒性。“肠-肝轴”在人体生理病理上起重要作用,越来越被大家认可,肝病的患者胆汁酸代谢出现异常,会引起肠道菌群失调及肠黏膜屏障功能受损,导致细菌转位和内毒素释放增加,从而诱发全身炎症反应,这可能与ICIs引发的肠道炎症产生协同效应,加重患者病情。
梅魁敏(主管医生):患者出现肝脏病灶明显进展后,最佳治疗策略是什么?重症免疫性肠炎病情缓解后,能否重启ICIs治疗?
赵颖(放射科):患者9月份复查CT提示肝脏病灶呈弥漫性分布,AFP也明显升高,评估为病情进展,经过1次介入治疗后,大部分肿瘤碘油沉积良好,说明患者肝脏肿瘤血供较丰富,评估为治疗有效,2次介入治疗后,患者因体质较弱,并发感染,没有继续行介入治疗。
王锋(肿瘤科):介入治疗是中期肝细胞癌的首选治疗方案,2025年2项重要III期临床研究EMERALD-1、LEAP012研究获得成功,使TACE联合靶向、免疫方案成为Ⅱ期、Ⅲa期患者的首选方案。但免疫性肠炎是可能致死的不良反应,CSCO指南建议G3级暂停ICIs治疗,G4永久停用ICIs治疗。该患者因为前期出现重症免疫性肠炎,合并多系统免疫毒性,未能重启ICIs类药物。目前肝癌仍缺乏针对驱动基因的靶向药物,已经获批上市的国内外多靶点TKIs疗效欠佳。近年来,个体化新抗原肿瘤疫苗 (PTCV) 、CAR-T 疗法在肝癌上进行小样本早期研究,取得较好疗效,是否在不能耐受免疫不良反应的患者中应用,还需要进一步探索研究。后续该患者口服阿帕替尼治疗,最终因严重感染、肿瘤进展、肝功能衰竭于2024年12月14日死亡。


附“免疫性肠炎顺口溜”
免疫肠炎恶名传,
直乙肠道最受伤。
水泻腹痛血粘便,
钙卫蛋白粪培养。
止泻禁食加补液,
警惕多毒和感染。
重症激素欠敏感,
英夫利西早救场。
注释:
国外文献报道,在免疫检查点抑制剂相关不良反应的死因中,免疫性肠炎位列第一位,其主要原因是CTLA-4抑制剂在国外应用较广泛,而在中国,PD-1/PD-L1抑制剂应用最为广泛,相比CTLA-4抑制剂,PD-1/PD-L1抑制剂引起的免疫性肠炎明显减少,但致死性免疫性肠炎仍时有报道,CTLA-4抑制剂联合PD-1/PD-L1抑制剂治疗免疫性肠炎的发生率更高,应保持高度警惕;免疫性肠炎主要累及直肠、乙状结肠,往往通过肠镜病理组织活检、增强CT检查明确诊断。水样泻、腹痛和血便/粘液血便是常见的临床症状,与溃疡性结肠炎、感染性肠炎、不完全性肠梗阻等疾病难以鉴别,粪钙卫蛋白阳性可协助诊断免疫性肠炎,粪培养检验有助于排除感染性肠炎。
止泻、禁食和补液是处理免疫性肠炎的常用方法,止泻药物有多种类型,根据腹泻的严重程度酌情采取不同强度的止泻药物治疗,中重度肠炎应及时给予禁食、补液、营养支持等治疗措施;值得注意的是,免疫性肠炎往往并存多系统免疫毒性,容易因肠道屏障功能受损而并发肠道感染、腹膜炎等,从而造成不良结局。重度免疫性肠炎往往对激素治疗不敏感,如果3~5天激素治疗无效,应联合使用其他免疫抑制剂,英夫利西单抗可作为挽救治疗的首选,早期使用能够明显改善患者的预后。
本期专家组成员

排版编辑:Hanna











 苏公网安备32059002004080号
苏公网安备32059002004080号


