
Abstract No.504 前瞻性III期临床试验WSG PlanB研究的最终分析: HER2阴性,临床高危,21基因检测中/高危,早期乳腺癌患者不同辅助化疗方案(4xEC→4x doc 对比 6x DC)疗效比较
背景:HER2阴性早期乳腺癌(EBC)的最佳化疗方案,尤其是HR阳性的患者,特别是蒽环类药物对此类患者预后的影响,目前仍然存在争议。回顾性分析提示6周期的CEF方案较6周期CMF更优的结果主要来自HER2阳性的早期乳腺癌。而前瞻性研究结果存在不一致性;对于HR阳性的早期乳腺癌,目前尚无经过验证的预测化疗疗效的分子标志。WSG PlanB研究是第一个仅针对临床高风险或复发评分(RS)高于11的HR阳性HER2阴性亚组(pN0-1)进行随机分组的研究。既往研究已经提示复发分数小于11(pN0-1)的患者仅接受内分泌即可获得极佳预后(5年DFS达到94%)(Gluz et al. ASCO 2016)。
方法:WSG PlanB研究最初研究计划是比较6xTC(Arm A)和蒽环紫衫联用的方案(4xEC→4xDoc)(Arm B)在HER2阴性早期乳腺癌中的非劣效性研究,纳入患者包括临床高危患者pN0(T2-4, G2-3, 年龄小于35岁, 或 高uPA/PAI-1)或pN+。由于所有HR阳性的肿瘤均进行Oncotype DX检测,对于RS≤11的HR阳性,pN0-1的患者不再推荐进行化疗,基于此对研究计划进行了修改。主要观察终点是DFS(包括任何复发,继发肿瘤或死亡)。所有患者完成5年随访后进行不同化疗方案随机分组的最终分析。
结果:WSG PlanB研究从2009年至2011年间共纳入3198例患者(其中3073名患者的肿瘤标本进行了中心病理评估)。其中348例(15.3%)患者(因RS≤11未予化疗)。其他2449名患者随机分入6xTC(Arm A)(n=1222) 和4xEC→4xDoc(Arm B)(n=1227)。经中心病理评估入组患者41%是pN+,42%为G3和18% HR阴性。中位随访61个月后,两组的5年DFS类似,分别为89.9%[88.1%-91.7%] 和90.2%[88.4%-92.0%];5年OS为94.7%[93.4%-96.1%]和94.6%[93.2%-96.0%]。 尽管含蒽环组(4xEC→4xDoc)(397例)出现不良反应的趋势高于不含蒽环6xTC组(358例)的趋势更明显,但两组的5年治疗相关的死亡率分别为0.1%(1例)和0.4%(5例)。虽然复发评分是一个有效的临床预后指标,但是并不能预测蒽环类药物的疗效。在三阴乳腺癌或阳性淋巴结超过4个的亚组分析中,两组疗效无差异。
结论:WSG PlanB试验提示对于早期HER2阴性乳腺癌,不含蒽环的6xTC方案不劣于含蒽环的4xEC→4xDoc方案。即使在高危亚组(三阴乳腺癌、淋巴结阳性或高复发评分)两组之间的疗效差异仍然不明显。蒽环类药物在早期HER2阴性乳腺癌的作用的最终结论仍然需要更多前瞻性研究证实。(NCT01049425)

浙江大学医学院附属邵逸夫医院肿瘤外科 副主任医师
耶鲁大学与浙江大学联合培养肿瘤学博士,耶鲁大学博士后,剑桥大学附属阿登布鲁克医院访问学者,伦敦圣乔治大学附属医院访问学者
临床方面严格按照循证原则,擅长乳腺,甲状腺,胃肠道肿瘤等常见实体瘤的个体化精准治疗。包括乳腺良恶性肿瘤微创活检,保乳根治术,改良根治术,前哨淋巴结活检,各种乳房重建术,以及乳腺癌综合诊治,甲状腺良恶性疾病的微创治疗。基础研究方面主要围绕乳腺癌内分泌耐药机制及逆转策略,乳腺癌癌前病变开展转化医学研究。
浙江省卫生高层次人才培养对象(医坛新秀)( 2020年),浙江大学郑树医学精英奖学金获得者( 2019年),浙江大学医学院附属邵逸夫医院优青培育人才项目( 2018年),首届中国临床肿瘤学会(CSCO)“35 under 35”青年潜力肿瘤医生称号获得者( 2017年)。
主持和主参与国家自然科学基金课题5项,科技部支撑项目1项及浙江省自然基金项目多项。已发表SCI论文30余篇,包括PNAS, Nature Communications, Nucleic Acids Research,Journal of Hematology & Oncology, Oncogene, EMBO Molecular Medicine等国际知名杂志,被他人引用次数超1700次, H-Index 17 。
点评:
WSG PlanB试验主要研究结果回顾:
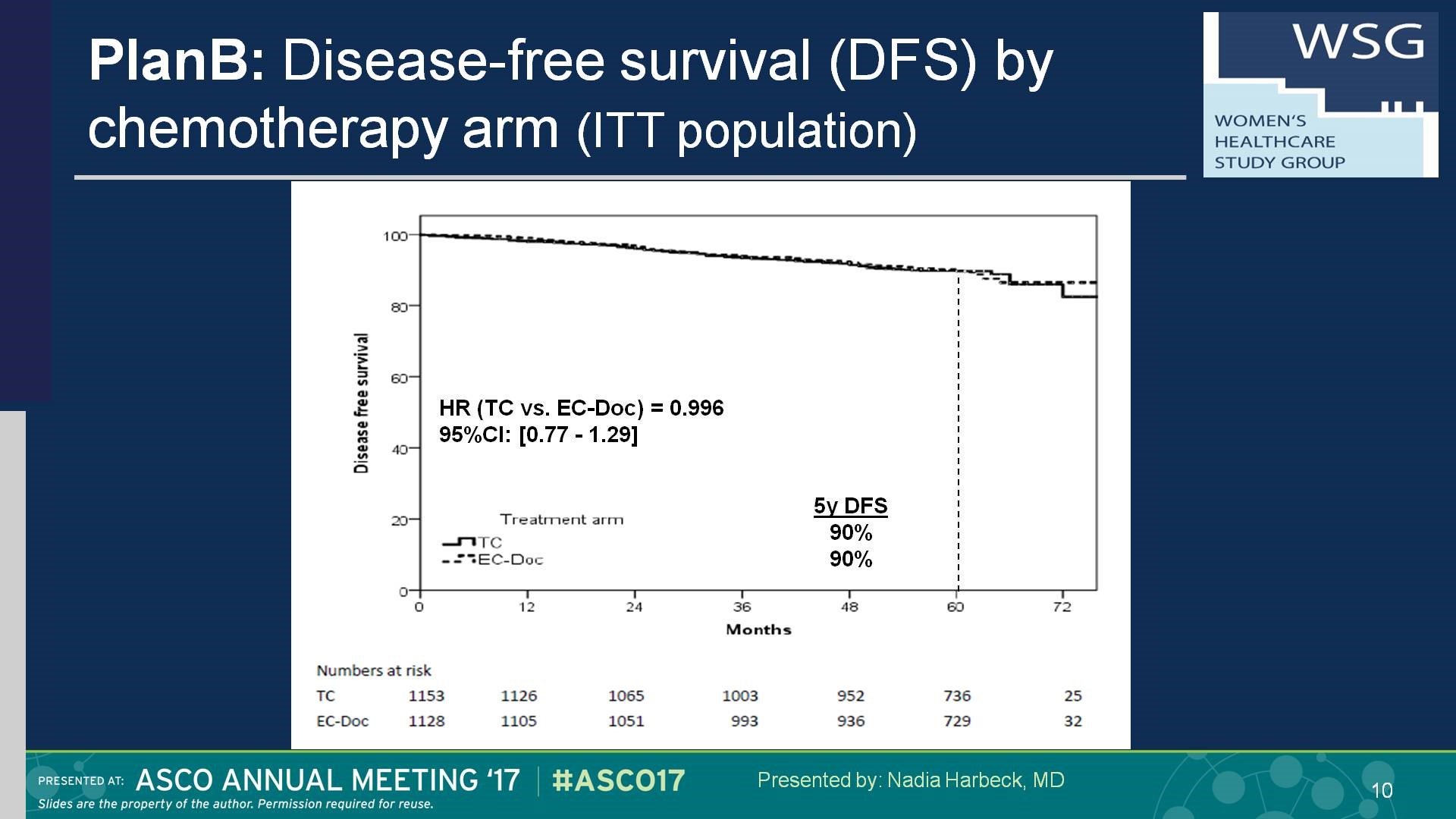
(两组5年DFS均达到90%)
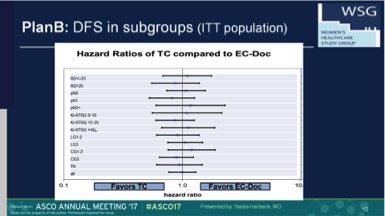 (不同亚组之间含或不含蒽环的方案均无差异)
(不同亚组之间含或不含蒽环的方案均无差异)
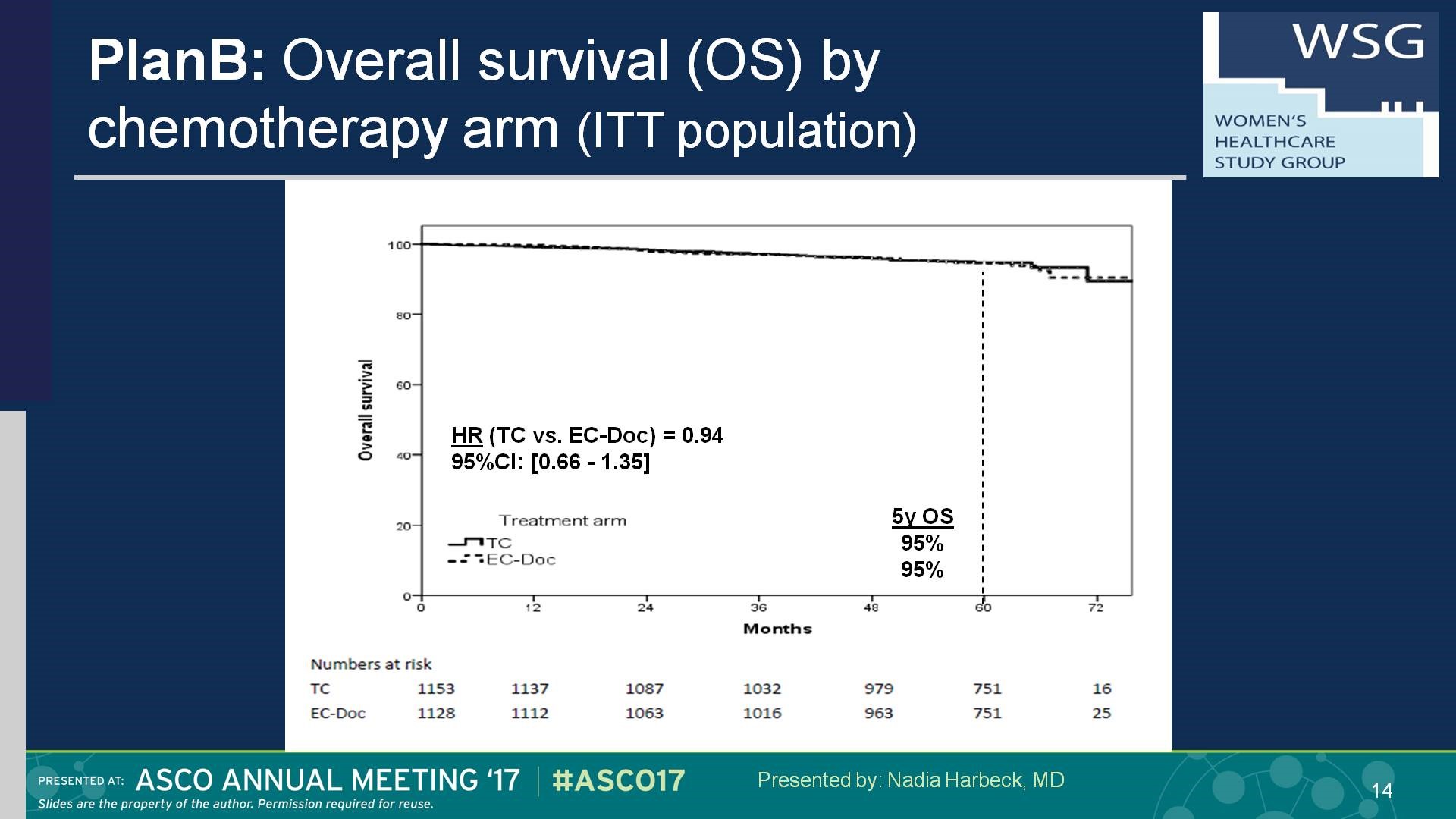
(两组间5年OS均达到95%,无统计学差异)
1.含蒽环类化疗方案在早期乳腺癌中的地位仍存在争议。EBCTCG的荟萃分析[1]显示:紫衫联合蒽环可减少乳腺癌死亡率(RR 0.86);蒽环序贯紫衫化疗方案减少乳腺癌死亡率1/3,基于这些证据,目前NCCN指南仍然将蒽环类药物的化疗方案作为早期乳腺癌治疗基石;但其使用增加心脏死亡事件(RR 1.56)等毒副反应。USOR9735研究[2]表明4周期TC方案OS优于4周期AC方案。ABC研究[3]汇总分析表明A-T方案对比6周期TC方案iDFS延长,中位随访时间3.3年,绝对获益小(4年iDFS仅从88.2%增加至90.7%),并且获益伴随更高的临床风险。

(NCCN2017推荐的浸润性乳腺癌新辅助/辅助化疗方案 )
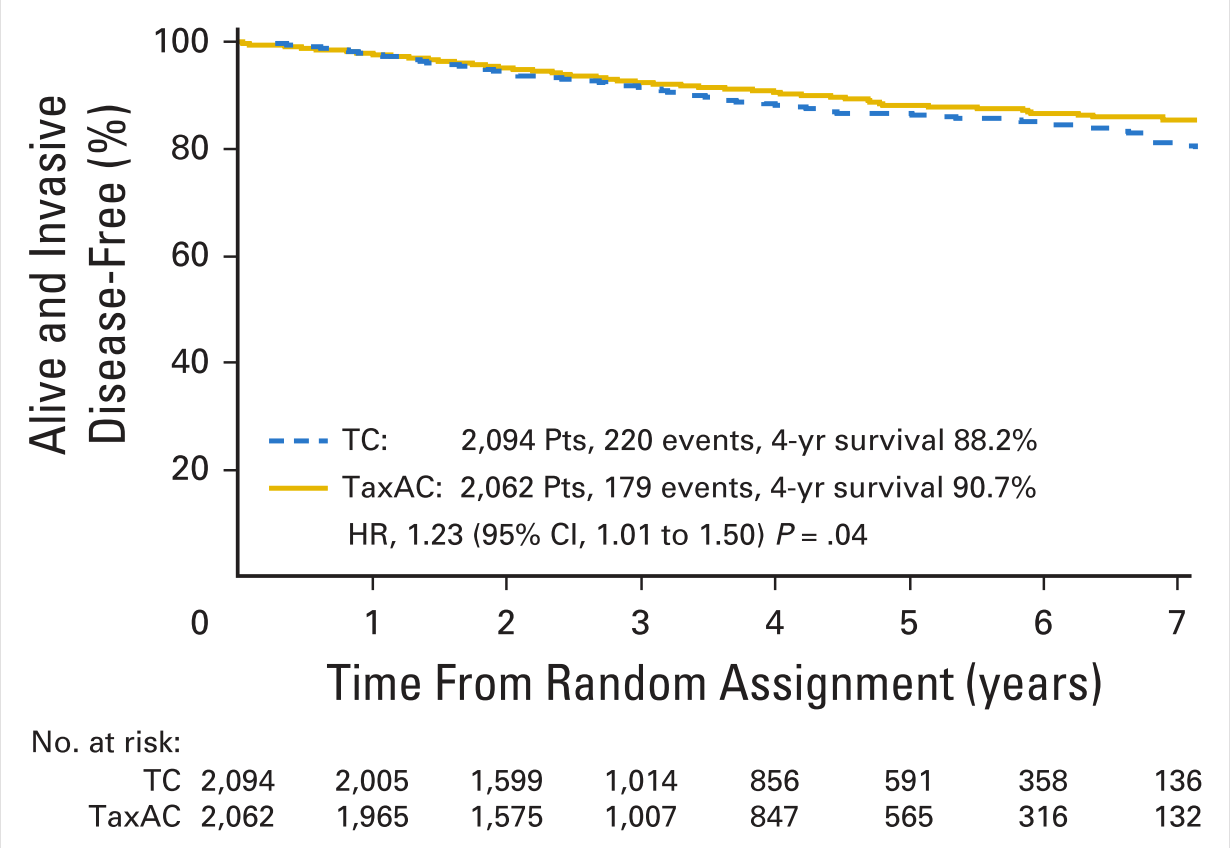
(ABC研究提示含蒽环的TaxAC较TC能提高iDFS)
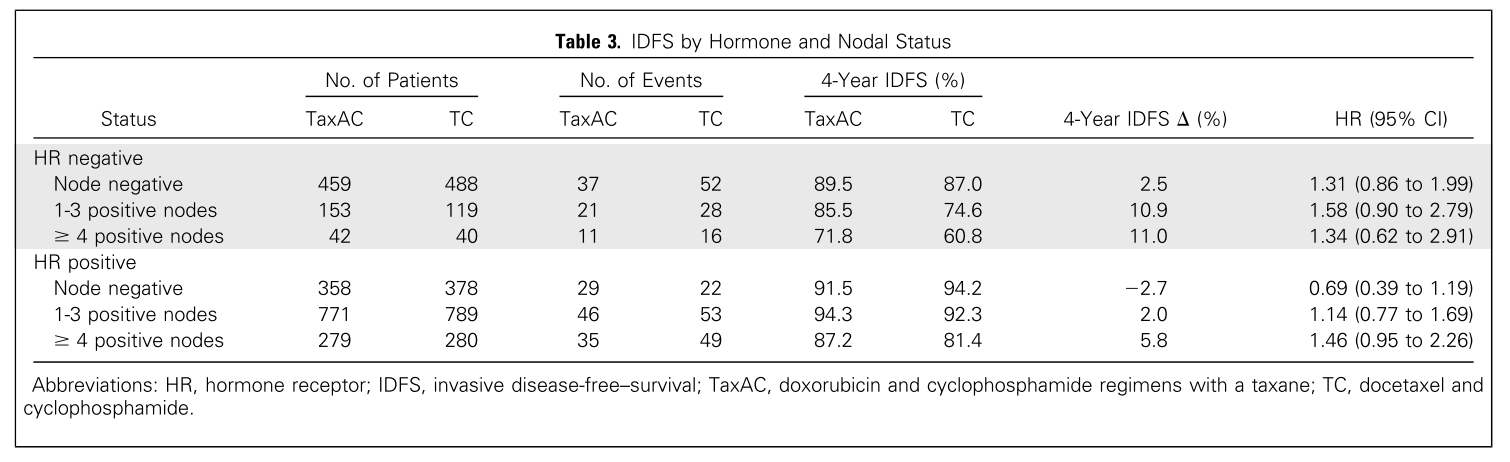
(ABC研究提示临床高风险的乳腺癌患者,如TNBC及淋巴结转移负荷的患者,更能从含蒽环的TaxAC方案中获益)
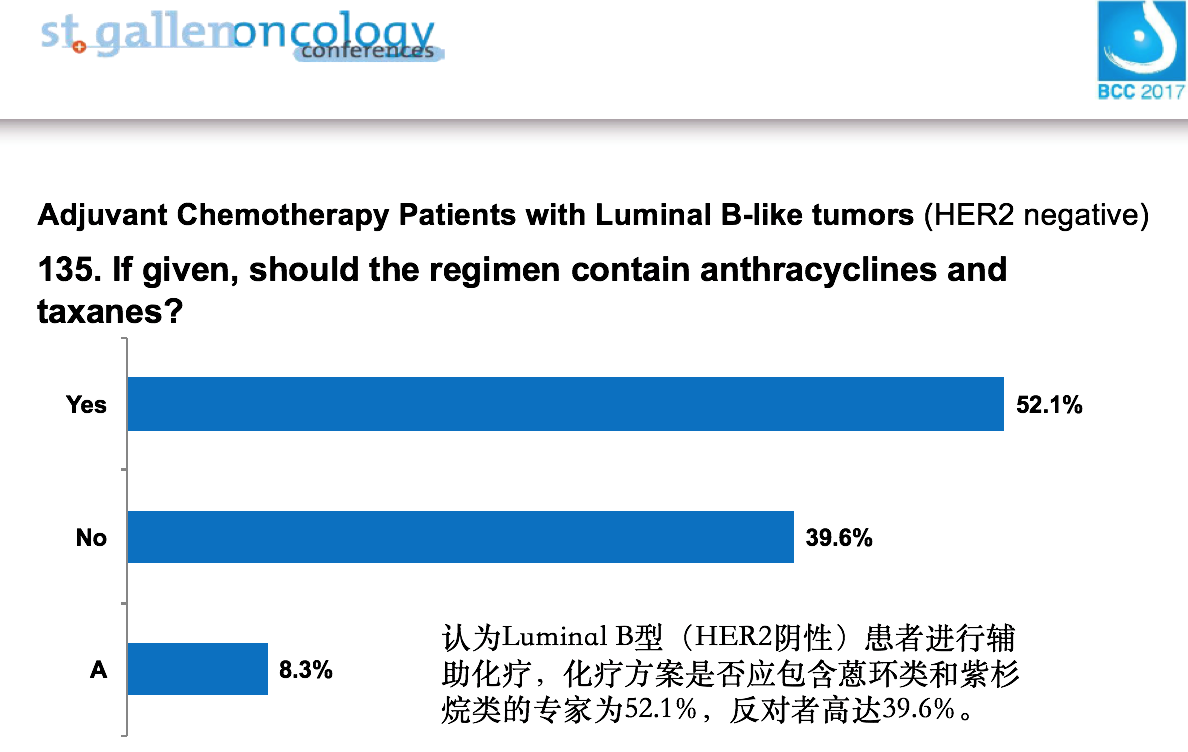
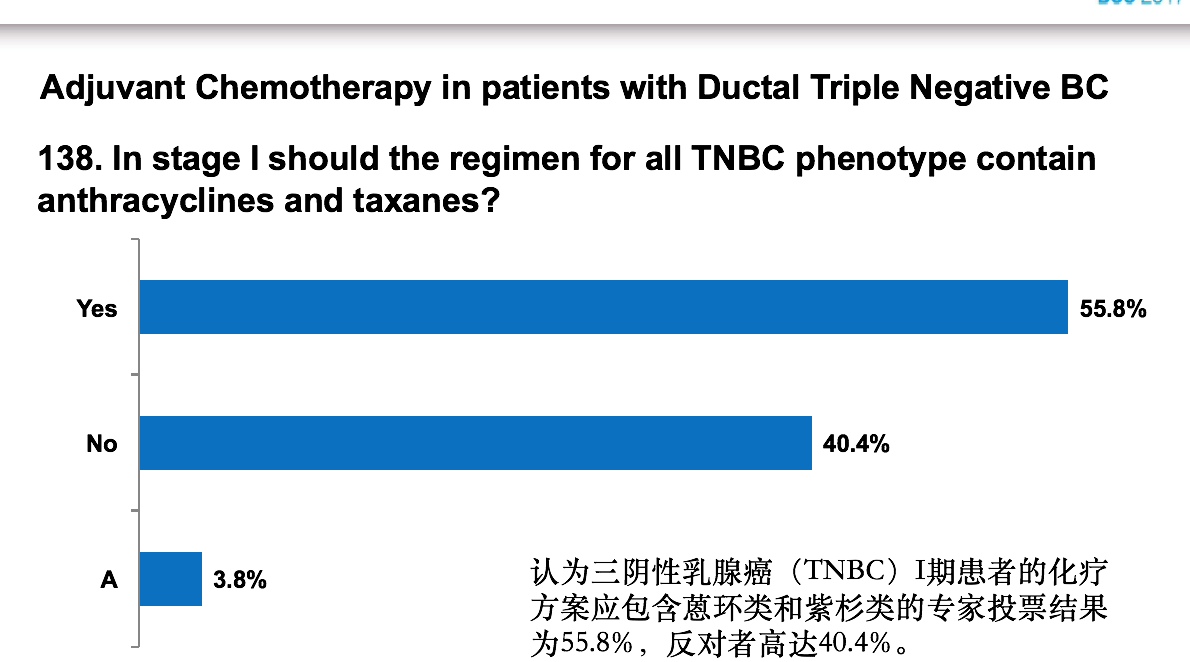
2. 2017 St.Gallen早期乳腺癌初始治疗专家共识的投票结果[4]可以看出,对于早期的HER2阴性乳腺癌(特别是Luminal B型和淋巴结转移较少的TNBC)是否应该包含蒽环类药物,目前争议较大。而对于淋巴结阳性较多的TNBC,专家对蒽环类药物的基石地位的认可仍未动摇。
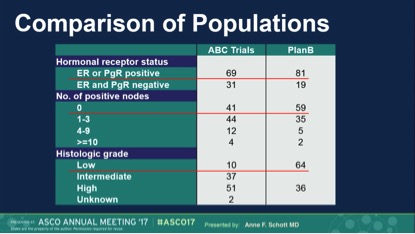
 3.ABC研究与PlanB研究纳入患者基线特征对比提示两个临床研究结果的差异可能由于入组患者基线水平不同。含蒽环类药物的化疗方案可能更加适合于更高危的人群(TNBC,淋巴结负荷更高及组织病理学分级较高的人群)。
3.ABC研究与PlanB研究纳入患者基线特征对比提示两个临床研究结果的差异可能由于入组患者基线水平不同。含蒽环类药物的化疗方案可能更加适合于更高危的人群(TNBC,淋巴结负荷更高及组织病理学分级较高的人群)。
 4.WSG PlanB在早前发布结果(EBCC 2016),提示经过55个月的中位随访后研究首次证实了RS评分≤11HR阳性乳腺癌患者(包含pN0-1)仅接受内分泌治疗的5年DFS达到94%与TAILORx研究[5]基本一致(iDFS 95.8%),而同期接受化疗的RS在11到25之间的中危组为94%,RS大于25的高危组患者的DFS为84%。由于TAILORx将中危组(RS 12-25)随机分为化疗组和单独内分泌治疗组的比较的随访数据尚未发布。但基于PlanB已发表的数据提示RS评分中危组5年DFS不管是6xTC组还是4xEC→4xDoc组均达到94%,高度提示其中部分患者可能在有效的基因检测筛选工具的支撑下避免化疗。
4.WSG PlanB在早前发布结果(EBCC 2016),提示经过55个月的中位随访后研究首次证实了RS评分≤11HR阳性乳腺癌患者(包含pN0-1)仅接受内分泌治疗的5年DFS达到94%与TAILORx研究[5]基本一致(iDFS 95.8%),而同期接受化疗的RS在11到25之间的中危组为94%,RS大于25的高危组患者的DFS为84%。由于TAILORx将中危组(RS 12-25)随机分为化疗组和单独内分泌治疗组的比较的随访数据尚未发布。但基于PlanB已发表的数据提示RS评分中危组5年DFS不管是6xTC组还是4xEC→4xDoc组均达到94%,高度提示其中部分患者可能在有效的基因检测筛选工具的支撑下避免化疗。
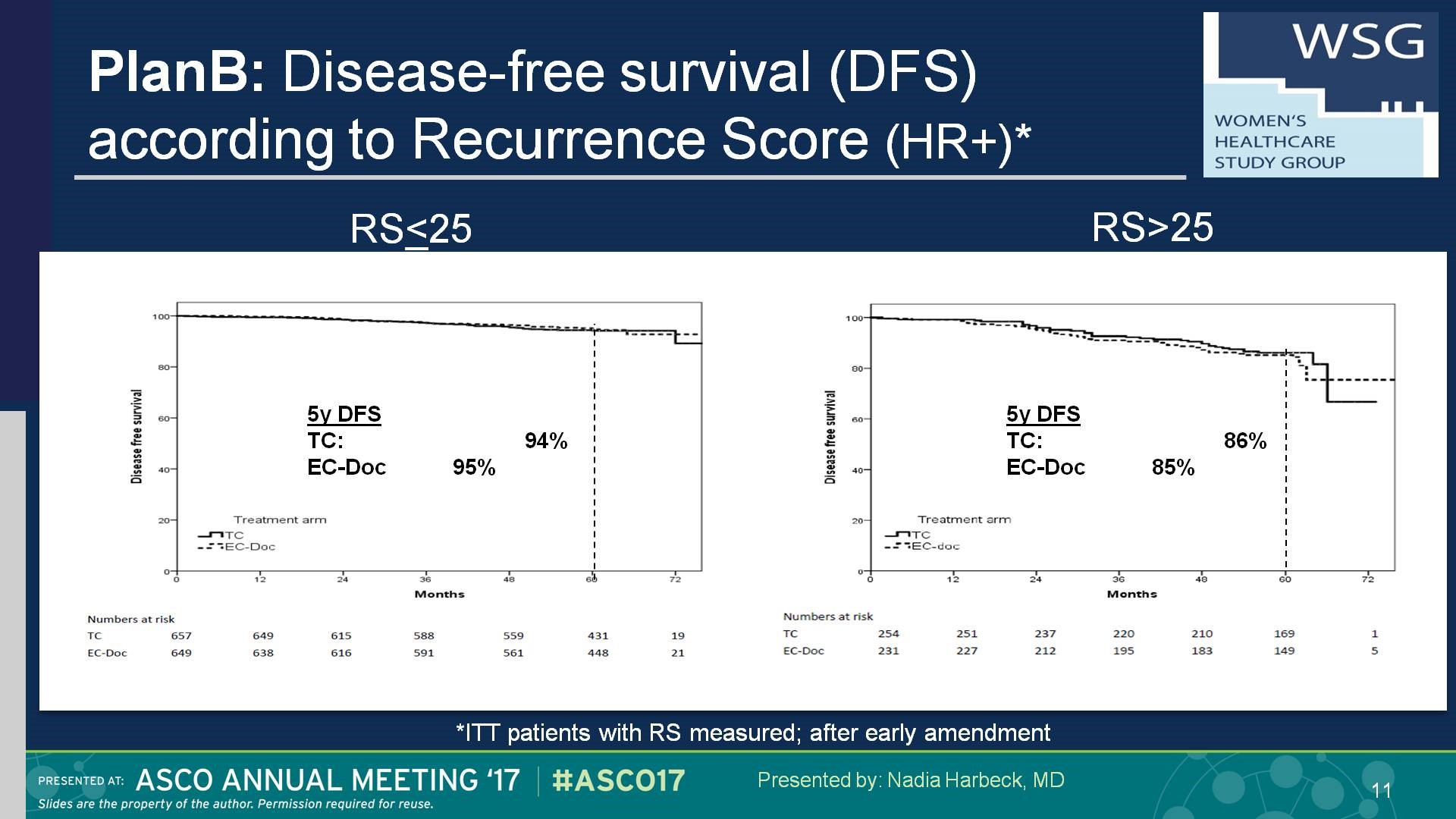
(RS 12-25之间的患者群不管接受何种化疗方案5年DFS均超过95%)
5. 临床仍缺乏蒽环类疗效的疗效预测工具,PlanB研究证实RS评分不能作为蒽环类药物是否获益的预测指标。在尚不能完全“去蒽环”的大背景下,我们仍然需要在这一领域进一步探索,以期发现有效的预测工具,筛选出更能从蒽环类药物治疗中获益的患者进行更为精准的治疗。
6.基于来自不同研究的结果,可以对现有已公布的结果进行meta分析,有可能得到更高级别的证据及更加细化的亚组分析作为指导蒽环类药物的使用。
【温馨提示】:如果您觉得周济春医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. Group(EBCTCG) EBCTC: Comparisons between different polychemotherapy regimens for early breast cancer: Meta-analyses of long-term outcome among 100 000 women in 123 randomised trials. Breast Diseases 2013, 24:76–78.
2. Jones S, Holmes FA, O’Shaughnessy J, Blum JL, Vukelja SJ, Mclntyre KJ, Pippen JE, Bordelon JH, Kirby RL, Sandbach J, Hyman WJ, Richards DA, Mennel RG, Boehm KA, Meyer WG, Asmar L, Mackey D, Riedel S, Muss H, Savin MA: Docetaxel with cyclophosphamide is associated with an overall survival benefit compared with doxorubicin and cyclophosphamide: 7-year follow-up of us oncology research trial 9735. Journal of Clinical Oncology 2009, 27:1177–1183.
3. Blum JL, Flynn PJ, Yothers G, Asmar L, Geyer CE, Jacobs SA, Robert NJ, Hopkins JO, O’Shaughnessy JA, Dang CT, Gómez HL, Fehrenbacher L, Vukelja SJ, Lyss AP, Paul D, Brufsky AM, Jeong J-H, Colangelo LH, Swain SM, Mamounas EP, Jones SE, Wolmark N: Anthracyclines in Early Breast Cancer: The ABC Trials—USOR 06-090, NSABP B-46-I/USOR 07132, and NSABP B-49 (NRG Oncology). Journal of Clinical Oncology 2017:JCO.2016.71.414.
4. Gnant M, Harbeck N, Thomssen C: St. Gallen/Vienna 2017: A Brief Summary of the Consensus Discussion about Escalation and De-Escalation of Primary Breast Cancer Treatment. Breast care (Basel, Switzerland) 2017, 12:102–107.
5. Sparano JA, Gray RJ, Makower DF, Pritchard KI, Albain KS, Hayes DF, Geyer CE, Dees EC, Perez EA, Olson JA, Zujewski J, Lively T, Badve SS, Saphner TJ, Wagner LI, Whelan TJ, Ellis MJ, Paik S, Wood WC, Ravdin P, Keane MM, Gomez Moreno HL, Reddy PS, Goggins TF, Mayer IA, Brufsky AM, Toppmeyer DL, Kaklamani VG, Atkins JN, Berenberg JL, et al.: Prospective Validation of a 21-Gene Expression Assay in Breast Cancer. New England Journal of Medicine 2015, 373:2005–2014.















 苏公网安备32059002004080号
苏公网安备32059002004080号


