前言
索拉非尼是唯一获得FDA批准的HCC系统治疗药物,它能将进展期HCC的OS延长3个月左右,是目前晚期HCC的标准治疗。
慢性肝脏炎症反应是肝脏肿瘤发展的首要危险因素,目前把增强肿瘤特异性免疫反应的方法作为HCC治疗策略来研究。更好地理解免疫系统如何促进肿瘤生长,有助于开发出更有效的治疗手段,也正是本文关注的焦点(Fig.1)。此外,本文还讨论了通过诱导抗原特异性T细胞或阻断免疫抑制机制来增强抗肿瘤免疫的在研药物的临床试验。
Fig. 1.
诱导免疫耐受的机制
肝脏的生理功能决定了它曝露于大量抗原,为了免遭自身免疫破坏,肝脏演化出了一套免疫耐受机制(Fig.2)。
Fig. 2.
在生理情况下, LSECs和Kupffer细胞共同释放抑制性细胞因子TGF-β在局部发挥免疫抑制作用。
在慢性炎症的肝脏中,PD-L1、PD-L2、PD-1的生理性表达增加。以上耐受反应在肝脏面对无害抗原时能起到保护作用,然而在HCC中对肿瘤相关抗原(TAA)的免疫耐受显然是不利的。
慢性炎症的免疫抑制
慢性炎症以不同细胞因子持续表达和免疫细胞募集至肝脏为特征,通过增强免疫抑制使癌细胞生长,在癌变和进展中发挥了作用。慢性炎症阶段抗原特异性免疫监视的抑制是由免疫检查点表达的变化、树突状细胞(DCs)功能的变化、Treg频率的增加、抑制性细胞因子如IL-10、TGF-β的释放来介导的。
近年来逐渐认识到免疫抑制性检查点在慢性炎症的免疫抑制中发挥了重要作用。白细胞上的配体PD-L1、PD-L2 表达上调与肝脏炎症程度呈正相关。表达PD-1的循环CD8+ T细胞频率增加与HBV相关性肝硬化进展至HCC有关。除了PD-1以外,其他T细胞负调节免疫检查点受体如CTLA-4、免疫球蛋白结构域、黏蛋白结构域-3(Tim-3)的上调,与慢性病毒性肝炎中效应T细胞功能的降低相关。以上结果提示免疫抑制性检查点在慢性炎症阶段发挥了免疫抑制作用,从而导致HCC进展。
HCC免疫耐受
在肿瘤宿主中,促进对肿瘤抗原耐受的策略包括降低恶性细胞的识别与肿瘤微环境中免疫系统功能的抑制。这些免疫反应包括免疫细胞数量或功能、细胞因子水平、免疫受体或配体表达的变化。
在细胞水平,抗原提呈失败,Treg、恒定型自然杀伤T细胞(iNKT)、CD14+HLA-DR−/low单核样髓源性抑制细胞(MDSC)、肿瘤相关巨噬细胞(TAMs)的增加以及CD4+ 辅助T细胞的减少。免疫抑制细胞因子(IL-4、IL-5、IL-8、IL-10)升高、免疫激活细胞因子(IL-1、肿瘤坏死因子(TNF)、干扰素γ(IFN-γ))下降。在受体和配体水平,HCC细胞共刺激分子B7-1、B7-2(免疫共刺激配体)表达显著降低,从而引起B7/CD28介导的活化效应T细胞减少。
还有由PD-L1/PD-1免疫检查点通路变化介导的HCC免疫耐受机制。HCC患者的CD8+T细胞上PD-1表达增加、肿瘤浸润和循环PD-1+CD8+T细胞增加与根治性肝切除术后疾病进展相关。除了T细胞上PD-1上调以外,瘤周基质细胞(Kupffer细胞、LSECs、单核细胞)和癌细胞上PD-L1高表达促进抗肿瘤T细胞免疫反应的PD-L1/PD-1通路驱动抑制。PD-1/PD-L1表达增加为使用PD-1、PD-L1免疫检查点阻断抗体治疗HCC提供了理论依据。
自发性肿瘤特异性免疫反应
肝癌患者仍能检测到抗肿瘤抗原的适应性免疫反应。抗HCC特异性CD8+T细胞TAA包括AFP、NY-ESO-136、SSX-2、TERT、MAGE-A、GPC3等。通过疫苗增强TAA导向的免疫反应并联合应用免疫检查点靶向药物可能控制HCC生长、引起肿瘤退缩,是一种富有前景的治疗策略。CD4+ 、 CD8+ TIL与HCC肝移植或肝切除术后复发相关,增加TIL和细胞毒性NK的靶向治疗能够改善根治性手术后的转归。
以上提示HCC宿主发生了多种免疫调节变化,原发性肝癌进展和消退之间平衡的免疫反应为HCC免疫治疗的开发提供了靶点。
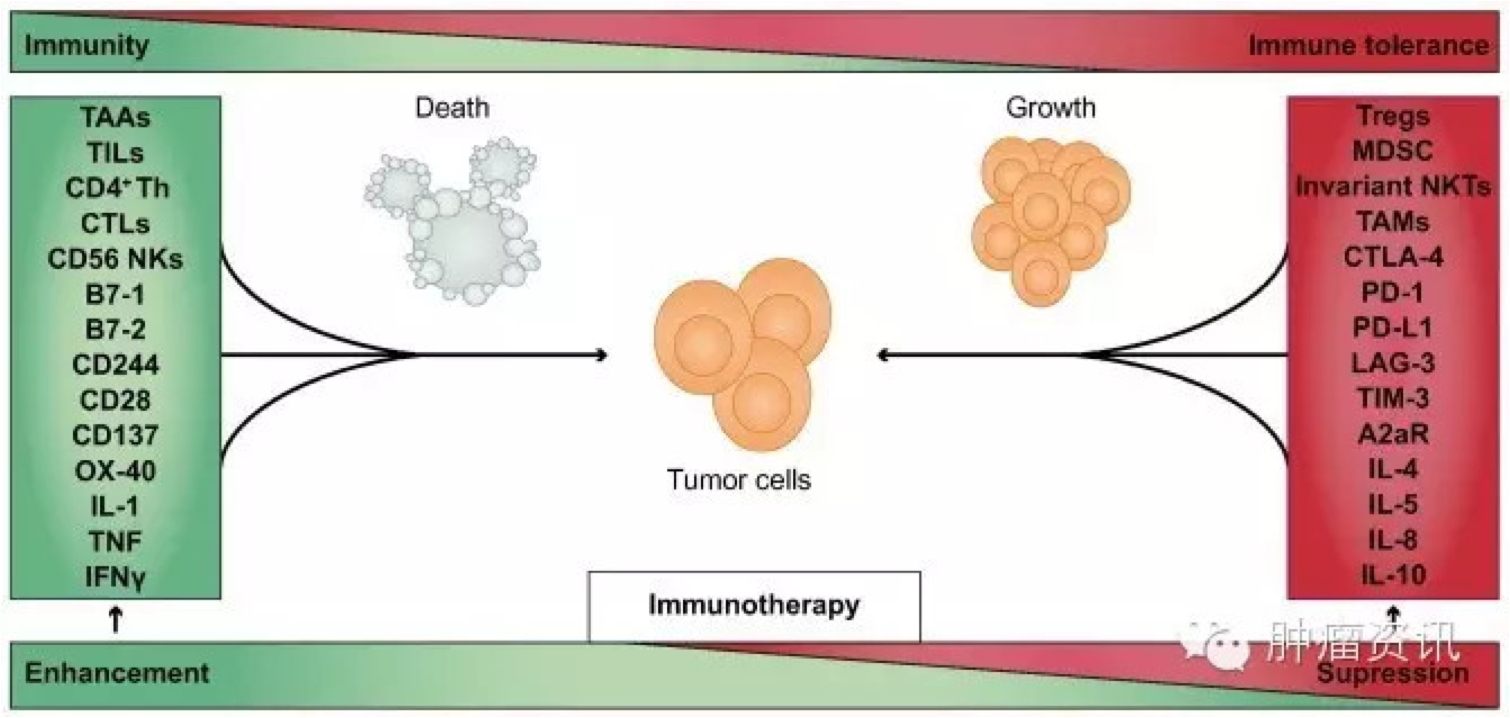
Fig. 3.
临床试验
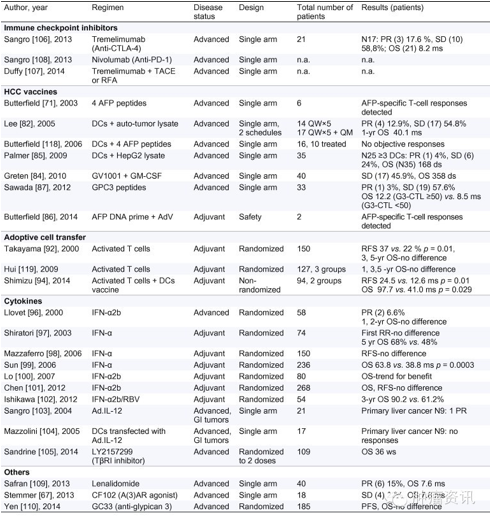
临床试验已评估了多种以诱导或加强抗肿瘤免疫为靶点的免疫治疗药物,多数药物都是作为单药治疗且处于早期试验阶段(Table1)。
Table 1
疫苗
HCC TAA为靶点的疫苗就已进入早期临床试验,各种疫苗的试验结果成败不一。AFP是第一种被用作治疗靶点的TAAs,2003年,第一种HCC疫苗临床试验报道了AFP阳性的HCC HLA-A∗0201患者使用四种HLA-A∗0201限制性多肽的疫苗后,可检测到T细胞反应,但随后的I/II期临床试验仅检测到一过性的免疫反应。另一种使用自体肿瘤裂解产物DC的HCC疫苗试验的临床转归更优,疫苗作为维持治疗的患者预后更好。另一项试验评价了HLA-A∗24:02限制性GPC3298–306或HLA-A∗02:01限制性GPC3144–152多肽疫苗:33例患者中有30例检测到GPC3特异性CTL反应,GPC3特异性CTL与生存期呈正相关,这一转归显示该疫苗富有前景。
过继细胞转移
过继细胞转移(ACT)是指将从患者肿瘤或外周血中获得的TIL在体外有选择的活化、扩增后进行自体输注。ACT已被用作HCC的辅助治疗。一项随机临床试验显示,ACT输注能够改善无复发生存。增强ACT临床获益的治疗策略包括全身应用细胞因子或接种疫苗。最近一项临床试验显示,HCC患者在根治性切除术后联合应用自体肿瘤裂解产物的DC疫苗和活化T细胞转移(ATVAC)后,联合治疗组42例患者的转归明显优于单纯手术组的52例患者,两组OS分别为97.9个月vs.41.0个月,这一结果支持在适应性免疫治疗中采用联合疗法。
细胞因子
细胞因子固有免疫治疗已经被广泛用于HCC。干扰素(IFN)原用于治疗丙型病毒性肝炎,因其抗病毒和抗肿瘤的双重作用,而成为HCC的治疗选择之一。多个随机临床试验采用不同方案、不同类型的IFN治疗,显示其无复发和生存转归结果不一。
LY2157299是一种新型的小分子抑制剂TGF-β受体I,是一种富有前景的细胞因子靶向治疗。II期试验结果显示中位OS36周(AFP反应组93.1周vs.AFP无反应组29.6周)。另一项旨在评价单药LY2157299与联合索拉菲尼疗效的非随机II期试验(NCT01246986)正在进行中。
免疫检查点抑制剂
目前,所有免疫检查点靶向治疗都是针对特定的免疫靶点而开发的单克隆抗体。尽管已经开始进行多种免疫检查点阻断剂的临床前研究,但大多数进入临床的都是以PD-1、PD-L1、CTLA-4分子为靶点的抗体。抗CTLA-4的ipilimumab和抗PD-1单抗pembrolizumab、nivolumab分别于2011年、2014年获得FDA批准用于治疗黑色素瘤。全人源化IgG2单抗tremelimumab是唯一一种进入临床评价的治疗HCC的抗CTLA-4药物。一项II期非对照多中心临床试验结果提示tremelimumab具有抗肿瘤和抗病毒的双重作用,说明在病毒感染引发的HBV或HCV相关HCC中,免疫检查点治疗有所获益。最近一项I/II临床试验正在评价tremelimumab联合局部治疗(TACE或RFA)的疗效。
抗PD-1受体的全人源化IgG4单抗nivolumab (BMS-936558)已进入I期剂量递增试验。试验目的是在有或无HBV或HCV感染的HCC患者中评价安全性和初步活性。尽管临床前研究显示包括LAG3、TIM-3、NK抑制性受体在内的免疫检查点抗体具有抗肿瘤活性,但用来治疗HCC患者尚没有获得临床疗效。其他免疫调节分子如CD244 (2B4) 、CD137 (4-1BB) 、OX-40尚处于临床前研究阶段,有待进一步开发出相应的免疫激动剂。
其他免疫治疗方法
已有I/II期临床试验评价了其他几种免疫治疗方法。一项II期试验评价了免疫调节剂来那度胺用于索拉菲尼治疗失败的进展期HCC的疗效,PR率15%、OS7.6个月。磷脂酰肌醇聚糖3 (glypican 3)是表达于肝癌细胞的一种胎儿肿瘤蛋白,一项II期试验评价了抗glypican 3单抗治疗进展期HCC的疗效,185例患者以2:1比例纳入抗glypican 3单抗组(GC33)vs.安慰剂组,结果显示两组PFS、OS无显著差异,但GC33高剂量组相对于安慰剂组有更长的OS(9.7 vs.6.7),因此,研究者认为GC33治疗没有获益的原因是未达最佳剂量。此外,安全性数据显示几种免疫靶向治疗即mapatumumab(肿瘤坏死因子相关凋亡诱导配体受体1激动剂,TRAIL-R1)、tigatuzumab (CS-1008,死亡受体5激动剂)、CF102(A(3)腺苷受体激动剂)具备良好的耐受性。
原文链接:
The yin and yang of evasion andimmune activation in HCC
Oxana V.Makarova-Rusher, etal. J Hepatol 2015Jun;62(6):1420-1429.

















 苏公网安备32059002004080号
苏公网安备32059002004080号


