多发性骨髓瘤(MM)是一种以克隆性浆细胞异常增殖为特征的血液系统恶性肿瘤,目前仍无法治愈。随着蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)及单克隆抗体(单抗)等新型药物的广泛应用,MM的治疗理念已从追求短期缓解,逐步转向以实现深度且持久的疾病控制为核心的长期管理策略。在这一背景下,诱导治疗后的持续治疗成为巩固疗效、延缓进展、改善远期预后的关键环节。
伊沙佐米作为新一代口服PI,以其良好的生存获益、可控的安全性、以及便捷的给药途径,为MM的长期持续治疗提供了重要选择。特别是“达雷妥尤单抗诱导序贯以伊沙佐米为基础的持续治疗”的策略,在临床实践中展现出综合优势,为新诊断MM(NDMM)的个体化、长程化管理提供了可行路径。
为深入探讨该序贯治疗模式在不同临床场景中的价值,【肿瘤资讯】特邀淄博市中心医院西院刘艳教授与青岛大学附属医院医院赵洪国教授,结合三例具有不同临床特征的NDMM病例,对达雷妥尤单抗诱导后序贯伊沙佐米持续治疗的诊疗过程、疗效与安全性进行系统剖析。
病例1
患者概况
患者男性,84岁。因“双侧肋部及左侧骨盆疼痛”于2024年4月就诊,伴肢体运动障碍。患者既往有间质性肺炎、下肢静脉曲张、腰椎间盘突出症、骨盆骨折病史。
检查结果
血常规:WBC 4.2×109/L,NE 2.59×109/L,Hb 113 g/L,PLT 127×109/L。
自身抗体检测:抗核抗体(+),1:100 核颗粒型。
血清免疫球蛋白定量:IgA 21.5g/L、IgM 0.35g/L。
血清游离轻链定量:轻链κ 6.52g/L。
生化:白蛋白34.9g/1,肌酐56.3umo1/L,葡萄糖6.96mmo1/L,总蛋白73.0g/L,球蛋白39.1g/L,血钙2.3mmol/L,乳酸脱氢酶158.9U/L,β2-微球蛋白2.22mg/L。
血清免疫固定电泳:在Y区可见一条单克隆IgA-κ成分。
血清M蛋白定量:13.14g/L。
尿免疫固定电泳:在Y区可见一条单克隆轻链IgA-κ成分。
颅骨X线:颅骨见多个低密度灶,不排除骨髓瘤。
椎体MRI:L4、5椎体骨质破坏。
骨盆CT:左股骨上段可见多发低密度影,未见明显硬化缘,较大者长径约1.8cm。
PET-CT:1.全身多发骨质改变伴 FDG 代谢增高,符合多发性骨髓瘤改变;2.双肺气肿;双肺炎症,部分呈间质性改变及间质性纤维化。
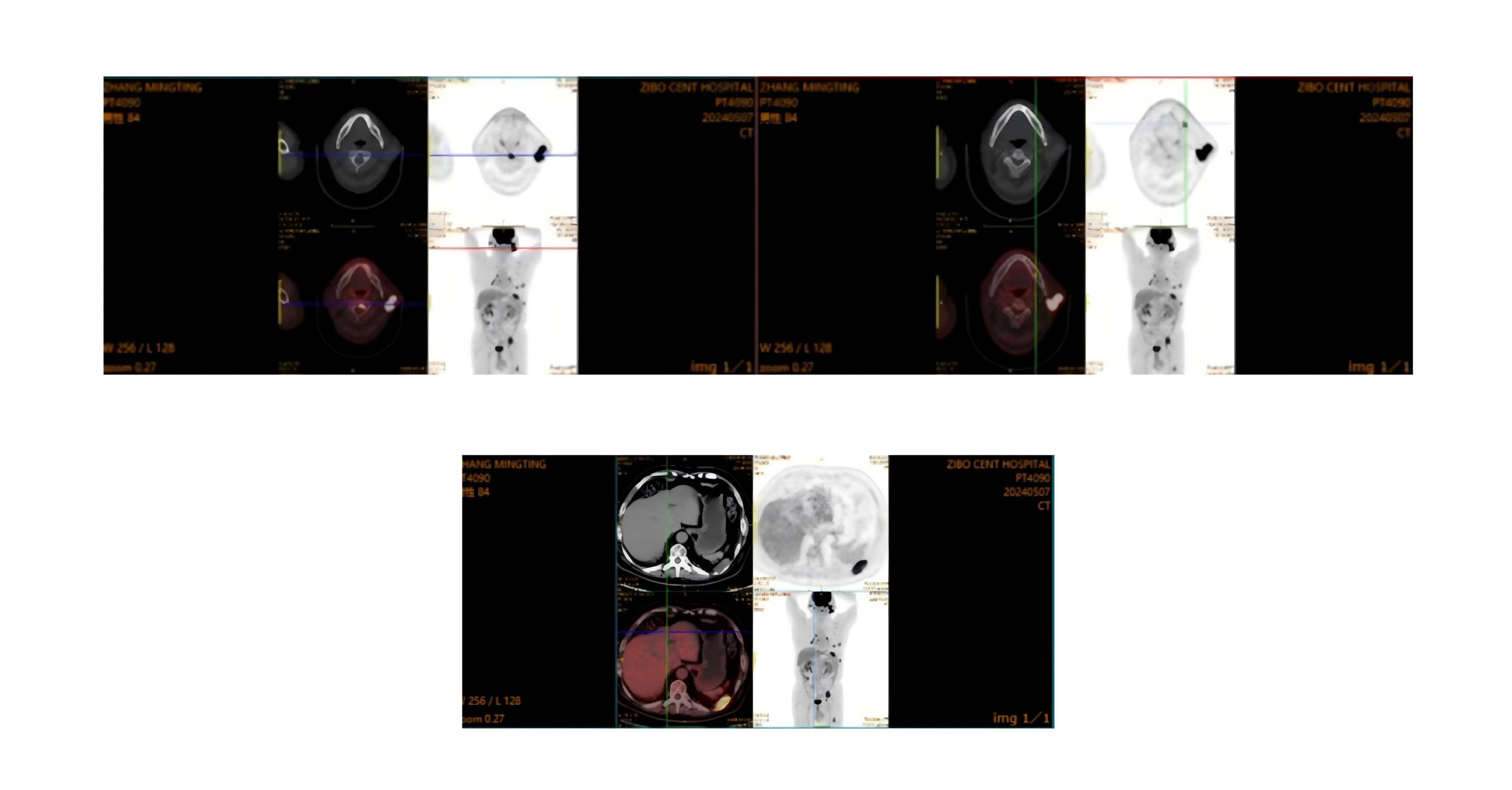
骨髓涂片:骨髓幼稚浆细胞占16%,伴形态异常,浆细胞肿瘤。
骨髓活检:单克隆浆细胞增生(约10%),考虑浆细胞肿瘤。
免疫分型:表型异常单克隆浆细胞占有核细胞的9.92%。
FISH:RB1基因缺失阳性。
诊断
1.多发性骨髓瘤(IgA-κ型,DS分期 Ⅱ期,ISS分期 Ⅱ期,R-ISS分期 Ⅱ期,标危);2.间质性肺炎;3.椎间盘突出。
治疗经过
诱导治疗(2024年5月~6月):予DRD方案(达雷妥尤单抗+来那度胺+地塞米松)化疗2个周期。疗效评估达部分缓解(PR),但治疗结束后出现肺部感染,经抗感染后好转。
方案调整(2024年7月起):为追求更深缓解,调整为DID方案(达雷妥尤单抗+伊沙佐米+地塞米松)治疗2个周期。复查血M蛋白转阴,疗效提升至非常好的部分缓解(VGPR)。
持续治疗(2024年9月起):因患者反复肺部感染,停用达雷妥尤单抗,转为ID方案(伊沙佐米+地塞米松)口服治疗8个周期。
疗效与转归
末次疗效评估显示,患者达到严格意义的完全缓解(sCR),血尿免疫固定电泳及M蛋白定量持续阴性。自转换为ID方案后,未再发生严重感染事件,患者耐受性良好。
病例小结
该例高龄且合并间质性肺炎的NDMM患者,初始接受含达雷妥尤单抗方案诱导时面临感染风险。在获得初步缓解后,治疗策略及时转换为含伊沙佐米的方案,不仅成功将疗效从PR提升至sCR;更重要的是,在口服伊沙佐米持续治疗阶段有效规避了再次严重感染的风险。
病例2
患者概况
患者男性,49岁。因“发现胸骨肿物2月”于2021年10月入院。患者自诉伴有胸部疼痛。当地医院查胸骨MRI提示胸骨柄区占位、左侧约第4、5后肋水平占位及部分胸椎多发异常病灶。
检查结果
血常规:WBC 6.55×109/L,NE 2.92×109/L,Hb 126g/L,PLT 201×109/L,C反应蛋白 5.54mg/L。
生化:白蛋白 34.1g/l,球蛋白 81.1g/L,白球比0.4,肌酐 90.0umol/L,钾 4.12mmol/L,钠 129.0mmol/L,β2微球蛋白 3.99mg/L;乳酸脱氢酶141U/L。
免疫球蛋白:IgG 71.2g/L,IgA 1.73g/L,IgM 0.21g/L。
血免疫固定电泳:IgG-κ链(+),血M蛋白 65.9g/L,血游离κ轻链 27.80mg/L。
尿免疫固定电泳:IgG-κ链(+),尿M蛋白 297mg/24h,尿游离轻链未见异常。
胸骨MR:胸骨柄区占位,左侧约第4、5后肋占位,多发胸椎多发异常病灶。
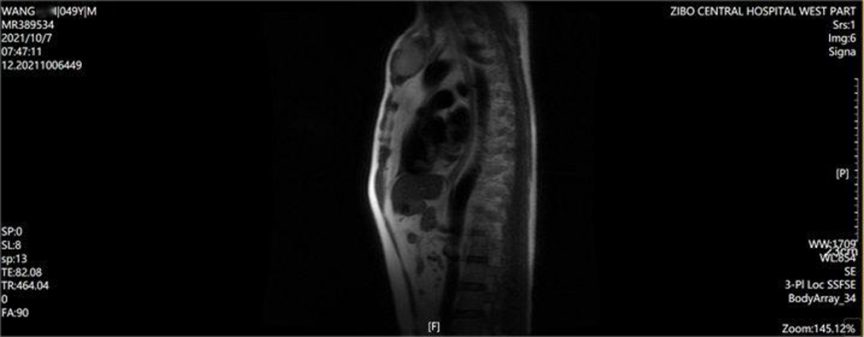
PET-CT:胸骨、多个胸腰骶椎椎体、骨盆、左侧第5肋骨、右侧股骨上段髓腔内多发FDG代谢明显增高软组织密度病灶,并溶骨性骨质破坏,考虑多发骨髓瘤可能性大。
骨髓涂片:骨髓瘤细胞占61%,可见双核或多核骨髓瘤细胞。红系增生减低,成熟RBC呈缗钱状排列。
骨髓活检:可见异常浆细胞比例增高,散在分布或灶性聚集。网状纤维染色(MF-1级)。
免疫分型:符合浆细胞肿瘤表型。另可见占有核细胞10.45%的单克隆B淋巴细胞,表型为CD19+,CD20+,CD38-,CD10-,CD5-,CD103-,κ+,λ-。
FISH:TP53阳性。
胸骨穿刺活检:病理诊断为浆细胞骨髓瘤“浆母细胞型”。免疫组化显示CD79α部分(+);bcl-2(+);Mum-1(+);CD38(+);CD138(+);K-轻链(+);Cyclin D1散在(+);CD56(+);c-myc(+)S占35%;Vimentin(+);Ki-67(+)S占45%。

诊断
1.多发性骨髓瘤(DS分期 Ⅲ期A组,ISS分期 Ⅱ期,R-ISS分期 Ⅲ期,高危)。
治疗经过
诱导治疗(2021年10月~2021年12月):予DVRD方案(达雷妥尤单抗+硼替佐米+来那度胺+地塞米松)强化诱导治疗4周期,疗效评估达VGPR。
巩固治疗与移植(2022年1月~2022年6月):患者接受2个周期的达雷妥尤单抗联合IRD方案(伊沙佐米+来那度胺+地塞米松)作为移植前巩固治疗。2022年6月6日,行自体造血干细胞移植(ASCT)。
持续治疗(2022年9月起):患者接受DI方案(达雷妥尤单抗+伊沙佐米)持续治疗1年,后停用达雷妥尤单抗,换用IR方案(伊沙佐米+来那度胺)持续治疗至今。
疗效与转归
患者经诱导治疗后定期复查,骨髓涂片及流式细胞术均未见异常浆细胞,微小残留病灶(MRD)持续阴性。PET-CT影像对比显示,原骨质破坏病灶FDG代谢显著降低,部分区域出现骨皮质修复。截至末次随访,患者持续完全缓解(CR)状态。
病例小结
该例浆母细胞型高危NDMM患者,预后较差。通过含达雷妥尤单抗的强化诱导联合ASCT获得深度缓解后,采用以伊沙佐米为核心的全口服方案进行长期持续治疗,成功实现了MRD阴性的持久深度缓解。
病例3
患者概况
男性,66岁。因“腰痛5年,加重伴肋部疼痛半年”于2022年3月入院。患者2017年无明显诱因出现腰背部疼痛,休息后好转,活动后加重,未予特殊治疗。半年前出现腰背部疼痛加重伴肋部疼痛,行腰椎MRI、抽血等检查,诊断为“腰椎压缩性骨折”,给予止疼制动等对症处理,效果欠佳。患者既往有2型糖尿病病史,血糖控制尚可。
检查结果
体格检查:腰背部广泛压痛叩击痛,脊柱纵向叩击痛+。双侧肋骨压痛明显。颈、胸、腰椎活动略受限。
血常规:WBC 5.17×109/L,NE 3.49×109/L,Hb 114g/L,PLT 341×109/L,C反应蛋白 28.34mg/L。
生化:β2微球蛋白 4.69mg/L,免疫球蛋白IgG 31.3g/L。
血M蛋白定量:24.1g/L。
血免疫固定电泳:IgG-λ型。
血游离轻链定量:血清游离κ轻链14.19mg/L,λ轻链13.77mg/L,K/λ:1.0305。
尿游离轻链定量:尿游离κ轻链25mg/L,λ轻链5.12mg/L,κ/λ:4.8828。
椎体MR:C3/4、C5/6、C6/7椎间盘突出,以C5/6椎间盘为著并相应椎管狭窄。L2/3、L3/4、L4/5、L5/S1椎间盘轻度突出。扫描范围椎体弥漫信号异常。胸、腰椎多发许莫氏结节形成。
PET-CT:全身骨多发密度不均匀减低,伴双侧肋骨多发骨折,L2、L3椎体压缩性骨折,FDG轻度代谢,考虑多发性骨髓瘤累及。
骨髓涂片:骨髓增生活跃,骨髓瘤细胞占35.5%,该类细胞中等或偏大,卵圆形;核圆形,偏位,可见双核,核染色质细致,胞浆丰富,染灰蓝色,可见“火焰浆”。形态学考虑MM。
骨髓活检:组织形态考虑浆细胞骨髓瘤。
流式细胞术:单克隆性异常浆细胞占有核细胞计数的5.2%。
FISH检测:IGH基因重排阳性;D13S319基因缺失阳性。染色体:46,XY[20]。
诊断
1.多发性骨髓瘤(IgG-λ型,DS分期 Ⅲ期A型,ISS分期 Ⅱ期,R-ISS分期Ⅱ期);2.2型糖尿病。
治疗经过
诱导治疗(2022年4月~7月):患者接受2个周期VRD方案(硼替佐米+来那度胺+地塞米松)诱导治疗,疗效评估达VGPR;后加用达雷妥尤单抗强化治疗,疗效显著,疗效提升至CR。
移植与巩固治疗(2022年8月):患者接受ASCT,移植后疗效进一步提升至sCR。此后患者继续接受2个周期的DVRD治疗。
持续治疗(2022年12月至今):患者接受DID方案(达雷妥尤单抗+伊沙佐米+地塞米松)持续治疗至2023年10月后,调整为ID方案继续持续治疗至今。
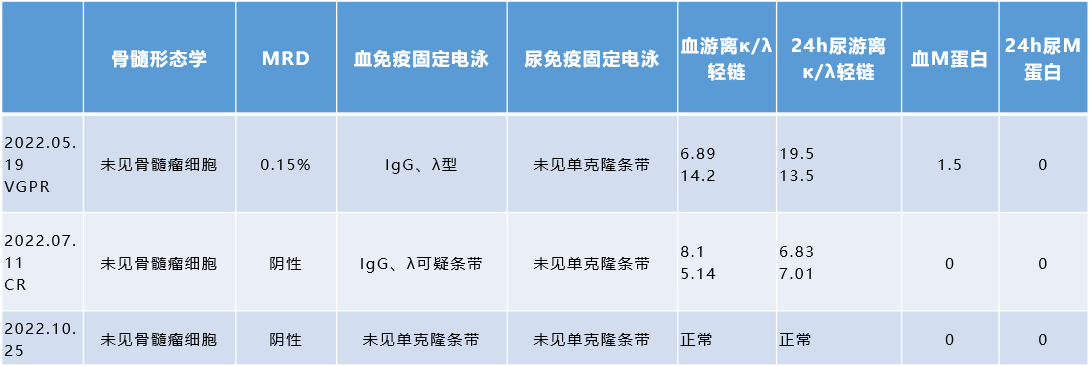
疗效与转归
启用以伊沙佐米为基础的持续治疗方案至今,患者定期接受骨髓形态学、MRD、血/尿免疫固定电泳等指标监测,疗效持续保持sCR状态。治疗过程顺利,未出现治疗相关不良反应,患者生活质量高。
病例小结
该例合并糖尿病的NDMM患者,在完成以达雷妥尤单抗为基础的强化诱导及移植后,其治疗重点顺利转向长期管理与生活质量的维护。调整为以伊沙佐米为基础的全口服持续治疗方案,在确保持续sCR状态的同时,显著简化了治疗流程,降低了治疗负担。


特邀专家
淄博市中心医院西院血液内科主任
中国人体健康科技促进会淋巴瘤专业委员会委员
山东省研究型医院协会血液病学分会副主任委员
山东省研究型医院协会淋巴瘤全程管理分会副主任委员
山东省医学会血液病学分会委员
山东省医师协会血液医师分会常务委员
山东省转化医学学会血液学分会常委委员
山东省临床肿瘤学会白血病专家委员会常务委员
山东中医药学会骨髓衰竭性疾病专委会常务委员
山东省抗癌协会血液肿瘤专业委员会委员
山东省老年医学学会血液病学专业委员会委员
淄博市老年医学会血液专业委员会主任委员
青岛大学附属医院
青岛市抗癌协会淋巴瘤专业委员会主任委员
青岛市医学会血液学专业委员会名誉主任委员
济南市医学会血液学专业委员会名誉主任委员
青岛市血液病质量控制中心名誉主任
山东省医学会血液学会副主任委员
山东省医师协会血液学会副主任委员
山东省抗癌协会血液专业委员会副主任委员
山东省中西医结合学会副主任委员
山东省免疫协会血液专业委员会副主任委员
中华医学会血液专业委员会白血病淋巴瘤学组委员
中国抗癌协会淋巴瘤专业委员会常务委员
中国血液医师协会委员
中国血液医师协会骨髓瘤专业委员会委员
中国海峡两岸血液学会委员
《中华血液杂志》《临床血液杂志》编委
[1] Moreau P, Masszi T, Grzasko N, et al. TOURMALINE-MM1 Study Group. Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med. 2016 Apr 28;374(17):1621-34.
[2] Joshua Richter, Saulius Girnius, Ruemu Birhiray, et al. In-class Transition from Parenteral Bortezomib to Oral Ixazomib in Newly Diagnosed Multiple Myeloma: Analysis of US MM-6 By Number of Treatment Cycles Received. Blood 2024; 144 (Supplement 1): 4757.
[3] Rifkin RM, Girnius SK, Noga SJ, et al. In-class transition (iCT) of proteasome inhibitor-based therapy: a community approach to multiple myeloma management. Blood Cancer J. 2023 Sep 19;13(1):147.
[4] Macro M, Hulin C, Vincent L, et al. Real-world effectiveness of ixazomib combined with lenalidomide and dexamethasone in relapsed/refractory multiple myeloma: the REMIX study. Ann Hematol. 2023 Aug;102(8):2137-2151.
[5] Vassilopoulos S, Vassilopoulos A, Kalligeros M, et al. Cumulative Incidence and Relative Risk of Infection in Patients With Multiple Myeloma Treated With Anti-CD38 Monoclonal Antibody-Based Regimens: A Systematic Review and Meta-analysis. Open Forum Infect Dis. 2022 Oct 31;9(11):ofac574.
[6] Rifkin RM, Girnius SK, Noga SJ, et al. In-class transition (iCT) of proteasome inhibitor-based therapy: a community approach to multiple myeloma management. Blood Cancer J. 2023 Sep 19;13(1):147.
[7] 伊沙佐米药品说明书.
[8] Leleu X, Lee HC, Zonder JA, et al. INSURE: a pooled analysis of ixazomib-lenalidomide-dexamethasone for relapsed/refractory myeloma in routine practice. Future Oncol. 2024 May;20(14):935-950.
排版编辑:肿瘤资讯-han











 苏公网安备32059002004080号
苏公网安备32059002004080号


