多发性内分泌腺瘤病1型(MEN-1)是一种常染色体显性遗传病,可在垂体、甲状旁腺、十二指肠、胰腺等多个部位发生肿瘤。对于该疾病的诊治,除了针对患者本人开展诊治工作,还有一个非常重要的工作需要做:家系筛查。本文详尽梳理3位来自同一家系的MEN-1患者的诊疗全过程,并结合多学科团队(MDT)的解析,探讨此类遗传性肿瘤的筛查策略、多发病灶的处理顺序及药物选择,以期为临床实践提供有价值的参考。
病例介绍
病例1:53岁,男性。
主诉:体检发现胰腺尾部占位。
外院诊疗经过:
2021年3月:胸部CT提示胰尾部饱满不规则,进一步MRI提示胰尾部占位,大小4.3cm*3.2cm,神经内分泌瘤可能。

我院诊疗经过:
2021年4月:腹部增强CT提示胰尾占位,神经内分泌肿瘤可能,胰管略扩张。
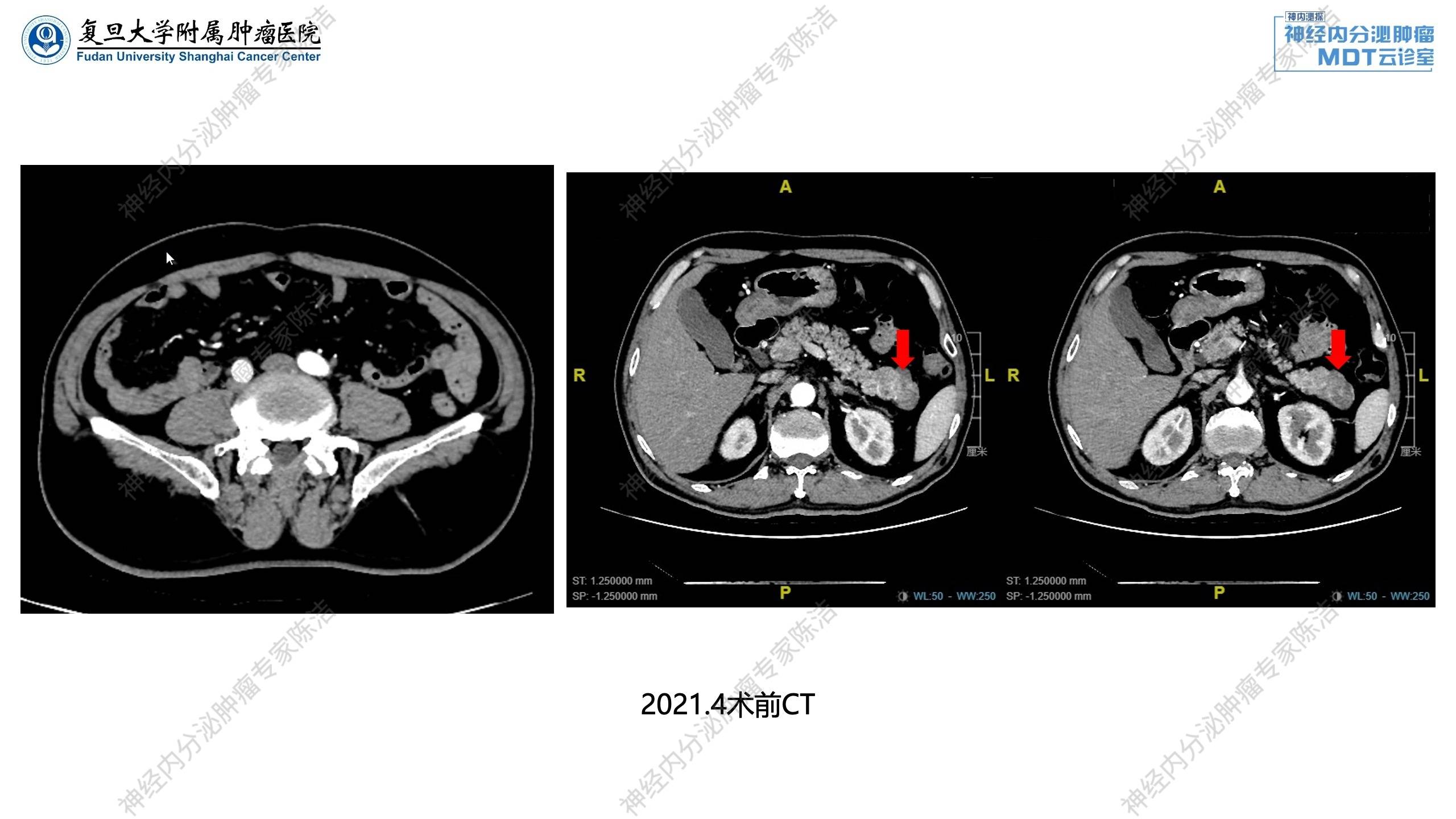
于我院行“腹腔镜根治性胰体尾切除术+腹腔镜下脾切除术”。术后病理提示胰腺神经内分泌肿瘤(G2);周围伴多发微小神经内分泌肿瘤(G1)。

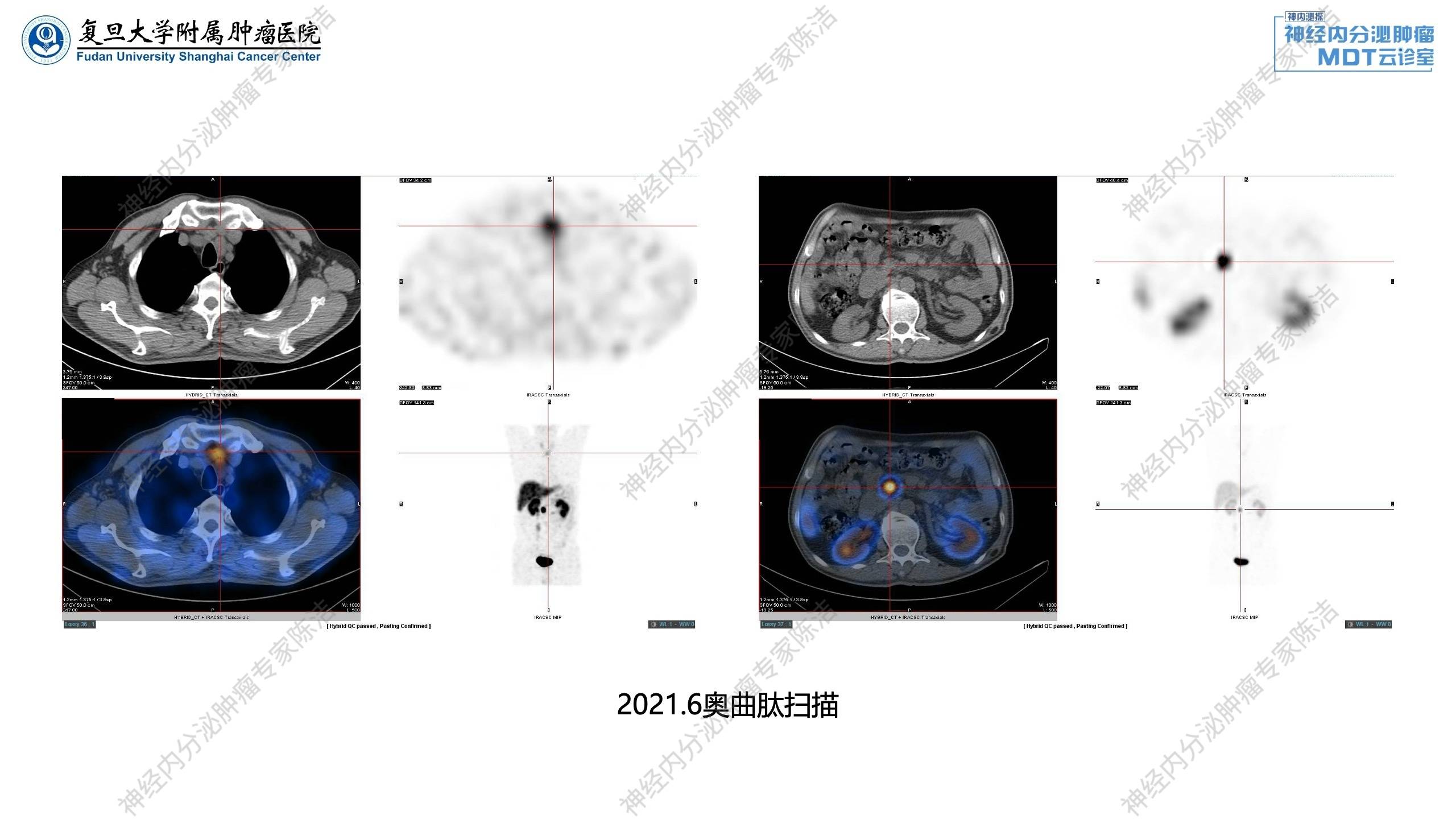
2021年6月:奥曲肽扫描显示:胰尾神经内分泌肿瘤术后残端及胰腺钩突、左侧锁骨上、高位气管旁、肝胃间隙、腹膜后、胰腺周围淋巴结生长抑素受体高表达,甲状腺右叶结节伴生长抑素受体高表达。
胚系基因检测证实存在MEN1基因致病性变异。甲状腺B超提示右侧甲状腺上极实质占位,左侧下颈部近锁骨上实质占位,肿大淋巴结可能。

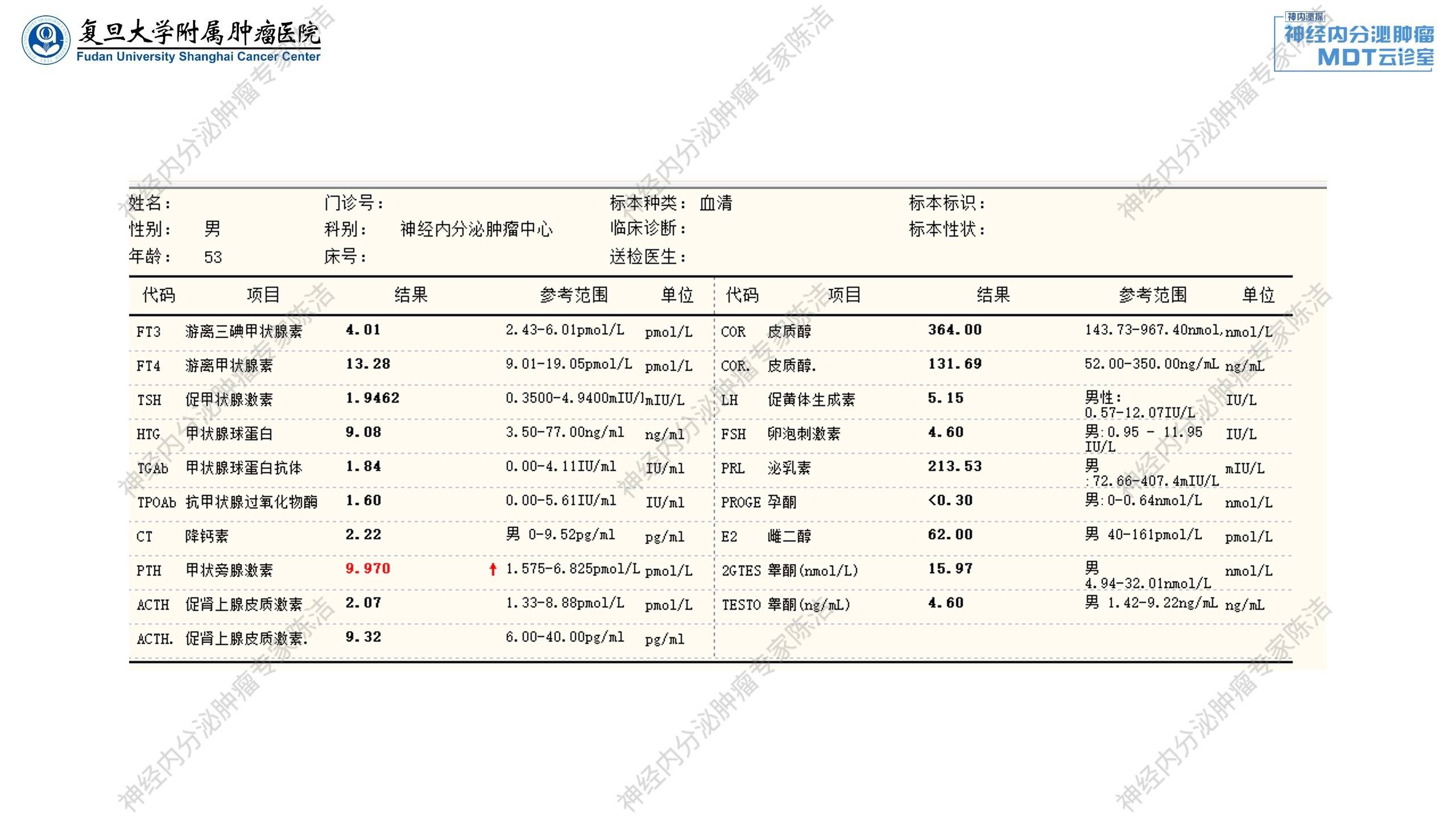
2021年9月:患者就诊于我院陈洁教授门诊。完善检查示甲状旁腺素(PTH)升高(9.970 pmol/L),血钙升高(2.92 mmol/L)。甲状旁腺MIBI显像提示甲状腺右叶下极后方结节,考虑甲状旁腺瘤。
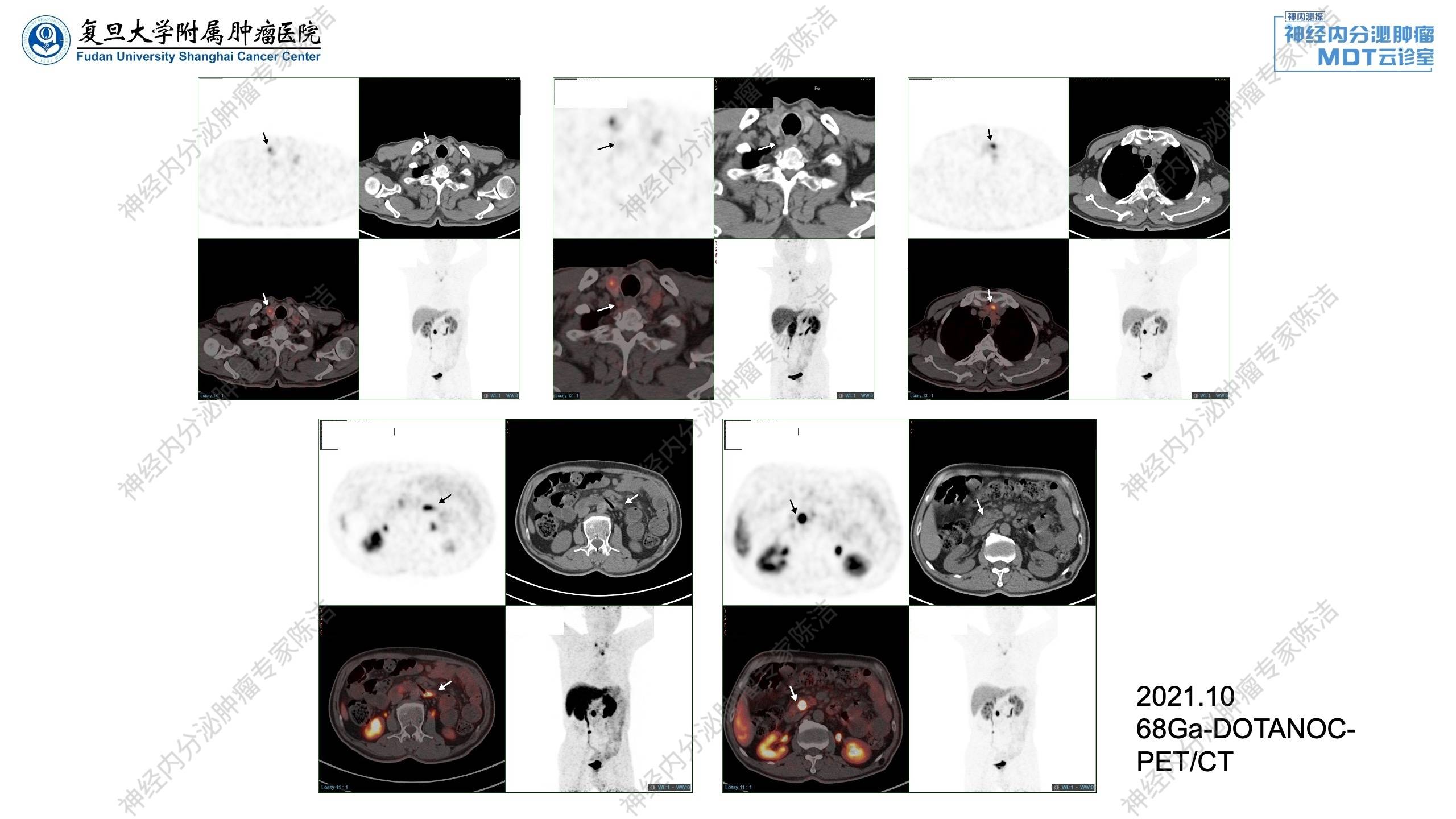
68Ga-DOTANOC-PET/CT提示胰腺神经内分泌瘤术后,胰头钩突部局灶性NOC摄取增高,考虑为神经内分泌瘤可能大;生长抑素受体高表达。左锁骨上、纵隔多发淋巴结转移,部分生长抑素受体表达轻度增高。甲状腺右叶低密度灶,NOC摄取增高;空肠起始段旁结节状NOC摄取增高灶。甲状腺右叶后方结节,未见NOC摄取增高,结合MIBI显像,考虑甲状腺旁腺腺瘤可能。

患者于2021年11月29日在全麻下行“右甲状旁腺肿瘤切除+右甲状腺部分切除术”。病理证实甲状旁腺肿物为甲状旁腺瘤。
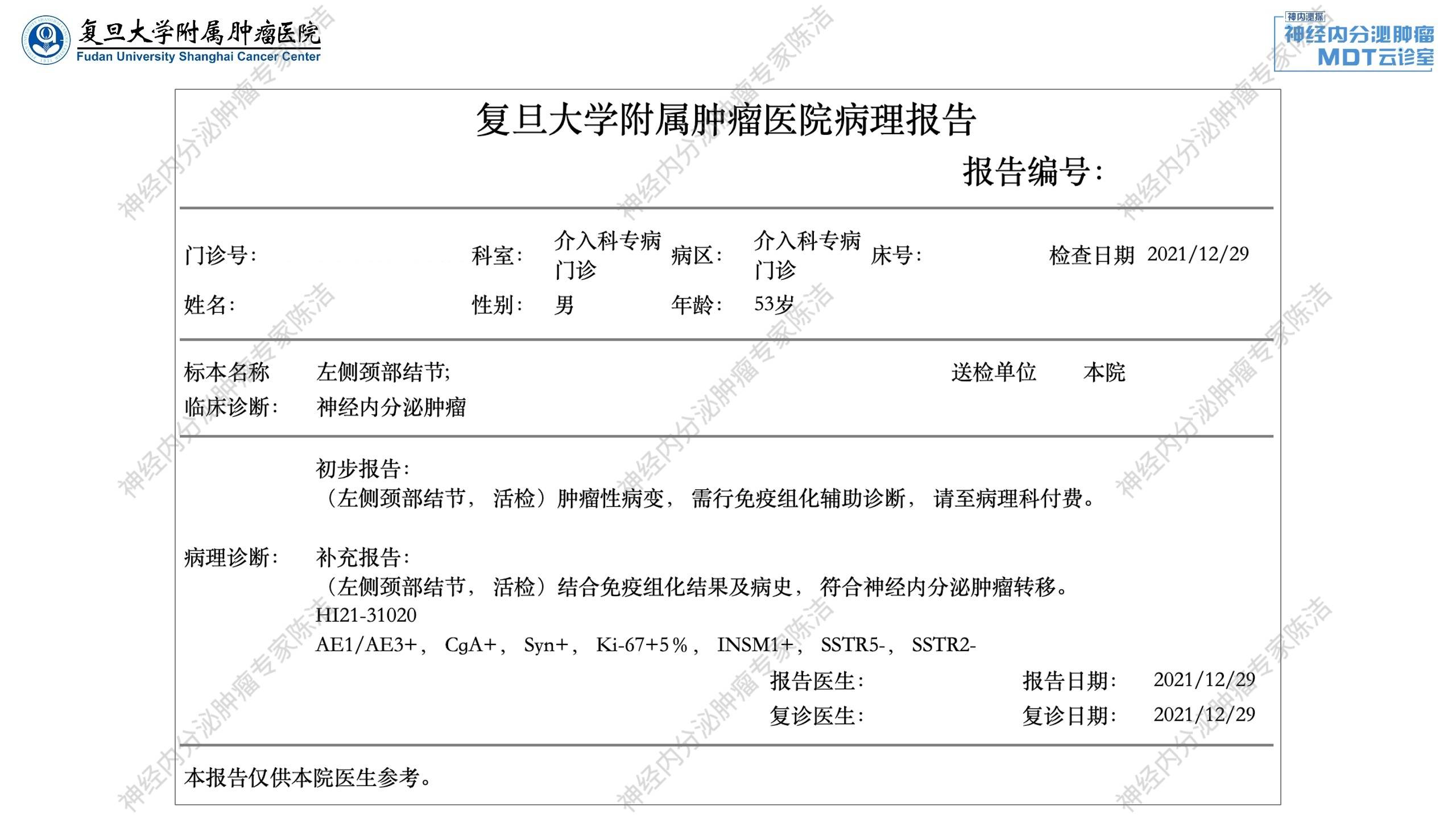
2022年1月:颈部淋巴结活检证实为神经内分泌肿瘤转移。应用舒尼替尼37.5mg QD 治疗,后患者规律复查,肿瘤疗效评价为基本稳定(SD)。
2023年11月:患者开始出现腹泻,查血清胃泌素明显升高(578.00pg/mL),胃镜示胃体黏膜肿胀。
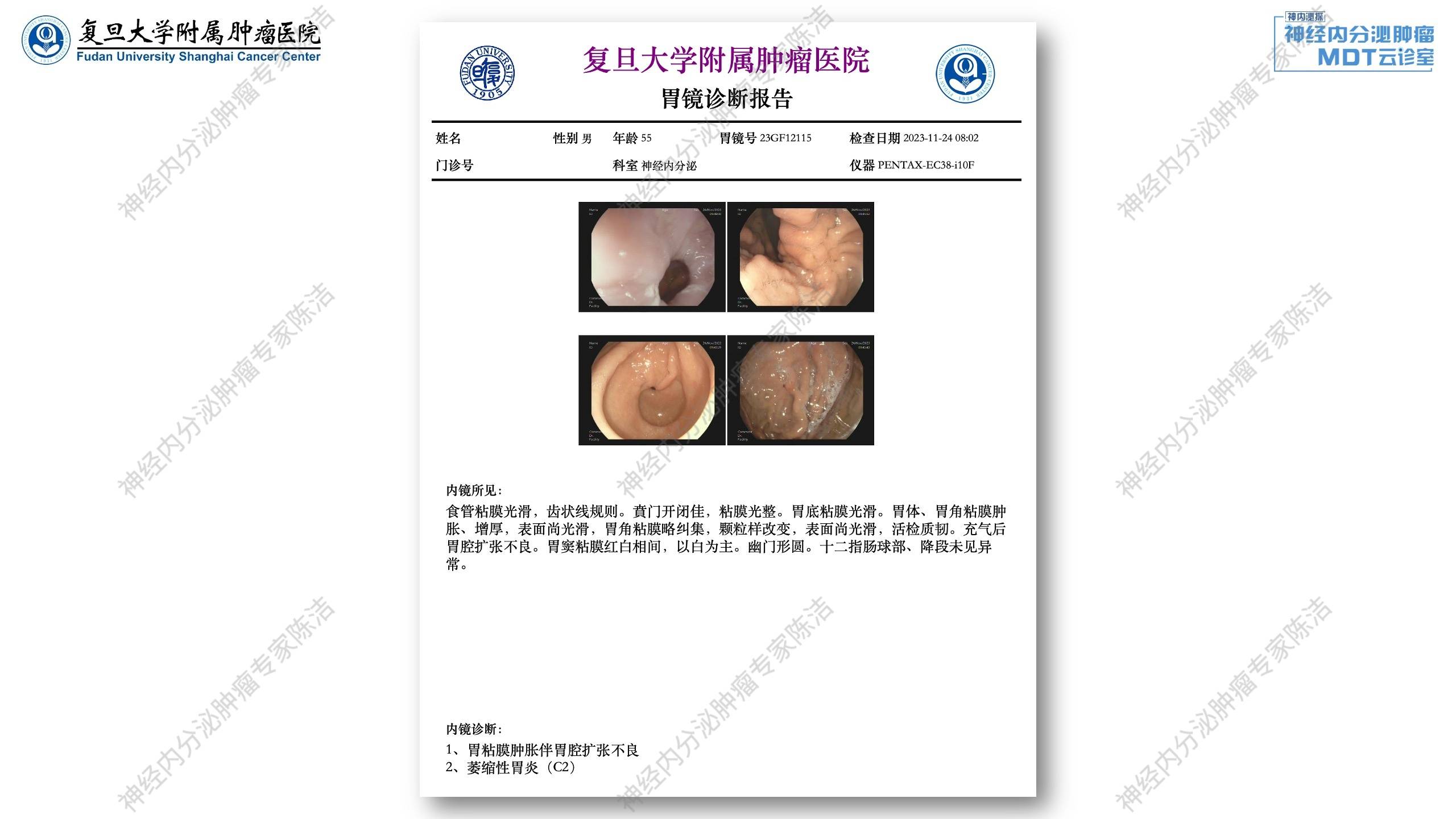
考虑肿瘤合并胃泌素分泌,继续舒尼替尼37.5mg QD口服治疗,并加用长效奥曲肽30mg Q4W+奥美拉唑 20mg QD。腹泻症状明显改善。
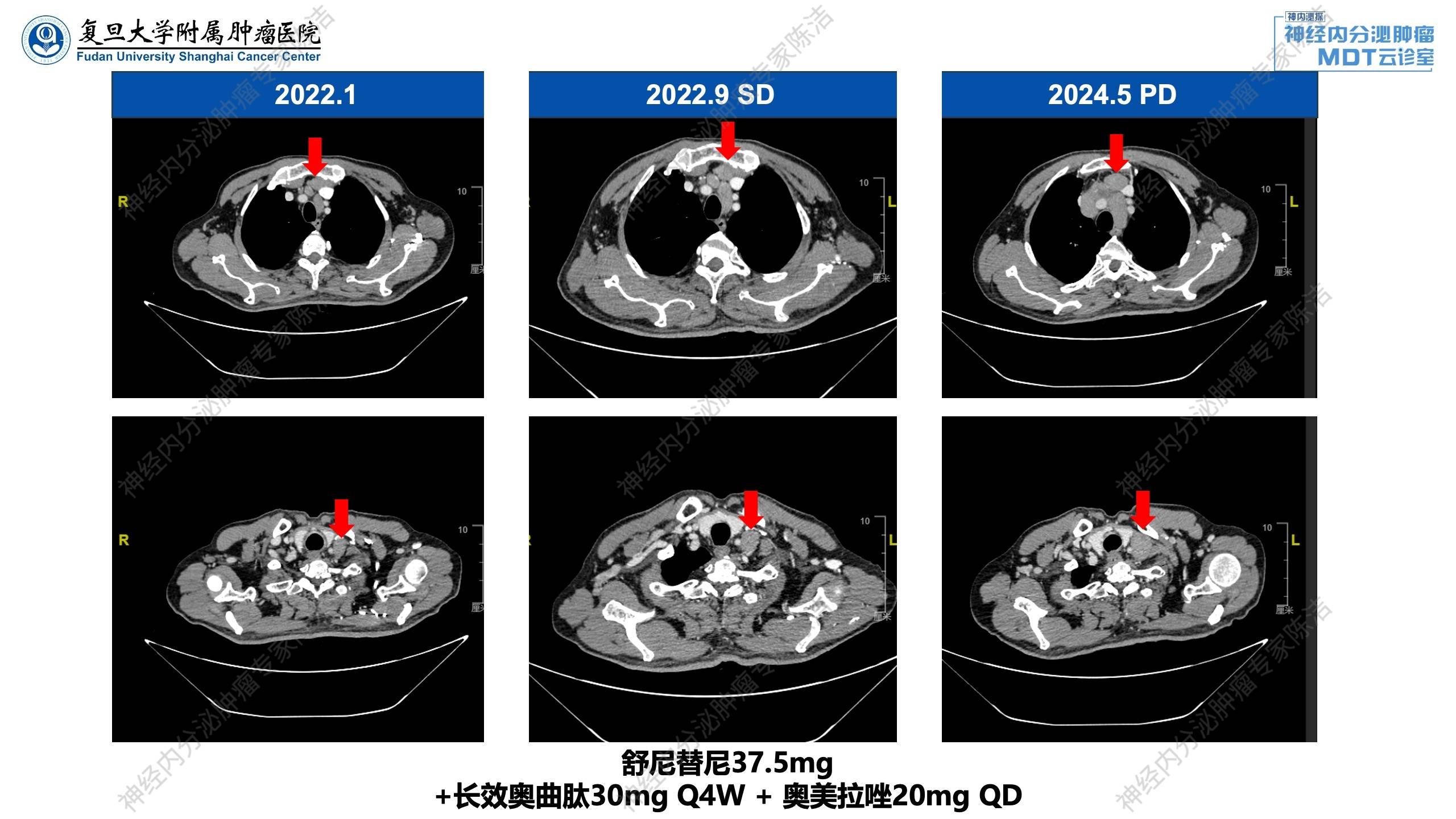
2024年5月:复查提示淋巴结病灶增大,评估为疾病进展(PD)。治疗方案改为CAPTEM方案(卡培他滨+替莫唑胺),并继续联合长效奥曲肽及奥美拉唑。

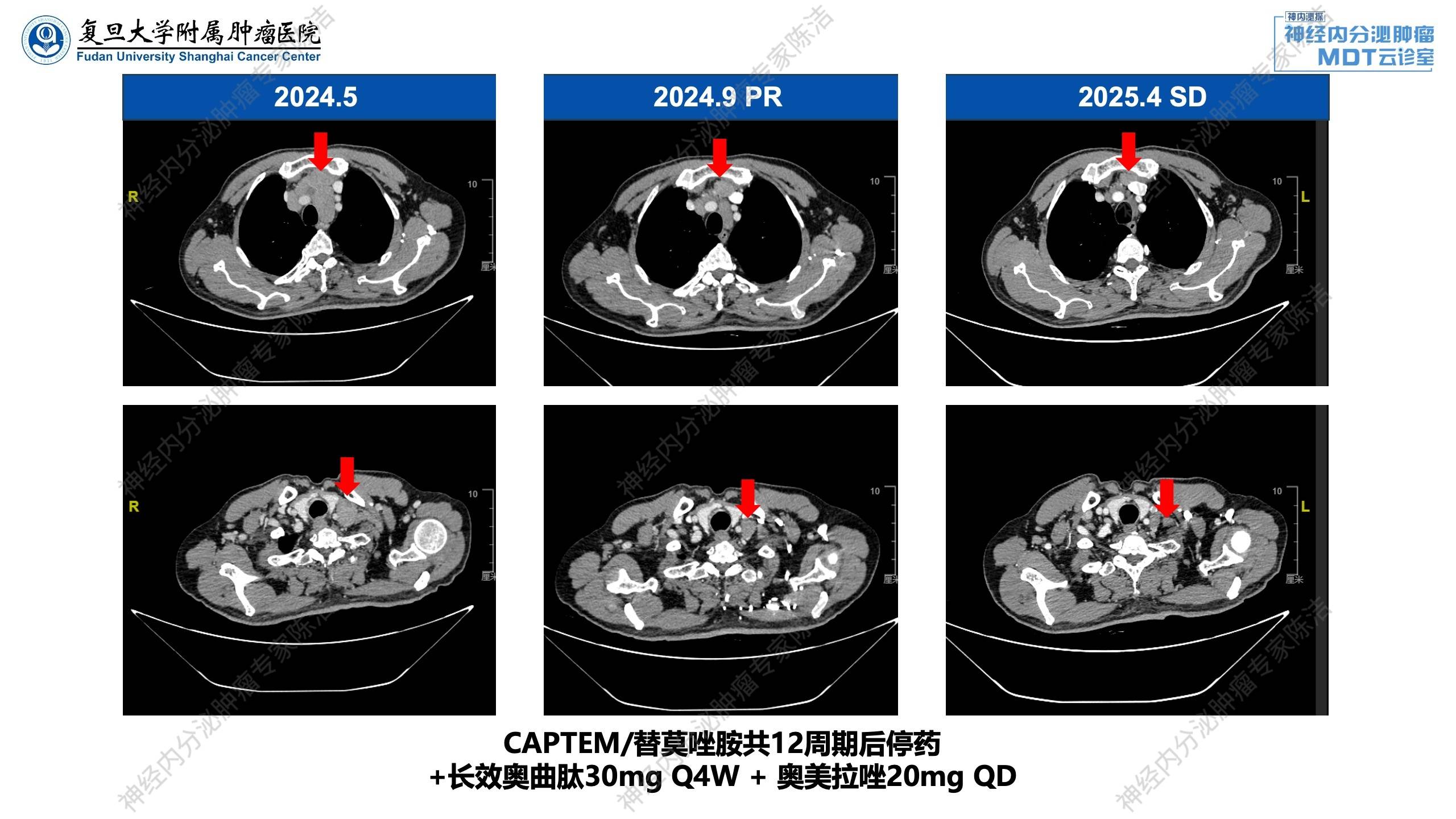
2024年9月:复查评估为部分缓解(PR)。因出现手足综合征,停用卡培他滨,改为替莫唑胺单药维持化疗,并继续联合长效奥曲肽及奥美拉唑。
2025年5月至今:替莫唑胺使用已满12周期,予停替莫唑胺,继续长效奥曲肽及奥美拉唑治疗,定期复查,肿瘤仍持续SD。

多学科团队(MDT)讨论
病理科黄丹教授:该患者的病理形态是诊断MEN-1的重要线索。在显微镜下,除了肉眼可见的4cm主瘤灶(NET G2, Ki-67 3%),在背景胰腺组织中还发现了大量的微小神经内分泌肿瘤。这种特征与散发性肿瘤单发、背景正常的特点截然不同。此外,淋巴结转移灶的Ki-67指数(5%)略高于原发灶,提示了肿瘤的高危生物学行为。
核医学科徐俊彦教授:该患者最初进行的是99mTc-TOC扫描,虽然分辨率有限,但仍显示了胰腺残端及纵隔淋巴结的SSTR高表达。随后进行的68Ga-DOTANOC-PET/CT提供了更清晰的图像,不仅确认了SSTR的高表达,还发现了更多微小病灶。
放射诊断科汤伟教授:术前增强CT显示胰尾部有一个明确占位,密度不均匀,富血供伴有低强化区,符合神经内分泌肿瘤特征。在动态图上可以看到肿块旁边还有多个强化的病灶,考虑多发胰腺神经内分泌瘤,提示临床有遗传综合征(如MEN-1综合征)的可能。关于疗效评估,CT动态展示了纵隔淋巴结的变化:2024年5月淋巴结较前明显增大(PD),更换替莫唑胺为基础的化疗方案后,淋巴结明显退缩(PR),证实治疗有效,停替莫唑胺治疗后,多次复查肿瘤稳定。
病例介绍
病例2:49岁,男性。
主诉:体检发现胰腺多发占位。
外院诊疗经过:
2024年5月:外院腹部增强CT发现胰腺多发囊实性占位,MEN-1可能。18F-FDG-PET/CT提示胰腺多发囊实性占位,增强后病灶边缘强化,代谢未见明显增高,考虑神经内分泌肿瘤可能;前纵隔异常信号灶,增强可见边缘轻度强化,代谢增高,恶性病变待排,胸腺来源?胸骨上窝肿大淋巴结,代谢增高,转移性病变不除外;胃粘膜皱襞宽大伴弥漫性代谢增高。
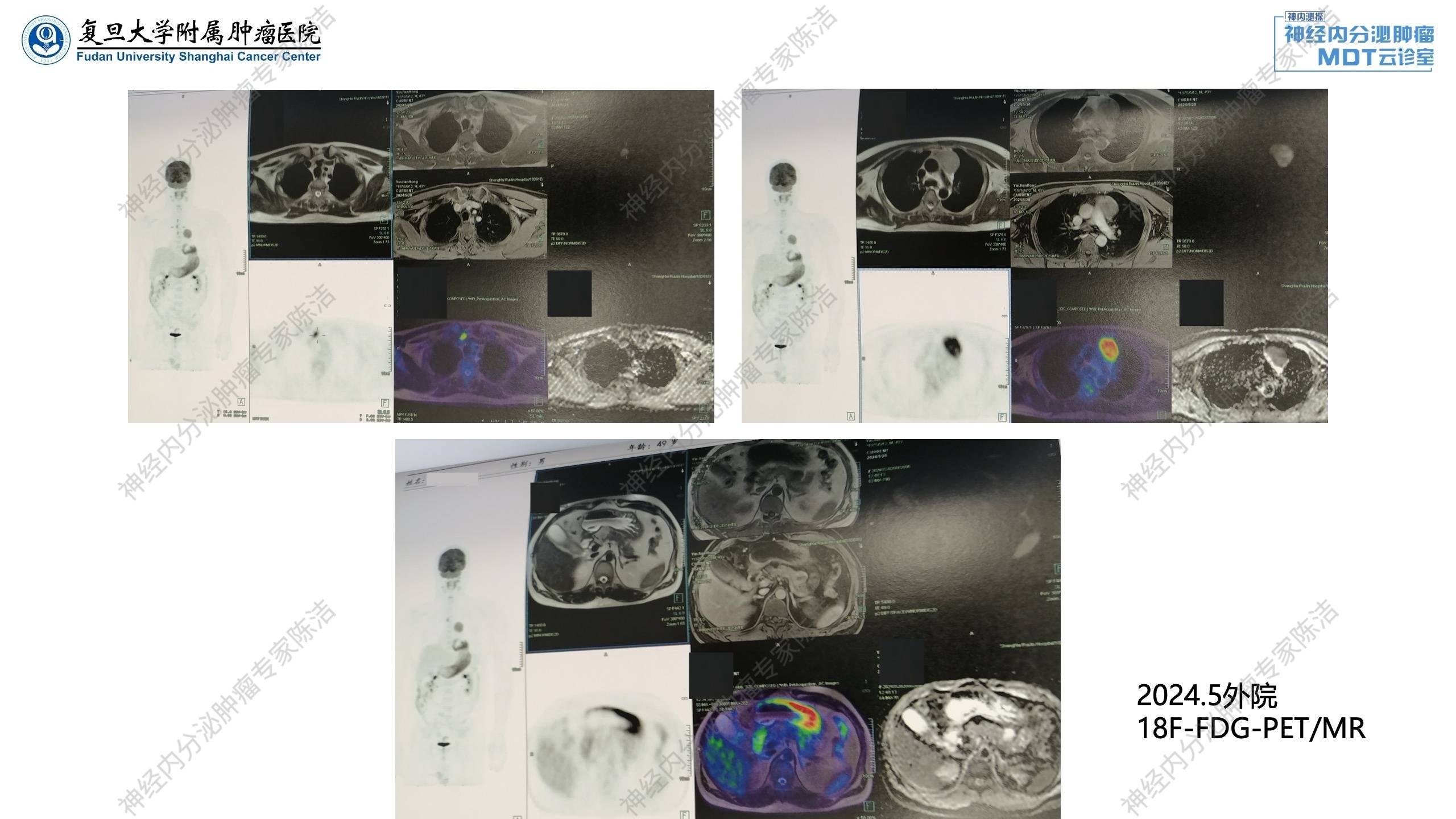
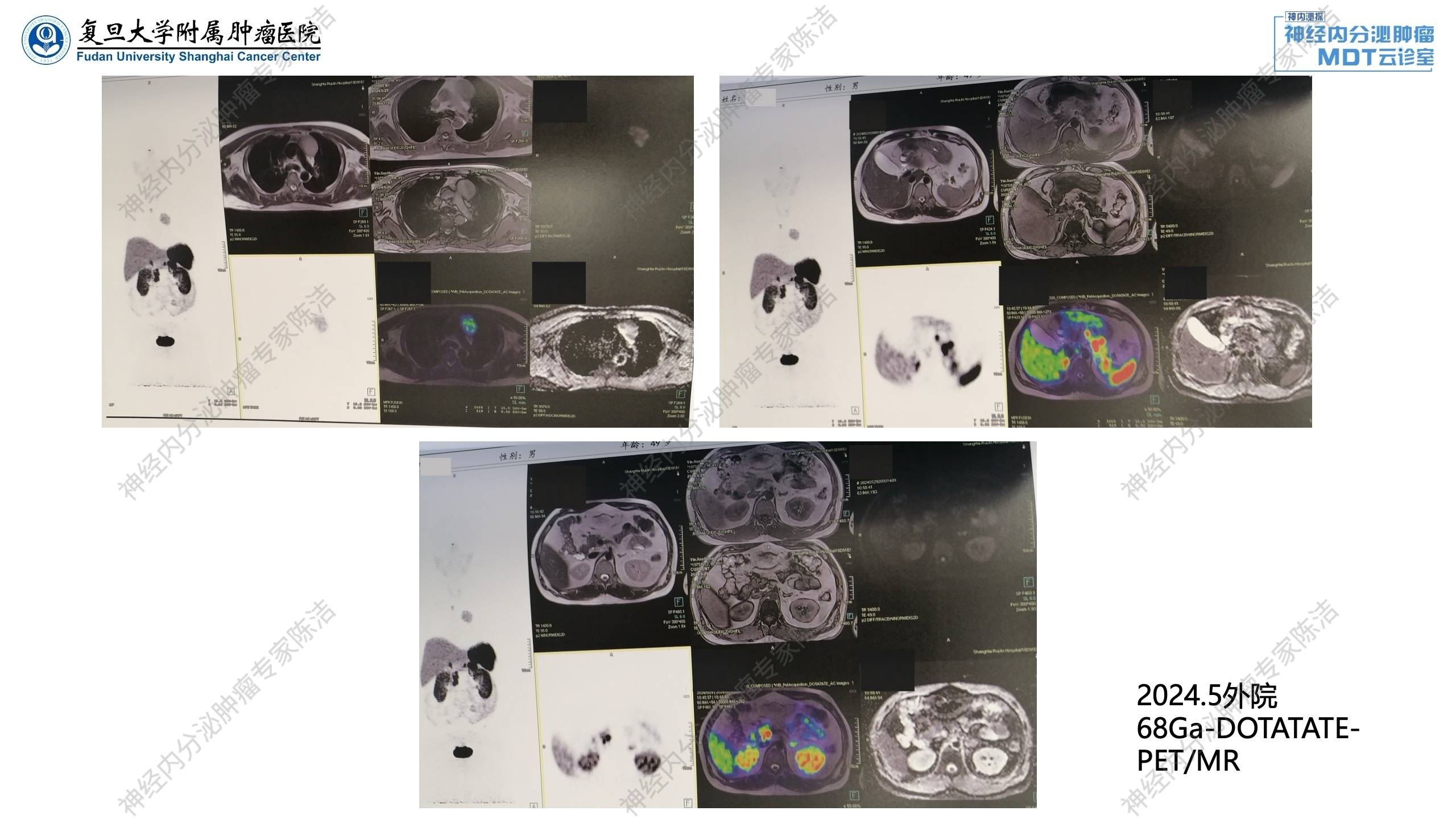
68Ga-DOTATATE-PET/MR提示胰腺多发囊实性占位,DOTATATE摄取增高,首先考虑多发胰腺神经内分泌瘤;前纵隔异常信号灶,DOTATATE摄取增高,结合FDG-PET考虑胸腺来源恶性病变可能,类癌?胸骨上窝异常信号灶,DOTATATE摄取增高,转移性淋巴结可能;左侧甲状腺上极背侧及左侧甲状腺下极点状DOTATATE摄取增高灶。
胸部增强CT提示前上纵隔团块,上纵隔见结节高密度影。
查血钙2.53-2.74mmol/L,24H尿钙:16.18 mmol/24h,PTH 125.9 pg/mL;甲状旁腺彩超提示左侧甲状腺中上极下方及下极下方低回声病灶,旁腺来源可能。甲状旁腺MIBI显像提示:左侧甲状腺中部后方见低密度结节影,边界清晰,可见MIBI摄取增高,考虑甲状旁腺腺瘤。右侧甲状腺中部后方见低密度结节影,未见MIBI摄取,考虑甲状旁腺腺瘤可能。上述病变下方另见一结节影,MIBI摄取轻度阳性,甲状旁腺来源待排。
垂体MRI提示垂体强化不均。

患者于2024年6月18日于外院行胸腔镜下纵隔病损切除术+胸膜粘连松解术。术后病理:符合神经内分泌肿瘤,核分裂象约6-8个/2mm2,可见小灶坏死,符合不典型类癌/神经内分泌瘤(G2)
外院予行胚系基因检测:MEN1基因致病突变。

我院诊疗经过:
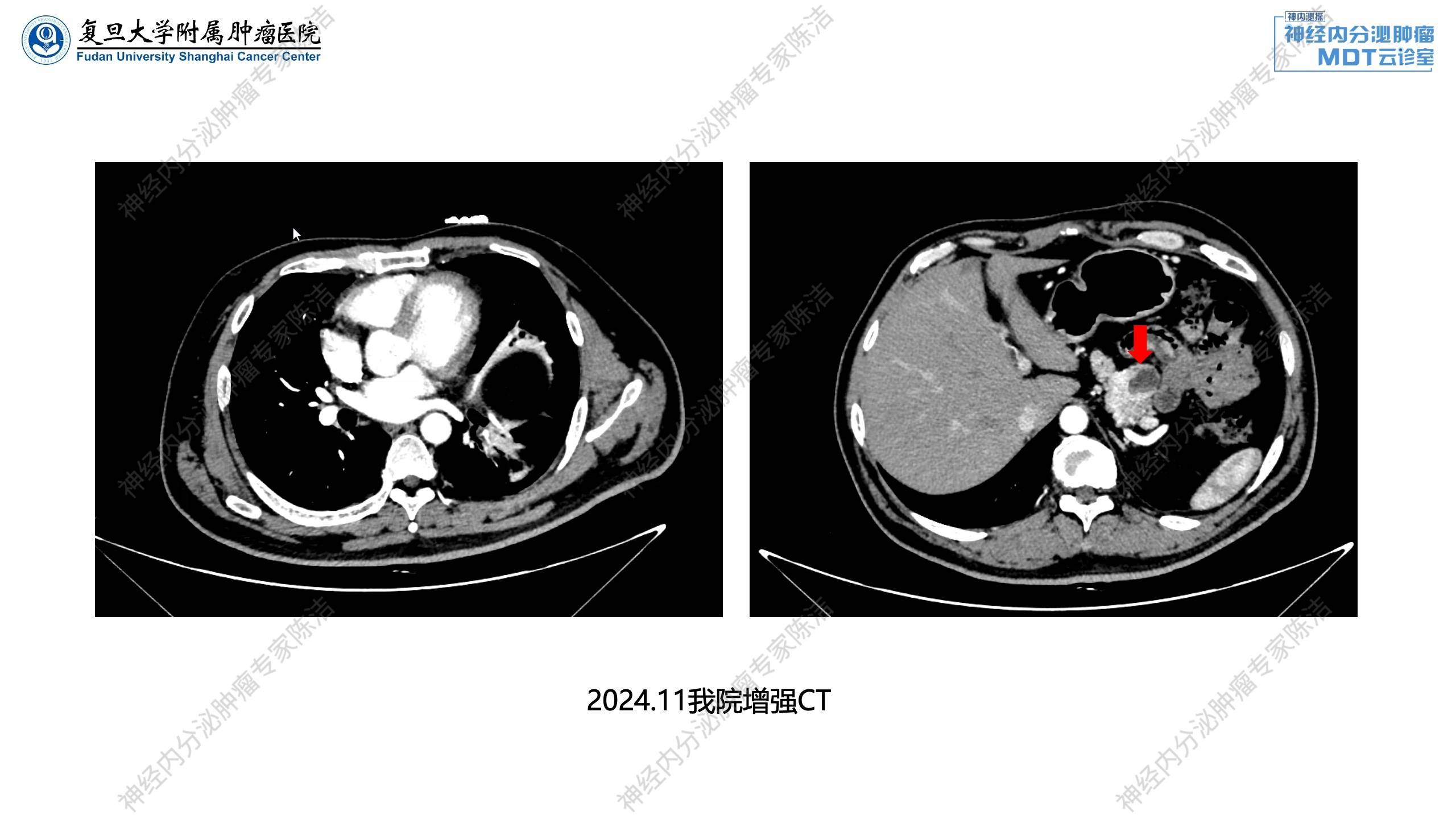
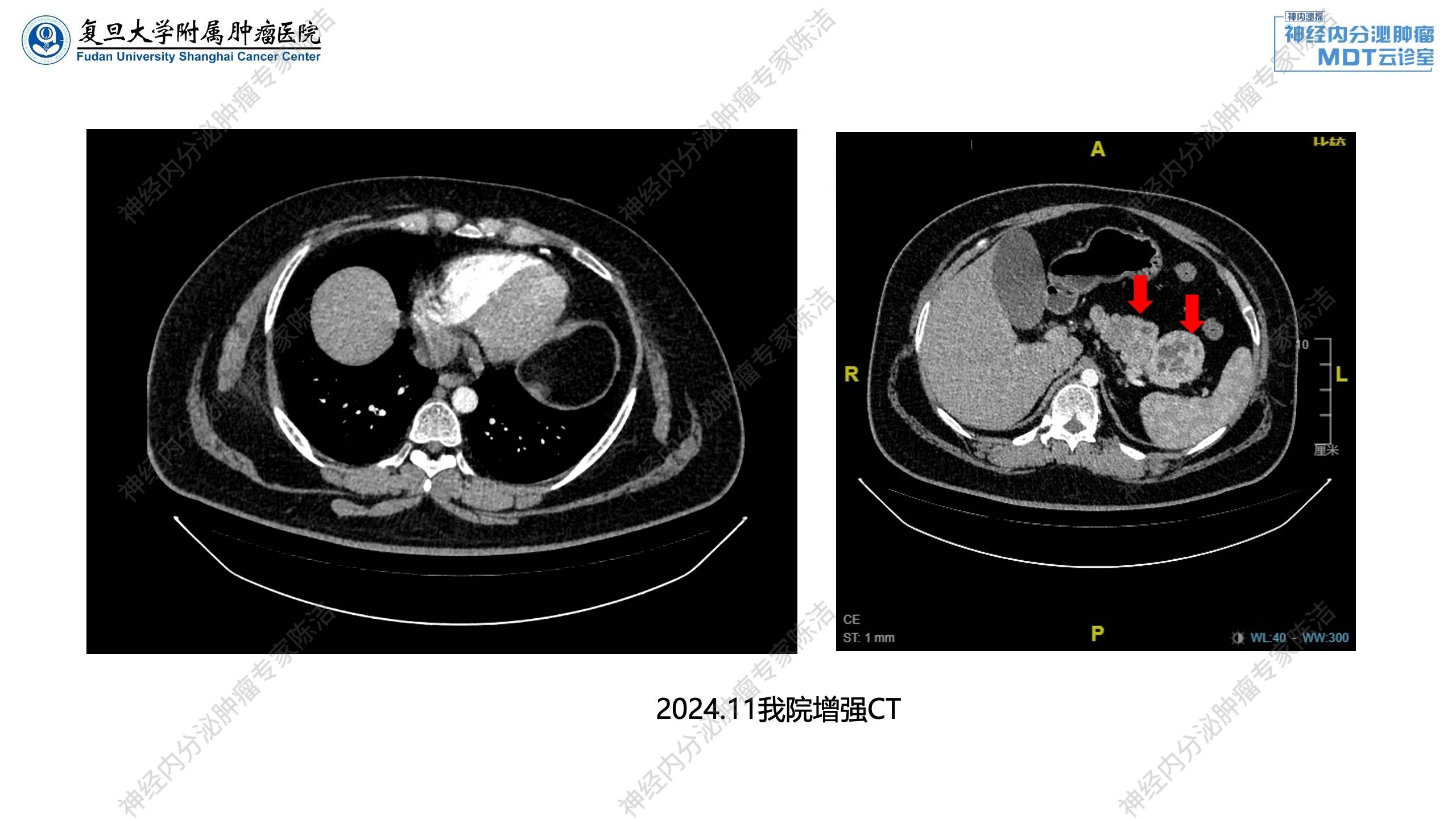
2024年11月:予完善相关激素检测,示垂体激素正常;胃泌素升高,PTH升高,血钙轻度升高。增强CT示胰腺多发囊实性占位;双肾小结石。
行超声内镜引导下胰腺病灶穿刺,病理示胰腺神经内分泌瘤,G1级。

鉴于胰腺病灶SSTR高表达且分级较低,予以长效奥曲肽 20mg Q4W维持治疗。
2025年4月及10月:定期复查增强CT,胰腺病灶持续稳定,未见新发病灶。疗效评价为SD。血钙、磷及激素水平基本稳定。

多学科团队(MDT)讨论
病理科黄丹教授:对于前纵隔病灶,结合免疫组化,且伴有坏死和核分裂象活跃,诊断为不典型类癌(肺/纵隔NET分类,相当于NET G2),没有脉管侵犯等其他高危因素。对于胰腺病灶(穿刺样本),诊断为NET G1。对比两者,虽然都是NET,但前纵隔病灶SSTR阴性,而胰腺病灶SSTR强阳性。
核医学科徐俊彦教授:外院FDG-PET提示前纵隔病灶显示清晰,糖代谢很高,且有区域淋巴结转移,但胰腺部位FDG低代谢。与之相反,DOTATATE-PET提示前纵膈病灶生长抑素仅轻度摄取,而胰腺可见多发生长抑素受体高表达病灶。考虑胰腺病灶及纵隔病灶为双原发神经内分泌肿瘤,结合病史,符合多发性内分泌腺瘤病1型表现。
放射诊断科汤伟教授:腹部增强CT显示胰体部有一个比较大的富血供占位,中央伴有一些囊变。除此之外,胰头、胰体、胰尾还有多个富血供占位。这跟第一个病例比较相似,为多灶性胰腺神经内分泌瘤的改变。
病例介绍
病例3:25岁,男性。
主诉:体检发现胰尾占位。
外院诊疗经过:
2024年9月:外院体检,腹部CT发现胰尾部占位(4.8cm*4.6cm)。
我院诊疗经过:
2024年9月:胰腺增强CT示胰头钩突及体尾部多发强化肿块结节,大者55*51mm。
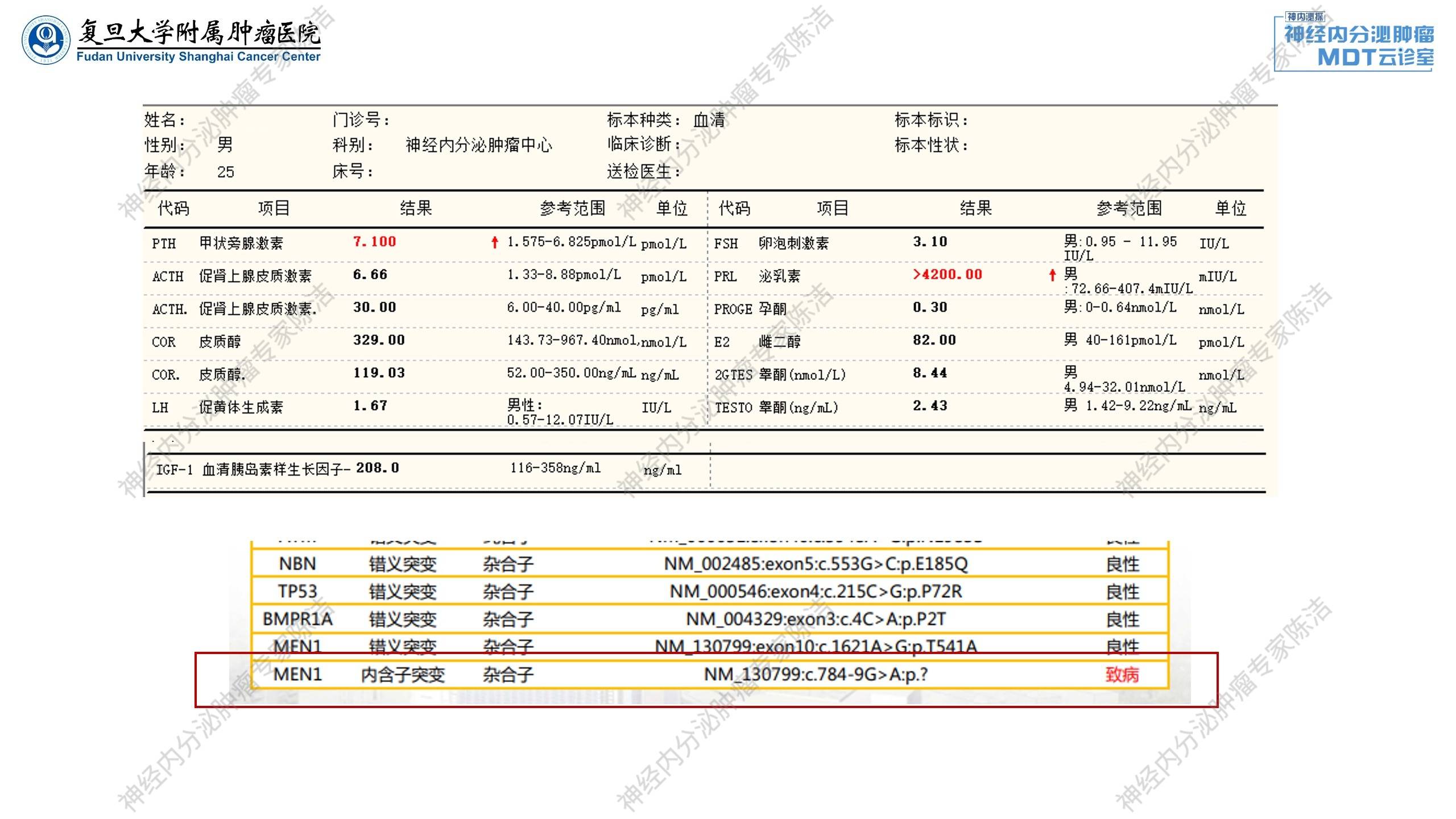
实验室检查示:血钙:2.67mmol,血葡萄糖:2.51mmol/L,泌乳素、甲状旁腺素升高。

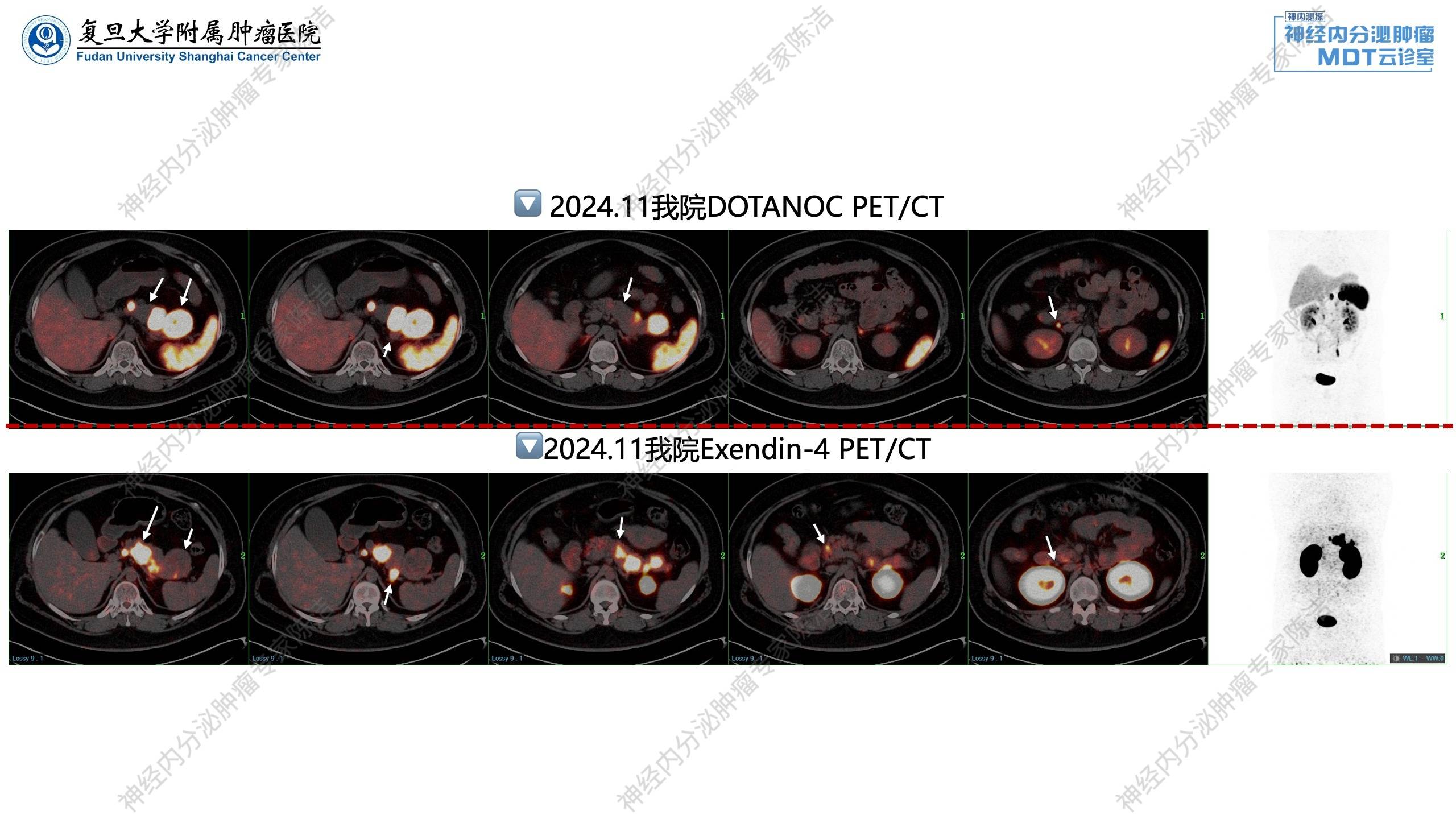
68Ga-DOTANOC-PET/CT示:胰腺及十二指肠降部多发NET,肠系膜根部及胰头后方多发淋巴结转移,生长抑素受体高表达,SSTR-RADS 5;垂体饱满,NOC摄取轻度增高,生理性摄取与pitNET难以鉴别。
患者虽无典型低血糖临床表现,但实验室检查发现血葡萄糖明显下降,予进一步完善GLP-1R-PET/CT,结果示:与2024年10月11日NOC PET/CT相比较,胰腺全程多发NET,部分SSTR高表达,部分GLP-1R高表达,GLP-1R高表达者考虑为胰岛素瘤,主要定位于颈体尾,胰头部仅见钩突一枚小病灶;胰尾后方淋巴结转移,GLP-1R高表达,SSTR不表达;肠系膜根部及胰头后方转移淋巴结,十二指肠降部病灶,SSTR高表达,GLP-1R不表达。
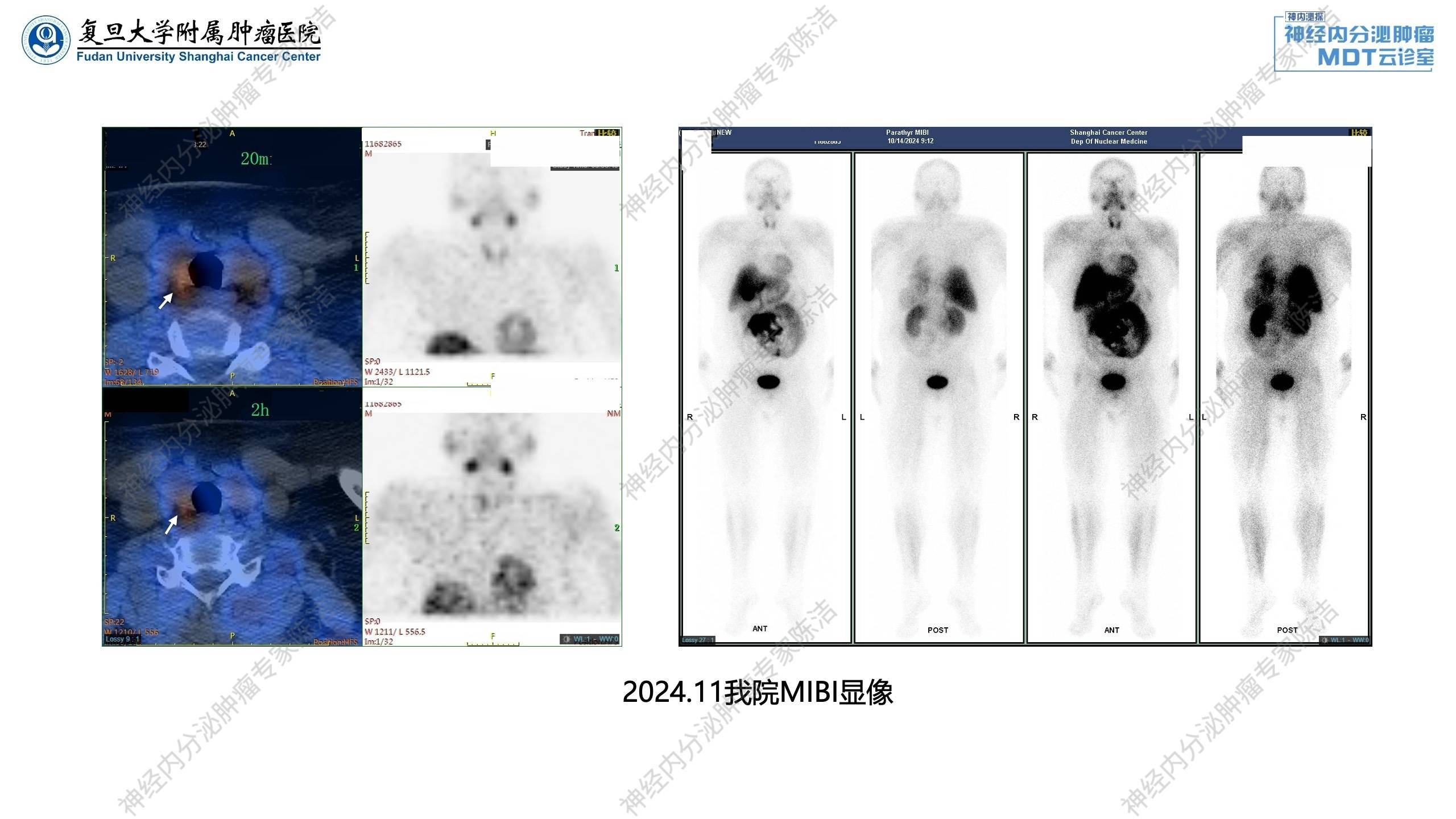
甲状旁腺MIBI显像提示甲状腺右叶后方结节,早期及延迟显像均见99mTc-MIBI摄取增高,提示为甲状腺旁腺来源可能。
胚系基因检测提示MEN1基因致病突变。
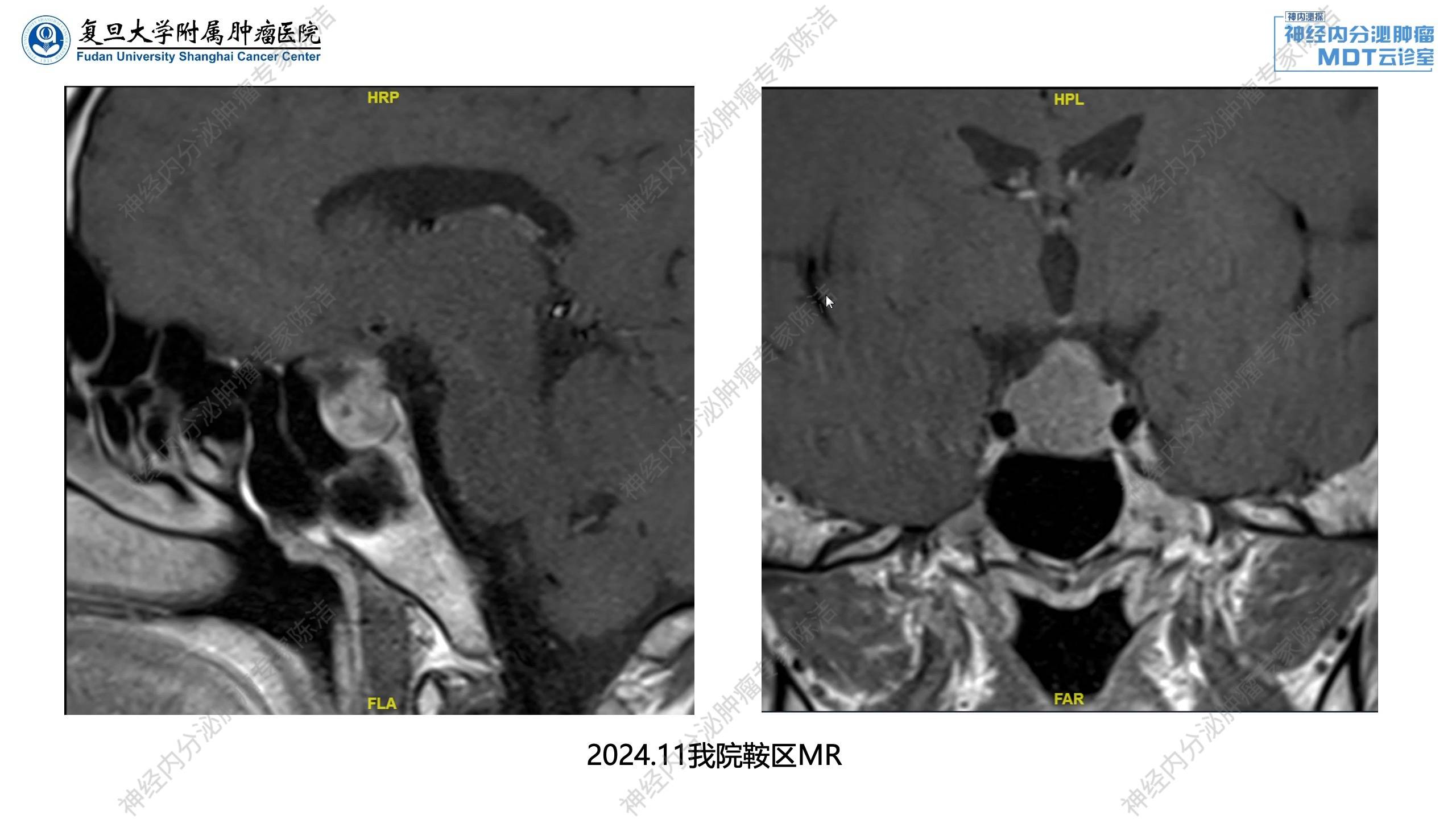
鞍区MRI示鞍区较大占位伴囊变,考虑垂体NET。
患者于2024年11月7日在全麻下行内镜下经鼻蝶入路垂体瘤切除术。术后病理提示垂体稀疏颗粒型泌乳素细胞腺瘤。
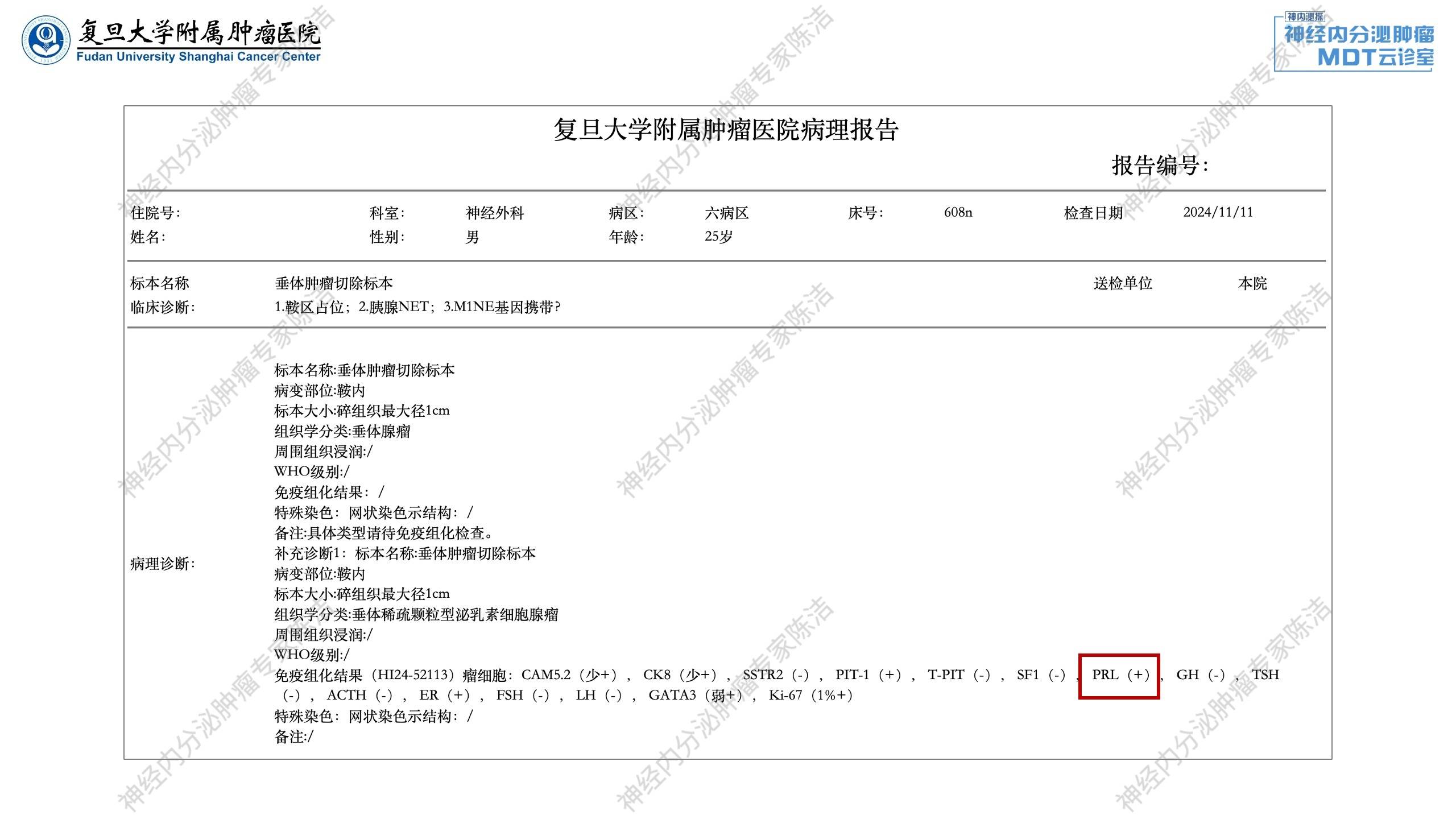
患者于2024年12月17日在全麻下行腹腔镜根治性胰体尾切除术+腹腔镜下脾切除术。术后病理:符合神经内分泌瘤(NET,G2),Ki-67(+,热点区约3%)。

2025年2月:复查增强CT,胰腺术区未见肿瘤复发,查血糖、激素水平(PTH、血钙、磷、PRL)均在正常范围。建议1年后复查鞍区MRI+胸腹盆增强CT+PTH+血钙磷+垂体激素+ACTH。

多学科团队(MDT)讨论
病理科黄丹教授:该患者垂体部位的肿瘤,根据WHO新版分类归为神经内分泌肿瘤,亚型分析为稀疏颗粒型泌乳素瘤(PRL阳性)。胰腺多发病灶特征为NET G2,SSTR(部分阳性,部分阴性),且PRL阴性,排除了垂体转移。虽然两个部位肿瘤类型一样,但起源组织学不同。
核医学科徐俊彦教授:该患者实验室检查发现低血糖,通过GLP-1R-PET/CT发现胰颈后方大病灶和胰头钩突部微小病灶均呈GLP-1受体高表达。这帮助外科医生精准定位了分泌胰岛素的功能性病灶,进行了胰体尾切除和胰头微小病灶的定点剜除,去除了功能性肿瘤,极大提高了患者生活质量。
放射诊断科汤伟教授:术前增强CT跟核医学PET结果一致,经观察发现存在两个较大的病灶,同时胰头部位亦有若干较小病灶,可明确为多灶性pNET。垂体MRI提示鞍区有个比较大的占位,两侧海绵窦受压,考虑垂体神经内分泌肿瘤改变。
陈洁教授总结
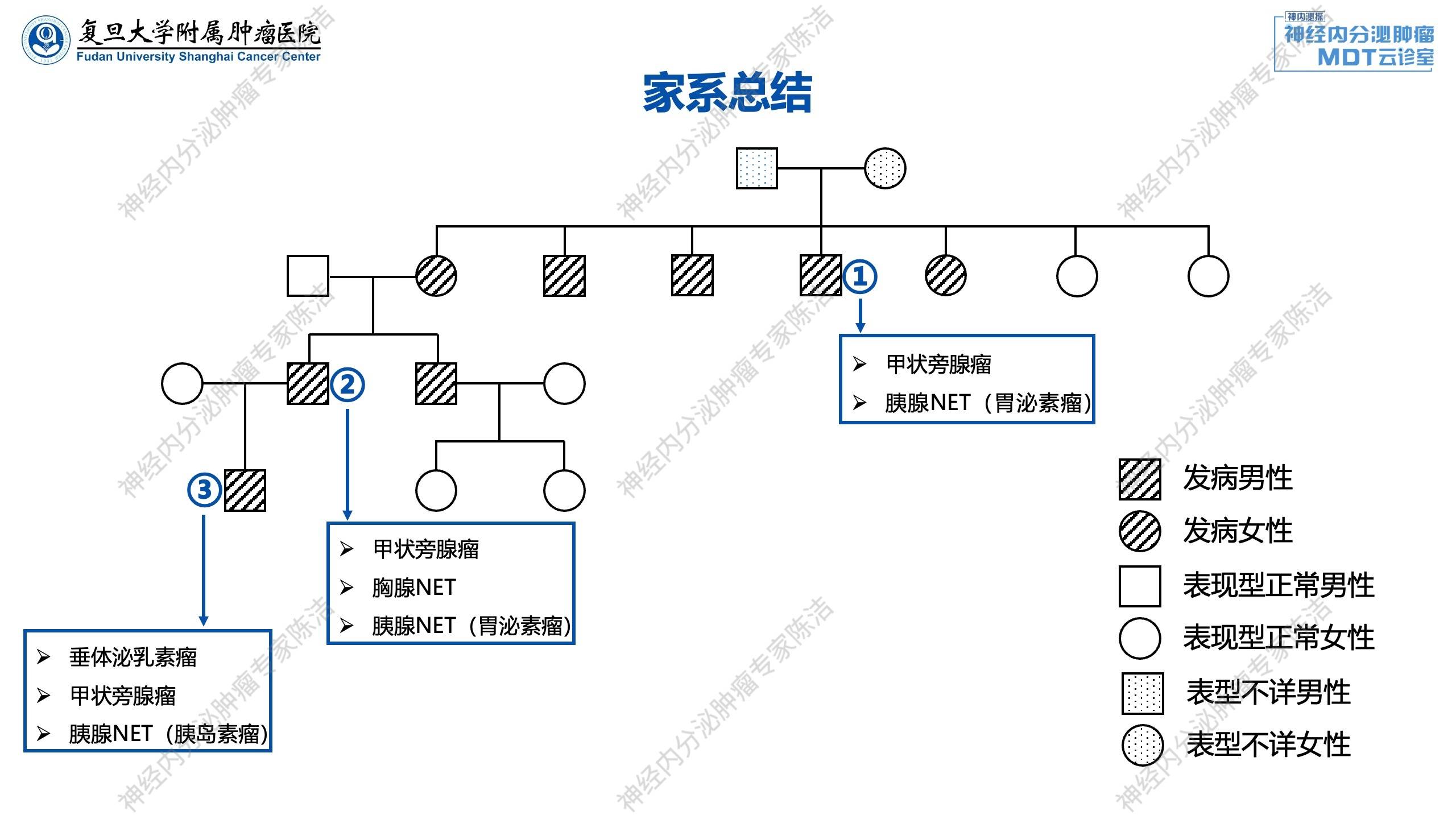
MEN-1是遗传性神经内分泌肿瘤综合征中最好发的类型,以上分享的三个病例构成了一个典型的MEN-1家系。该家系三代人均存在致病基因突变,呈现出代代相传的特征,导致家族成员出现甲状旁腺瘤、胸腺神经内分泌肿瘤、胰腺神经内分泌肿瘤及垂体神经内分泌肿瘤等一系列典型的MEN-1相关肿瘤表现。这体现了该病的遗传危害性,若不尽早识别出致病基因携带者,悲剧将在家族中一代代重演。
在临床工作中,对于具备以下特征的患者需高度怀疑MEN-1:发病年龄较轻;多发、多部位受累,如同时累及垂体、甲状旁腺、胰腺及胸腺等。此类患者需进一步通过基因检测证实。值得注意的是,MEN-1相关肿瘤具有时空异质性,即在不同年龄阶段呈现不同表型,各部位肿瘤并非同时发生,而是可能在不同时期显现。
针对本家系中三个病例的治疗,遵循以下分部位处理原则:对于存在甲状旁腺瘤的患者(常因泌尿系结石或高钙血症就诊),应优先进行手术处理(如前两例患者均已行手术)。胸腺神经内分泌肿瘤往往不表达生长抑素受体,靶向药物或化疗的有效维持时间相对有限。因此,若具备手术条件,应尽可能优先切除。切除不表达受体的胸腺病灶后,后续处理胰腺神经内分泌肿瘤将更为从容。胰腺神经内分泌肿瘤通常表达生长抑素受体,使用生长抑素类似物即可获得长期维持治疗效果(如前两例患者术后均使用了此类药物)。另外,MEN-1相关的胰腺神经内分泌肿瘤常为胰腺多发小病灶。本家系中的三个胰腺肿瘤病例均为功能性肿瘤(2例分泌胃泌素,1例分泌胰岛素),故手术选择相对积极;若切除不净,再予以药物治疗。对于无功能、病灶极小的多发病灶,可予随访或小剂量药物维持。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室第三十八期 | 神经内分泌肿瘤基因检测专场回放:
https://doctor.liangyihui.net/#/doc/160363

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


