每年11月10日为神经内分泌肿瘤日(NET Cancer Day),设立该纪念日旨在提高大众对神经内分泌肿瘤的认知,为神经内分泌肿瘤这一罕见肿瘤的患者群体发声,以改善该疾病的诊断、治疗、护理及研究。2025年的神经内分泌肿瘤日,由上海市防癌抗癌事业发展基金会主办,陈洁教授领衔的复旦大学附属肿瘤医院神经内分泌肿瘤多学科团队,联合国内多位神经内分泌肿瘤专家,举办了公益云问诊,为神经内分泌肿瘤患者提供线上公益问诊,解答患者及家属在神经内分泌肿瘤诊治过程中可能存在的困惑,以期患者得到更好的治疗和照护。本期为云问诊的第5例病例——一例胃神经内分泌癌患者,详细阐述该病例局部治疗及术后治疗误区、术后复发后一线化疗及入组临床试验的诊治全程,并记录了陈洁教授对患者及家属提出的问题进行的细致解答。
病例介绍
患者基本情况:男性,64岁。
主诉:胃神经内分泌癌ESD术后5个月发现肝转移。
外院诊疗经过:
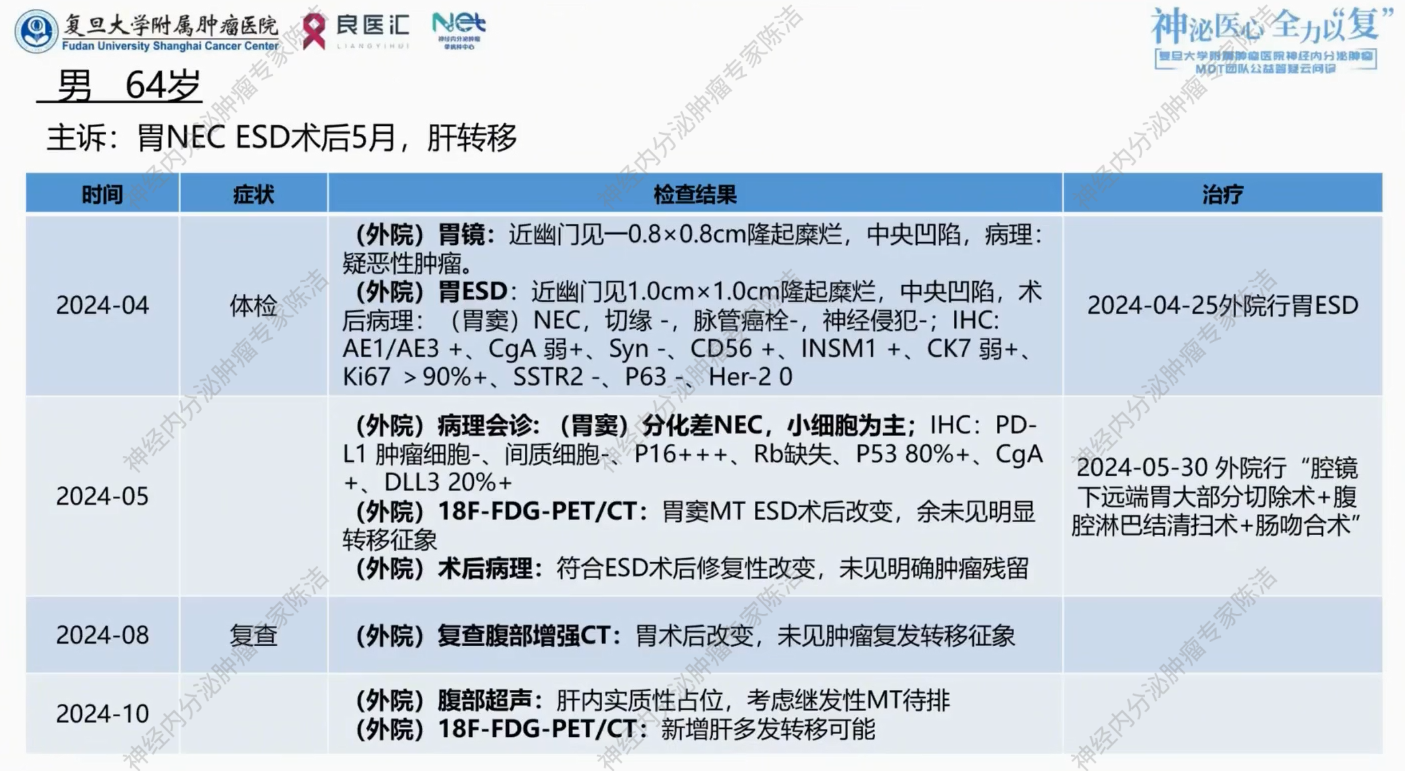
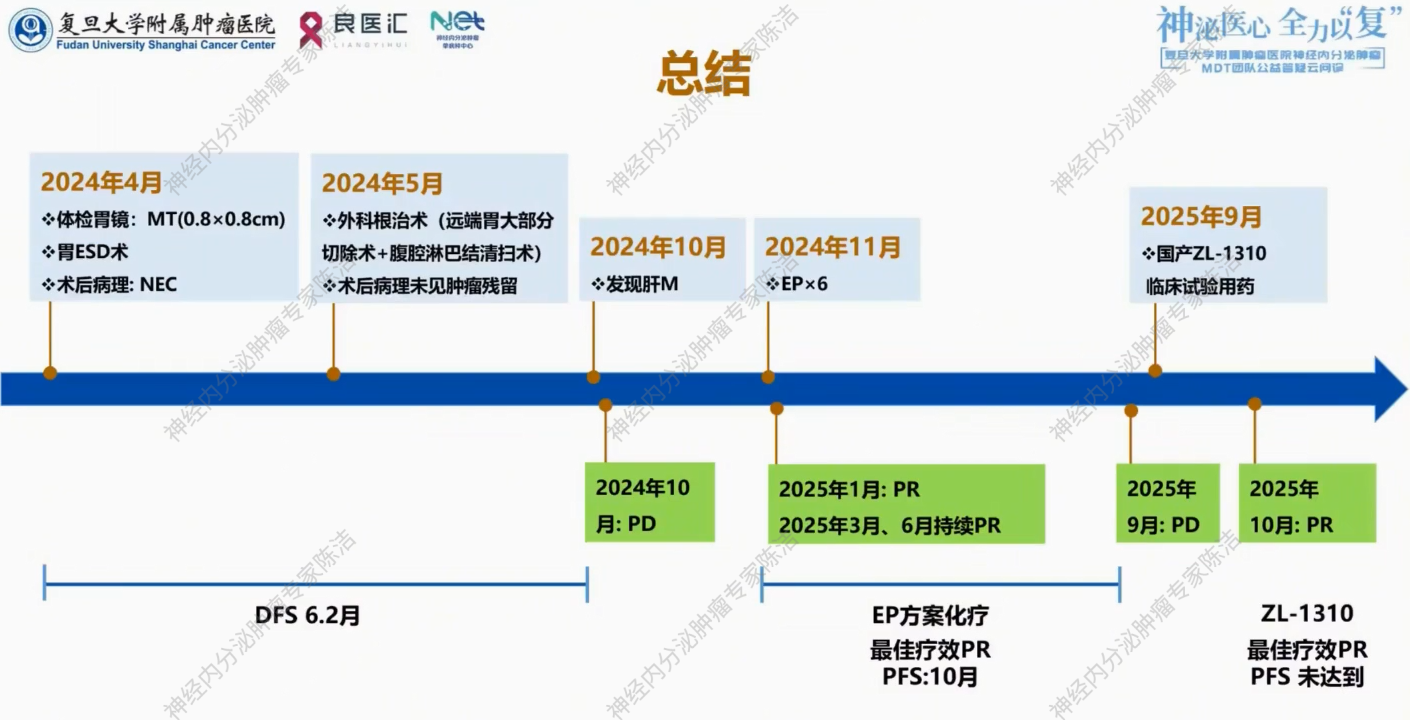
2024年4月,患者体检胃镜发现幽门处约0.8cm*0.8cm隆起糜烂,中央凹陷。病理提示恶性肿瘤可能。2024年4月25日外院行胃ESD治疗。
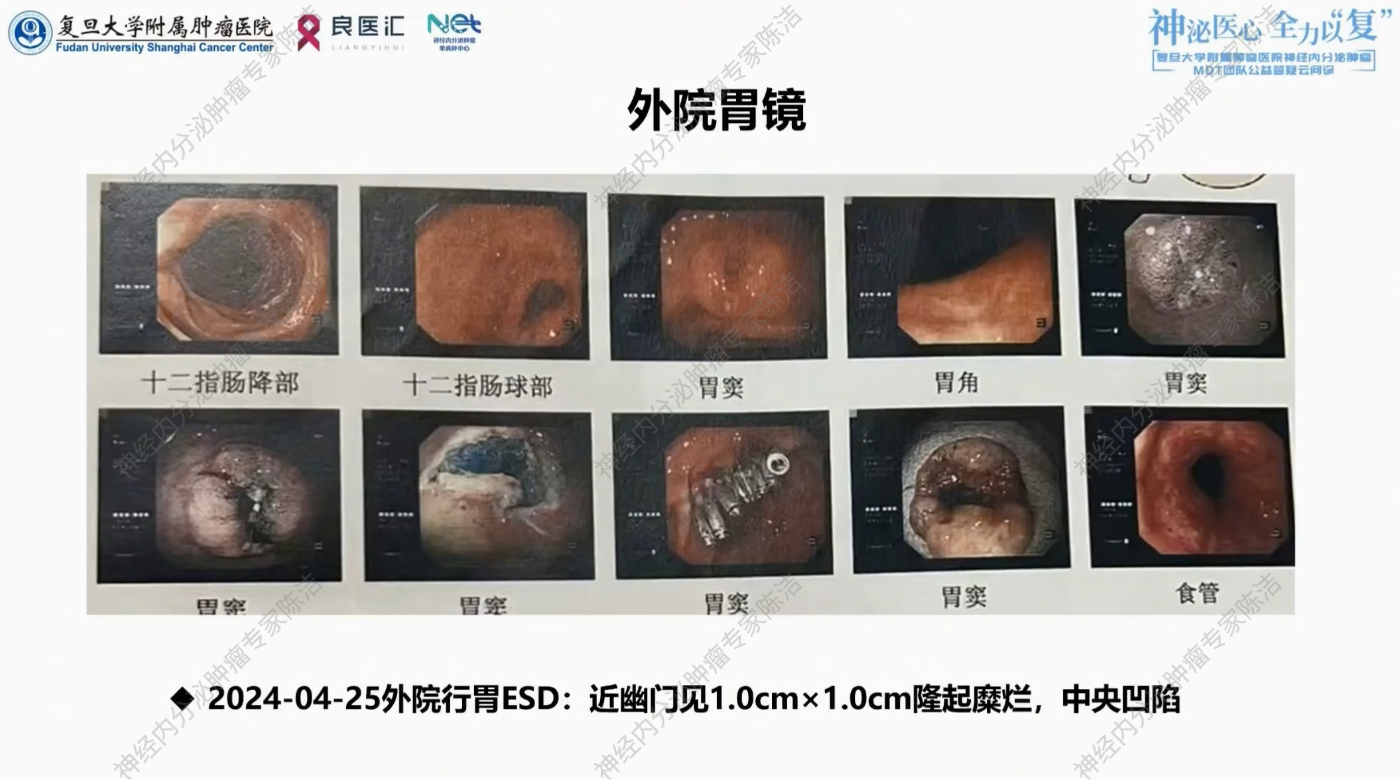
ESD术后病理提示:胃窦部神经内分泌肿瘤。免疫组化提示:AE1/AE3+、CgA弱+、Syn-、CD56+、INSM1+、CK7弱+、Ki67>90%+、SSTR2-、P63-、Her-2 0。
2024年5月,外院进一步进行病理会诊,提示(胃窦)分化差神经内分泌癌,小细胞为主。免疫组化提示:Rb缺失、p53(80%+)、DLL3(20%+)。

外院FDG-PET/CT提示胃窦恶性肿瘤ESD术后改变,余未见明显转移征象。2024年5月30日外院行“腹腔镜下远端胃大部切除术+腹腔淋巴结清扫术+肠吻合术”。术后病理提示符合ESD术后修复性改变,未见明确肿瘤残留,淋巴结阴性。

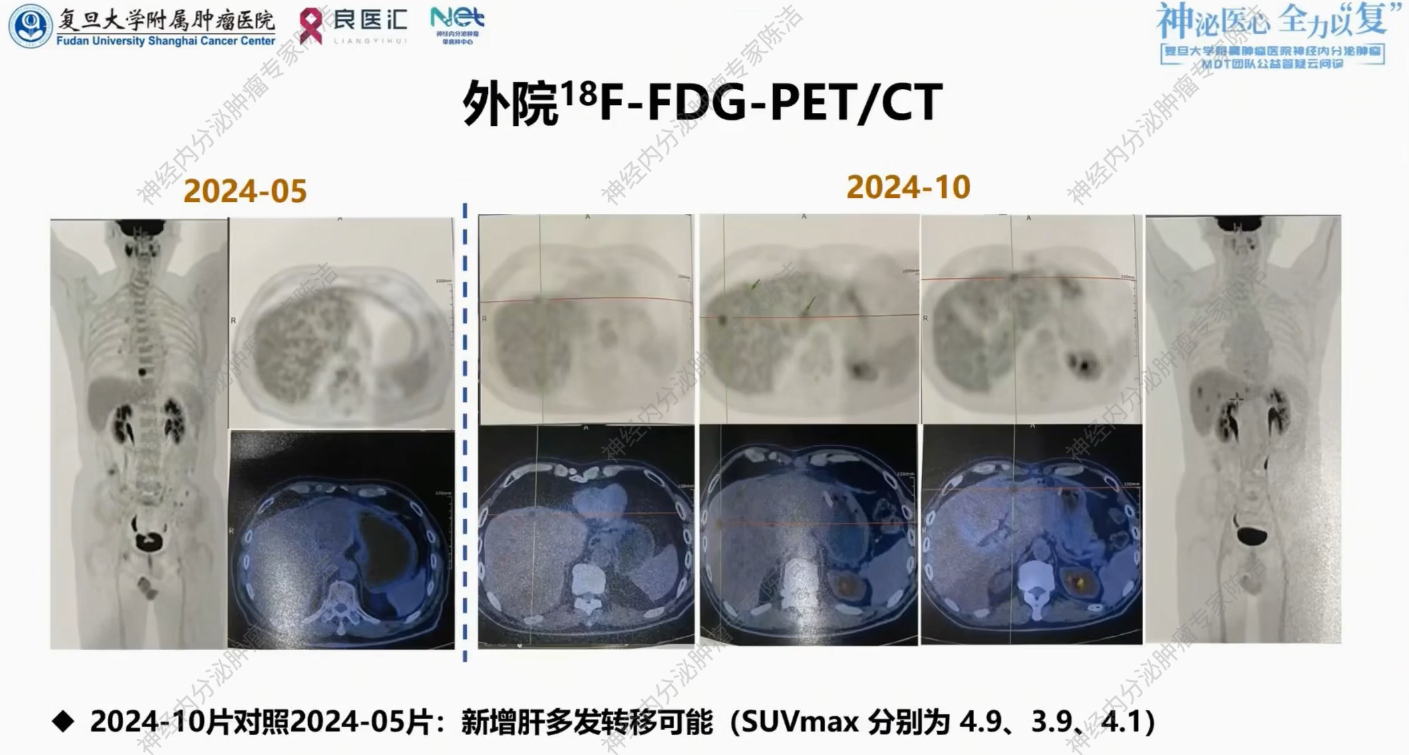
术后外院未予辅助化疗,定期复查。2024年8月复查腹部增强CT,提示胃术后改变,未见肿瘤复发转移征象。2024年10月,腹部超声发现肝脏实质性占位。外院进一步行18F-FDG-PET/CT提示肝内新发多发转移可能。
我院诊疗经过:
患者于2024年11月至我院就诊,完善胸腹盆增强CT+肝普美显MRI,提示肝脏多发结节,考虑胃神经内分泌癌术后肝转移。

一线治疗:
患者于2024年11月11日起行C1-3程EP方案(依托泊苷+顺铂)化疗。2025年1月复查胸腹盆增强CT+肝普美显MRI,提示肿瘤明显退缩,疗效评价为部分缓解(PR)。2025年1月13日起行C4-6程EP方案化疗。2025年3月复查评估,肿瘤均明显退缩,疗效评价为持续PR。后续予定期复查。
2025年9月,停药半年后复查,影像学提示肝脏尾状叶及右叶出现新发病灶并增大,评估为疾病进展(PD)。

后续治疗:
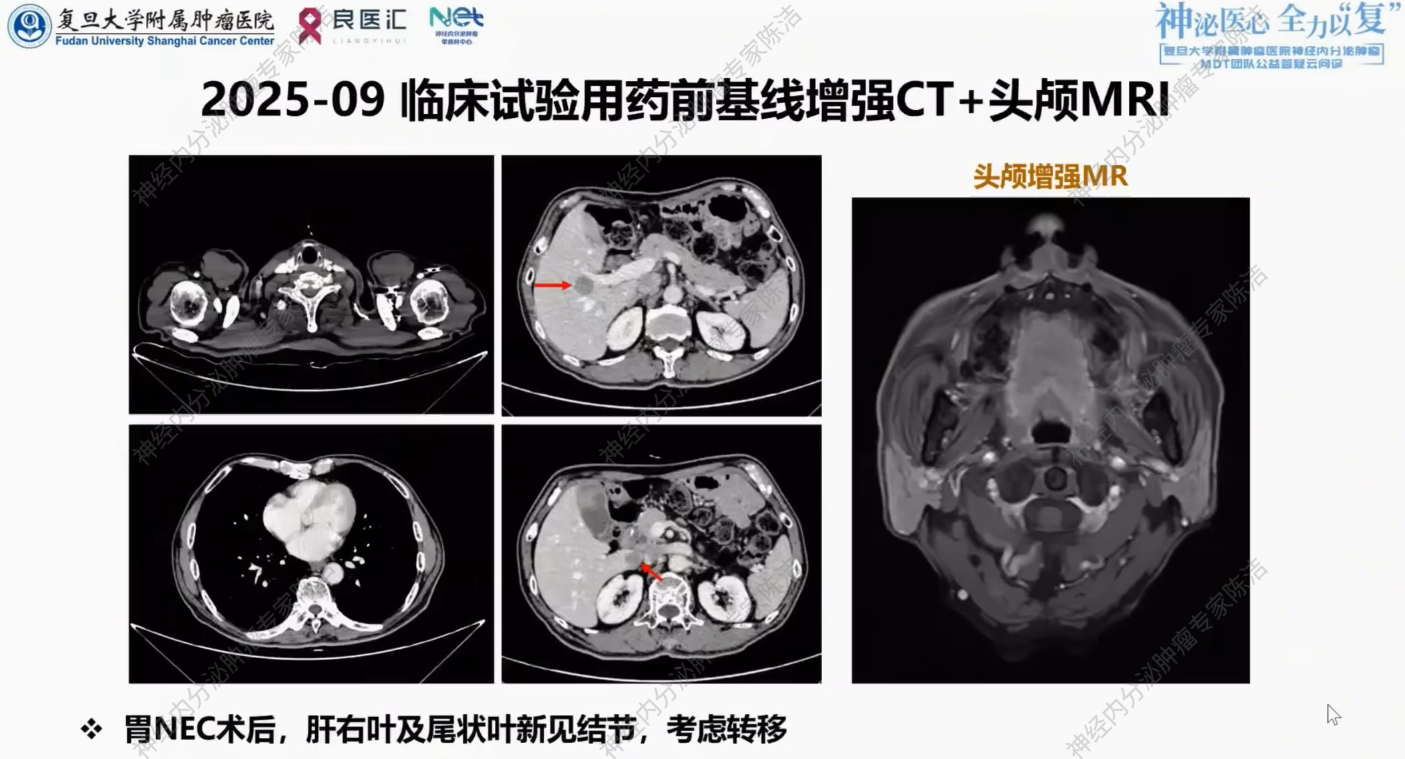
考虑到患者DLL3表达阳性,且一线化疗后进展,筛选入组ZL-1310临床试验,2025年9月23日起行C1-2程临床试验用药。2025年10月复查,提示肝内病灶肉眼可见明显缩小,评估为PR。
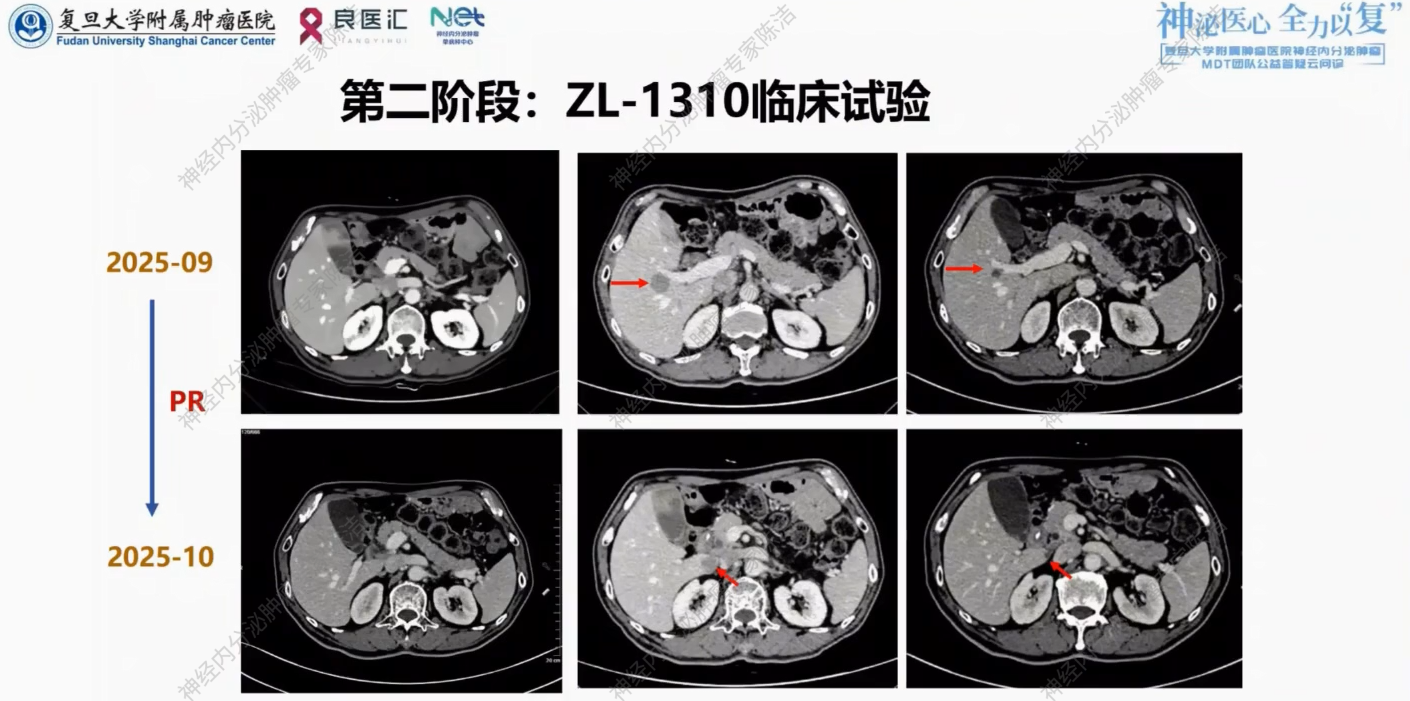
后续继续临床试验用药,目前已完成3周期治疗。
MDT讨论
病理科黄丹教授:该患者经历了ESD及外科根治术,病理免疫组化结果显示Syn(+)、CgA(-),且DLL3阳(20%+),诊断为神经内分泌癌,且亚型为小细胞癌。其生物学特点是增殖活性很高(Ki-67阳性,>90%),通常不表达生长抑素受体(SSTR2阴性),且PD-L1阴性(属于“免疫冷肿瘤”)。这些特征决定了其易复发,且不适合常规的生长抑素类似物治疗。
核医学科徐俊彦教授:回顾患者外院两次FDG PET/CT图像,2024年5月(术后):胃部未见明显代谢异常,胸椎处虽有代谢增高但考虑非特异性改变。2024年10月(复发时):肝内出现散在新发病灶,且FDG代谢显著增高。这符合神经内分泌癌的影像学特征:病灶虽小,但糖代谢极高,提示肿瘤恶性程度高、生长迅速。
放射诊断科汤伟教授:影像学清晰记录了患者对治疗的反应:2024年11月基线时肝内多发转移,经EP方案化疗后,至2025年1月及3月,病灶几乎消失,显示对EP方案敏感。2025年9月,肝尾状叶及右叶再发结节,明确PD。患者入组ZL-1310试验,用药2周期后(2025年10月),靶病灶急剧缩小,尾状叶病灶几乎不可见,疗效评估为PR。
陈洁教授总结(并回答患者提问)

本病例是本次云问诊中唯一的神经内分泌癌病例。神经内分泌癌是神经内分泌肿瘤中恶性程度最高的类型。回顾患者最初的胃镜表现,形态提示恶性度较高的肿瘤:表面隆起糜烂、中央凹陷。对于这种病灶,内镜医生应保持高度警惕,切忌贸然进行内镜下切除(如ESD)。正确的做法应该是先取活检,明确病理性质。如果活检提示是神经内分泌癌,在排除远处转移后,应转外科行根治性手术,而不是先内镜下切下来,发现不对劲再去补做手术。这是内镜医生需要格外注意的。
其次,也是很关键的一点,神经内分泌癌的恶性程度比多数胃癌还高,尽管患者后来补做了外科根治术,且病理提示切除干净、淋巴结阴性,但这并不意味着无需术后辅助治疗。对于神经内分泌癌,哪怕分期为Ⅰ期,我们依然建议术后进行辅助化疗(通常建议4个周期)。遗憾的是,该患者在当地未行术后辅助化疗,不到半年就出现肝转移。该病例从内镜诊治到术后管理的经验教训,非常值得所有临床医生和患者深思。
针对患者及家属提出的关于复发原因、治疗间歇期、临床试验及局部治疗选择等核心问题,陈洁教授进行了深入浅出的详细解答:
1. 神经内分泌肿瘤为什么在化疗后仍会出现复发转移,有什么治疗手段能够使病情较长时间维持稳定不进展?
陈洁教授:因为神经内分泌癌恶性程度很高,即使手术后做了辅助化疗,也不代表不会复发了。化疗的意义在于延长复发转移的时间。例如,如果当初做了辅助化疗,可能复发时间会从半年延长到一年甚至更久,患者的生存时间会因此获益。对于晚期神经内分泌癌,目前的医疗手段很难实现“治愈”或长期维持无瘤状态。只有极个别的患者可能对化疗或免疫治疗特别敏感而长期生存,但对绝大多数患者而言,目标是尽可能延长生存期。
2. 为什么一线治疗后只能等待肿瘤进展再进行二线治疗?
陈洁教授:这是神经内分泌癌化疗的时间问题,主要基于两点考量:
毒性累积:化疗是“杀敌三千,自损八百”的治疗。患者的身体无法承受无休止的化疗,随着疗程增加,毒性会累积,患者会非常痛苦。
耐药性:化疗药物用久了必然产生耐药,不会永远有效。
目前对于神经内分泌癌,缺乏温和有效的维持治疗药物。因此,我们的策略通常是进行约6个疗程的化疗,如果肿瘤控制良好,就让患者停药休息。这段时间是让患者从化疗的打击中恢复过来。我们会密切随访(如每3个月复查),直到肿瘤再次进展,我们才启动二线治疗。这是为了平衡化疗的毒性、耐药性与患者的生活质量。
3. 患者参加ZL-1310临床试验,2程治疗后复查疗效评估PR(肿瘤体积缩小达50%),后续应继续该临床试验药物治疗至何时停药?
陈洁教授:该患者在一线治疗进展后没有立即选择二线化疗,是因为常用的二线化疗方案有效率总体并不高。推荐该患者参加ZL1301[靶向DLL3的抗体偶联药物(ADC)]临床试验,是基于多重考量:
精准获益:该患者肿瘤细胞DLL3表达阳性(20%),这恰好是该ADC药物的靶点。ADC药物可以通俗理解为靶向化疗——将化疗药物挂载在抗体上,像“生物导弹”一样精准覆盖到肿瘤细胞,预期效果更好、毒性更小。
排兵布阵:参加临床试验是我们综合治疗策略的一部分。参加试验并不意味着断送了其他治疗机会。如果试验无效,患者完全可以进行常规的二线、三线治疗;如果试验有效,患者则可能获得额外的生存获益。
时机至关重要:临床试验筛选严格,通常不接受三线以上治疗失败、身体状况极差的患者。因此,在患者身体状况尚好、一线治疗刚进展时抓住机会入组,是比较好的选择。
关于ZL-1310临床试验的停药时机,目前的初步评估是有效的,按照临床试验的设计,患者需持续接受ZL-1310治疗直至出现疾病进展或不可耐受的毒性反应。在此期间,我们将定期进行影像学和安全性评估,密切监测肿瘤变化及患者耐受情况。
4. 如果后续病程中肿瘤再次进展,还有什么治疗手段?
陈洁教授:神经内分泌癌的治疗总体以传统化疗为基石。即使患者在临床试验进展后,仍可使用传统化疗方案。尽管极少数患者可能通过生物标志物筛选,尝试在化疗基础上联合免疫治疗,但鉴于神经内分泌癌多属“免疫冷肿瘤”,免疫治疗获益概率较低。因此,在目前的临床实践中,化疗依然是该病主流的治疗手段。
5. 针对患者病情,目前局部介入治疗、质子治疗等能否使患者获益?
陈洁教授:对于分化差、恶性程度极高的神经内分泌癌,我们不推荐进行介入、射频或质子治疗等局部治疗。原因在于神经内分泌癌是高度侵袭性的全身性疾病,具有早期远处转移倾向,局部治疗手段难以控制整体病程进展。局部治疗(如消融处理一个肝转移灶)往往赶不上肿瘤生长的速度,这边消融掉了,那边可能长得更快,甚至肝外病灶也会迅速进展。总体而言,局部治疗对延长神经内分泌癌患者生存时间的获益很小。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-国际神经内分泌肿瘤日在线科普义诊暨CACA神经内分泌肿瘤专委会系列科普活动回放:
https://doctor.liangyihui.net/#/doc/158041

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


