胃癌作为全球第五大恶性肿瘤,每年新发患者近100万例,死亡率位居癌症相关死亡第三位,尤其在东亚地区疾病负担沉重。尽管新辅助化疗、靶向治疗及免疫治疗取得显著进展,根治性胃切除术仍是局部进展期胃癌治愈的基石。然而,术后并发症发生率仍高达12.8%—14.0%,严重影响患者康复与长期生存。营养状况不良作为围手术期可调控的关键因素,在胃肠道肿瘤患者中发生率高达65%—85%,不仅削弱抗肿瘤免疫应答,更与术后感染、吻合口瘘及肿瘤复发密切相关。目前,预后营养指数(PNI)和营养风险筛查2002(NRS-2002)等工具已用于临床,但其在真实世界中的协同价值及最优风险评估模型尚未明确。本研究通过综合meta分析与单中心前瞻性队列数据,系统评估术前营养状况对胃癌手术预后的预测价值,并构建多维度风险分层体系,为围手术期精准营养干预提供循证依据。相关成果已于2025年9月发表于Journal of Gastrointestinal Surgery杂志。
研究背景
胃癌的高度异质性及复杂的肿瘤微环境使其治疗充满挑战。肿瘤代谢重编程导致宿主能量消耗激增,加之消化道梗阻、出血及化疗毒性,使患者术前常处于中度至重度营养不良状态。这种代谢紊乱不仅损害器官功能储备,更通过激活系统性炎症反应、抑制T细胞介导的抗肿瘤免疫,促进术后并发症发生和肿瘤早期复发。全球疾病负担研究显示,胃癌每年造成全球经济损失达1.5万亿美元,位居恶性肿瘤第五位,而术后并发症导致的住院时间延长和治疗费用增加是造成这一负担的重要组成部分。
营养风险筛查2002(NRS-2002)作为欧洲肠外肠内营养学会推荐的一线工具,通过营养状态受损评分、疾病严重程度评分及年龄调整,可快速识别存在营养风险的患者(≥3分为高风险)。预后营养指数(PNI)则整合血清白蛋白和淋巴细胞计数,计算公式为PNI=白蛋白(g/L)+5×淋巴细胞计数(×109/L),兼具营养与免疫双重评估效能。白蛋白不仅是肝脏合成功能的标志物,更通过调节血浆胶体渗透压、运输营养物质及清除自由基维持内环境稳定;淋巴细胞作为抗肿瘤免疫的核心效应细胞,其数量减少直接反映机体免疫监视功能受损。既往研究证实,PNI在结直肠癌、胰腺癌等多种消化道肿瘤中具有独立预后价值,但针对胃癌的meta分析自2016年后未再更新,且缺乏与NRS-2002的联合评估数据。
东西方胃癌治疗模式差异显著:欧美指南推荐对局部进展期患者常规行新辅助化疗,而东亚地区(尤其中国、日本、韩国)对选择性III期患者更倾向于直接手术。这种差异导致术前营养基线数据受到治疗干扰的程度不同,亟需针对东亚人群开展独立验证。此外,现有研究多局限于单一指标评估,未能整合免疫-营养-炎症多维信息构建复合预测模型。本研究首次通过大规模meta分析明确PNI的独立预后价值,并利用单中心前瞻性队列数据验证PNI与NRS-2002的协同效应,为建立胃癌围手术期标准化营养评估路径提供高级别证据。
研究方法
1. 系统评价与meta分析
本研究严格遵循PRISMA 2020声明和Cochrane手册规范,系统检索PubMed、Embase、Web of Science及Cochrane Library数据库截至2024年12月25日的相关文献。检索策略采用主题词联合自由词模式,包括"gastric cancer"、"gastrectomy"、"Prognostic Nutritional Index"、"nutritional assessment"等关键词,并手工检索纳入研究的参考文献。由两位研究者独立筛选文献、提取数据,采用纽卡斯尔-渥太华量表(NOS)评估队列研究质量,评分>5.5分为高质量研究。
纳入标准:①组织学确诊胃腺癌;②接受根治性胃切除术;③报告术前PNI及术后OS、DFS或并发症数据;④可提取风险比(HR)或比值比(OR)。排除标准:①接受新辅助治疗(以排除治疗对营养指标的干扰);②复发病例;③数据不完整或无法转化。主要结局指标为OS和DFS,次要指标包括术后总并发症发生率、严重并发症(Clavien-Dindo分级≥III级)及淋巴结转移率。
采用Stata 15.1软件进行统计分析。异质性通过I²统计量和Cochran Q检验评估,I²>50%采用随机效应模型。通过亚组分析(按国家、发表年份、样本量、PNI截断值、研究质量分层)、meta回归及敏感性分析探讨异质性来源。发表偏倚采用漏斗图、Egger检验和Begg检验评估。P<0.05为统计学显著。
2. 单中心前瞻性队列验证
研究对象:连续纳入2021年1月至2024年6月于厦门大学附属第一医院胃肠外科接受根治性胃切除术的203例原发性胃癌患者(TNM I-III期)。排除标准包括ASA分级≥IV级、急诊手术、术前接受肠外营养支持或预防性空肠造瘘(以确保基线评估的纯净性)。
营养评估:术前3天内完成NRS-2002筛查(≥3分定义为营养风险)并计算PNI值(截断值取45)。根据术后30天内是否发生Clavien-Dindo分级≥II级的早期并发症(EPC),将患者分为EPC组(n=48)和非EPC组(n=155)。
数据收集:基线资料包括年龄、性别、肿瘤部位、病理分期、手术方式(腹腔镜/开放)、消化道重建方式(Roux-en-Y或Kamikawa吻合)及ASA分级。术后指标包括肠功能恢复时间、住院天数、总费用及并发症类型。炎症指标(CRP、IL-6)和人体成分分析(通过生物电阻抗)作为探索性变量。
统计分析:连续变量采用t检验或Mann-Whitney U检验,分类变量采用χ²或Fisher精确检验。多因素logistic回归分析识别EPC的独立预测因子。构建受试者工作特征曲线(ROC)评估PNI、NRS-2002单独及联合应用的预测效能,计算曲线下面积(AUC)、敏感度、特异度及约登指数。采用SPSS 26.0软件,P<0.05为显著。
研究结果
1. Meta分析结果
文献筛选与研究特征:初检获得2709篇文献,经去重、筛选后最终纳入27项队列研究(2010—2024年),共19,285例患者。研究主要来自日本(n=15)、中国(n=9)、韩国(n=2)和西班牙(n=1),样本量80-7781例不等,中位样本量386例。所有研究NOS评分均≥6分,质量较高。

PNI与总生存期(OS):低PNI显著降低OS,单因素分析合并HR为3.140(95%CI 1.564~6.302,P<0.001,I²=93.4%),多因素分析校正混杂因素后HR仍为1.344(95%CI 1.111~1.625,P<0.001,I²=87.1%)。亚组分析显示,无论按国家(中国、日本、韩国、西班牙)、发表年份(≥2017 vs <2017)、样本量(≥300 vs <300)、PNI截断值(≥45 vs <45)或研究质量分层,低PNI均与不良OS显著相关。Meta回归未发现上述协变量显著影响异质性(均P>0.05),提示结果稳健。


表1 PNI和OS的荟萃分析和亚组分析结果

PNI与无病生存期(DFS):8项研究(n=3,528)显示,低PNI组DFS显著缩短(多因素分析HR=0.977,95%CI 0.667~1.432,P<0.001,I²=83.1%),单因素分析HR=2.890(95%CI 2.236~3.735)。亚组分析结果与OS一致,证实PNI对肿瘤复发的预测价值。

表2 与PNI和DFS相关的多变量和单变量研究的荟萃分析结果

PNI与术后并发症:11项研究(n=11,727)显示,高PNI降低总体并发症风险(RR=0.665,95%CI 0.544~0.814,P<0.001,I²=71.5%);7项研究(n=10,263)显示,高PNI显著减少严重并发症(RR=0.512,95%CI 0.333~0.789,P=0.002,I²=70.1%)。然而,15项研究(n=11,042)未发现PNI与淋巴结转移率显著相关(RR=0.916,95%CI 0.761~1.102,P=0.352,I²=96.0%),提示PNI主要影响围手术期恢复而非肿瘤生物学行为。
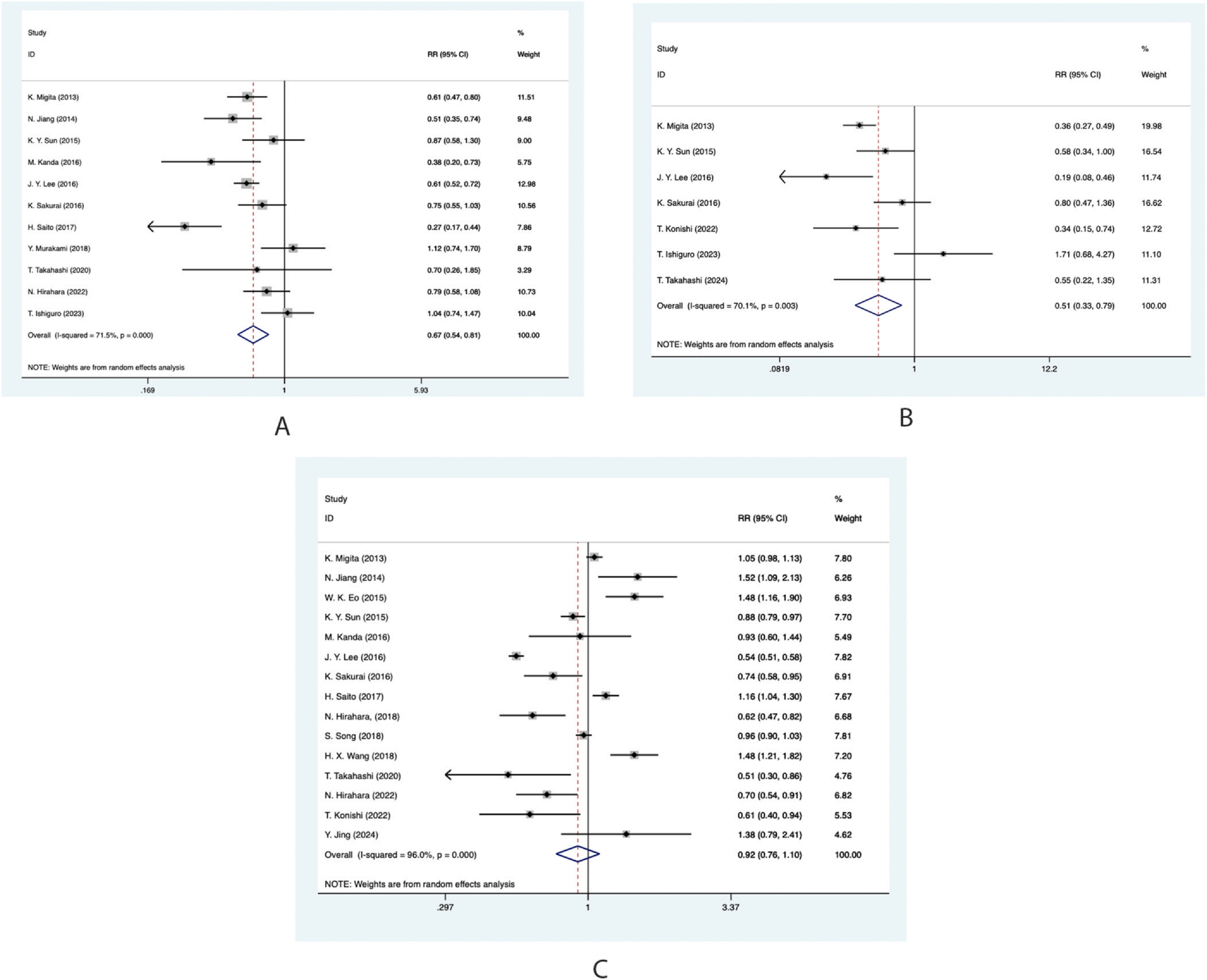
表3 PNI和并发症的荟萃分析结果

发表偏倚与敏感性分析:漏斗图显示研究分布基本对称,Egger检验(P=0.089)和Begg检验(P=0.234)未提示显著发表偏倚。逐一剔除研究后效应量未发生方向性改变,证实结果可靠性。

2. 队列研究结果
基线特征:203例患者中EPC组48例(23.6%),NEPC组155例(76.4%)。EPC组年龄显著更大(64.77±10.52 vs 58.97±11.57岁,P=0.002),但性别、TNM分期、ASA分级及手术方式无显著差异,提示营养状态而非肿瘤分期主导并发症发生。
表4 患者基线特征

营养评估指标比较:EPC组NRS-2002评分>3分比例显著高于NEPC组(39.6% vs 63.2%,OR=2.624,95%CI 1.351~5.099,P=0.004);PNI<45比例亦显著增加(36.7% vs 19.5%,OR=2.400,95%CI 1.186~4.855,P=0.015)。多因素logistic回归显示,低PNI(β=0.804,OR=2.235,95%CI 1.087~4.593,P=0.029)和高NRS-2002评分(β=0.914,OR=2.493,95%CI 1.272~4.888,P=0.008)是EPC的独立预测因子。
表5 术前营养状况指标
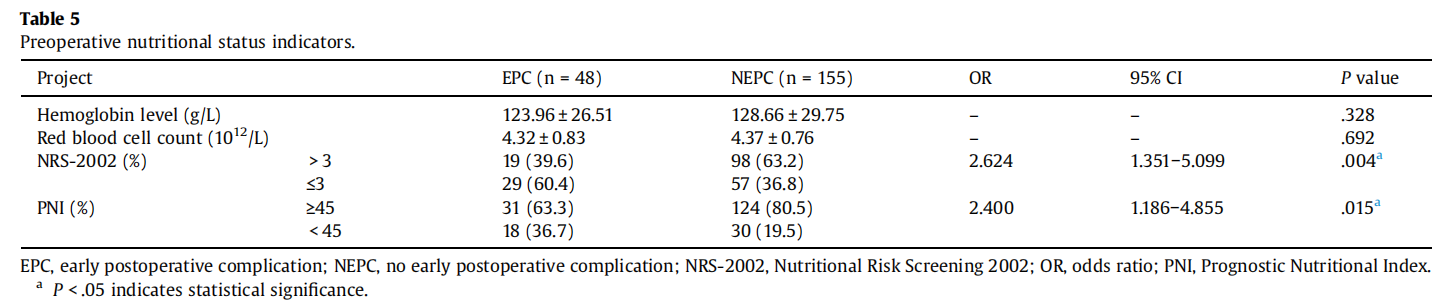
表6 PNI和NRS-2002评分的Logistic回归分析

术后恢复与经济学指标:EPC组住院时间延长6.31天(16.12±11.01 vs 9.81±2.84天,P<0.001),肠功能恢复延迟2.17天(6.52±6.88 vs 4.35±2.11天,P=0.036),非手术费用增加19,510元(87,650±39,980 vs 68,140±12,990元,P=0.002),凸显并发症带来的沉重经济负担。
表7 术后恢复时间和治疗费用
预测模型效能:PNI单独预测EPC的AUC为0.588(95%CI 0.492~0.683),敏感度37.5%,特异度80.0%;NRS-2002单独AUC为0.618(95%CI 0.527~0.710),敏感度60.4%,特异度63.2%。联合模型(PNI+NRS-2002)AUC提升至0.657(95%CI 0.569~0.746),敏感度75.0%,特异度52.3%,约登指数0.273,诊断效能显著优于单一指标(P=0.018)。
表8 PNI和NRS-2002评分的疗效分析及早期术后并发症的联合预测


结论
本研究通过大规模meta分析和前瞻性队列验证,首次系统证实术前营养状况是胃癌根治术后预后的独立预测因子。低PNI不仅显著降低OS和DFS,更使术后并发症风险增加1.5倍,住院时间延长6.3天,医疗费用上升28.6%。NRS-2002与PNI联合应用可构建多维度风险评估模型,AUC达0.657,为临床识别高危患者、指导术前营养干预提供了可量化的工具。
从机制层面,PNI整合白蛋白和淋巴细胞双重信息,精准反映肿瘤相关营养不良导致的免疫抑制和代谢紊乱状态。术前营养支持通过改善瘦组织储备、降低系统性炎症反应、增强T细胞抗肿瘤活性,可能逆转不良预后。本研究结果为胃癌围手术期精细化管理提供了高级别证据:①推荐将PNI和NRS-2002纳入术前常规评估,对PNI<45或NRS-2002≥3分患者启动7—14天预康复营养干预;②建立营养-免疫-炎症综合评分体系,未来可整合CRP、IL-6等动态指标提升预测精度;③开展多中心前瞻性研究验证模型在不同地区、不同治疗模式(含新辅助化疗)下的适用性。未来需开展随机对照试验,探索基于PNI/NRS-2002指导的精准营养支持方案对短期结局和长期生存的改善作用,推动该模型纳入国际胃癌治疗指南,实现从风险预测到干预转化的临床实践闭环。
Zheng K, Weng X, Huang Z. Prognostic value of preoperative nutritional status in patients with gastric cancer undergoing radical gastrectomy: a comprehensive meta-analysis and multidimensional risk assessment. J Gastrointest Surg. 2025;29(11):102229. doi:10.1016/j.gassur.2025.102229
审批编号:CN-173230 有效期:2026/12/1
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


