BRAF V600E突变的转移性结直肠癌(mCRC)是一种预后极差的亚型,约占mCRC的10%,其中位总生存期(OS)通常不足20个月。传统化疗方案对此类患者疗效有限,而靶向治疗(尤其是抗BRAF和抗EGFR联合)的出现已显著改善了患者预后。本期,福建省肿瘤医院宋锦添教授分享了1例伴有BRAF V600E突变的晚期CRC病例。该患者拒绝化疗,接受了BRAF抑制剂(达拉非尼)联合EGFR单抗(西妥昔单抗)及Mek抑制剂(曲美替尼)及信迪利单抗的四联方案治疗,获得了明显的肿瘤缓解,其OS已超过32个月,为该类难治性肠癌的精准治疗提供了新的临床参考。【肿瘤资讯】将病例诊疗过程整理如下,并特邀福建省肿瘤医院陈奕贵教授对病例进行点评,以飨读者。
副主任医师 医学博士 硕士生导师
肿瘤临床医学院肿瘤学教研室成员
福建省抗癌协会胃癌专业委员会委员
福建省抗癌协会腹膜肿瘤专业委员会委员
福建省抗癌协会热疗专业委员会委员
福建省肿瘤医院胃癌多学科诊治组(MDT)成员
福建省肿瘤医院神经内分泌肿瘤多学科诊治组(MDT)成员
在国内外以第一作者发表论文14篇,其中SCI论文8篇,累计影响因子30余分,专注于消化系统恶性肿瘤的综合治疗,包括胃癌、结直肠癌、食管癌、肝癌和胆肿瘤的化疗、分子靶向治疗及免疫治疗等,主持福建省自然科学基金面上项目、福建省卫健委科研课题等项目,参加国际及国内新药临床研究数十项,尤其晚期胃癌、肠癌等创新药物临床研究领域具有丰富的经验
病例介绍
基本情况
患者:女性,70岁。
既往史:“糖尿病”病史;升结肠癌根治术后(pT4aN2aM0 IIIc期, MSS)(近2年)、甲状腺癌(2年)、右肺癌(2年)、贲门癌(pT4aN1M0 IIIa期)(8年)。
体格检查:一般情况可,ECOG 评分 0分。腹平软,无压痛、反跳痛,肝脾肋下未触及。
辅助检查
肿瘤标志物 (2023.3.27):CEA 53.93 ng/ml,CA199 942.6 U/ml。
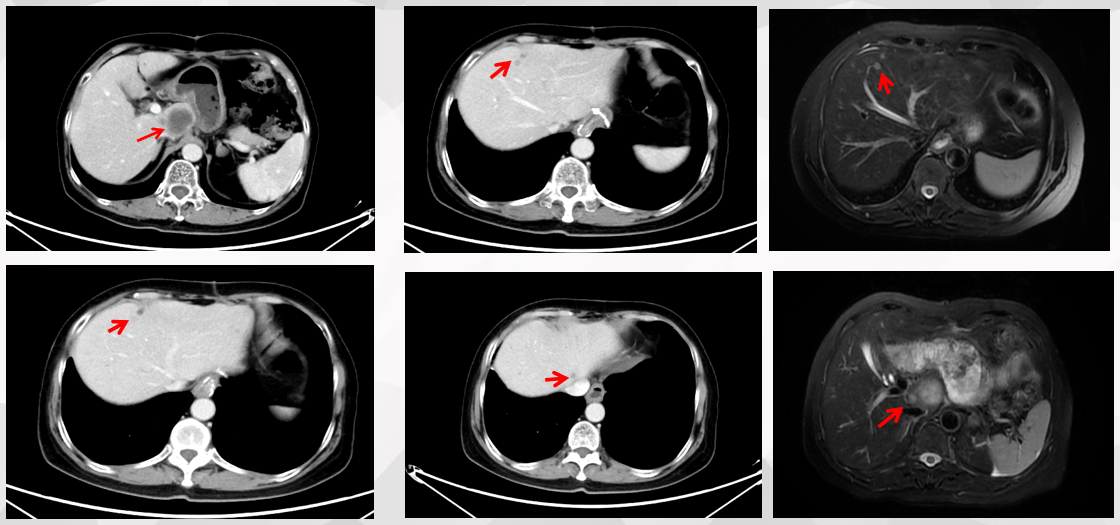
腹部CT (2023.3.14):肝内见数个结节状,最大一个位于尾状叶,直径约30mm(图1)。
腹部MR (2023.3.27):肝S1、2、3段见多发散在分布的类圆形病灶,大小不等,较大者位于肝S1段,最大截面约3.4cm*3.3cm,考虑转移。
胃肠镜:未见明确肿瘤征象。
肝穿刺活检病理:镜下见腺癌浸润,结合病史及免疫组化结果考虑胃肠道来源。免疫组化结果:CK7(-),CK20(+),CK19(+),CDX-2(少数+),SATB2(-)。
基因检测:MSS,KRAS野生型,NRAS野生型,BRAF:V600E突变,RNF43突变,TMB-H。
初步诊断
升结肠溃疡型浸润性中低分化管状腺癌术后化疗后肝多发转移(pT4aN2aM1 Ⅳ 期 MSS,BRAF:V600E突变, RNF43突变,TMB-H)。
诊疗经过
一线治疗
患者于2023.4.12至2023.11.12予以达拉非尼+西妥昔单抗+曲美替尼+信迪利单抗方案联合治疗。
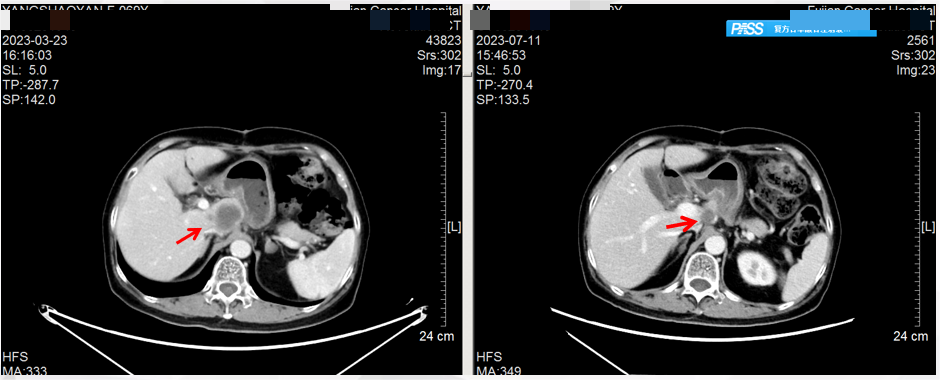
首次复查(2023.7.11):腹部CT:与治疗前(2023.3.23)CT影像对比,提示肝脏多发转移灶均较前明显缩小(图2)。影像学评估:部分缓解(PR)。
患者在治疗过程中出现皮肤毒性,自行暂停抗肿瘤治疗。
复查(2024.3.11):腹部CT:提示肝转移灶较前(2023.7.11)明显进展,病灶增多、增大。并出现新增腹腔、腹膜后淋巴结转移(最大约2.7cm * 2.5cm)。影像学评估:疾病进展(PD)。
局部治疗(2024.3.13):针对进展的肝脏病灶,行“CT引导下肝转移灶射频消融术”。
患者于2024.3.22至2025.5.23再次间断性接受原方案(达拉非尼+西妥昔单抗+曲美替尼+信迪利单抗)治疗。
复查(2024.5.21):腹部MRI评估提示PD。
患者放弃后续抗肿瘤治疗,改为姑息保守对症支持治疗。
截至最后随访,患者总生存期(OS)已超过32个月。
专家点评
主任医师 医学硕士
福建省肿瘤医院胃肠肿瘤内科23区行政主任
福建省抗癌协会:胃癌专业委员会常委,肿瘤科普专业委员会主任委员,国家疼痛专业医疗质量控制中心癌症疼痛专家组专家成员
发表肿瘤相关论文50余篇,其中SCI论文10余篇,对腹部肿瘤,特别是胃癌、肠癌的内科靶向、免疫治疗,以及姑息治疗有较丰富的临床经验
该患者为晚期右半结肠癌患者,伴有BRAF Ⅰ类突变(V600E突变),因抗拒化疗,接受联合靶向治疗,取得良好的抗肿瘤疗效,我们知道目前BRAF基因突变,根据1、基因突变是否具有激酶活性。2、激酶活性是否依赖于RAS基因活化。3、BRAF基因是否二聚化,进行分型。Ⅰ类突变是具有强活化激酶活性,独立于RAS,可作为单体发出信号。Ⅱ类突变具有中-强活化激酶活性,独立于RAS,需要依靠二聚体发出信号。Ⅲ类突变具有低或无激酶活性,依赖于RAS,需要依靠二聚体发出信号。与Ⅰ类和Ⅱ类突变不同,Ⅲ类突变具有更好的生成预后,也因此今年NCCN指南指出对于Ⅲ类BRAF突变的晚期结肠癌,可考虑接受抗EGFR单抗治疗。
针对BRAF V600E突变的晚期结肠癌研究,早些年SWOG 1406研究,针对BRAF V600E突变mCRC二线及以上姑息治疗,才用伊立替康联合西妥昔单抗加入维莫非尼后PFS明显提高(HR=0.5,95%Cl,0.32-0.76,P=0.001),两组中位PFS分别为4.2个月和2.0个月,客观缓解率(ORR)为17% vs.4%(P=0.05)。以及去化疗化的BEACON Ⅲ期研究,在BRAF V600E突变型mCRC患者中,评价三联康奈非尼(BRAF抑制剂)+Binimetinib(比美替尼,MEK抑制剂)+西妥昔单抗和二联康奈非尼+西妥昔单抗对比标准治疗(伊立替康+西妥昔单抗或FOLFIRI+西妥昔单抗)的疗效和安全性,主要终点是三联组与对照组OS和ORR。
BEACON CRC研究是首个探索BRAF/MEK抑制剂联合抗EGFR单抗在BRAFV600E突变型mCRC中疗效的Ⅲ期优效性研究,该研究证实了康奈非尼+西妥昔单抗±比美替尼的三靶或双靶方案在既往接受过至少一种或两种系统性治疗患者的疗效与安全性。共纳入665例受试者,结果提示三靶组(康奈非尼+西妥昔单抗+比美替尼)和双靶组(康奈非尼+西妥昔单抗)与对照组(伊立替康+西妥昔单抗或FOLFIRI+西妥昔单抗)相比,均可改善患者OS和PFS,三组中位OS分别为9.3个月、9.3个月和5.9个月,三靶组和双靶组较对照组可分别降低死亡风险达40%和39%;中位PFS分别为4.5个月、4.3个月和1.5个月。缓解率方面,三靶组(27%)和双靶组(20%)的ORR与对照组(2%)相比均显著提高(P<0.0001)。三药并不优于两药。
TMB可间接反映肿瘤新生抗原的能力和程度,可以用于预测肿瘤的免疫治疗疗效。MyPathway研究中的临床和基因检测数据分析TMB-H肿瘤患者接受阿替利珠单抗的疗效及安全性。纳入分析的121例患者涵盖20种肿瘤类型,其中9种肿瘤对于免疫治疗有应答。42例TMB≥16mut/Mb的患者中,中位DOR尚未达到,ORR为38.1%,DCR为61.9%。其疗效优于10≤TMB<16mut/Mb患者,后者ORR为2.1%,DCR为22.9%。该研究结果提示,无论肿瘤类型如何,TMB均为预测免疫治疗效果的可靠生物标志物。
2025年ASCO公布的全球Ⅲ期BREAKWATER研究取得里程碑式突破。结果显示,与标准治疗(SOC)相比,康奈非尼+西妥昔单抗+mFOLFOX6组客观有效率(ORR)显著提升(65.7% vs. 37.4%),中位PFS延长5.7个月(12.8个月 vs. 7.1个月),中位OS超过30个月(30.3个月 vs. 15.1个月)。该联合方案安全性良好,未显著增加剂量调整或停药事件。基于这一结果,该方案已获美国FDA加速批准用于BRAF V600E突变mCRC患者(含一线治疗),为其临床广泛应用提供了关键证据。
但是即使是接受双靶或者三靶或者靶向联合化疗的BRAF V600E突变的晚期结肠癌患者中,也同样存在疗效的差异,其中关于疗效差异的探索分析中就发现,其中来自西班牙巴塞罗那瓦尔德希伯伦大学医学研究中心的学者在2022年发表在Nature medicine的一篇文章中指出RNF43作为BRAF V600E突变的晚期肠癌接受抗EGFR和BRAF抑制剂治疗疗效预测的生物标记物的分子机制,在BRAF V600E突变的晚期肠癌患者中,接受抗EGFR联合BRAF抑制剂患者中,如果伴随RNAF4突变则疗效好,基础研究提示功能丧失的RNF43突变体失去了泛素化和降解FZD-NT受体的能力,使得这些受体在细胞膜上累积,进而导致WNT信号通路持续激活状态从而抑制了MAPK信号,因此在接受抗EGFR联合BRAF抑制剂疗效佳。
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


