2025年11月14-15日,由上海市抗癌协会主办,中国抗癌协会乳腺癌专业委员会支持的第二十届上海国际乳腺癌论坛(SIBCS)在上海世博中心成功举行。本届论坛以“廿廿不忘,生生不息”为主题,在创办二十周年这一里程碑时刻,汇聚了国内外乳腺癌领域的顶尖专家学者,回首峥嵘岁月,共绘未来蓝图。
其中,中国医学科学院肿瘤医院徐兵河院士在“乳腺癌精准治疗的现状与展望”一题下,高屋建瓴地梳理了精准医学的发展脉络与未来方向。【肿瘤资讯】在此对相关讲题进行整理。


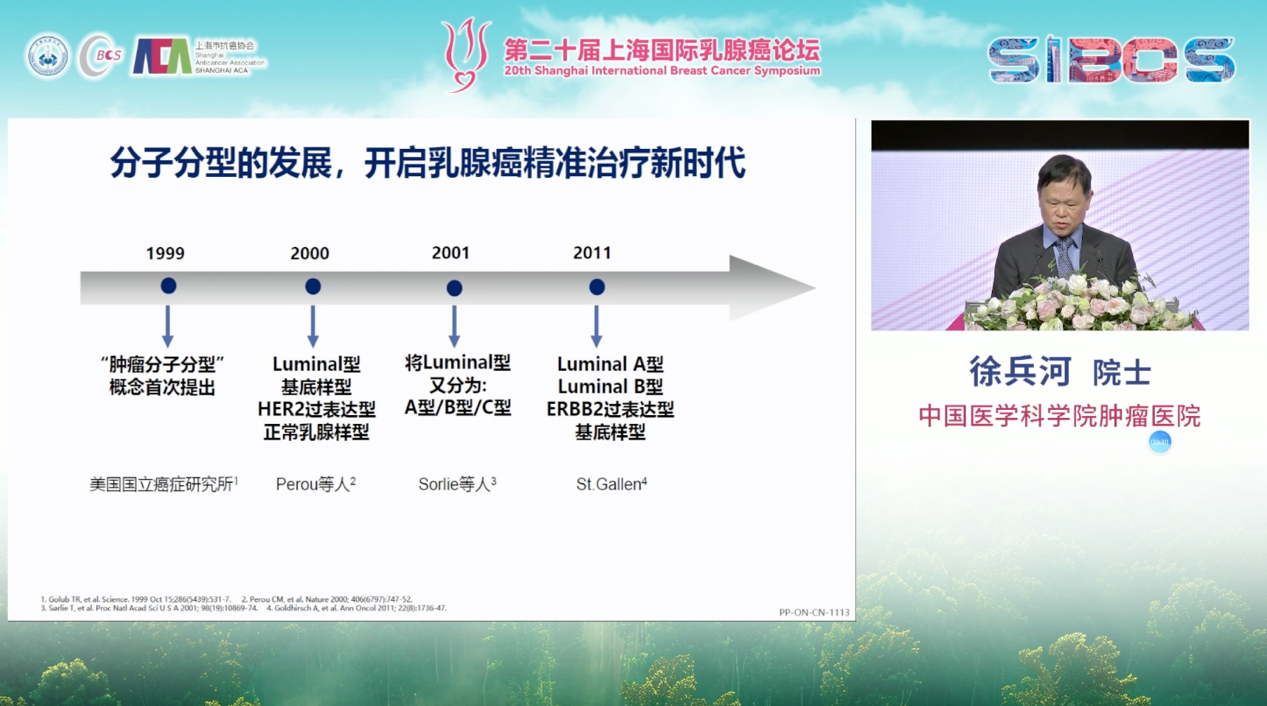
分子分型的开展,开启乳腺癌精准治疗新时代
乳腺癌的精准治疗源于其分子分型。自2011年St. Gallen国际乳腺癌会议正式确立基于激素受体(HR)与人表皮生长因子受体2(HER2)状态的核心亚型分类以来,乳腺癌的治疗便驶入了“量体裁衣”的快车道。此后十余年间,无论是“升阶梯”与“降阶梯”的治疗理念,还是个体化方案的精雕细琢,都紧密围绕分子分型这一基石展开,引领着临床实践与科学研究的持续革新。
HER2阳性乳腺癌:
靶向治疗的持续革新与挑战
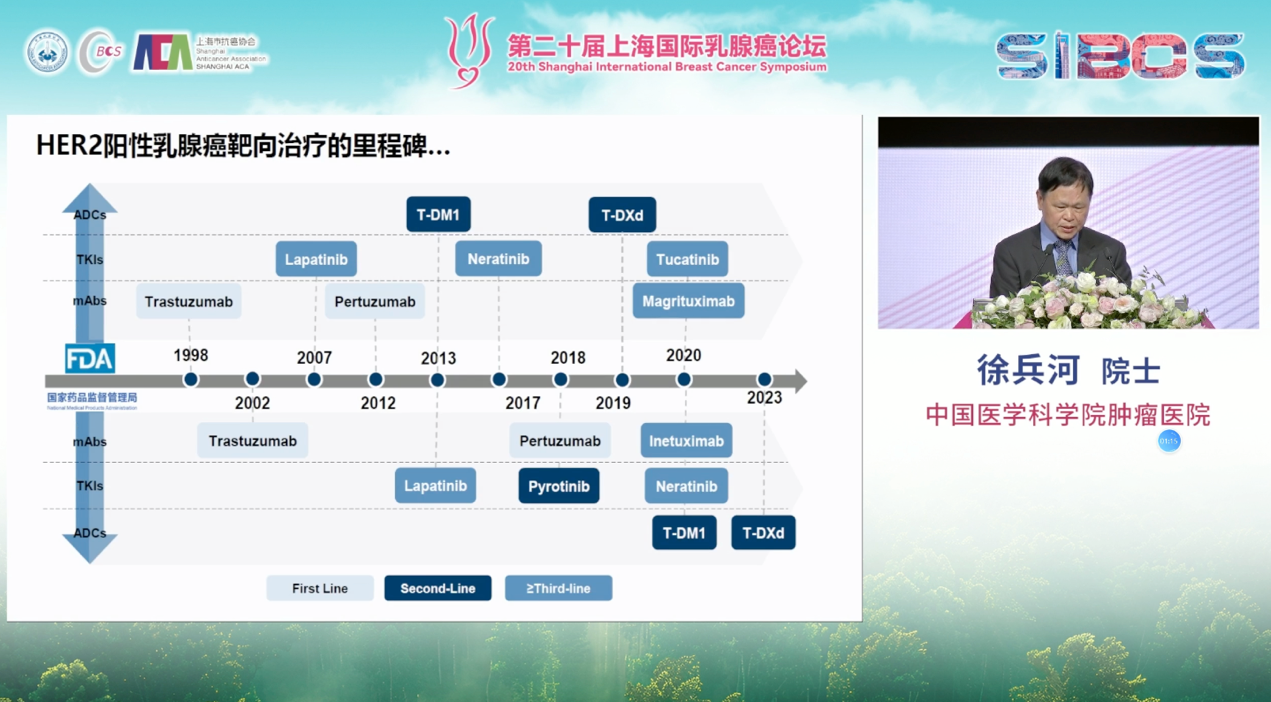
在HER2阳性乳腺癌领域,靶向治疗的出现彻底改变了其治疗命运。自1998年曲妥珠单抗获批以来,针对HER2靶点的药物已发展出三大支柱:单克隆抗体、小分子酪氨酸激酶抑制剂(TKI)以及革命性的抗体药物偶联物(ADC)。
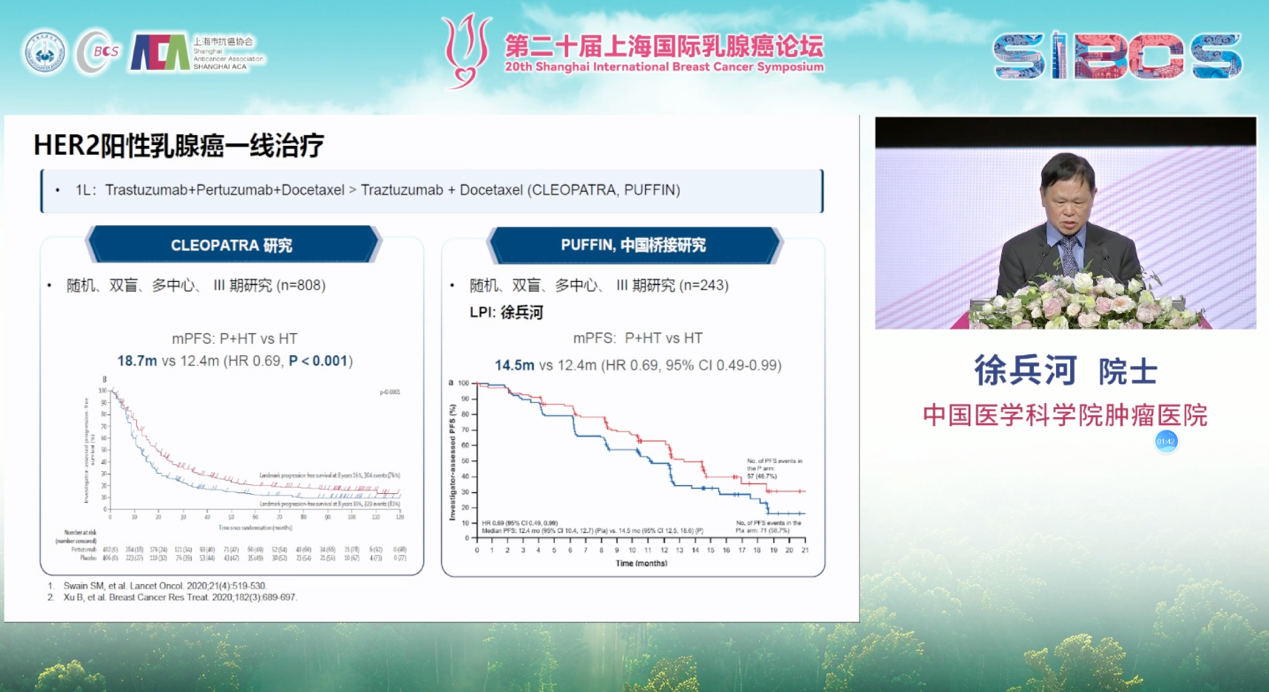
一线治疗的金标准由经典的CLEOPATRA研究确立,曲妥珠单抗联合帕妥珠单抗的“曲帕双靶”方案,显著改善了患者的生存预后。
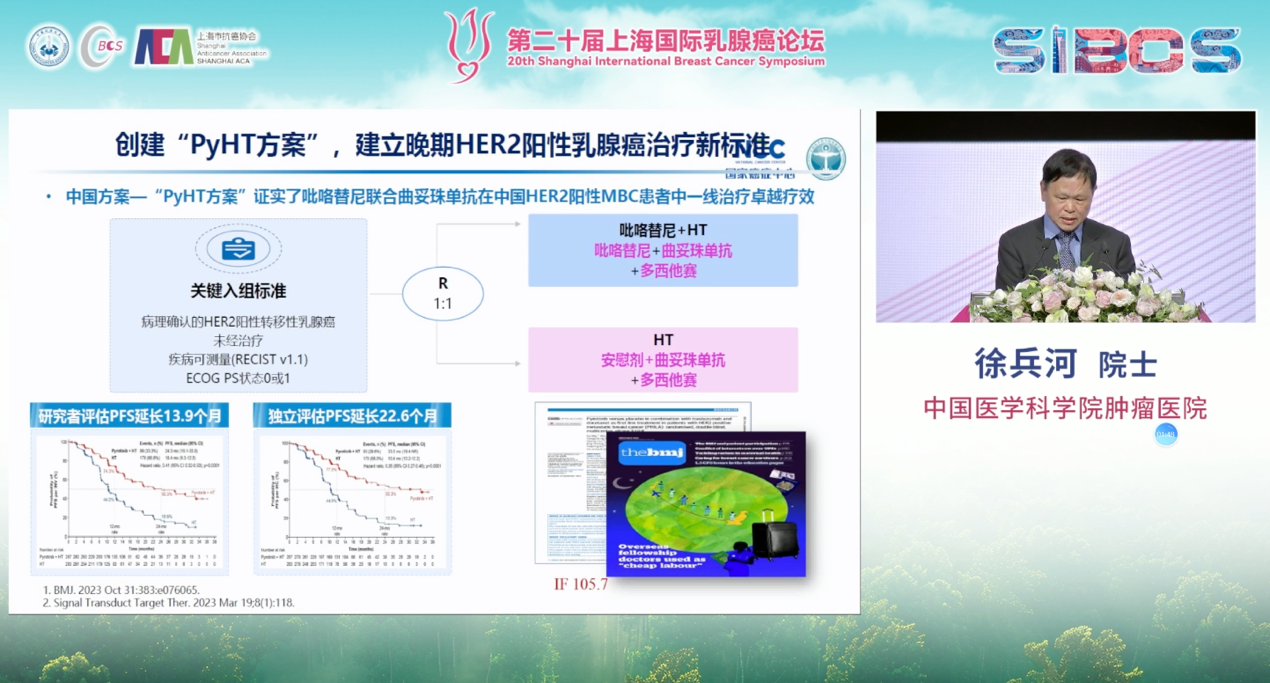
在中国,本土创新也贡献了重要力量,例如吡咯替尼这一新型TKI联合曲妥珠单抗及化疗的方案,在一线治疗中展现出卓越的疗效,为患者提供了强有力的治疗选择。
二线及后线治疗的格局则被ADC药物彻底改写。划时代的DESTINY-Breast03研究,头对头比较了新型ADC药物T-DXd与上一代标准治疗T-DM1,结果显示T-DXd在无进展生存期(PFS)和总生存期(OS)上均取得了压倒性的优势,无可争议地确立了其在二线治疗中的新标准地位。
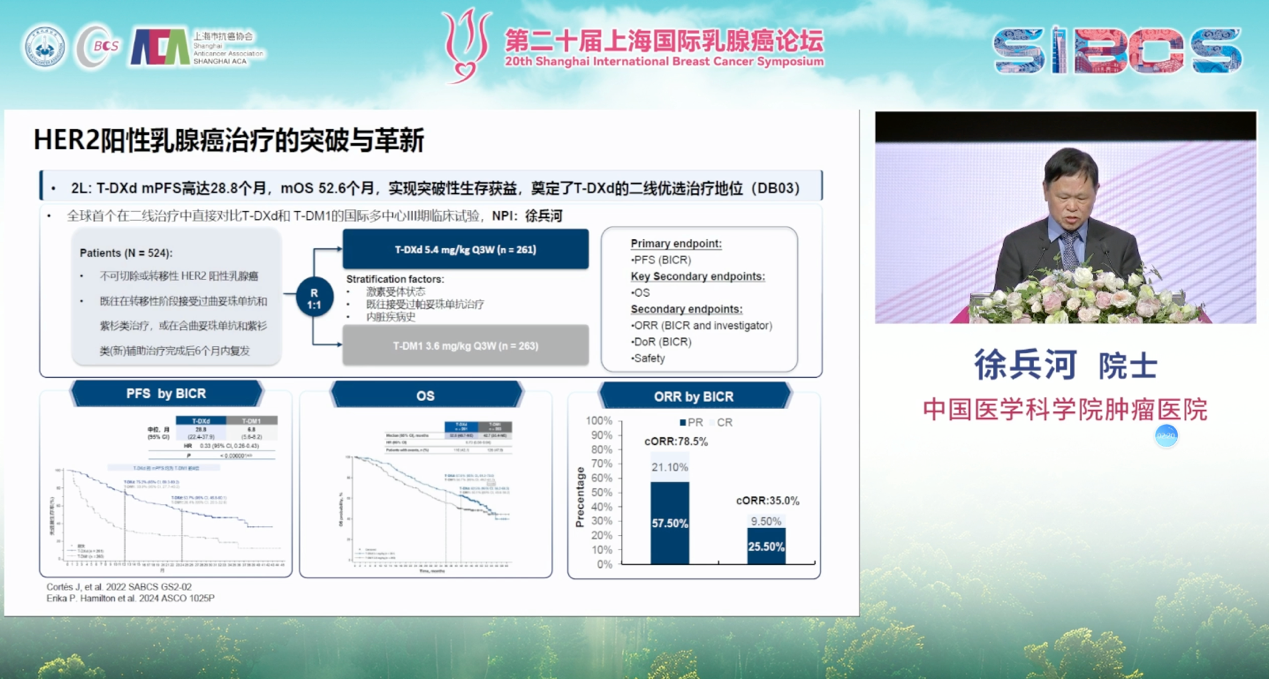
此外,PHOEBE研究证实了吡咯替尼联合卡培他滨相较于拉帕替尼联合卡培他滨在经治患者中的优越性。加之图卡替尼等药物的涌现,使得HER2阳性晚期乳腺癌的后线治疗选择变得前所未有的丰富。


总体而言,目前,HER2阳性晚期乳腺癌的一线治疗仍以紫杉类药物联合双靶向治疗为主流方案。在国内临床实践中,吡咯替尼联合曲妥珠单抗及紫杉类药物的治疗方案同样为一线治疗选择;而在二线治疗中,T-DXd则是国际公认的标准选择。此外,在中国,二线治疗也可选用吡咯替尼联合卡培他滨的方案,其他可选策略还包括图卡替尼联合卡培他滨与曲妥珠单抗等组合方案。

然而,耐药是靶向治疗无法回避的终极难题。其机制复杂多样,涉及HER2受体变异、HER2表达下调或表达的异质性、PI3K/AKT/mTOR通路的下游激活、雌激素受体(ER)的上调,以及逃避抗体依赖的细胞毒性作用(ADCC)等。
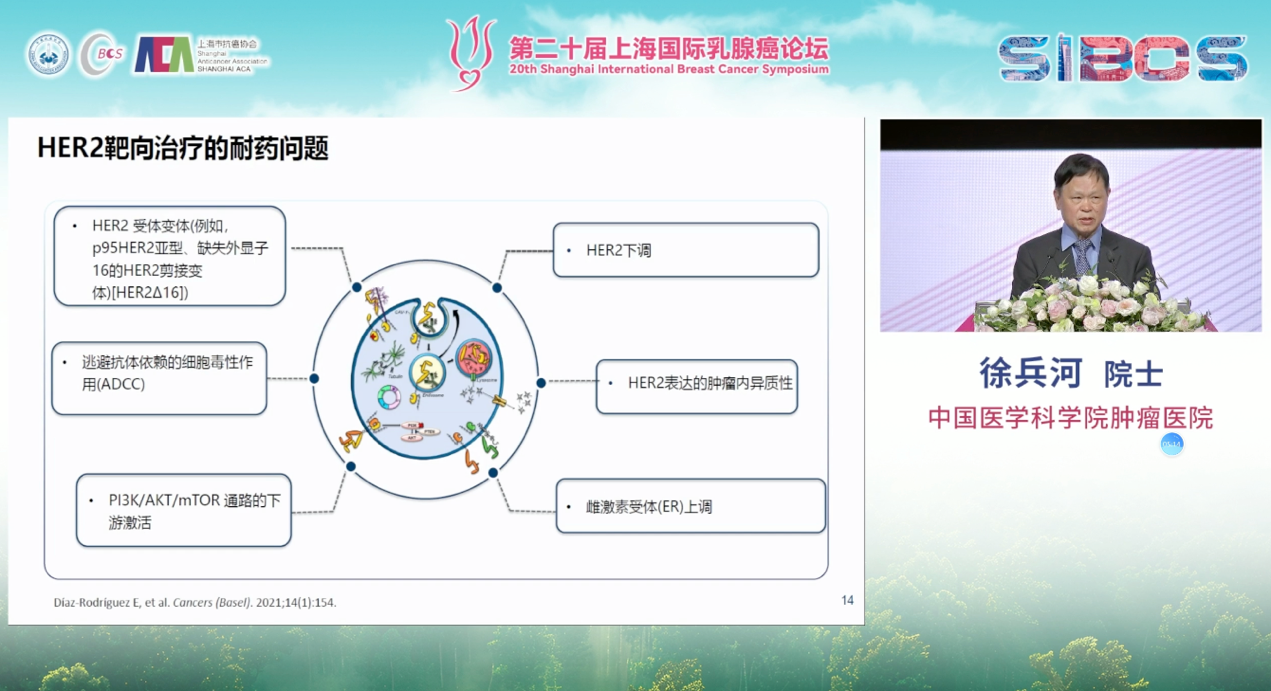
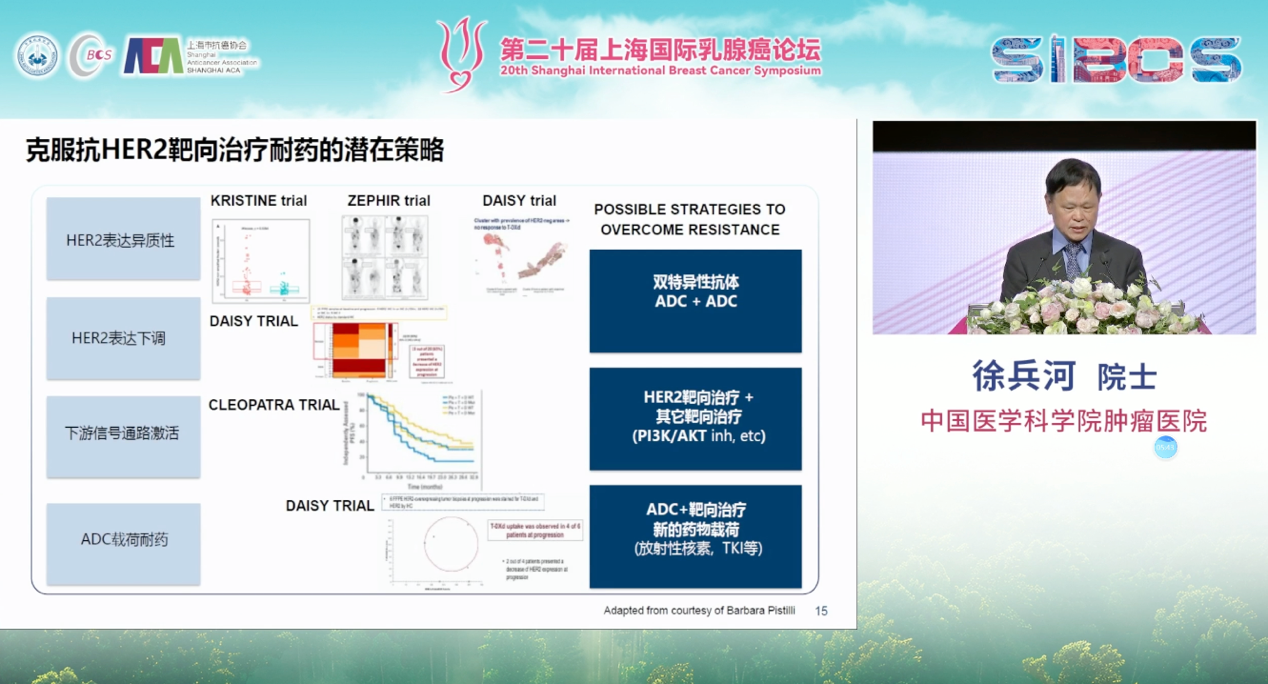
针对HER2阳性乳腺癌的耐药机制,目前已开发出多种治疗策略。例如,针对HER2表达抑制或下调的情况,双特异性抗体已成为重要研究方向。我们已完成一项双特异性抗体的初步研究,预计结果将于明年在相关学术会议上公布,目前数据显示其具有一定潜力。此外,ADC药物与其他ADC药物的联合应用也在探索中,旨在应对下游信号通路(如PI3K/AKT/mTOR通路)激活所导致的耐药。在此背景下,HER2靶向治疗与其他靶向药物的联合,如PI3K抑制剂、AKT抑制剂等,也显示出克服耐药的潜力。
另一方面,针对ADC药物载核相关的耐药机制,研究也在推进“ADC+靶向治疗”的组合策略。同时,放射性核素治疗作为新兴领域,受到广泛关注,预计将在不久的将来为HER2阳性乳腺癌的精准治疗格局带来变革。
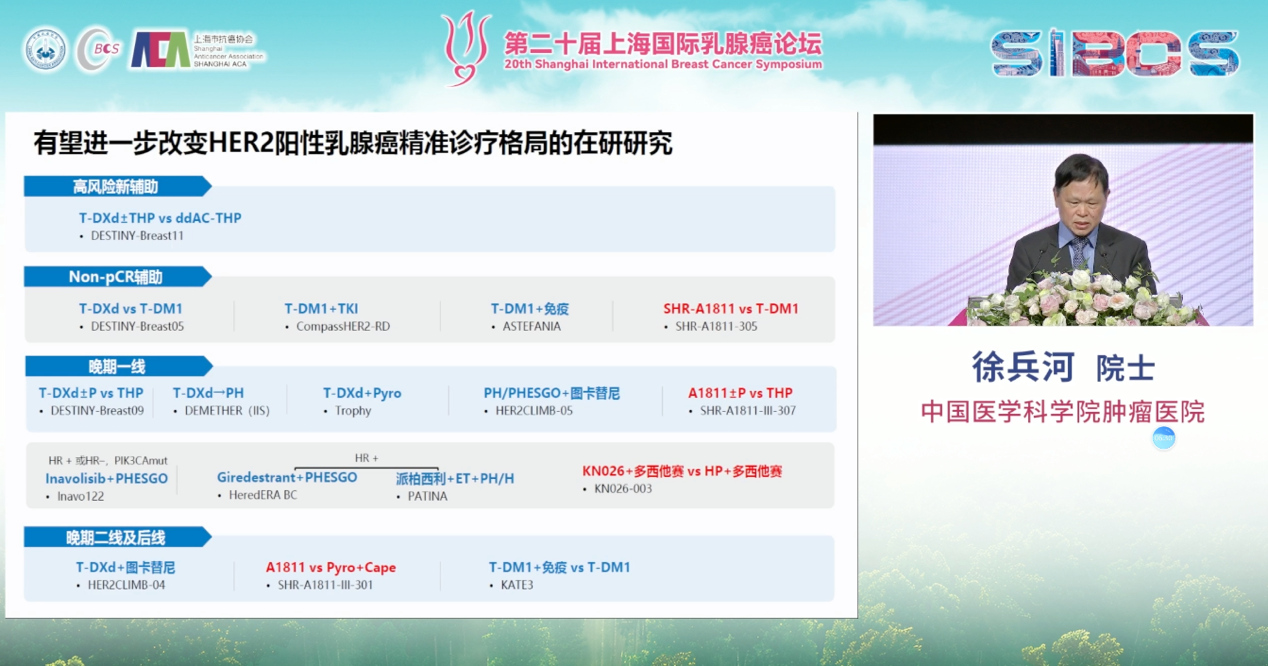
目前多项重要研究正在开展,有望重塑当前HER2阳性乳腺癌治疗标准。在高风险新辅助治疗领域,有研究探索T-DXd联合或不联合其他药物,对比剂量密集的AC序贯THP方案;针对non-pCR患者,国外已有T-DXd与T-DM1的对比研究。在国内,晚期一线治疗中,由上海复旦肿瘤医院所牵头的A1811对比双靶向治疗的研究正在进行;同时,徐兵河院士团队所牵头的一项双特异性抗体相关研究也在挑战双靶方案的一线标准地位。在晚期二线治疗中,国内亦有A1811对比化疗联合卡培他滨的方案等探索。这些研究的结果,无论国内还是国际,均可能引领未来HER2阳性乳腺癌精准治疗方向的更新。
HR阳性乳腺癌:
内分泌联合靶向治疗的深化与拓展
对于临床上占比最高的HR阳性乳腺癌,其治疗策略已从单一的内分泌治疗,全面迈入了内分泌联合靶向治疗的新纪元。
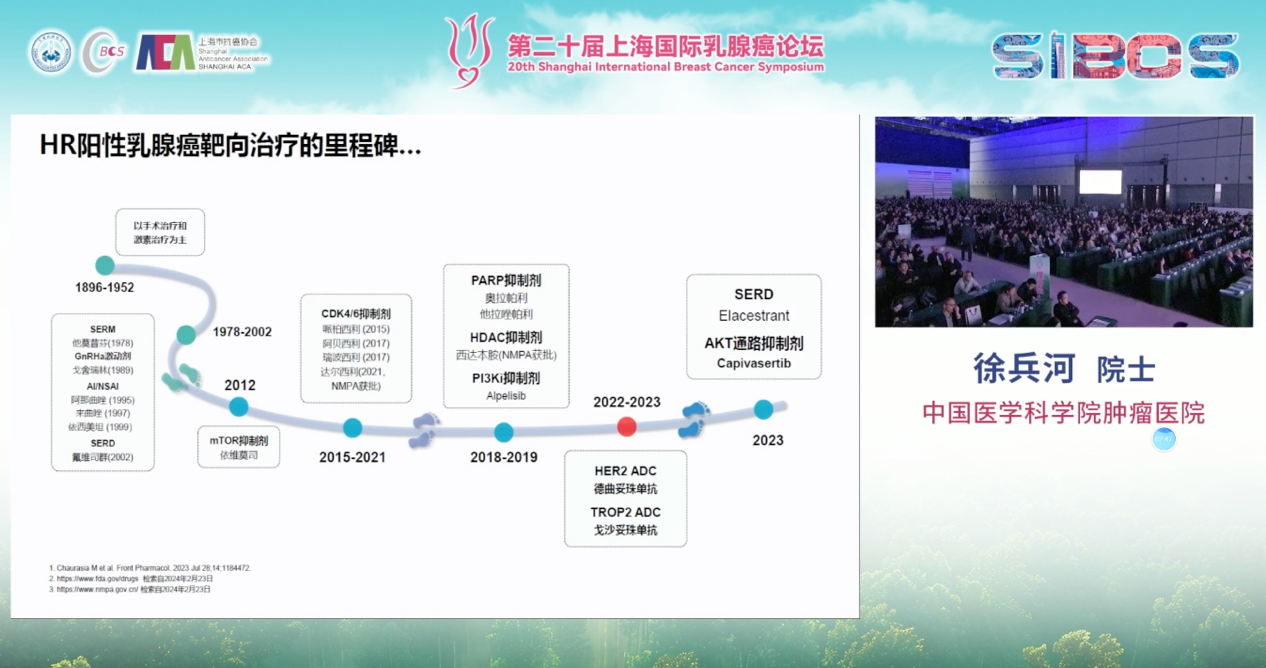
CDK4/6抑制剂的问世是这一进程中的里程碑。其与内分泌治疗的联合应用,已成为晚期患者一线和二线治疗的基石,能将中位PFS从过去的一年左右显著延长至两年以上。
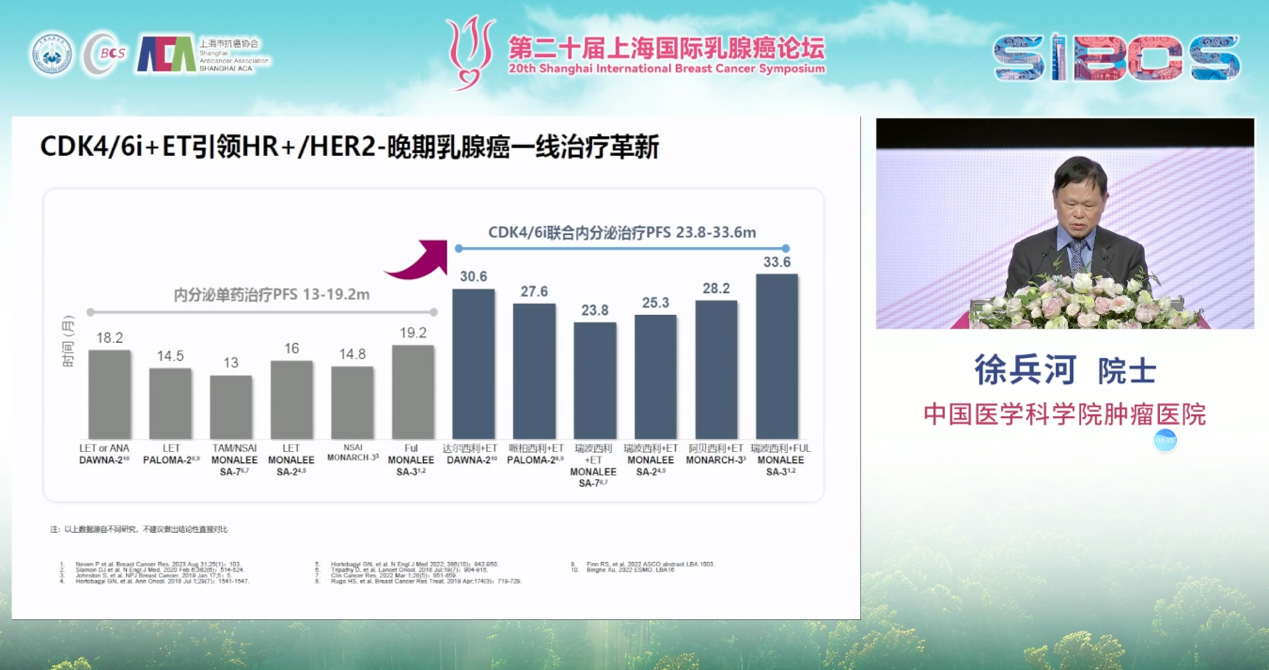
更具颠覆性意义的是RIGHT Choice研究,它挑战了“内脏危象等侵袭性疾病患者首选化疗”的传统观念,证实了瑞波西利联合内分泌治疗的疗效优于联合化疗,PFS从12个月延长至24个月,为这类病情危重的患者带来了创新的、去化疗的优选方案。

当CDK4/6抑制剂出现耐药后,治疗选择正变得日益丰富和精准。一方面,针对PI3K/AKT/mTOR通路的异常激活(该通路在HR阳性乳腺癌中改变率高达60%),CAPItello-291研究显示,AKT抑制剂卡匹色替联合氟维司群能为CDK4/6抑制剂经治的患者带来显著的PFS获益。另一方面,针对ESR1基因突变这一常见的内分泌耐药机制,EMERALD研究验证了新型口服SERD药物艾拉司群的有效性,为携带此突变的患者提供了精准打击的武器。

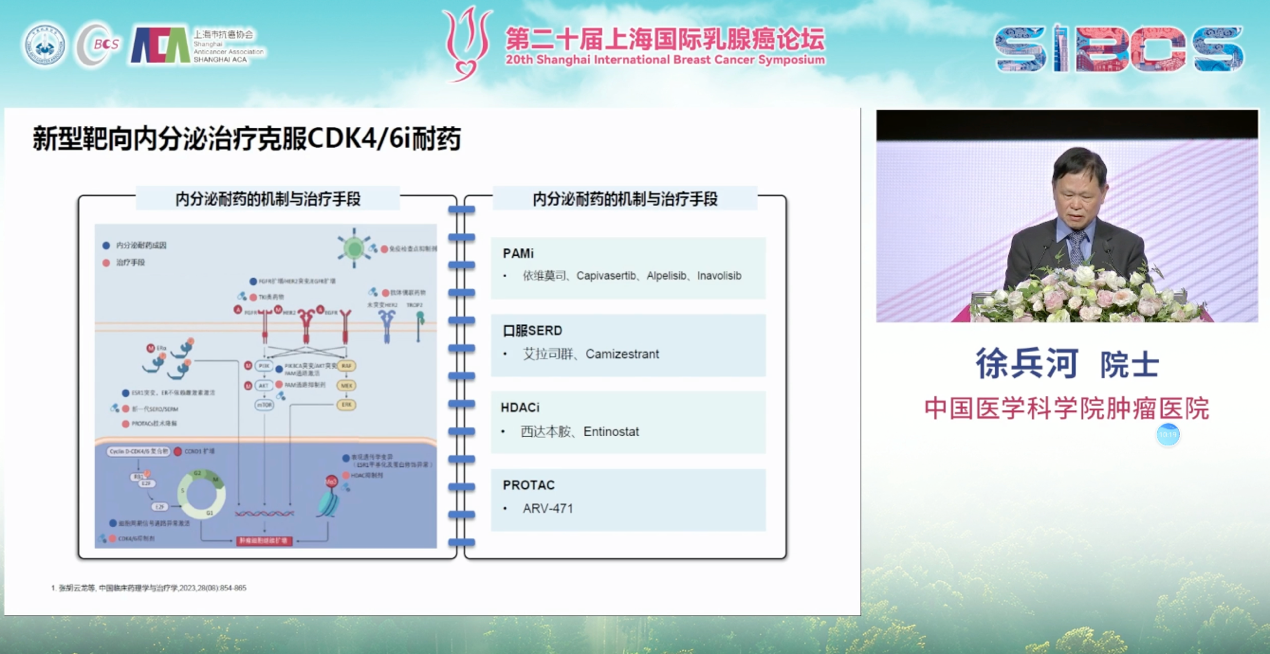
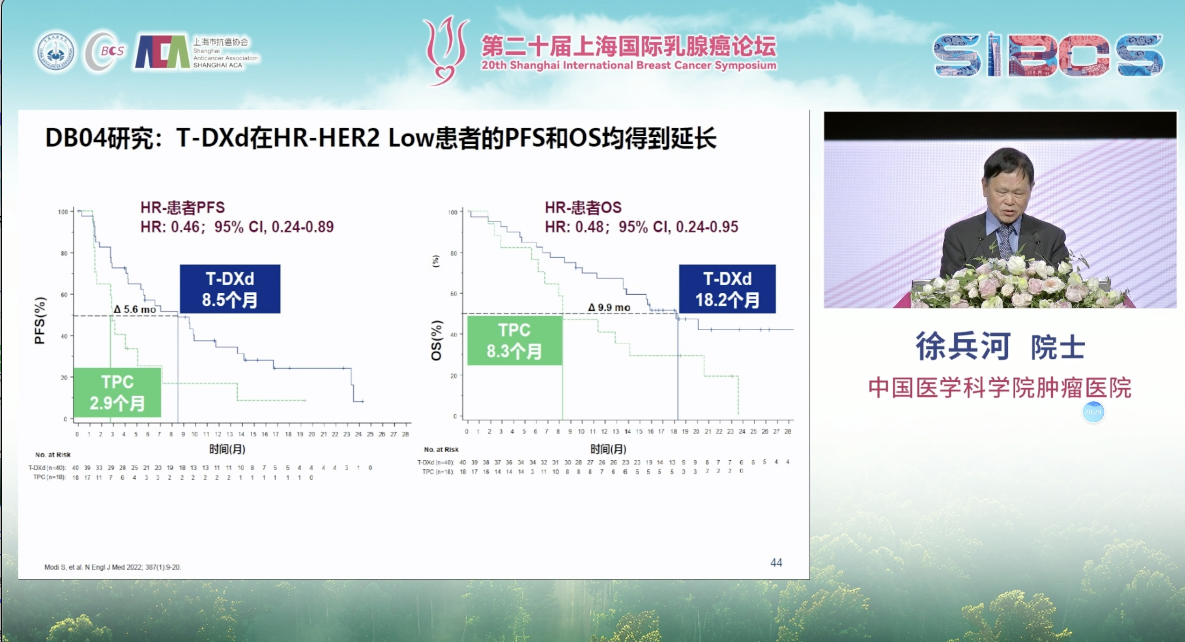
更令人振奋的是,ADC药物的浪潮也为HR阳性乳腺癌带来了范式转变。DESTINY-Breast04研究开创性地定义了“HER2低表达”这一可被靶向治疗的庞大新人群,并证实T-DXd对此类患者的疗效远超传统化疗。随后的DESTINY-Breast06研究进一步将获益人群拓展至“HER2超低表达”的患者,再次拓宽了ADC药物的治疗版图。此外,靶向TROP-2的ADC药物也显示出巨大潜力,TROPICS-02研究中的戈沙妥珠单抗(SG),以及TROPION-Breast01研究中的Dato-DXd,都为经多线治疗的HR阳性后线患者提供了宝贵的治疗新选择。

总体而言,2025年HR阳性/HER2阴性转移性乳腺癌的治疗格局已趋于精细化。对于新诊断或辅助治疗结束后≥12个月出现进展的患者,一线治疗通常选择CDK4/6抑制剂联合内分泌治疗或单用内分泌治疗。若患者在辅助治疗结束后<12个月内发生进展,则可在上述方案基础上联合PI3K抑制剂。对于合并内脏危象,尤其是病情严重快速进展的患者,化疗仍是重要选择,ADC也可作为替代方案。在二线及三线治疗中,目前也存在多种治疗策略可供选择。

三阴性乳腺癌:
免疫与ADC药物引领的精准突破
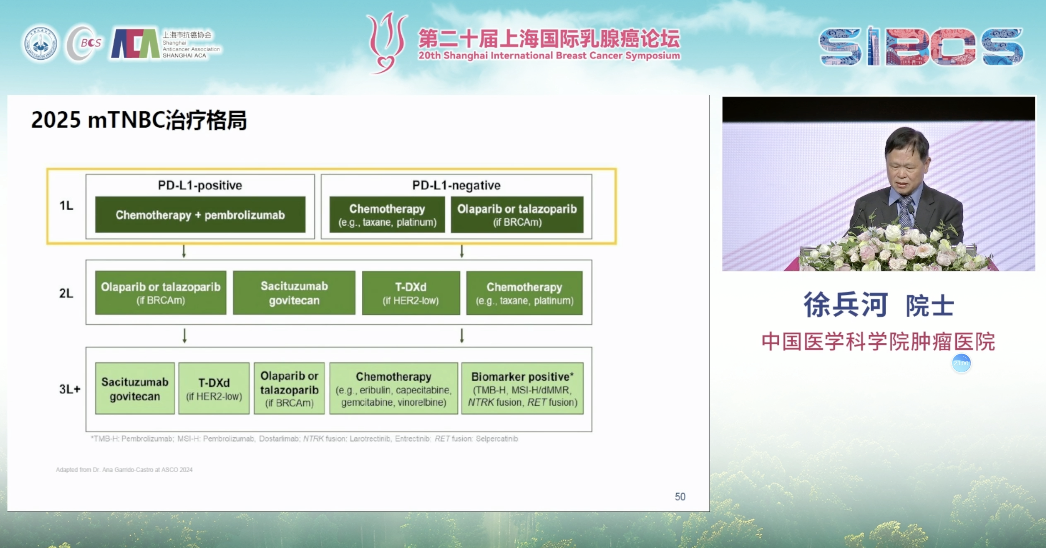
三阴性乳腺癌(TNBC)因其高度的异质性,历来是乳腺癌治疗的难点。对其进行更深层次的分子分型,是实现精准治疗的前提。“复旦四分型”为指导个体化治疗提供了重要的理论基础。
在治疗策略上,对于PD-L1阳性的晚期TNBC,IMpassion130和KEYNOTE-355等一系列研究已确立了免疫检查点抑制剂联合化疗作为一线标准治疗的地位,显著改善了患者的生存。
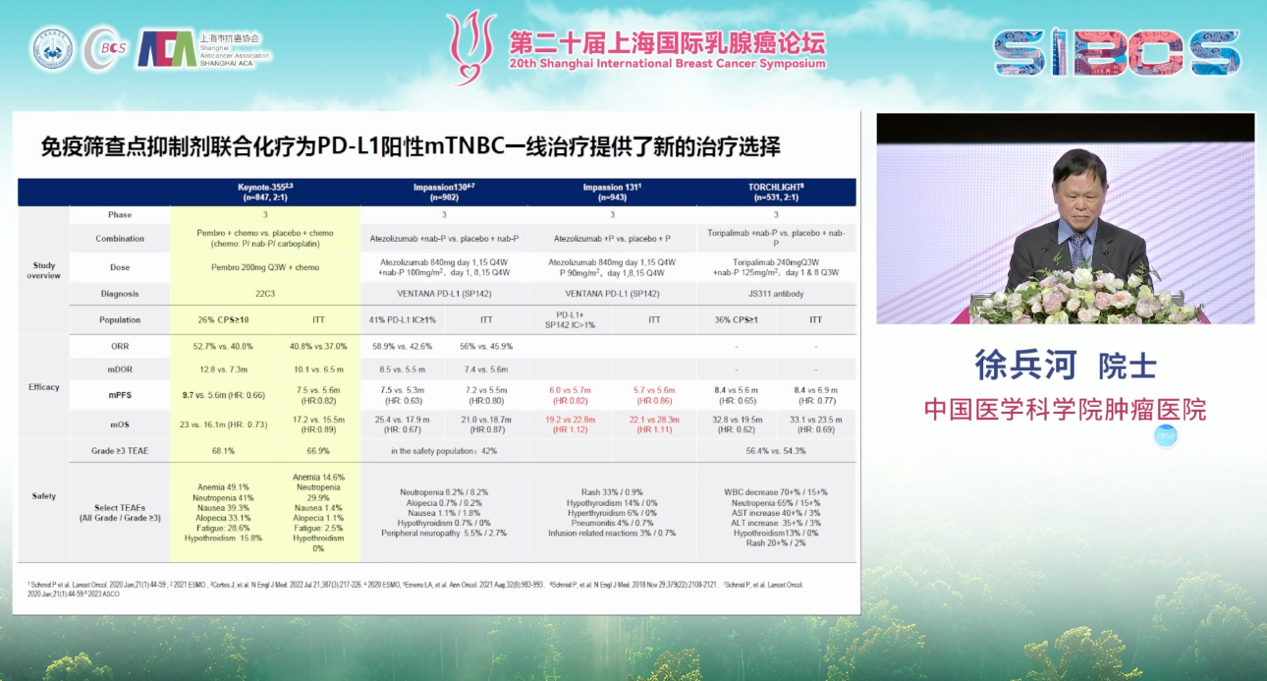
而对于PD-L1阴性或免疫治疗失败的患者, ADC药物再次扮演了“破局者”的角色。首先,DESTINY-Breast04研究的结果同样覆盖了部分属于HER2低表达的TNBC患者,为患者打开了抗HER2治疗的大门。
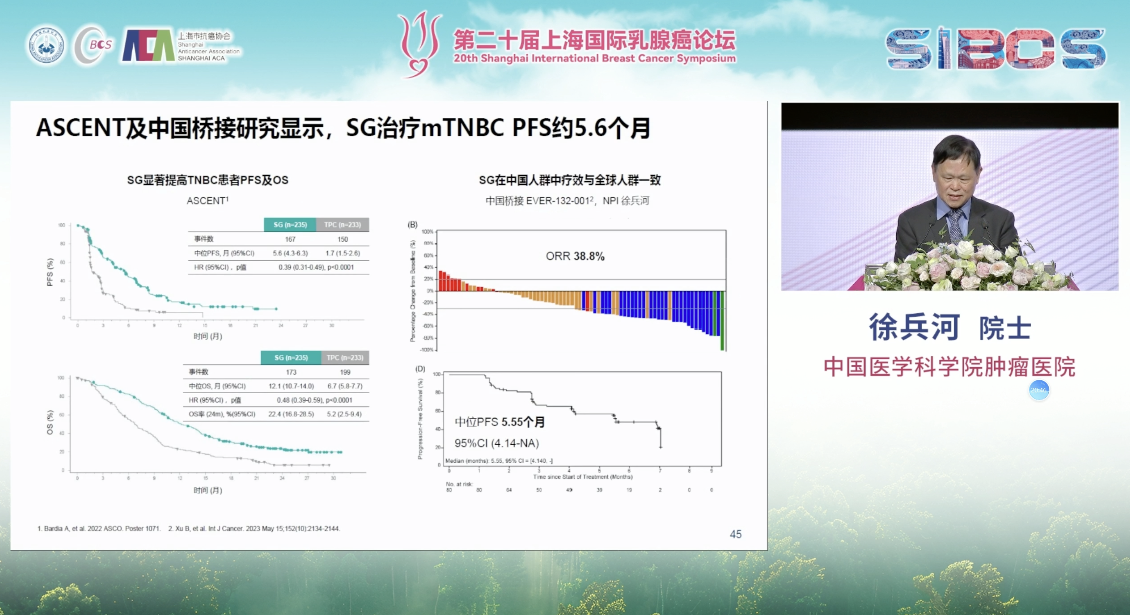
其次,靶向TROP-2的ADC药物已成为TNBC治疗的关键组成部分。戈沙妥珠单抗在ASCENT研究中证实了其对经治TNBC患者PFS和OS的双重改善。
尤其值得一提的是,由中国学者主导的新型TROP-2 ADC药物SKB264,在OptiTROP-Breast01研究中取得了令人鼓舞的阳性结果,PFS从2.5个月延长至6.7个月,彰显了本土创新药物的强大实力。

此外,以HER2为靶点的ADC与免疫治疗联合应用于一线治疗的研究已显示出初步的积极疗效。且ADC药物的靶点研究正在向HER2与TROP-2之外不断拓展。
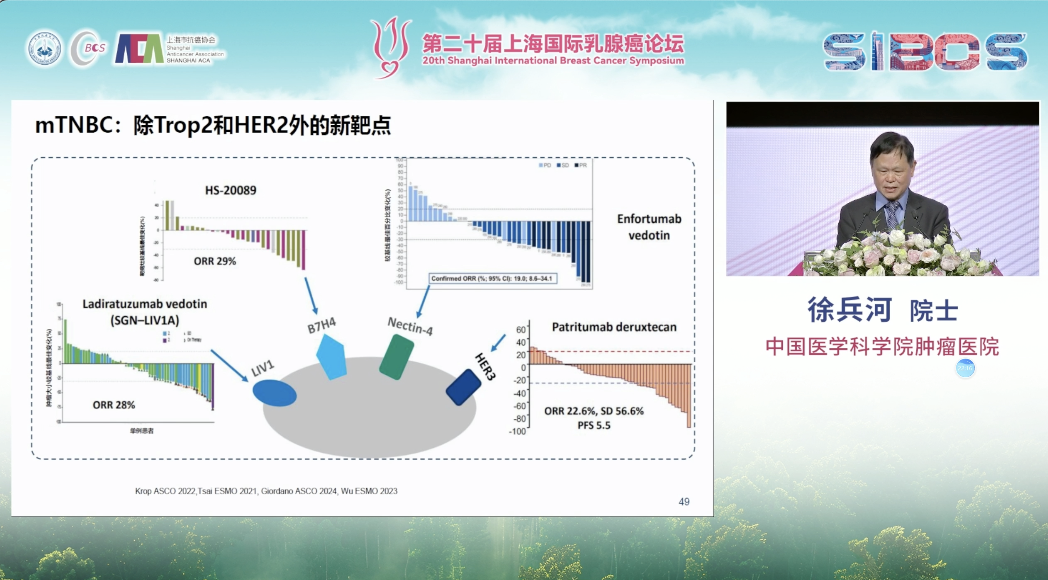
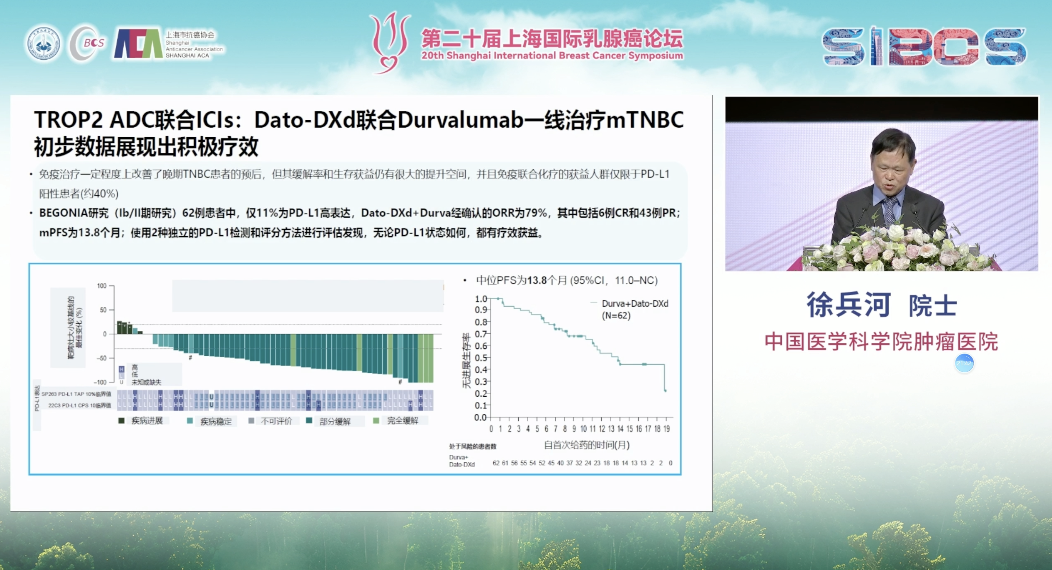
当前,TNBC的治疗格局正趋向精细化。在一线治疗中,PD-L1阳性患者的标准方案为免疫治疗联合化疗;而对于PD-L1阴性患者,则仍以化疗为主。此外,对于存在BRCA等特定基因突变的患者,可考虑采用PARP抑制剂等药物。在二线及后线治疗中,多种ADC及其他化疗方案提供了更多选择。总体而言,基于分子分型的精准治疗策略正推动TNBC的诊疗不断走向深化与细化。
未来展望:迈向多维融合的全周期管理新时代
展望未来,乳腺癌诊疗的发展可能呈现以下趋势:
首先,精准诊疗模式将持续创新。国际上提出的TNBC六分型、国内邵志敏教授和江一洲教授团队提出的“复旦四分型”等分子分型体系,将推动治疗策略的进一步细化与优化。
其次,基于平台的研究(如I-SPY2等)将有助于筛选出新辅助治疗中高危的早期乳腺癌人群,为新药研发和治疗方案优化提供重要平台。
第三,探索乳腺癌潜在新靶点也是未来重点方向。目前研究多集中于HER2等已知靶点,而如BRCA1、BRCA2等更多新靶点与三阴性乳腺癌的增殖、侵袭、转移及复发密切相关,值得进一步开展转化与临床研究。
第四,基于生物标志物的个体化治疗决策将更加深入。在分子分型基础上,进一步依据PIK3CA突变、HER2低表达、ESR1突变等特定标志物制定治疗策略,是未来的重要研究方向。
第五,人工智能将赋能乳腺癌精准治疗,在药物研发、靶点选择、个性化用药及智能诊疗等方面具有广阔应用前景。
第六,数字医疗通过将现代计算机与信息技术应用于医疗全过程,有望整体提升肿瘤诊疗水平。
第七,生物技术与信息技术的融合将打破数据孤岛,推动数据整合,为乳腺癌精准诊疗与研究提供新动力。
最后,随着乳腺癌患者生存期延长,乳腺癌正被视为一种慢性疾病。在多学科综合治疗的基础上,构建涵盖心血管、骨骼、妇科内分泌、心理健康等方面的全方位、全周期跨学科管理模式,已成为当前乳腺癌管理的重要发展方向。
排版编辑:肿瘤资讯-zxy











 苏公网安备32059002004080号
苏公网安备32059002004080号


