神经内分泌癌(NEC)是神经内分泌肿瘤(NEN)中一类高级别、低分化的肿瘤,涵盖小细胞肺癌(SCLC)及肺外神经内分泌癌(epNEC)以及肺大细胞神经内分泌癌(LCNEC-L)等类型[1-3]。与SCLC类似,其他类型的NEC也具有高度侵袭和早期转移等特性,常在诊断时已处于晚期或伴有远处转移,预后不良[4]。目前,epNEC和LCNEC-L的治疗手段有限,一线治疗往往参照SCLC治疗方案采用传统含铂双药化疗[4],但疗效并不理想[1,5],难以满足患者对有效治疗的迫切需求。
在2025年北美神经内分泌肿瘤学会(NANETS)年会上,一项I期临床试验DAREON-7 研究首次公布其初步结果。该研究聚焦于新型DLL3/CD3 IgG样T细胞衔接器(TcE)Obrixtamig(BI 764532)从诱导治疗阶段开始联合标准治疗(含铂双药化疗)用于DLL3阳性NEC一线治疗的安全性及有效性[5]。结果显示,该联合方案展现出显著的抗肿瘤活性,经确认的客观缓解率(ORR)为72%,中位缓解持续时间(DoR)为8.8个月,中位无进展生存期(PFS)为7.6个月,且安全性可控,为这一极具挑战性的肿瘤领域带来了全新的治疗思路。本文特邀北京大学肿瘤医院陆明教授深度点评DAREON-7研究成果,并盘点Obrixtamig在NEC治疗中的临床价值与未来治疗潜力。
专家介绍
·北京大学肿瘤医院消化内科 主任医师 副教授 硕士生导师
·北京高博医院消化肿瘤内科 执行主任
·中国医师协会外科医师分会MDT学组委员兼秘书
·中国临床肿瘤学会(CSCO)神经内分泌肿瘤委员会常委
·中国医促会神经内分泌肿瘤分会委员
·中国抗癌协会神经内分泌肿瘤专委会常委
·北京迈迪科公益基金会理事
·康林肿瘤科技创新研究院(苏州工业园区)理事
DAREON-7 研究数据首次披露,Obrixtamig联合疗法一线治疗NEC,安全性可控,疗效显著
DAREON-7(NCT06132113)是一项正在进行的I期开放标签剂量递增/扩展研究,旨在评估Obrixtamig联合标准治疗(SoC)含铂双药化疗(卡铂+依托泊苷)用于DLL3阳性NEC一线治疗的安全性和有效性。本次大会上研究者首次报告了DAREON-7研究剂量递增部分的初步安全性和有效性结果[5]。
研究设计
研究纳入局部晚期/转移性DLL3阳性epNEC、LCNEC-L,或原发灶不明的NEC患者。Obrixtamig通过静脉注射给药,起始阶梯给药,随后给予目标剂量(共设置3个目标剂量水平,10 mg、30 mg、60 mg)。在诱导治疗阶段(第1~6周期),给予Obrixtamig+卡铂+依托泊苷联合治疗;在维持治疗阶段(第7周期及以后),给予Obrixtamig单药治疗。
研究主要终点为在最大耐受剂量(MTD)评估期间出现的剂量限制性毒性(DLT)。次要终点包括治疗期间的不良事件(AE)和DLT,以及研究者根据RECIST v1.1标准评估的ORR、DoR、PFS。

患者特征
截至2025年8月28日,共25例患者接受了≥1个周期的目标剂量Obrixtamig联合SoC治疗,其中epNEC占88%(肿瘤部位包括胃肠道、泌尿生殖系统及其他部位),LCNEC-L占4%,原发灶不明的NEC占8%。亚裔患者占32%。Obrixtamig的中位治疗周期数为8(范围:2~17),中位治疗暴露时间为6.9个月(范围:1.4~12.0个月)。

安全性
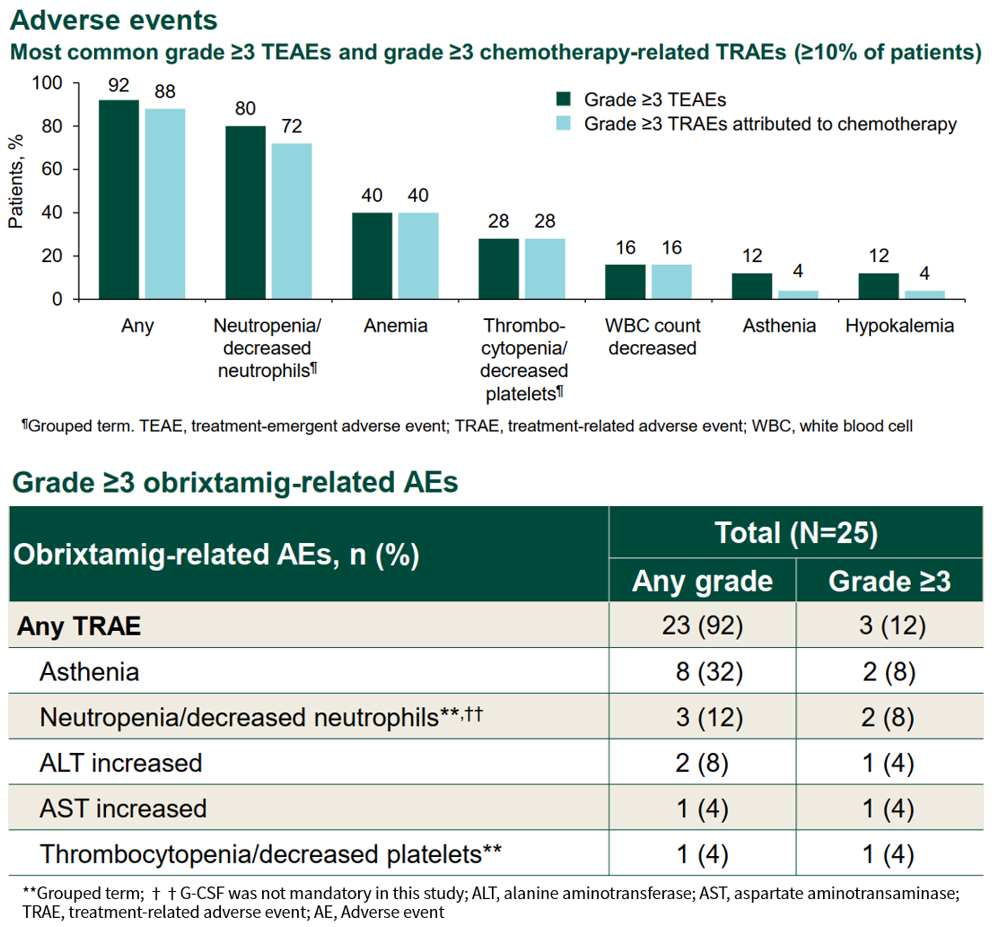
截至2025年8月28日,无DLT发生,MTD未达到。最常见的≥3级治疗期间不良事件(TEAE)是血细胞减少症,绝大部分事件与化疗相关。未发生5级AE。
总体而言,Obrixtamig联合SoC的安全性可控,最常见的Obrixtamig相关AE为乏力(32%),与Obrixtamig相关的3级AE发生率较低,仅为12%,没有患者因AE而停止Obrixtamig治疗。1例患者因AE(3级乏力和3级食欲减低)进行Obrixtamig剂量减低。临床较为关注的Obrixtamig相关细胞因子释放综合征(CRS)的发生率为72%,大部分为1级事件(56%),无≥3级CRS事件。Obrixtamig相关神经毒性事件罕见,仅报告1例(4%,1级)。
有效性
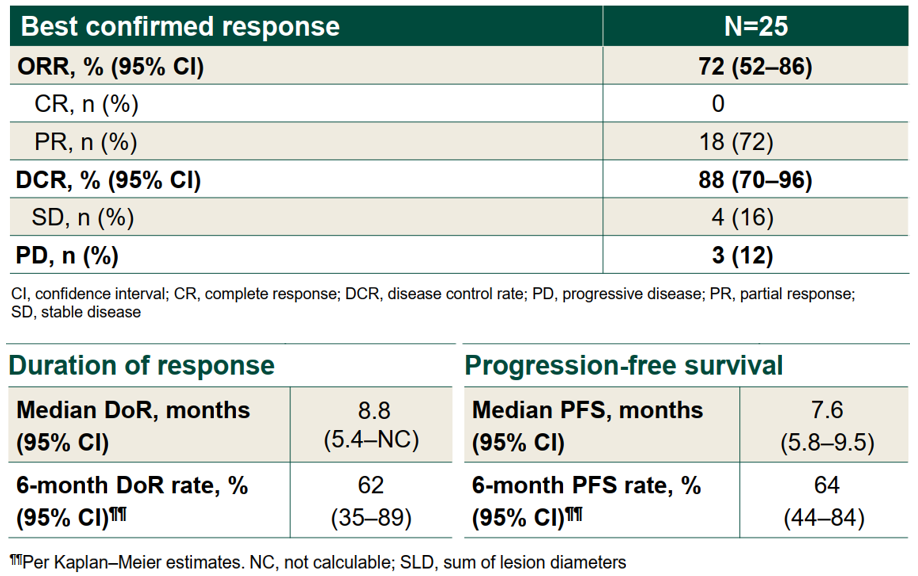
Obrixtamig联合SoC显示出令人鼓舞的抗肿瘤活性。截至2025年8月28日,在25例可评估的患者中,23例观察到靶病灶肿瘤缩小。经确认的ORR为72%(95% CI:52%~86%),经确认的疾病控制率(DCR)为88%(95% CI:70%~96%)。大多数确认的缓解持续时间已超过6个月,而且仍在持续缓解中。中位DoR为8.8个月(95% CI:5.4个月~NC),6个月DoR率为62%(95% CI:35%~89%)。中位PFS为7.6个月(95% CI:5.8~9.5个月),6个月PFS率为64%(95% CI:44%~84%)。11例患者仍在接受治疗。
专家点评:
Obrixtamig一线治疗潜力凸显,或成NEC治疗新契机
NEC是一类高度异质性的肿瘤,可发生于全身多个部位,通常进展迅速,多数患者在确诊时已属晚期[2,4]。SCLC是最常见的NEC,发病率约为4.61例/10万人[2,6]。相比之下,epNEC和LCNEC-L的发病率极低,分别约为0.8例/10万人和0.31例/10万人[6, 7]。其中,epNEC发生部位极为广泛,最常见于胃肠胰(GEP,约37%),其次是泌尿生殖系统(GU,约17%)和妇科系统(GY,约10%)[2],具有高度异质性。
目前,epNEC和LCNEC-L一线治疗缺乏大规模前瞻性数据指导[5],多参照SCLC治疗方案,采用传统含铂双药化疗,免疫治疗对于一线epNEC和LCNEC-L患者的临床价值未得到充分验证。总体上,目前的治疗方案无法为患者带来长期的生存益处[1]。以晚期epNEC患者为例,含铂双药方案一线治疗的ORR约为30%~54.5%,中位PFS约4~5.6个月,中位总生存期(OS)约11~12.5个月[3, 8]。而且,这些试验主要集中在GEP-NEC,或采用过时的分类标准,或未能全面纳入各类epNEC患者[3,5,8]。因此,亟需在更广泛的NEC患者群体中探索更有效的治疗策略。
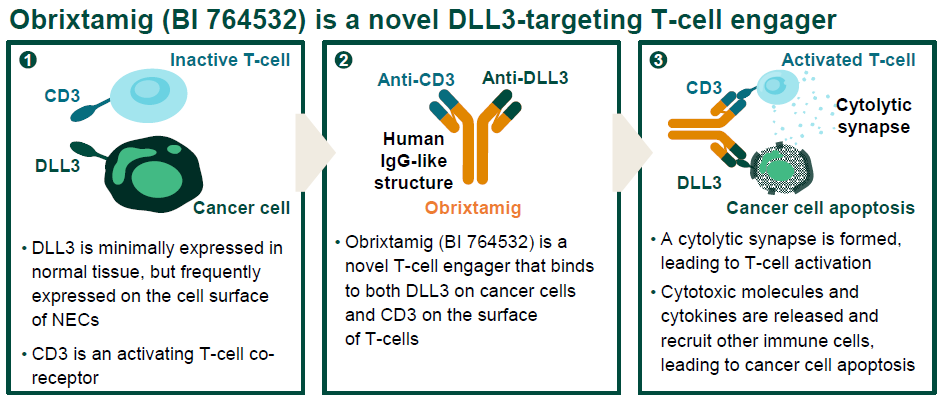
DLL3是一种Notch通路抑制性配体,在正常组织中几乎不表达,但在NEC细胞表面广泛表达,其中epNEC以及LCNEC-L的癌细胞表面DLL3阳性率分别为80%和75%[1]。Obrixtamig是一种双特异性DLL3/CD3 IgG样TcE,通过同时结合肿瘤细胞表面的DLL3和T细胞表面的CD3,将T细胞引导至表达DLL3的肿瘤细胞,产生细胞溶解性免疫突触,激活免疫系统以杀伤癌细胞[1, 5, 9]。
2025年9月,肿瘤领域权威期刊《Journal of Clinical Oncology》重磅发表了Obrixtamig的首项人体、剂量递增Ia期1438.1研究(NCT04429087)结果[1]。该研究表明,Obrixtamig单药二线治疗DLL3阳性晚期或转移性SCLC、epNEC和LCNEC-L均具有良好的安全性和抗肿瘤活性。其中,在剂量水平≥90μg/kg时,epNEC患者的ORR为27.9%,DCR为45.9%,而LCNEC-L患者的ORR高达70.0%,DCR达90%,为在epNEC和LCNEC-L中进一步探索提供了有力依据[1]。在2025年美国临床肿瘤学会(ASCO)年会上,1438.1研究进一步更新了其在epNEC患者中的研究数据。此次更新基于DLL3表达情况,对疗效及安全性结果进行了分析,研究发现,DLL3高表达epNEC患者确认的ORR可达40%,DCR达67%,中位DoR达7.9个月,且安全性可控[10]。
在此基础上,Obrixtamig进一步开展了DAREON-7研究,探索其从诱导治疗阶段联合SoC用于NEC一线治疗的潜力。DAREON-7研究首次证实,在初治DLL3阳性NEC患者中,Obrixtamig联合SoC不仅安全可控,且疗效令人鼓舞。MTD评估期间未观察到DLT发生,与Obrixtamig相关的3级AE发生率较低,无患者因AE停药,且联合方案的安全性特征与各单药一致,未出现新的毒性信号,支持其与含铂双药化疗联合的良好耐受性。在epNEC和LCNEC-L患者中,近四分之三的患者肿瘤显著缩小,经确认的ORR为72%,中位DoR和中位PFS分别为8.8个月和7.6个月,6个月DoR率和PFS率分别为62%和64%,截至数据分析时大多数患者仍在持续获益[5]。这些结果令人振奋,支持进一步推进Obrixtamig联合含铂双药化疗方案在NEC人群中的研发。
不仅如此,Obrixtamig联合标准化疗(卡铂+依托泊苷)与PD-L1抑制剂(阿替利珠单抗)一线治疗广泛期小细胞肺癌(ES-SCLC)的DAREON-8研究,也在2025年欧洲肿瘤内科学会(ESMO)年会上公布了初步结果[11]。其结果显示,Obrixtamig联合标准化疗与PD-L1抑制剂一线治疗具有可接受的安全性和卓越的疗效,经确认的ORR为68%,中位DoR为7.3个月,6个月和9个月的PFS率分别为73%和52%[11]。
长期以来,NEC一线治疗选择有限,患者生存结局不容乐观。DAREON-7和DAREON-8研究的公布,犹如一道曙光,为这类患者的一线治疗开辟了全新的治疗方向。我们期待DAREON-7/8研究后续数据的公布,以及Obrixtamig在更大规模临床试验中的进一步验证,为NEC患者点亮生命的希望之光。
[1] Wermke M, Gambardella V, Kuboki Y, et al. Phase I Dose-Escalation Results for the Delta-Like Ligand 3/CD3 IgG-Like T-Cell Engager Obrixtamig (BI 764532) in Patients With Delta-Like Ligand 3+ Small Cell Lung Cancer or Neuroendocrine Carcinomas. J Clin Oncol. 2025. 43(27): 3021-3031.
[2] Stumpo S, Formelli MG, Persano I, et al. Extrapulmonary Neuroendocrine Carcinomas: Current Management and Future Perspectives. J Clin Med. 2023. 12(24): 7715.
[3] Morizane C, Machida N, Honma Y, et al. Effectiveness of Etoposide and Cisplatin vs Irinotecan and Cisplatin Therapy for Patients With Advanced Neuroendocrine Carcinoma of the Digestive System: The TOPIC-NEC Phase 3 Randomized Clinical Trial. JAMA Oncol. 2022. 8(10): 1447-1455.
[4] 中国临床肿瘤学会(CSCO). CSCO神经内分泌肿瘤诊疗指南2024.
[5] Aman Chauhan, Saori Mishima, Ana Custodio, et al. DAREON®-7: Phase I open-label dose-escalation/-expansion study of first-line obrixtamig (BI 764532) plus platinum-doublet chemotherapy in patients with DLL3-positive neuroendocrine carcinomas. 2025 NANETS. #C-8.
[6] Huang L, Feng Y, Xie T, Zhu H, Tang L, Shi Y. Incidence, survival comparison, and novel prognostic evaluation approaches for stage iii-iv pulmonary large cell neuroendocrine carcinoma and small cell lung cancer. BMC Cancer. 2023. 23(1): 312.
[7] Dasari A, Mehta K, Byers LA, Sorbye H, Yao JC. Comparative study of lung and extrapulmonary poorly differentiated neuroendocrine carcinomas: A SEER database analysis of 162,983 cases. Cancer. 2018. 124(4): 807-815.
[8] Sorbye H, Welin S, Langer SW, et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol. 2013. 24(1): 152-60.
[9] Wermke M, Felip E, Gambardella V, et al. Phase I trial of the DLL3/CD3 bispecific T-cell engager BI 764532 in DLL3-positive small-cell lung cancer and neuroendocrine carcinomas. Future Oncol. 2022. 18(24): 2639-2649.
[10] Jaume Capdevila, Valentina Gambardella, Yasutoshi Kuboki, et al. Efficacy and safety of the DLL3/CD3 T-cell engager obrixtamig in patients with extrapulmonary neuroendocrine carcinomas with high or low DLL3 expression: Results from an ongoing phase I trial. 2025 ASCO. Abstract 3004.
[11] Solange Peters, Rafal Dziadziuszko, Ewa Kalinka, et al. DAREON®-8: A phase I trial of first-line obrixtamig plus chemotherapy and atezolizumab in extensive-stage small cell lung carcinoma (ES-SCLC). 2025 ESMO. 2759MO.
排版编辑:肿瘤资讯-黄洋洋
审批号:SC-CN-18236,有效期至:11/18/2026











 苏公网安备32059002004080号
苏公网安备32059002004080号


