小细胞肺癌(SCLC)是一种神经内分泌细胞来源的恶性肿瘤,由于其较强的侵袭性,约80%-85%的患者在初诊时已发展至广泛期小细胞肺癌(ES-SCLC),2年生存率不足5%[1-3]。尽早开始最佳治疗至关重要,因为许多患者可能无法进入治疗维持期[4]。在今年欧洲肿瘤内科学会(2025 ESMO)年会上,一项I期临床试验DAREON-8研究以口头报告的形式首次公布其初步数据,探索了新型DLL3/CD3 IgG样T细胞衔接器(TcE)Obrixtamig从诱导治疗阶段开始联合标准治疗(SoC)用于ES-SCLC一线治疗的安全性与有效性[4]。本文特邀上海市胸科医院艾星浩教授深入剖析和点评该研究结果,并展望Obrixtamig在SCLC中的未来应用前景。

DAREON-8研究数据首度公布,
Obrixtamig联合疗法一线治疗ES-SCLC,安全性与疗效表现优异
DAREON-8(NCT06077500)是一项正在进行的剂量递增/扩展试验,旨在评估Obrixtamig联合标准治疗用于ES-SCLC患者一线诱导治疗和维持治疗的安全性和有效性。本次大会上研究者首次报告了DAREON-8试验剂量递增部分的数据[4]。
研究设计
Obrixtamig通过静脉注射给药,起始阶梯给药,随后给予Q3W目标剂量给药(共设置3个目标剂量水平)。在诱导治疗阶段(第1-4周期),给予Obrixtamig与卡铂+依托泊苷+阿替利珠单抗联合治疗;在维持治疗阶段(第5周期及以后),给予Obrixtamig与阿替利珠单抗联合治疗。Obrixtamig治疗持续至疾病进展、出现不可接受的毒性或停药。剂量递增试验阶段不允许G-CSF预防性用药。
研究主要终点为在最大耐受剂量(MTD)评估期间出现的剂量限制性毒性(DLTs)。次要终点包括治疗期间的不良事件(AEs)和DLTs,以及研究者根据RECIST v1.1标准评估的客观缓解率(ORR)、缓解持续时间(DoR)等。

截至2025年8月21日,28例患者接受了≥1个周期的目标剂量Obrixtamig联合SoC治疗。Obrixtamig的中位治疗周期数为9(范围:1-18),中位治疗暴露时间为6.4个月(范围:0-12.9)[4]。
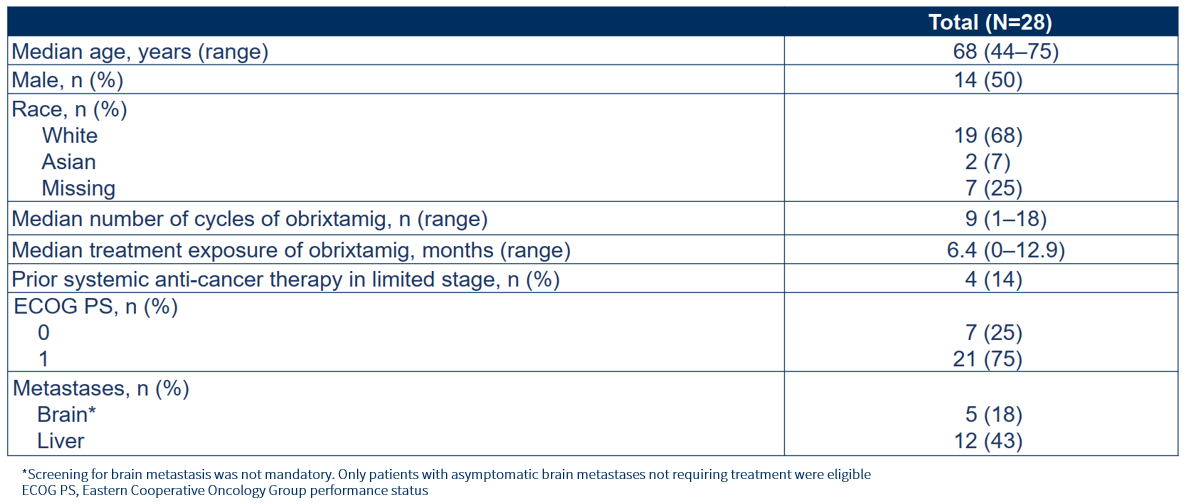
安全性结果
截至2025年8月21日,仅发生1例DLT(肿瘤相关疼痛,3级);MTD未达到。治疗期间不良事件(TEAEs)特征符合预期且可控。最常见的≥3级 TEAEs是血细胞减少症,绝大部分事件与化疗相关(图2A)。未发生5级AEs。总体上,观察到Obrixtamig与化疗及免疫治疗联合模式具有良好的耐受性。
最常见的(≥25%)Obrixtamig相关不良事件包括细胞因子释放综合征(CRS)、味觉障碍、食欲减低、中性粒细胞减少症、发热、贫血及疲劳,多为1-2级(图2B)。其中,CRS事件发生率为50%,无3级或以上事件。Obrixtamig相关潜在神经毒性事件发生率为25%,无3级或以上事件,报告事件包括肌痉挛(3例)、免疫效应细胞相关神经毒性综合征(ICANS,2例)以及头晕(1例)。中性粒细胞减少症发生率(任意级别/≥3级)为29%/21%,其中,只有1例2级事件仅与Obrixtamig相关[4]。
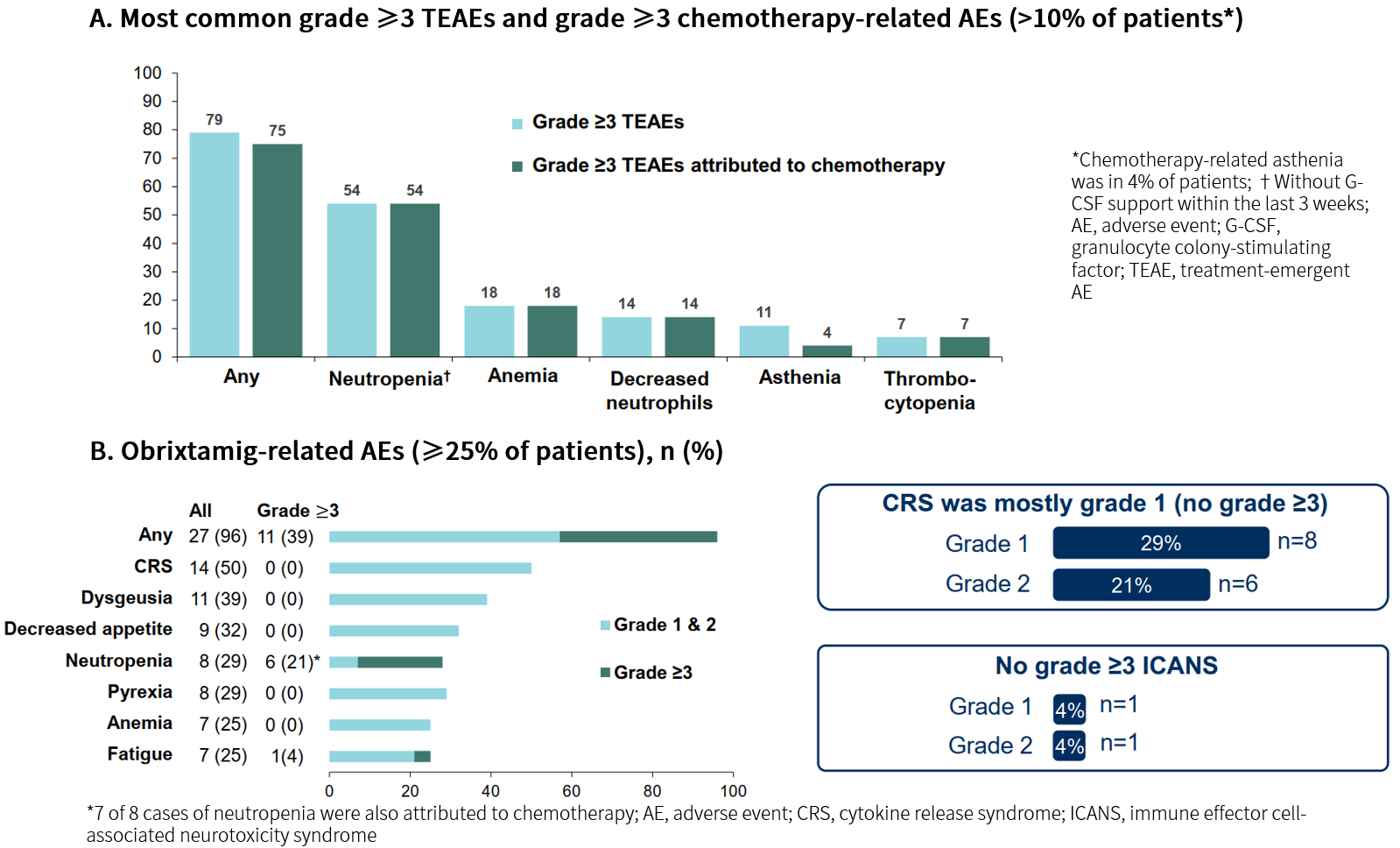
有效性结果
截至2025年8月21日,经确认的ORR为68%(95% CI: 49–82),经确认的疾病控制率(DCR)为89%(95% CI: 73–96),中位DoR为7.3个月(95% CI: 4.4–NC)。中位无进展生存期(PFS)尚未达到,6/9个月PFS率分别为73%和52%(中位随访时间为6.9个月)[4]。在SoC基础上联合Obrixtamig在一线诱导治疗和维持治疗ES-SCLC患者中展示出令人鼓舞的初步疗效。
专家点评:
Obrixtamig一线治疗未来可期,有望为ES-SCLC患者带来新希望
SCLC是一种发生在肺部的神经内分泌癌(NEC),约占所有肺癌病例的15%,全球每年新确诊病例高达25万[2]。根据国家癌症中心发布的中国恶性肿瘤调查数据,2022年新发现SCLC病例数约为16万人[5]。SCLC具有生长迅速、侵袭性强、转移早、预后差等特点,约80%-85%的患者首次确诊时已发展至ES-SCLC,60%的患者在诊断时已发生转移[1, 2]。目前,ES-SCLC以铂类联合依托泊苷和PD-(L)1抑制剂作为一线SoC[6]。虽然一线治疗应答率较高,达到60%-80%,但约50%-70%的患者在6个月内出现疾病进展[1, 7-12],总体生存获益亟待改善,中位无进展生存期(PFS)仅约5个月,总生存期(OS)约12-13个月,2年生存率不足5%[3, 6]。因此,亟需针对ES-SCLC一线治疗开发新的治疗策略和药物组合,以填补巨大的临床未满足需求。
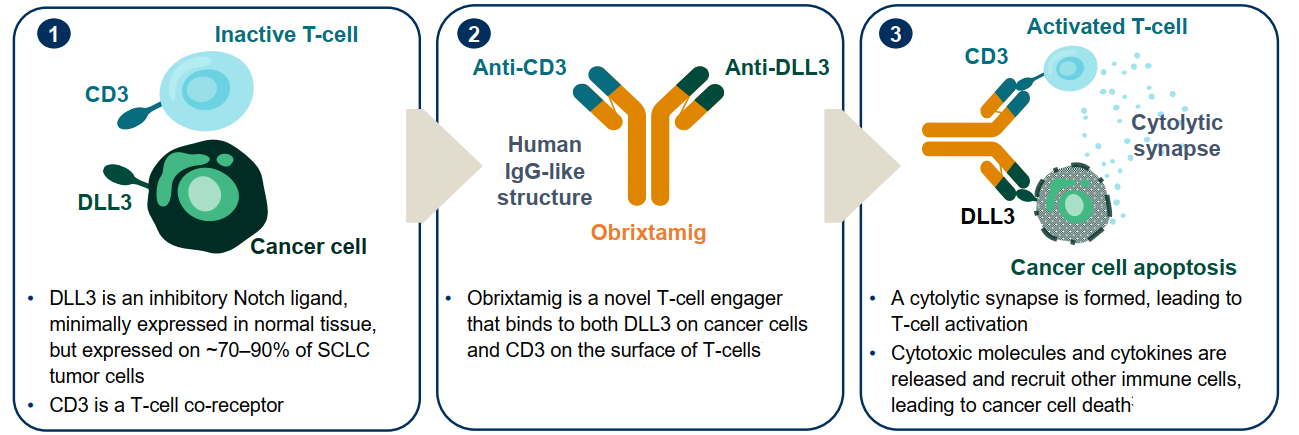
DLL3是一种Notch通路抑制性配体,在正常组织中几乎不表达,但约70%-90%的SCLC患者在肿瘤细胞表面具有DLL3异常表达,这使DLL3成为选择性免疫治疗的理想靶点[4, 6]。Obrixtamig(BI 764532)是一种新型DLL3/CD3 IgG样TcE,通过同时结合肿瘤细胞表面的DLL3和T细胞表面的CD3,将T细胞引导至表达DLL3的肿瘤细胞,产生细胞溶解性免疫突触,激活免疫系统以杀伤癌细胞,为SCLC治疗带来了新的希望[6]。
2025年9月,Obrixtamig的首项人体、剂量递增Ia期1438.1研究(NCT04429087)结果发表于《Journal of Clinical Oncology》杂志[6]。该研究表明,Obrixtamig单药治疗在既往经治的DLL3阳性晚期或转移性SCLC、肺外神经内分泌癌(epNEC)和肺大细胞神经内分泌癌(LCNEC-L)患者中均显示出可控的安全性和令人鼓舞的抗肿瘤活性,且支持Obrixtamig以Q3W给药,为后续Obrixtamig以联合治疗策略在SCLC等NEC人群的进一步临床研发奠定了基础。
今年美国临床肿瘤学会(ASCO)上对DAREON-9研究(Ib 期研究,NCT05990738)的中期分析结果进行了公布[13],这项研究旨在探索Obrixtamig与化疗联合用于ES-SCLC 后线治疗的安全性和有效性。本次ESMO大会上对DAREON-9研究进行了数据更新:截至 2025年5月22日,已有 30 例患者入组并接受≥1个周期Obrixtamig,Obrixtamig联合化疗在二线及以上ES-SCLC患者中经确认ORR达到72%,DCR为86%,中位DoR为 6.9 个月,中位PFS为5.7个月,该联合疗法的安全性结果符合预期,无额外毒性[14]。Dareon-9研究结果进一步强调了Obrixtamig联合方案用于SCLC治疗的临床潜力。
在此基础上,Obrixtamig进一步在DAREON-8研究中对其从诱导治疗阶段开始联合SoC用于ES-SCLC一线治疗进行了研究,并在本次ESMO大会上首次公开数据。在安全性方面,Obrixtamig联合标准治疗展现出良好的耐受性,绝大部分≥3级TEAE归因于化疗,未报道≥3级CRS/潜在神经毒性事件(包括ICANS)。该联合方案的不良事件发生特征与各单药治疗的已知安全性特征一致[4]。在疗效方面,从一线诱导治疗早期开始联合Obrixtamig显示出令人鼓舞的临床结果,经确认ORR为68%,中位DoR为7.3个月,6个月和9个月的PFS率分别为73%和52%。本试验中观察到的Obrixtamig与化疗及免疫治疗的可联合性,支持该联合方案在ES-SCLC一线治疗中进行进一步研究[4],有望为ES-SCLC一线治疗提供全新的治疗路径。
总的来说,Obrixtamig作为一种新型DLL3/CD3 IgG样双特异性TcE,凭借其在联合治疗中展现的良好的安全性、耐受性以及令人鼓舞的初步疗效,将为其后续大规模临床试验铺平道路,为SCLC的一线治疗带来了新的曙光。同时,Obrixtamig也正在其他DAREON系列研究中以单药或联合治疗策略探索其用于各类epNEC人群治疗的临床潜力[15, 16]。我们期待Obrixtamig在未来的临床研究中取得更多突破,为SCLC和广泛的神经内分泌癌患者带来更多的治疗选择,改善患者预后与生活质量。
专家简介
专家介绍
医学博士,上海市胸科医院肺部肿瘤临床医学中心副主任医师,硕士生导师
中国医药教育协会肿瘤免疫治疗专业委员会委员
中国抗癌协会科普委员会委员
中国抗癌协会免疫治疗专业委员会委员
中国肺癌防治联盟肺癌免疫治疗委员会委员
吴阶平医学基金会肿瘤多学科诊疗专业委员会副秘书长
上海市女医师协会肺癌专业委员会副主任委员
上海市抗癌协会肿瘤免疫治疗专业委员会秘书长
上海市康复医学医疗器械专业委员会委员
JCO中文编委
2021年获中华医学科学技术奖二等奖
2023年获上海医学科技奖一等奖
[1] 中国临床肿瘤学会小细胞肺癌专家委员会, 中国医师协会肿瘤多学科诊疗专业委员会. 小细胞肺癌免疫治疗专家共识(2025版). 中华肿瘤杂志. 2025. 47(01): 65-75.
[2] Ogieuhi IJ, Ajekiigbe VO, Oladipo TC, et al. Bispecific T-cell engagers (BiTE): a review of tarlatamab in small cell lung cancer. Clin Transl Oncol. 2025 .
[3] Lally BE, Urbanic JJ, Blackstock AW, Miller AA, Perry MC. Small cell lung cancer: have we made any progress over the last 25 years. Oncologist. 2007. 12(9): 1096-104.
[4] Solange Peters, et al. DAREON®-8: A phase I trial of first-line obrixtamig plus chemotherapy and atezolizumab in extensive-stage small cell lung carcinoma (ES-SCLC). 2025 ESMO. 2759MO .
[5] 郑荣寿, 陈茹, 韩冰峰等. 2022年中国恶性肿瘤流行情况分析. 中华肿瘤杂志. 2024. 46(03): 221-231.
[6] Wermke M, Gambardella V, Kuboki Y, et al. Phase I Dose-Escalation Results for the Delta-Like Ligand 3/CD3 IgG-Like T-Cell Engager Obrixtamig (BI 764532) in Patients With Delta-Like Ligand 3+ Small Cell Lung Cancer or Neuroendocrine Carcinomas. J Clin Oncol. 2025. 43(27): 3021-3031.
[7] Xie J, Chen M, Han H, et al. Clinical impact of first-line PD-1 or PD-L1 inhibitors combined with chemotherapy in extensive-stage small cell lung cancer patients: A real-world multicenter propensity score-matched study. Thorac Cancer. 2023. 14(15): 1327-1338.
[8] Horn L, Mansfield AS, Szczęsna A, et al. First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer. N Engl J Med. 2018. 379(23): 2220-2229.
[9] Goldman JW, Dvorkin M, Chen Y, et al. Durvalumab, with or without tremelimumab, plus platinum-etoposide versus platinum-etoposide alone in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): updated results from a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2021. 22(1): 51-65.
[10] Wang J, Zhou C, Yao W, et al. Adebrelimab or placebo plus carboplatin and etoposide as first-line treatment for extensive-stage small-cell lung cancer (CAPSTONE-1): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022. 23(6): 739-747.
[11] Cheng Y, Fan Y, Zhao Y, et al. Tislelizumab Plus Platinum and Etoposide Versus Placebo Plus Platinum and Etoposide as First-Line Treatment for Extensive-Stage SCLC (RATIONALE-312): A Multicenter, Double-Blind, Placebo-Controlled, Randomized, Phase 3 Clinical Trial. J Thorac Oncol. 2024. 19(7): 1073-1085.
[12] Cheng Y, Zhang W, Wu L, et al. Toripalimab Plus Chemotherapy as a First-Line Therapy for Extensive-Stage Small Cell Lung Cancer: The Phase 3 EXTENTORCH Randomized Clinical Trial. JAMA Oncol. 2025. 11(1): 16-25.
[13] Martin Wermke, Jürgen Alt, Farastuk Bozorgmehr, et al. DAREON-9, a phase Ib study of obrixtamig plus topotecan in patients (pts) with advanced small cell lung cancer (SCLC): Interim analysis results. 2025 ASCO Abstract 8094 .
[14] Martin Wermke, Juergen Alt, Farastuk Bozorgmehr, et al. DAREON®-9: A phase Ib open-label dose escalation and dose confirmation study of obrixtamig (BI 764532) plus topotecan in patients (pts) with advanced small-cell lung cancer (SCLC): Updated results. 2025 ESMO. 2774P .
[15] Marianne E. Pavel, Chris Verslype, Pedro Rocha, et al. Obrixtamig (BI 764532) in patients (pts) with relapsed/refractory delta-like ligand 3 (DLL3)-high expressing extrapulmonary neuroendocrine carcinoma (epNEC): Trial in progress of the dose expansion part of the phase II DAREON®-5 trial. 2025 ESMO. 1731TiP .
[16] Aman Chauhan, Saori Mishima, Ana Custodio, et al. DAREON®-7: Phase I open-label dose-escalation/-expansion study of first-line obrixtamig (BI 764532) plus platinum-doublet chemotherapy in patients with DLL3-positive neuroendocrine carcinomas. 2025 NANETS. #C-8 .
审批号:SC-CN-18189, 有效期至:11/3/2026
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


