直肠癌是常见的消化系统恶性肿瘤,低位(肿瘤下缘距肛缘≤5cm)直肠癌又占据了一半左右的病例[1]。新辅助同步放化疗(CRT)后行全直肠系膜切除术(TME)是局部晚期低位直肠癌的标准治疗方案[2]。然而,由于盆腔的空间狭小,低位直肠癌手术难度大,手术切缘有时难以保障,术后易复发。此外,TME可能导致肛门无法保留,须永久性造口;即使肛门能够保留也常需要临时佩戴造口袋,术后生活质量差。患者常陷于“保命”还是“保肛”的难题,有质量的生活还是仅追求长期生存是低位直肠癌患者的痛苦选择。
既往研究证实,对新辅助治疗后达到临床完全缓解(cCR)的患者实施观察等待策略可保留直肠、肛门的结构和功能,使患者避免手术及术后并发症的同时可达到较为满意的远期生存[3]。然而,传统CRT新辅助治疗后达到病理完全缓解(pCR)的患者比例相对较低,文献报道约为20%;全程新辅助治疗(TNT)可提高pCR率至30%左右[4,5]。CRT或TNT后达到cCR的患者比例则少有报道。
近期的数项临床研究结果表明,与单独使用TNT相比,PD-1抑制剂联合TNT可显著提高MSS型直肠癌的pCR率。UNION研究证实,短程放疗序贯CAPOX联合卡瑞利珠单抗的pCR率显著高于TNT组的pCR率(39.8% vs. 15.3%,P<0.001)[6]。另一项II期RCT研究显示,长程新辅助放化疗后序贯CAPOX联合信迪利单抗的完全缓解率(pCR+cCR率)显著高于对照组(44.8% vs. 26.9%,P=0.031)[7]。因此,预计PD-1抑制剂联合TNT对于提高低位直肠癌患者的器官保留比例有较大潜力。
正在德国柏林召开的2025 ESMO大会公布了一项免疫治疗用于MSS型低位直肠癌器官保留的研究——RELIEVE-01研究的初步结果[8]。【肿瘤资讯】邀请RELIEVE-01研究的主要研究者——复旦大学附属中山医院许剑民教授和汤文涛医师为读者解读本研究的初步数据及未来研究方向。


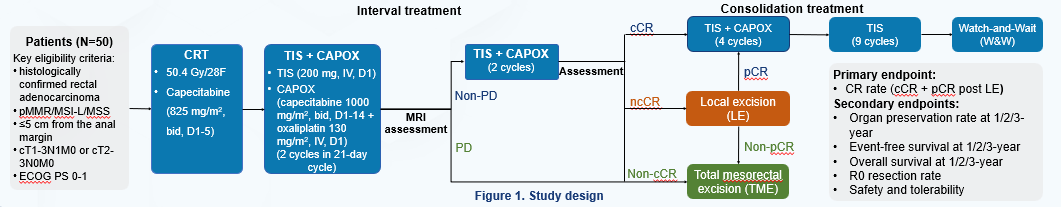
RELIEVE-01研究设计
RELIEVE-01研究(NCT06390982)是一项全国多中心、单臂、Ⅱ期研究,旨在评估CRT序贯替雷利珠单抗+CAPOX方案用于低位直肠癌患者的器官保留的疗效。该研究纳入经组织病理学确认的局晚期低位直肠腺癌患者(肿瘤下缘距肛缘≤5厘米),关键入组标准还包括:错配修复正常(pMMR)/微卫星低不稳定性(MSI-L)/微卫星稳定(MSS),cT1~3N1M0/T2~3N0M0,且ECOG体能状态评分≤1。
患者首先接受6周的CRT(50.4 Gy/28次,卡培他滨825 mg/m2,每日2次,每周第1~5天),随后接受4个周期的替雷利珠单抗+CAPOX方案(21天为一个周期,替雷利珠单抗200 mg,静脉注射,第1天;卡培他滨1000 mg/m2,每日2次,第1~14天;奥沙利铂130 mg/m2,第1天)。治疗完成后,将评估临床缓解程度以决定后续治疗:达到cCR的患者将接受替雷利珠单抗+CAPOX方案(4个周期)和替雷利珠单抗单药治疗(最多9个周期),随后采用等待观察(W&W)策略。ncCR的患者将接受局部切除(LE),病理达到pCR的患者将接受与cCR患者相同的治疗,未达到pCR的患者将接受TME。未达到cCR和ncCR的患者将接受TME。
研究的主要终点为完全缓解率(定义为cCR+ncCR局部切除后pCR的患者比例)。次要终点包括1年、2年和3年的器官保留率、无事件生存率及总生存率。
研究结果
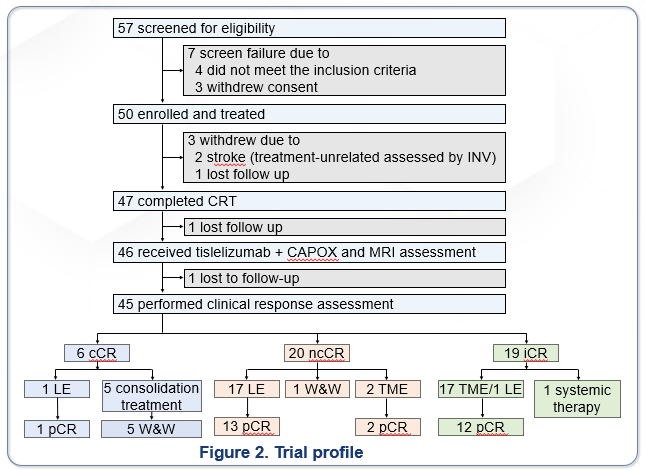
研究流程及患者基线
2024年6月至12月,全国6家中心共入组50例患者。研究流程图如图2。
入组患者中位年龄64.5岁,男性68%,92%为T3期,50%为N1期,肿瘤距肛缘的中位距离为3.4 cm。
疗效
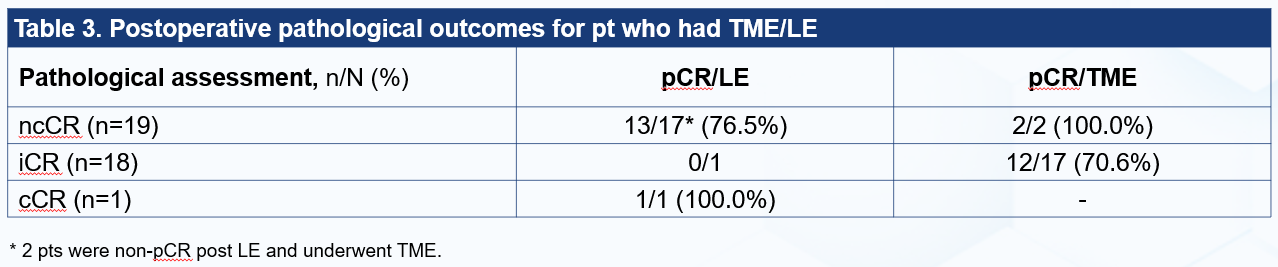
截至2025年9月1日,46例接受至少一次MRI评估,进入疗效分析集。45例患者接受临床疗效评估:cCR 6例(13.0%),ncCR 20例(43.5%),iCR 19例(41.3%);1例患者失访。主要终点CR率为41.3%(19/46,6例cCR+13例pCR post LE in ncCR);cCR+pCR率为71.7%(33/46,6例cCR+27例pCR post LE /TME)。在21例接受TME的患者中,20例达到R0切除,1例因外院手术导致数据无法收集。

安全性
新辅助治疗期间任意级别治疗相关不良事件(TRAEs)发生率为82%(41/50),3级TRAEs发生率为26%(13/50)。最常见的TRAE为淋巴细胞计数降低(52%)、白细胞计数降低(48%)。没有患者死亡。
结论
CRT后序贯替雷利珠单抗联合CAPOX方案用于MSS型低位直肠癌患者保器官治疗有良好的疗效,且能提高pCR率,安全可耐受。
研究点评
RELIEVE-01研究探索了替雷利珠单抗联合放化疗用于MSS型低位直肠癌器官保留的疗效和安全性。此研究具有重要意义:对于低位直肠癌患者,免疫治疗联合放化疗可使超过40%的患者达到临床无瘤状态,从而免于接受TME手术,成功实现器官保留。此外,免疫治疗联合放化疗后的cCR+pCR率达到了72%,提示潜在可实现器官保留的患者比例仍有巨大的提升空间。
值得关注的是,目前指南仅推荐cCR患者保留器官。但即使新辅助治疗中加入免疫治疗药物,cCR比例也仅为10%左右[7]。本研究通过对ncCR患者行局部切除的设计,并创新性使用了CR率(定义为cCR+ncCR局切pCR的患者比例)作为主要终点,扩大了可行器官保留的患者比例,使更多患者获得保器官的机会,也保证了治疗的预后。ncCR局切患者中,近1/4患者有肿瘤残留,提示ncCR直接进行W&W仍具有较大的风险。
与其他免疫治疗研究类似,本研究面临影像学评估与病理评估不一致性的问题:在19例iCR者中,18例接受了手术,pCR 率为66.7%。这种现象可能与免疫治疗后组织已坏死,淋巴细胞浸润聚集导致内镜或者核磁中仍显示为肿瘤有关[9]。既往研究也显示,直肠癌及其他瘤种免疫治疗的肿瘤评估常存在cCR与pCR一致性较差的问题:影像学退缩通常低估了病理学退缩水平[10-14]。通过延长治疗周期、推后临床缓解的评估时间或使用PET CT评估可能降低这种不一致性[15,16]。目前,我们团队正在进行一系列转化医学研究,试图深入探索这一问题的机制和解决方式。初步结果将于2025年ESMO Asia 大会公布。
鉴于RELIEVE-01研究的出色结果,一项随机对照研究——RELIEVE-02研究(NCT07132463)正在入组中。希望这些研究的结果能为低位直肠癌的器官保留提供新的解决方式。
本期特邀专家——许剑民 教授
博导,主任医师,二级教授,国务院特殊津贴专家
国家卫生健康突出贡献中青年专家、科技部重大专项四大慢病首席专家、上海工匠、上海市领军人才
复旦大学附属中山医院结直肠外科主任、结直肠癌中心主任,上海结直肠肿瘤微创工程技术研究中心主任
中国医师协会外科分会常务委员兼机器人外科、MDT专家工作组副组长,结直肠肿瘤专委会副主任委员兼机器人手术专委会组长,肛肠外科分会肿瘤转移专委会组长
中国抗癌协会大肠癌专业委员会副主任委员,肿瘤大数据与真实世界研究专委会副主任委员,大肠癌整合委员会副主任委员,大肠癌整合科普专委会主任委员
中华医学会外科分会结直肠外科学组委员
中国临床肿瘤学会(CSCO)结直肠癌专家委员会副主任委员
中国医促会肿瘤转移专业委员会副主任委员
中国研究型医院学会机器人与腹腔镜外科专业委员会、肿瘤外科专业委员会副主任委员
中国上海肿瘤防治联盟结直肠癌专业委员会主任委员
《中华结直肠疾病电子杂志》副主编
本期特邀专家——汤文涛 医师
外科学博士
复旦大学附属中山医院结直肠外科主治医师, 临床研究秘书
设计并管理多项RCT研究,ESMO和ASCO等国际大会发言
中国医师协会外科医师分会临床研究专家工作组委员
上海市医学会肿瘤靶分子委员会青年委员
主持国家自然科学基金、上海市自然科学基金、上海市卫健委等项目
第一作者/通讯作者(含共同)发表SCI论文20余篇
1、中国实用外科杂志,2023,43:93-99
2、NCCN Guidelines® Insights: Rectal Cancer, Version 3.2024.
3、Park IJ, et al. Journal of Clinical Oncology, 2012; 30:1770-6.
4、Dattani M, et al. Annals of surgery, 2018; 268(6): 955-67.
5、Rettig R L, et al. Diseases of the Colon & Rectum, 2023, 66(3): 374-82.
6、Lin Z, et al. Annals of Oncology, 2024; 35:882-91.
7、Xiao W W, et al. Cancer Cell, 2024; 42:157081. e4.
8、2025 ESMO 741P
9、Ribas A, Chmielowski B, Glaspy JA. Do we need a different set of response assessment criteria for tumor immunotherapy?Clin Cancer Res 2009; 15: 7116–18.
10、Topalian SL, Bhatia S, Amin A, et al. Neoadjuvant nivolumab for patients with resectable Merkel cell carcinoma in the CheckMate358 trial. J Clin Oncol 2020; 38: 2476–87.
11、Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018; 378: 1976–86.
12、Cascone T, William WN Jr, Weissferdt A, et al. Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial. Nat Med 2021; 27: 504–14.
13、Blank CU, Rozeman EA, Fanchi LF, et al. Neoadjuvant versus adjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma. Nat Med 2018; 24: 1655–61.
14、Neoadjuvant PD-1 blockade with toripalimab, with or without celecoxib, in mismatch repair-deficient or microsatellite instability-high, locally advanced, colorectal cancer (PICC): a single-centre, parallel-group, noncomparative, randomised, phase 2 trial
15、Neoadjuvant camrelizumab plus apatinib for locally advanced microsatellite instability-high or mismatch repairdeficient colorectal cancer (NEOCAP): a single-arm, openlabel, phase 2 study
16、PD-1 Blockade in Mismatch Repair–Deficient, Locally Advanced Rectal Cancer
排版编辑:肿瘤资讯-WJH











 苏公网安备32059002004080号
苏公网安备32059002004080号


