2025年欧洲肿瘤内科学会(ESMO)年会于10月17日至21日在德国柏林盛大召开,作为全球肿瘤学界的年度盛事,本届大会汇聚了多项重塑临床实践的突破性研究。其中,针对局部晚期或转移性尿路上皮癌(la/mUC)的EV-103研究Cohort K队列公布了中位随访长达约3.5年的最新数据(摘要号:3074P),引发了与会专家的广泛关注与热烈讨论。该更新以坚实的循证证据,进一步巩固了维恩妥尤单抗(EV)联合帕博利珠单抗(P)在la/mUC一线标准治疗中的核心地位,并为实现持久疾病控制乃至长期生存的目标提供了清晰的临床路径。基于此,本文特整理此数据更新,并综合回顾la/mUC治疗历程,评析维恩妥尤单抗联合治疗方案临床应用前景。
治疗困境:顺铂不耐受la/mUC患者一线治疗的未竟之需
尿路上皮癌(UC)是泌尿系统最常见的恶性肿瘤之一,其中约90%发生于膀胱。约半数la/mUC患者因肾功能不全、体能状态不佳(ECOG PS≥2)或其他合并症而无法耐受顺铂治疗。对于这部分患者,既往治疗选择有限:卡铂化疗方案疗效欠佳,免疫检查点抑制剂(ICI)单药有效率有待提升且适用人群受限。因此,为广大顺铂不耐受的la/mUC患者寻求一种兼具高效、良好耐受性且能带来持久获益的一线治疗方案,始终是该领域一项亟待突破的临床难题。
创新联合:ADC与免疫治疗协同增效的理论基础与临床探索
鉴于Nectin-4在UC广泛高表达,由此Nectin-4迅速成为UC治疗领域研究的稳健靶点之一。在此背景下,一种创新的无铂方案——维恩妥尤单抗(EV)联合帕博利珠单抗(P)应运而生。维恩妥尤单抗是一款针对Nectin-4的ADC药物,可特异性识别并结合肿瘤细胞表面高表达的Nectin-4抗原,介导细胞毒性药物单甲基澳瑞他汀E(MMAE)的靶向递送,从而实现肿瘤细胞的选择性杀伤2。更具前瞻意义的是,临床前研究表明,MMAE诱导的免疫原性细胞死亡(ICD)能够释放肿瘤相关抗原,增强肿瘤微环境的免疫原性,从而为PD-1/PD-L1抑制剂创造更有利的抗肿瘤免疫应答条件3。基于这一协同增效的科学基础,这项开放标签、多队列的Ib/II期研究EV-103研究中部分队列旨在评估维恩妥尤单抗联合方案一线治疗顺铂不耐受la/mUC患者疗效与安全性。
循证奠基:从初步惊艳到确立标准,维恩妥尤单抗联合方案的坚实数据
EV-103研究的初步探索始于其早期剂量递增/A队列。该队列纳入了45例顺铂不耐受的la/mUC患者,其报告的卓越疗效引发了学界的高度关注:客观缓解率(ORR)高达73.3%,更令人振奋的是其持久的生存获益,中位缓解持续时间(mDoR)和中位总生存期(mOS)分别达到了惊人的25.6个月和26.1个月4。这一结果在顺铂不耐受这一预后不良的人群中前所未有,初步证实了维恩妥尤单抗+P方案巨大的临床潜力。值得注意的是,在长达约5年的随访中,A队列展现出持续的生存获益:5年OS率达到41.5%(95% CI: 26.45-55.99),无进展生存期(PFS)率3-5年间均维持在38.2%(95% CI: 23.10-53.08)平台期水平,充分证实了该方案的长期疗效5。
K队列入组的也是顺铂不耐受的患者以随机设计的形式展开,旨在更严谨地评估维恩妥尤单抗联合方案(n=76)或维恩妥尤单抗单药治疗(n=73)的疗效。已公布的数据显示,维恩妥尤单抗联合治疗组的确认ORR(cORR)为64.5%(95% CI: 52.7-75.1),同时维恩妥尤单抗单药组的cORR为45.2%2。彼时的数据显示,联合治疗组的mDoR尚未达到,且安全性特征可控,未发现新的安全信号。
EV-103研究的成功,使得美国FDA加速批准维恩妥尤单抗+P在顺铂不耐受人群中一线治疗适应症,且为正在进行的III期确证性临床试验EV-302/KEYNOTE-A39奠定了信心。该研究将维恩妥尤单抗+P方案与标准铂类化疗(顺铂或卡铂)进行头对头比较,结果显示,无论患者是否耐受顺铂,维恩妥尤单抗联合方案均能将mOS和中位PFS延长近一倍,从而无可争议地确立了其在la/mUC一线治疗中的全新标准地位6。
ESMO 2025更新揭晓:EV-103研究3.5年随访数据定义“长期生存”
在坚实的循证基础之上,本届ESMO大会公布的EV-103研究K队列的中位随访期延长至约3.5年,为评估长期疗效与安全性进一步提供了扎实的数据:
卓越的长期生存优势
维恩妥尤单抗联合治疗组的mOS为30.7个月(95% CI: 20.7- 44.8),维恩妥尤单抗单药治疗组的mOS为22.8个月(95% CI: 16.3-28.4)。更具里程碑意义的是,联合治疗组 3年OS率高达44.1%(95% CI: 32.7-54.9%)。这意味着在接受联合治疗的患者中,近半数能够存活超过3年,这在顺铂不耐受这一预后极差的人群中实属罕见(图1)。生存曲线在后期呈现明显的“平台期”趋势,提示该方案能够为相当一部分患者带来长期生存甚至“功能性治愈”的可能。
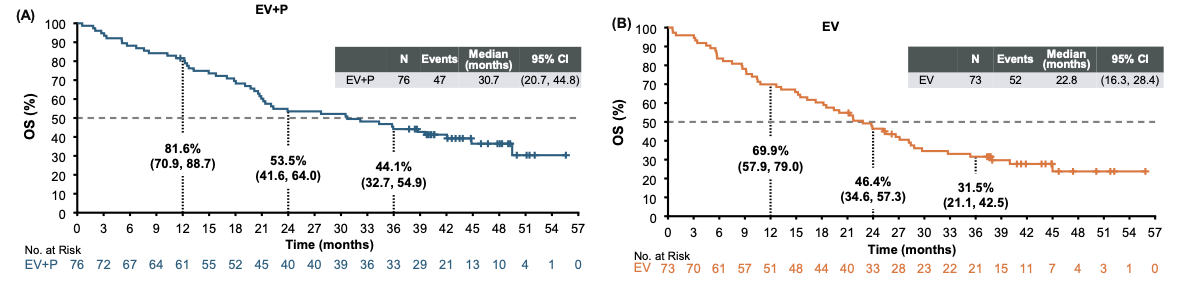 图1. EV-103 研究K队列OS数据更新
图1. EV-103 研究K队列OS数据更新
持久且深度的肿瘤缓解
本次更新确认,维恩妥尤单抗联合方案的mDoR为 38.7个月(95% CI: 20.9个月-未达到)。更值得关注的是,联合治疗组36个月时的缓解持续率高达58.8% (95% CI:40.6-73.2),维恩妥尤单抗单药治疗组也可达35.4%(95% CI: 15.1-56.5)(图2)。长达数年的缓解时间,充分证明了该联合方案所诱导的抗肿瘤效应并非昙花一现,而是具有极强的持久性。
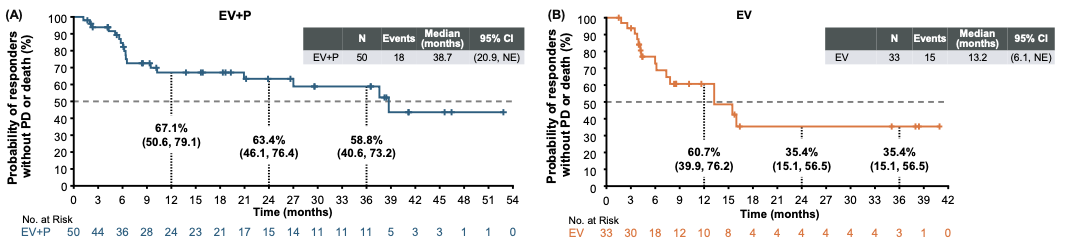
联合治疗组cORR为65.8%(95%CI: 54.0-76.3)(50例),其中CR达14.5%(11例),PR为51.3%(39例);同时单药治疗组的cORR为45.2%(95%CI: 33.5-57.3)(33例),CR为6.8%(5例),PR为38.4%(28例)(表1)。联合治疗组这一深度缓解的优势为患者带来了更好的疾病控制和生活质量改善。
表1. EV-103 研究K队列ORR数据更新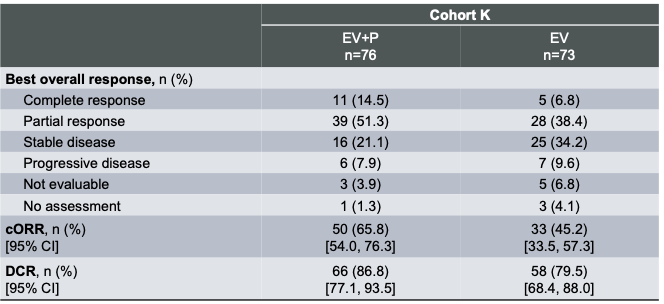
显著的PFS获益
mPFS数据进一步印证了联合治疗方案的疾病控制优势。维恩妥尤单抗联合方案的mPFS为29.0个月(95%CI: 8.3-48.1)(图3)。这些数据表明,联合治疗方案不仅能够延长患者的生存时间,更能够提供持续的疾病控制,使患者在更长的时间内免于疾病进展。
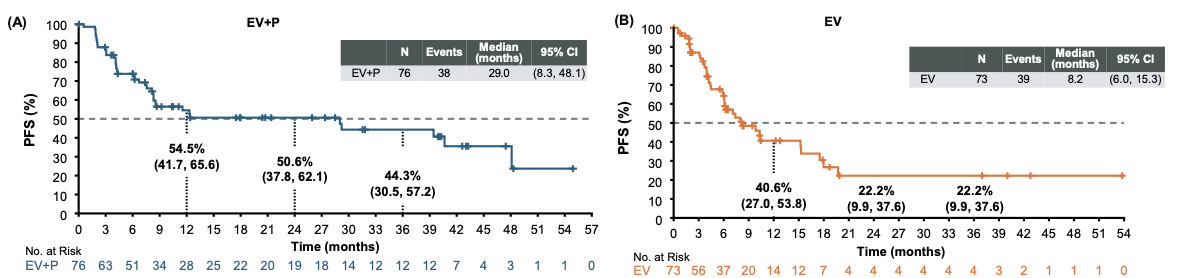 图3. EV-103 研究K队列PFS数据更新
图3. EV-103 研究K队列PFS数据更新
长期可控的安全性特征
此次长达约3.5年随访更新中的安全性特征与既往报告保持一致 ,总体可管理 。维恩妥尤单抗联合治疗组最常见的 ≥3级的治疗相关不良事件(TRAEs)为斑丘疹性皮疹(17.1%)、疲劳(9.2%)和中性粒细胞减少(9.2%);维恩妥尤单抗单药治疗组最常见的 ≥3级TRAEs则为高血糖(9.6%)、疲劳(8.2%)、中性粒细胞减少(6.8%)和腹泻(6.8%)。针对维恩妥尤单抗的特别关注不良事件(AESIs)在两组中均主要为低级别。在维恩妥尤单抗联合方案组与维恩妥尤单抗单药治疗组中,最常见的(≥3级)维恩妥尤单抗相关AESIs分别为:皮肤反应(21.1%;6.8%)、周围神经病变(2.6%;2.7%)(表2)。值得指出的是,长期随访证实,大部分AESIs均可随时间改善或缓解。以周围神经病变为例,维恩妥尤单抗联合方案组患者的中位发生时间(time to onset)为3.0个月,维恩妥尤单抗组为2.4个月;中位症状消退时间(time to resolution)分别为8.3个月和5.2个月(表3),进一步证实了该方案的良好耐受性与持久疗效。
表2. EV-103 研究K队列维恩妥尤单抗相关AESIs更新数据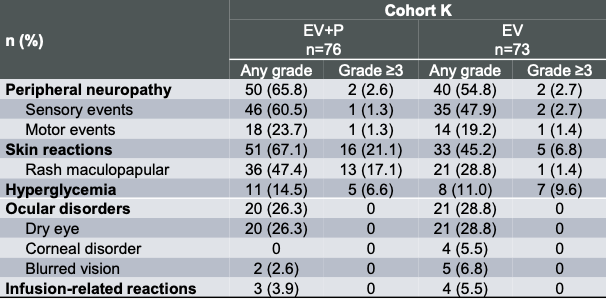
表3. EV-103 研究K队列维恩妥尤单抗相关AESIs的发生与消退更新数据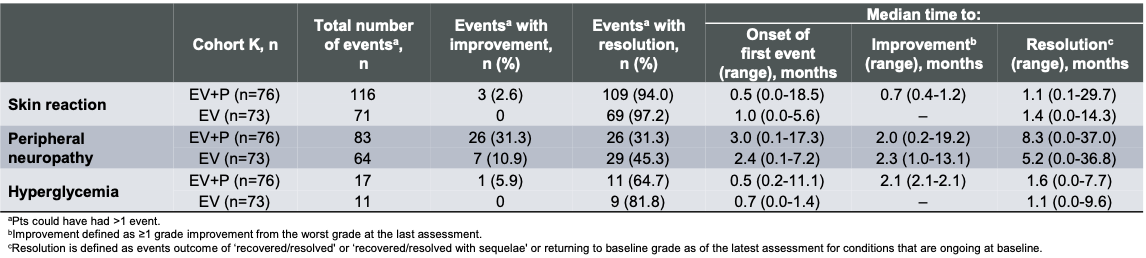
总体而言,本次公布的3.5年随访数据,它不仅再次确认了维恩妥尤单抗联合方案的压倒性优势,更重要的是,它为“晚期UC患者是否有望获得更长生存?”这一深刻的临床命题,提供了迄今最有力的肯定性证据。从临床实践角度而言,这一高级别证据将进一步增强临床医生在实践中应用该方案的信心,并为患者提供更为确切的预后预期。
从一线标准到全程管理,维恩妥尤单抗引领尿路上皮癌治疗新纪元
ESMO 2025上呈报的EV-103研究K队列3.5年随访数据,标志着晚期尿路上皮癌一线治疗从“延长生存”迈向“长期控制”的关键转折。值得一提的是,在本届ESMO大会上公布的另一项关键研究——EV-302研究的最新数据显示,即使在年龄≥75岁、合并糖尿病或肾功能不全等传统意义上的“挑战性”患者亚组中,维恩妥尤单抗联合方案依然能带来与总体人群一致、甚至更为突出的生存获益,显著延长PFS和OS,且安全性良好 。这一结果强有力地证明,维恩妥尤单抗联合方案的获益覆盖了更广泛的la/mUC患者人群,进一步巩固了其作为全人群一线标准治疗的地位 。
基于EV-302研究等一系列高级别循证医学证据,《2025版CSCO尿路上皮癌诊疗指南》已将维恩妥尤单抗联合方案作为一线治疗的推荐等级提升至最高的1A类,实现了与NCCN、ESMO等国际权威指南的全面接轨 。
展望未来,维恩妥尤单抗+P方案的应用正逐步扩展至肌层浸润性膀胱癌(MIBC)新辅助/辅助治疗领域(如EV-303/KEYNOTE-905研究)。可以预见,一个以维恩妥尤单抗为核心、贯穿尿路上皮癌全程管理的无铂精准治疗新纪元,正在加速到来,有望为更多患者带来生命的转机。
1. Challita-Eid PM, Satpayev D, Yang P, et al. Enfortumab Vedotin Antibody–Drug Conjugate Targeting Nectin-4 Is a Highly Potent Therapeutic Agent in Multiple Preclinical Cancer Models. Cancer Research 2016;76(10):3003-3013. DOI: 10.1158/0008-5472.CAN-15-1313.
2. O'Donnell PH, Milowsky MI, Petrylak DP, et al. Enfortumab Vedotin With or Without Pembrolizumab in Cisplatin-Ineligible Patients With Previously Untreated Locally Advanced or Metastatic Urothelial Cancer. J Clin Oncol 2023;41(25):4107-4117. (In eng). DOI: 10.1200/jco.22.02887.
3. Hingorani DV, Allevato MM, Camargo MF, et al. Monomethyl auristatin antibody and peptide drug conjugates for trimodal cancer chemo-radio-immunotherapy. Nat Commun 2022;13(1):3869. (In eng). DOI: 10.1038/s41467-022-31601-z.
4. Hoimes CJ, Flaig TW, Milowsky MI, et al. Enfortumab Vedotin Plus Pembrolizumab in Previously Untreated Advanced Urothelial Cancer. J Clin Oncol 2023;41(1):22-31. (In eng). DOI: 10.1200/jco.22.01643.
5. Rosenberg JE, Petrylak DP, Flaig T, et al. 1968P Study EV-103 dose escalation/cohort A (DE/A): 5y follow-up of first-line (1L) enfortumab vedotin (EV) + pembrolizumab (P) in cisplatin (CIS)-ineligible locally advanced or metastatic urothelial carcinoma (la/mUC). Annals of Oncology 2024;35:S1139-S1140. DOI: 10.1016/j.annonc.2024.08.2053.
6. Powles TB, Van der Heijden MS, Loriot Y, et al. Enfortumab vedotin plus pembrolizumab in untreated locally advanced or metastatic urothelial carcinoma: 2.5-year median follow-up of the phase III EV-302/KEYNOTE-A39 trial<sup>☆</sup>. Annals of Oncology 2025;36(10):1212-1219. DOI: 10.1016/j.annonc.2025.05.536.
MAT-CN-PAD-2025-00313
Preparation Date 2025-10-13
仅供医疗卫生专业人士阅读
排版编辑:肿瘤资讯-高惠











 苏公网安备32059002004080号
苏公网安备32059002004080号


